Prof. Michele Giugliano (Dicembre 2001)
Complementi di
Termologia.
III parte
N. 3. - Lavoro nelle trasformazioni.
In generale se un gas, soggetto ad una variazione della pressione p, varia il volume V, esso
compie un lavoro L sull’ambiente esterno.
Si ricordi, ad esempio, il sistema termodinamico costituito da un cilindro contenente un gas ideale e chiuso, superiormente, da un pistone a perfetta tenuta; il lavoro è dovuto ad una qualunque trasformazione del gas che comporti una variazione del suo volume.
Tale lavoro in generale si può calcolare mediante l'integrale definito:
∫
V2
V1
pdV
essendo V1 e V2 i valori del volume V allo stato iniziale e a quello finale della trasformazione.
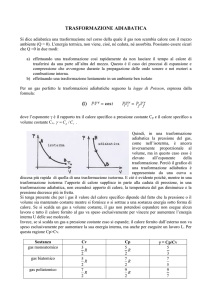
Dal punto di vista geometrico, tale lavoro è rappresentato dall'area della superficie (trapezoide)
situata al di sotto della curva di trasformazione del gas, nel piano (p, V), compresa fra l'asse delle
ascisse (V) e le parallele all'asse delle ordinate (p) passanti per i punti estremi P1 e P2 della curva di
trasformazione (avente equazione del tipo p = f(V) ).
p
V1
V2
V
Segno del lavoro.
Il lavoro si considera positivo o negativo, a seconda che durante la trasformazione il volume
del gas aumenti (allora è L > 0) o diminuisca (L < 0).
Per illustrare meglio la trasformazione si usa indicare con una freccia il senso di percorrenza,
dallo stato iniziale verso quello finale, sulla curva di trasformazione (grafico della legge, nel piano pV).
1
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
In pratica, se il verso di percorrenza sulla curva è diretto verso destra (rispetto agli assi di riferimento), allora il lavoro è positivo; se è diretto verso sinistra sarànegativo.
Nella figura precedente, il lavoro eseguito dal gas (sull'ambiente) è positivo, perché il verso di
percorrenza del grafico, relativo alla trasformazione, è diretto verso destra e, quindi, determina un aumento del volume.
3.1. Casi particolari di trasformazione (calcolo del lavoro).
A) Trasformazione isobara (o isobarica), ossia a pressione costante.
Equazione della trasformazione: p = costante.
Può avvenire per aumento di volume (V2 > V1: espansione isobarica) o per diminuzione di volume
(V2 < V1: compressione isobarica).
In questo caso, il calcolo del lavoro è semplificato.
Basta osservare la figura per accorgersi che il trapezoide considerato è un rettangolo di base V2 V1, ed altezza p
p
V1
V2
V
Calcolo del lavoro:
L = p∆V = p(V2 −V1)
(Trasformazione isobarica)
B) Trasformazione isoterma (o isotermica).
Equazione della trasformazione pV = costante.
Il grafico, nel piano (p,V) è quello di un arco d'iperbole equilatera riferita agli asintoti (giàdisegnato prima).
Calcolo del lavoro.
Mediante il calcolo integrale, facilmente si trova che:
L = nRT log
V2
V1
(Trasform. isoterma)
con ovvio significato delle lettere, ove il logaritmo è quello in base e (ossia è il logaritmo naturale o
neperiano).
2
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
C) Trasformazione isovolumica.
Equazione della trasformazione V = costante (= V1 = V2).
Il grafico, nel piano (p, V), è un segmento parallelo all'asse delle ordinate.
p2
p1
V1 = V2
Calcolo del lavoro.
L=0
(Trasformazione isovolumica)
Calcolo di ∆U.
Calcoliamo anche la variazione dell'energia interna ∆U del sistema termodinamico.
Applicando il primo principio della Termodinamica (con Q ed L espressi in joule)
Q - L = ∆U
si ha subito (essendo L = 0)
Q = ∆U
Ricordando ora l'equazione fondamentale della Calorimetria, e tenuto conto che il volume del
gas è costante, segue:
∆U = Q = cvm∆T = cvm(T2 − T1)
perché , in questo caso, tutto il calore assorbito dalla trasformazione va ad incrementare l'energia interna
del sistema.
OSSERVAZIONE. La precedente formula è valida anche per quelle trasformazioni il cui volume
non sia costante.
Naturalmente, se la pressione è costante, si deve adoperare cp.
D) Trasformazione adiabatica (ossia senza scambio di calore con l'ambiente esterno: Q = 0).
Equazione della trasformazione (di Poisson):
pVγ = costante ((Trasformazione adiabatica)
3
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
con γ =
cp
cv
La formula può essere espressa anche mediante T (in gradi kelvin) e V:
TVγ−1 = costante
γ
Infatti, sostituendo, nella formula pV , il valore di p =
nRT
, ricavato dall’equazione di ClapeV
yron per i gas ideali (valida per n moli di gas), si ottiene:
pV γ =
nRT γ
V = nRTV γ − 1 = cos tan te
V
da cui segue che
TV γ − 1 =
cos tan te
= ancora costante
nR
La legge può, infine, essere espressa anche così:
T1V1γ − 1 = T2V2γ − 1
e anche:
V2
V1
γ −1
=
T1
T2
Da quest’ultima formula segue che:
a) V2 < V1 ⇒ T2 > T1 e
b) V2 > V1 ⇒ T2 < T1
In parole:
a)
Se il gas subisce una compressione adiabatica (V2 < V1) la temperatura T aumenta (T2 > T1,
ossia, il gas si riscalda); in questo caso il lavoro è negativo.
b) Se esso subisce una espansione adiabatica (V2 > V1) la temperatura diminuisce (T2 < T1, il gas
si raffredda); in questo caso il lavoro è positivo.
Calcolo del lavoro (per una trasformazione adiabatica).
Tenuto conto che Q = 0 la prima legge della Termodinamica fornisce ∆U = −L; quindi L = −∆U.
4
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
Inoltre, poiché la formula ∆U = cvm∆T, vista per le trasformazioni isovolumiche, è valida anche
per le altre trasformazioni (quindi anche per le adiabatiche), segue
L = −∆U = −cvm∆T
Calcolo di ∆U.
Per quanto visto prima:
∆U = cvm∆T
Nota.
Si dimostra, inoltre, che se il gas in esame è un gas ideale, allora l'energia interna U del sistema dipende solo dalla sua temperatura assoluta T (e non anche dal volume V).
Quindi se due gas subiscono trasformazioni aventi stessi stato iniziale e finale, essi avranno anche uguali energie interne e quindi subiranno uguali variazioni di energia interna (∆U1 = ∆U2).
E) Trasformazione ciclica.
p
V
In una trasformazione ciclica lo stato finale coincide con quello iniziale.
E' facile dimostrare che il lavoro eseguito in tale trasformazione è geometricamente rappresentato dall'area del ciclo, ossia dall'area della superficie racchiusa dalla curva di trasformazione; inoltre tale lavoro è positivo se il verso di percorrenza della trasformazione (quello che va dallo stato iniziale a
quello finale) è quello orario, è negativo se il verso è quello antiorario.
Nella figura, il lavoro è negativo.
Per la dimostrazione si rinvia alla spiegazione fornita durante le lezioni.
F) Grafici delle trasformazioni nel piano pt.
Se rappresentiamo le trasformazioni nel piano pT, ossia si riporta sull'asse delle ascisse la temperatura t, anziché il volume V, e sull'asse delle ordinate ancora p, si ottengono curve utili per alcuni
importanti studi.
Un esempio si ha nel diagramma di stato dell'acqua nel piano p t (con punto triplo), che vedremo più avanti.
5
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com