APPUNTI DI METODI FISICI IN CHIMICA ORGANICA C. Santi
SPETTROSCOPIA UV E VISIBILE CAPITOLO 2
Spettroscopia
UV e Visibile
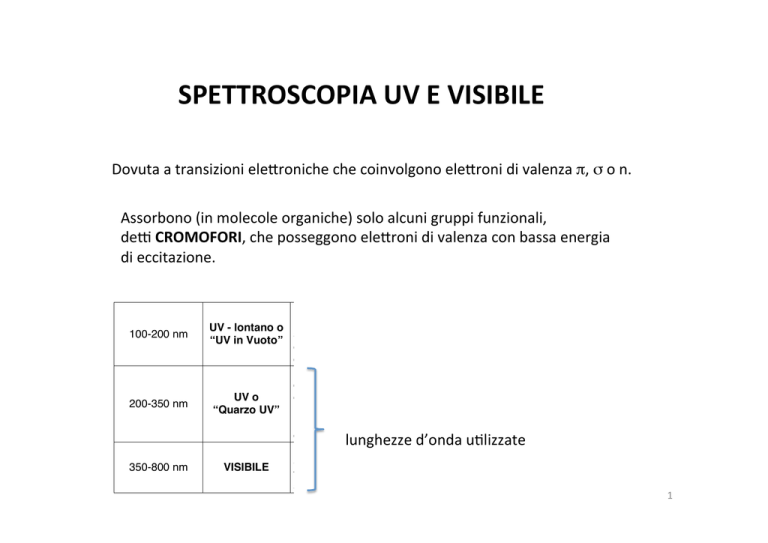
Dovuta a transizioni ele4roniche che coinvolgono ele4roni di valenza π, σ o n. !
" INTRODUZIONE
Assorbono (in molecole organiche) solo alcuni gruppi funzionali, de? CROMOFORI, che posseggono ele4roni di valenza con bassa energia La regione dello spettro elettromagnetico che va da 100 nm ad 800 nm
viene
indicata come regione dell’ ultravioletto e del visibile.
di eccitazione. Il ”range” appena riportato viene suddiviso in tre zone che, da un punto di
vista spettroscopico, necessitano di differenti caratteristiche strumentali:
100-200 nm
200-350 nm
350-800 nm
Richiede apparecchiature sofisticate
in grado di registrare spettri
UV - lontano o
sottovuoto in completa assenza di
“UV in Vuoto”
qualsiasi altra specie chimica oltre a
quella in esame.
Sono gli spettrometri più comuni, il
campione viene inserito in
UV o
contenitori (cuvette) di quarzo
“Quarzo UV” poiché le radiazioni coinvolte sono
incapaci di attraversare il vetro
comune.
lunghezze d’onda u-lizzate Il campione può essere contenuto
anche in cuvette di vetro
VISIBILE
trasparente, come rivelatore è
sufficiente l’occhio umano
Fortunatamente la maggior parte dei cromofori utili da un unto di vista
analitico assorbono nelle regioni comprese tra 200 ed 800 nm, ciò rende
possibile l’utilizzo di spettrofotometri non eccessivamente complessi e
1 all’interno di una singola transizione elettronica. Questo determina una
combinazione di linee sovrapposte per cui lo spettro appare come una
banda continua di assorbimento.
Le principali transizioni elettroniche, che coinvolgono elettroni di legame
e “lone-pair” in una molecola organica, sono riassunte nello schema
Di solito è uno spe4ro a bande, a causa della sovrapposizione di molte transizioni seguente e verranno di seguito analizzate in dettaglio.
vibrazionali e rotazionali all’interno di una singola transizione ele4ronica. Principali transizioni ele4roniche: CAPITOLO 2 Spettroscopia UV e Visibile
19
2 APPUNTI DI METODI FISICI IN CHIMICA ORGANICA C. Santi
APPUNTI DI METODI FISICI IN CHIMICA ORGANICA C. Santi
Transizione σ- σ*
Transizione σ- σ*
E
E
σ∗
σ∗
σ∗
σ∗
σ
σ
σ
σ
Transizione n- σ*
Transizione n- σ*
C
E
C
σ∗
σ∗
σ∗
σ∗
n
n
N
n
n
N
σ
σ
N
N
E
C
C
C
C
N
N
σ
σ
Transizione π- π*e π- σ*
Transizione π- π*e π- σ*
E
E
σ∗
σ∗
σ∗
Un elettrone in un orbitale di legame s
uesta transizione l’energia viene eccitato Per al qcorrispondente
Un
elettrone
in
un
orbitale
s
orbitale di non richiesta legame.di legame
L’energia
è
e
levata (ad es. 125 nm per viene
al Ad
corrispondente
richiestaeccitato
è grande.
esempio il
orbitale
L’energia
il legame.
C-­‐H dsolo
el Clegami
H4): transizione non metano, dichenon
possiede
richiesta
è
grande.
Ad
esempio
il
σ C-H, può dar luogo
solo a questo
visibile. metano,
che
possiede
solo
legami
tipo di transizione mostra un massimo
σ
può dara luogo
solo
a questo
diC-H,
assorbanza
125nm
. Transizioni
tipo
di transizione
mostra
massimo
di questo
tipo nonTransizione sono un
quindi
visibili
-pica degli idrocarburi. di
assorbanza
a
125nm
.
Transizioni
con i normali spettrofotometri e
di
questo far
tipo ricorso
non sonoa quindi
visibilidi
bisogna
tecniche
con i normali spettrofotometri e
registrazione “in vuoto”.
bisogna far ricorso a tecniche di
Transizioni
tipiche
degli
registrazione “in vuoto”.
IDROCARBURI
Transizioni
tipiche
degli
Composti saturi contenenti atomi con
IDROCARBURI
“lone pair” (coppie elettroniche non
Composti saturi contenenti atomi con
condivise)
N, S)elettroniche
sono capaci
“lone
pair” (O,
(coppie
nondi
Questa t
ransizione, dovuta ad atomi dare
questo
tipo
di
transizione.
condivise) (O, N, S) sono capaci di
Questequesto
transizioni
lrispetto
one pairs (N, O, S, alogeni) dare
tipo con di generalmente
transizione.
richiedono
meno
energia
alla
Queste
transizioni
generalmente
richiede eno σ-σ* e meno
vengono
promosse
da energia (150-­‐250 nm) richiedono
energia
rispettomalla
radiazioni
tra
iè150-250
nm.
scarsamente rilevabile. σ-σ*
e comprese
vengono ed promosse
da
Solo
gli
ioduri
arrivano
a
255-260
nm
radiazioni comprese tra i 150-250 nm.
e pertanto
sono
visibilia con
i normali
Solo
gli ioduri
arrivano
255-260
nm
spettrometri.
e pertanto sono visibili
con i normali-pica di ammine, alcoli, Transizione I composti organici che possono dar
spettrometri.
eteri, solfuri, mercaptani. a queste
transizioni
Iluogo
composti
organici che
possonosono:
dar
AMMINE,
ALCOLI,
TIOALCOLI,
luogo
a queste
transizioni
sono:
ETERI,
TIOETERI,
AMMINE,
ALCOLI,
TIOALCOLI,
ALOGENODERIVATI.
ETERI,
TIOETERI,
Prendendo
in
considerazione
ALOGENODERIVATI.
3 un’olefina semplice,
laconsiderazione
transizione più
Prendendo
in
importantesemplice,
(minore
energia) sarà
un’olefina
la transizione
più
quella tra gli orbitali
e LUMO
importante
(minore HOMO
energia)
sarà
quella
orbitali HOMO
e LUMO
(π-π*). traIngli sistemi
semplici
essa
C
N
σ
Transizione π- π*e π- σ*
E
σ∗
σ∗
LUMO
π∗
π∗
HOMO
π
π
σ
σ
σ I composti organici che possono dar
luogo a queste transizioni sono:
AMMINE,
ALCOLI,
TIOALCOLI,
ETERI,
TIOETERI,
ALOGENODERIVATI.
Prendendo
in
considerazione
un’olefina semplice, la transizione più
Transizione cara4eris-ca dei legami mul-pli. importante
(minore energia) sarà
es., oHOMO
lefine. eSLUMO
e l’olefina è semplice, il ΔE quella tra Ad gli orbitali
σ∗ (π-π*). In sistemi semplici essa
è abbastanza elevato e la transizione non è avviene a 170-200 nm per cui non è
rilevabile (170-­‐200 m). Se l’olefina è coniugata, normalmente
rilevabile.
Diverso nè
π∗
invece il discorso
si eha
il ΔE si aquando
bbassa la un
transizione diventa diene coniugato, poiché le diolefine
Con la coniugazione aumenta anche assorbonorilevabile. in una regione
accessibile
π
all’UV. (Es.
Butadienedel 210
nm). a causa dell’aumento l’intensità segnale Aumentando il numero dei doppi
σ
del coefficiente di π-π*
es-nzione molare ε
legami coniugati,
la transizione
diviene sempre
più d
importante.
(legge i Lambert-­‐Beer). Vediamo perché
HOMO: Highest Occupied Molecular Orbital LUMO: Lowest Unoccupied Molecular Orbital CAPITOLO 2 Spettroscopia UV e Visibile
20
I gruppi che contengono ele4roni π coniuga- sono de? cromofori. L’inserimento di gruppi cromofori in una molecola ne determina lo shiB batocromico, ossia lo spostamento della banda di assorbimento a lunghezze d’onda maggiori. 4 coinvolgono elettroni π. σ o n.
Transizioni caratteristiche di composti
contenenti un cromoforo insaturo in cui
uno degli atomi
è un eteroatomo
(es.di compos- con un cromoforo Transizioni -piche legami
carbonilici
o
imminici).
ontenente un eteroatomo (ad esempio, Consideriamo insaturo il gruppo c
C=O.
Di sei
elettroni di valenza
uno ècarbonilici impegnato – contenen- il gruppo C=O – compos- nella formazione del legame σ con il
o cnella
ompos- imminici carbonio, uno
formazione
del – contenen- il gruppo C=N). legame π e L’eteroatomo le due rimanenti coppie
con-ene lone pairs che possono una occupa l’orbitale ibrido sp e l’altra
dare origine a questo -po di transizione. l’orbitale p. Per
un sistema
energetico
come quello qui rappresentato due
sono le transizioni più importanti: una
Transizione n- π*
C
O
σ∗
C
O
π∗
C
O
n(py)
C
O
π
C
O
σ
C
O
n-π
π* ed una π- π*. La prima è poco
probabile a causa della sfavorevole
caso qui riportato geometria Nel degli
orbitali
che si (un composto carbonilico), trovano consideriamo naturalmente
gli ele4roni coinvol- nel legame C=O. perpendicolari. L’intensità di questa
ele4roni sono coinvol- nel legame σ e due transizioneDue che
si
definisce
bassa
conC un
proibità sarà
nel lmolto
egame π tra e O. Po ci sono i due lone pairs ε= 10-100 a circa 280nm.
n(sp)
dell’ossigeno, pos- su orbitali n (non legan-): ques- ul-mi quella sono dei doppi
legami
C=Ccahe daranno la transizione. La transizione π-π* è invece analoga a
180 nm con un ε = 10.000. Nella seguente tabella vengono riportati i
valori indicativi di λmax relativi ad alcuni importanti gruppi funzionali.
Composto
Aldeidi
Chetoni
Acidi Carbossilici
Esteri
Amidi
n- π*
λmax
190
180
π- π*
log ε
1,5-2,0
3-4
λmax
290
280
205
205
210
log ε
1
1
1-2
1-2
1-2
5 !"
REGOLE EMPIRICHE DI WOODWARD-FIESER
AssorbimenC caraDerisCci di gruppi funzionali Nella tabella di seguito riportata vengono indicati i massimi di
assorbimento dei più comuni gruppi funzionali .
λ
η
π∗
π
π∗
π
π∗
η
σ∗
η
σ∗
π
π∗
η
∗
∗
π
π
η
π∗
η
σ∗
η
∗
π
η
π∗
η
π∗
η
σ∗
η
π∗
η
π∗
APPUNTI DI METODI FISICI IN CHIMICA ORGANICA
Uno spe4ro UV è dovuto a gruppi funzionali contenen- ele4roni n e π coniuga-, !"
quindi molecole contenen- Poiché uno gli spettro
UV cèromofori dovuto alladpresenza
stessi aranno di un gruppo cro
(elettroni n ed elettroni π coniugati) e non è influenzato dal resto
spe4ri UV uguali. scheletro molecolare, molecole diverse che possiedono lo stesso
cromoforo hanno
UV identici. A
Per
gli spettri dei compo
Ad espettri
s, i compos- eesempio
B avranno B sono coincidenti, in quanto sia il gruppo cromoforo che il tip
V iesso
den-co. posizione deispe4ro sostituentiUad
legati sono identici. Tali spettri risult
ε
anche coincidenti con quelli di un qualunque altro composto che a
stesse caratteristiche, cioè che possieda la struttura generica indicata
O
HO
HO
HO
O
A
O
O
B
C
Se si ha il sospetto che un composto incognito abbia la struttura B,
6 L’analisi degli spettri UV di numerosi composti a struttura nota haintanto
portatostabilire la struttura del suo cromoforo sintetizzando A ed osse
se gli spettri
di A e B coincidono.
ad utili correlazioni tra spettri di assorbimento e struttura consentendo
di
Questo
formulare semplici regole empiriche di additività per il calcolo
deiapproccio, cioè l’uso di composti modello, è pratica comun
Nello spettro di assorbimento UV-Vis del benzene possono essere individuate tre bande di
interesse particolare:
BANDA
E1
E2
B
184
203,5
254
60.000
7.400
204
Lo spe4ro UV di un campione incognito può quindi solo dare indicazioni sulla Di sicuro, però,
quella che
maggiormentemcia interessa
è proprio la banda
benzenoide, la cui
presenza di alcuni cromofori, non perme4erà di iden-ficare il composto in posizione varia a seconda dei sostituenti portati dall’anello.
assenza di altre informazioni. Ad es.: 37
7 del reciproco della trasmittanza:
I
1
100
A
log
log 0
log
2 log%T
T
I
%uT-le nell’analisi quan-ta-va (ad esempio, Questo -po di spe4roscopia è invece molto come rivelatore per le aLa
nalisi in diHPLC). legge
Lambert – Beer
Infa? la legge di Lambert-­‐Beer correla l’assorbanza di un campione con la sua Esiste una legge che ci permette di calcolare la concentrazione di campione dal suo assorbimento;
concentrazione, conoscendo o specifico questa è la legge di Lambert
– Beer, che lassume
la forma: coefficiente di es-nzione molare ε. A
c d
dove:
ε indica il valore di assorbanza del composto in esame quando d = 1 cm e c = 1 M Ad
= ipende assorbenzaidel
campione
e noltre dal solvente e dalla lunghezza d’onda u-lizzata. = coefficiente di estinzione molare, specifico per ogni sostanza
d = cammino ottico (cm)
c = concentrazioni (mol / l)
Conoscendo ε, si può costruire una re4a di taratura misurando l’assorbanza in funzione APPUNTI DI METODI FISICI IN CHIMICA ORGANICA C. Santi
Secondoconcentrazione: la legge di Lambert – Beer, dunque, l’assorbanza A è proporzionale sia alla
della concentrazione della sostanza assorbente, sia allo spessore dello strato attraversato, per cui più
elevata è la concentrazione delle molecole che passano dallo stato fondamentale a quello eccitato,
maggiore sarà l’assorbanza (maggiore sarà la diminuzione dell’intensità del raggio incidente).
Da notare che il coefficiente di estinzione molare indica il valore
composto in
A e dic assorbanza
hanno pdel
roporzionalità dire4a esame quando [d = 1] cm e [ c = 1 ], e il suo valore dipende:
solo a basse concentrazioni. dalla lunghezza d’onda della radiazione assorbita
dalla natura del solvente
dal pH
dalla specie chimica che assorbe
È invece indipendente dalla temperatura!
8 Come si vede dal grafico la linearità della correlazione è valida solo per
soluzioni diluite, ad un certo punto la curva “devia” rispetto alla retta teorica
24
Poichè il coefficiente angolare della re4a corrisponde al coefficiente di es-nzione molare ε, si può u-lizzare un grafico di questo -po per determinare ε di un composto c d è l’equazione che descrive una retta passante
Ricordiamo infine che l’espressione A
(con d = 1ottico
cm): per l’origine, dove, per
un percorso
unitario (1 cm), il coefficiente angolare corrisponde
proprio al coefficiente di estinzione molare !
Ricordiamo però una cosa:
LA LEGGE DI
SOLO PER SOLUZIONI MOLTO DILUITE!
LAMBERT – BEER
È UN’ASTRAZIONE, ESSENDO VALIDA
Se la concentrazione del campione è bassa, infatti, esiste proporzionalità fra A e C:
Se invece la concentrazione è troppo elevata la legge subisce una deviazione e la proporzionalità
viene a mancare:
Un testo in internet: h4p://www.metodifisici.net/TESTI/testo/capitolo2.pdf Al crescere della concentrazione del soluto si verificano deviazioni notevoli con conseguente scarsa
attendibilità del dato analitico.
9










