Fisiopatologia delle Malattie Umane
Lezione n°6 - 28/10/13
Prof. Oreto
Sbob: Clelia Filardo
Malattie delle valvole cardiache
Definizione, eziologia, anatomia patologica e fisiopatologia [dovete studiare]. Praticamente non dovete studiare i dati
clinici, che saranno oggetto di studio del quarto anno. Dovete studiare essenzialmente la fisiopatologia delle malattie
delle valvole cardiache, ma anche la definizione.
Cominciamo con la stenosi mitralica, che è la riduzione dell’area valvolare mitralica. L’area
valvolare mitralica di solito misura 4/6 cm2. Fino a 2.5 cm2 non succede nulla, perché c’è un’area
valvolare sufficiente a permettere il flusso del sangue dall’atrio sinistro al ventricolo sinistro
durante la diastole ventricolare; al di sotto di 2.5 cm2 la valvola, stretta, rappresenta un ostacolo al
flusso del sangue.
Quindi possiamo definire la stenosi mitralica:
- lieve: area 2.5/ 1.5 cm2
- moderata: area 1.5/1.0 cm2
- serrata: area 1.0 cm2
Quindi la definizione di stenosi mitralica è questa, riduzione dell’area valvolare mitralica; è un
concetto molto semplice, non ha bisogno di ulteriore esplicitazione.
L’eziologia della stenosi mitralica è praticamente unica: la malattia reumatica. Esiste anche una
forma congenita di stenosi mitralica, ma è talmente rara che in 40 anni di carriera un cardiologo ne
vede forse un caso o due. La malattia reumatica è dovuta ad un’infezione streptococcica,
autoimmune in fondo, perché si sviluppano anticorpi contro il batterio, ma che in realtà sono delle
vere strutture dell’organismo stesso; non soltanto il cuore, ma anche una gran quantità di altri
organi può essere colpita. La malattia iniziale guarisce completamente, anche senza terapia, però
resta un piccolo danno valvolare. Il piccolo danno valvolare fa sì che chiudendosi e aprendosi
100.000 volte al giorno (perché un essere umano adulto ha circa 100.000 battiti al giorno), con il
trauma c’è un’alterazione progressiva dei veli valvolari, cosicché c’è l’inspessimento, la
calcificazione, la saldatura di questi veli che provocano una diminuzione dell’area valvolare
mitralica, ma anche l’apparato sottovalvolare ( muscoli papillari e corde tendinee) può essere
compromesso dal processo. Quindi la stenosi mitralica esordisce diciamo a 15/16 anni, e comincia
a essere una vera e propria malattia a 40 anni perché occorre molto tempo prima che il danno sia
considerevole, poiché la valvola, che inizialmente presenta alterazioni modeste, figuriamoci se non
guarisce con gli antibiotici.
Circa a metà del secolo scorso la stenosi mitralica era una malattia diffusa perché non se ne
conoscevano bene la fisiopatologia e l’eziologia, c’era chi addirittura pensava fosse virale,
oltretutto non c’erano gli antibiotici giusti per le malattie streptococciche, quindi c’era una gran
diffusione (non soltanto per la valvulopatia mitrale ma anche per quella aortiche o tricuspidali).
Negli ultimi trent’anni del secolo scorso la terapia antibiotica si è sviluppata al punto tale che
l’infezione reumatica è stata pressocché sconfitta e non si è vista più la stenosi mitralica per molti
anni; adesso torna la stenosi mitralica perché la popolazione italiana è mista, gli extracomunitari
che arrivano da paesi “non così fortunati” dal punto di vista economico e sociale come il nostro,
spesso ce l’hanno, quindi spesso la vedrete in soggetti che non sono nati in Italia.
La riduzione dell’area valvolare mitralica comporta un ostacolo alla progressione del sangue
dall’atrio al ventricolo, perché l’area valvolare è ristretta, e a sua volta questo provoca un
aumento della pressione atriale. Questo perché si deve creare un gradiente di pressione per
superare l’impedimento rappresentato dalla valvola stessa, cioè ci vuole una differenza di
pressione tra l’atrio e il ventricolo: questo si chiama gradiente di pressione. Il gradiente di
pressione coincide con un incremento di pressione nell’atrio. Quindi si crea questa differenza di
pressione, o gradiente, fra l’atrio e il ventricolo; questo a sua volta comporta una serie di
conseguenze fisiopatologiche.
Il gradiente dipende da due fattori: l’area valvolare mitralica e la velocità di flusso.
Se aumenta la velocità di flusso succede perché nell’unità di tempo bisogna far passare più
sangue. Quando un soggetto corre, o comunque fa uno sforzo, la velocità di flusso deve subire un
incremento, perché nell’unità di tempo deve passare più sangue attraverso la valvola. Questo è un
meccanismo fisiologico che non comporta nessun problema in un soggetto normale. In un
soggetto con la stenosi mitralica fa crescere il gradiente, cioè la differenza di pressione, e questo
avrà conseguenze nefaste.
La velocità di flusso dipende da due cose: la portata cardiaca e la frequenza cardiaca.
La portata cardiaca è intuitivo, perché più sangue passa, più veloce deve essere nel tempo, perché
nell’unità di tempo deve passare più sangue.
La frequenza cardiaca è meno chiara, perché con l’aumentare di questa il periodo diastolico si
riduce e non è un concetto semplice. Diminuisce perché la sistole è fissa, tutto quello che resta dal
ciclo cardiaco quando togli la sistole è diastole.
Aumentando la portata, una maggior quantità di sangue passa per l’orificio valvolare nell’unità di
tempo. Aumentando la frequenza, si riduce il periodo della diastole, semplicemente perché il
periodo della sistole è fisso, e la diastole è il ciclo meno la sistole. A 60 battiti al minuto il ciclo
cardiaco è un secondo, perché ovviamente sono 60 secondi, la sistole è fissa, 300 millisecondi, la
diastole arriva a 700 millisecondi, tutto quello che resta dal ciclo meno la sistole è la diastole. A
frequenza 100 al minuto il ciclo cardiaco è 600 millisecondi la diastole è 300 millisecondi perché è
quello che resta dal ciclo meno la sistole. A 120 battiti al minuto la diastole si accorcia: 200
millisecondi. A 150 battiti al minuto il ciclo è 400 millisecondi, la diastole è ancora più breve, allora
è chiaro che se la frequenza cardiaca aumenta, il tempo diastolico si riduce e perciò in quel tempo
deve passare una maggior quantità di sangue. E allora deve passare più sangue nell’unità di tempo
attraverso la valvola atrio-ventricolare, perché se la portata, che era 5 litri, deve diventare il triplo
e se la frequenza si incrementa è chiaro che quei 15 litri devono passare in un tempo più breve.
Allora comprenderete perché il soggetto con la stenosi mitralica quando è a riposo non ha sintomi
e quando corre si affanna. L’aumento di questa pressione in atrio sinistro non resta isolato lì,
perché il sangue deve scorrere dal ventricolo destro all’atrio sinistro, allora se aumenta la
pressione all’atrio sinistro, aumenterà a monte, cioè nelle vene polmonari, e da qui nelle venule
polmonari e nei capillari polmonari, nell’arteria, perché il gradiente di pressione deve essere
mantenuto per tutto il circolo, quindi ci sarà un aumento di pressioni nel circolo polmonare.
Qual è l’anello debole del circolo polmonare? Il capillare, che non sopporta pressioni maggiori di
25mm Hg, perché è deputato agli scambi tra il sangue e il liquido interstiziale; questo è governato
da due forze, la pressione idrostatica e la pressione oncotica: l’idrostatica tende a far uscire il
liquido dal capillare, la pressione oncotica lo trattiene. Sono le grosse molecole proteiche che non
sono diffusibili e quindi trattengono il liquido.
Il capillare non sopporta più di 35 mm Hg, perché al di là la pressione oncotica è vinta, ed è più il
liquido che fuoriesce rispetto a quello che è trattenuto all’interno: questo provoca l’edema. La
trasudazione di liquido provoca dapprima un edema interstiziale, quindi interstizio polmonare, che
poi diventerà alveolare, e qui andiamo nel campo dell’edema polmonare acuto: trasudazione
massiva di liquido all’interno delle cavità alveolari con grande ostacolo tra gli scambi tra l’aria e
il sangue. L’edema è una conseguenza di ogni condizione che comporti l’aumento della pressione
capillare polmonare; al di là della capacità della pressione oncotica di trattenere il liquido
all’interno del capillare c’è la trasudazione di liquido, quando l’interstizio è saturo il liquido va a
finire nell’alveolo e provoca disturbi respiratori molto gravi. Il motore del circolo polmonare è il
ventricolo destro e se cresce la pressione nei capillari polmonari deve crescere anche a monte.
Questo è quanto succede in una stenosi mitralica usuale.
C’è un’altra possibilità che si sviluppi un’ipertensione arteriosa polmonare sproporzionata rispetto
a quella della stenosi mitralica: si può verificare per una malattia delle arteriole polmonari. La
malattia comincia con una vasocostrizione, fenomeno funzionale: davanti all’ipertensione
polmonare le arteriole polmonari si “vaso-costringono”, diminuisce la sezione del circolo
polmonare, quindi si crea un’ipertensione polmonare, perché si crea un ostacolo al flusso del
sangue dall’arteria polmonare ai capillari polmonari e chi ne fa le spese è il ventricolo destro.
Inizialmente l’ostacolo è funzionale, col tempo diventa anatomico per degenerazioni anatomiche e
strutturali dell’arteriola polmonare. Si crea perciò un quadro di ipertensione polmonare arteriosa
molto grave, con immediate ripercussioni sul ventricolo destro perché questo è abituato a
generare basse pressioni.
Davanti a pressioni alte entra in crisi, perché mentre il ventricolo sinistro è abituato a lavorare con
180, 220, 240, anche 250 mm Hg durante lo sforzo, il destro lavora con 20, 25, 30, 35 mm Hg,
perciò se deve affrontarne 120 non ce la fa, si dilata e si scompensa. La dilatazione del ventricolo a
sua volta fa sì che insorga un’insufficienza tricuspidale, perché allontana i foglietti della valvola
tricuspide tra di loro dando come conseguenza il rigurgito tricuspidale: il ventricolo destro
pomperà una parte del suo contenuto ematico in arteria polmonare e una parte in atrio destro. Ci
sarà un’insufficienza tricuspidale funzionale dovuta a questa dilatazione del ventricolo destro.
Con l’insufficienza tricuspidale si instaureranno una serie di alterazioni fisiopatologiche importanti,
ci sarà la stasi del circolo venoso sistemico, perché durante la sistole il ventricolo destro pomperà
il sangue in atrio, la pressione in atrio crescerà, e se cresce la pressione in atrio, crescerà nelle
vene cave e a sua volta se cresce in queste, crescerà nelle periferiche, quindi ci sarà
un’ipertensione venosa sistemica che si esprimerà con l’edema periferico. L’edema periferico è
dovuto in questo caso alla ipertensione venosa sistemica che consegue alla ipertensione
polmonare e quindi all’ipertrofia e dilatazione del ventricolo destro che risulta infine in
un’insufficienza tricuspidale. Questo percorso ha tutta una sua logica. Ripeto, la stasi venosa
sistemica dipende dal fatto che c’è un grande incremento di pressione in atrio destro durante la
sistole ventricolare proprio perché il ventricolo si sposta in gran parte in atrio, cioè manda più
sangue all’indietro che in avanti, ovvio, perché indietro trova la strada aperta, in atrio ci saranno 4,
5, 6 mm Hg al massimo, nel circolo polmonare ne trova 120, quindi è ovvio che il ventricolo destro
trova molto più comodo svuotarsi all’indietro che in avanti, e allora ci sarà la stasi venosa sistemica
che da un punto di vista clinico anche se queste cose ancora non le dovete dire, si estrinseca con il
turgore giugulare, le vene giugulari diventano turgide, con l’epatomegalia e con gli edemi
periferici, le gambe diventano gonfie proprio a causa dell’ipertensione capillare, perché nei
capillari ci deve essere pressione maggiore di quella che c’è nelle vene, altrimenti il sangue non
proseguirebbe. Allora a questo punto l’aumento della pressione capillare sistemica proverà
l’edema periferico che si accumula agli arti inferiori se il soggetto sta in piedi, o al sacro se il
soggetto sta coricato.
Se uno capisce queste cose, si rende conto che l’edema polmonare è dovuto a un aumento di
pressione capillare polmonare, quello sistemico invece può essere dovuto anche ad altre cause,
per esempio un deficit di proteine del plasma, perché sono queste che trattengono i liquidi
all’interno della membrana, i soggetti che perdono l’albumina con le urine, con la sindrome
nefrotica, hanno gli edemi non perché c’è un aumento di pressione capillare polmonare ma per il
deficit di proteina all’interno dei vasi.
Allora siamo d’accordo con questa stenosi mitralica. Alla dilatazione ventricolare consegue
l’insufficienza tricuspidale, dilatazione dell’atrio destro e congestione venosa sistemica,
compariranno le manifestazioni della stasi venosa, turgore giugulare epatomegalie, ascite, edemi
declivi e tutto questo è detto tricuspidalizzazione della malattia mitralica. La malattia nasce dalla
valvola mitralica, ma finisce per coinvolgere funzionalmente la valvola tricuspide perché non c’è
un’alterazione reumatica (ci può anche essere ma è molto rara), le alterazioni sono invece
secondarie a quelle della valvola mitrale che si è tricuspidalizzata.
La valvola insufficiente è una valvola che non tiene, perché una valvola quando si chiude è fatta
per non permettere il passaggio all’indietro del sangue.
La valvola mitrale è fatta per permettere il passaggio dall’atrio al ventricolo sinistro, ma non
viceversa; con la sistole la valvola si chiude e non c’è passaggio di sangue. La disgiunzione di uno
dei componenti dell’apparato mitralico può far sì che ci sia rigurgito di sangue per il mancato
funzionamento della valvola.
La valvola non è un tutt’uno, è composta da più elementi, i foglietti della valvola, le corde
tendinee, i muscoli papillari, l’anulus (l’anello fibroso al quale sono attaccati i lembi della valvola)
e ci sono ancora l’atrio e il ventricolo che fanno parte dell’apparato mitralico, quindi come vedete
è complesso. La tenuta della valvola, per fare in modo che non refluisca, è legata al perfetto
funzionamento di tutte queste cose. Facciamo un esempio banale: l’anulus è una struttura rigida,
con la contrazione dei muscoli in sistole si restringe in qualche modo; se l’anulus è calcifico, cosa
che succede spesso in soggetti che non sono più giovani, quindi negli anziani, la calcificazione
impedisce un perfetto funzionamento della valvola, perché l’anulus sotto la spinta dei muscoli si
stringe in qualche modo, non si contrae da sé. Quando è calcifico non si può più stringere, quindi è
causa di insufficienza mitralica.
Un altro esempio sono le corde tendinee, quelle propaggini che dai muscoli si attaccano vicino al
margine libero della valvola e che “tengono” se una corda si rompe, e può succedere: questo è
causa di insufficienza mitralica.
La malattia mitralica ma anche l’endocardite provocano alterazione dei lembi della valvola. Il
ventricolo è importantissimo perché la sua dilatazione fa sì che i lembi valvolari che prima non
aprivano, siano in qualche modo separati, quindi basta un’importante dilatazione del ventricolo
sinistro e si genera un’insufficienza mitralica.
Come vedete ciascun elemento è in grado di provocare un’insufficienza mitralica. Il rigurgito di
sangue dal ventricolo all’atrio durante la sistole è una cosa innaturale, un doppio lavoro, come uno
che ha la moglie ma anche l’amante. Il ventricolo manda il sangue in aorta ma anche in atrio,
quindi deve spendere molte più energie. Il cuore deve lavorare di più, si deve dilatare e
ipertrofizzare, allora va incontro a ipertrofia concentrica. L’aumento pressorio stimola l’ipertrofia
concentrica, l’aumento di volume del cuore stimola invece l’ipertrofia eccentrica.
Nell’ipertrofia eccentrica i sarcomeri si dispongono in serie e la fibra si allunga, con la concentrica
invece si dispongono in parallelo e la fibra diventa più spessa.
L’aumento del volume ventricolare aumenta anche la forza di contrazione ventricolare secondo la
legge di Starling, che dice che con lo stiramento della fibra il sarcomero si allunga; fino a 2,2
micron di lunghezza del sarcomero aumenta il numero di ponti fra actina e miosina che si
generano, quindi aumenta la forza di contrazione (e vi prego di non confondere la forza di
contrazione con la “contrattura”?, perché sono due caratteristiche completamente diverse,
entrambe aumentano il rendimento ma la forza è governata dalla legge di Starling). La legge dice
che fino a un certo punto aumenta la forza di contrazione poi a un certo punto diminuisce, quindi
lo scompenso cardiaco è caratterizzato dal fatto che a un certo punto, per un’ulteriore dilatazione
del cuore, la gittata diminuisce. La pressione in atrio sinistro aumenta, la gittata anterograda si
riduce e c’è il sovraccarico di volume che determina l’ipertrofia eccentrica del ventricolo sinistro.
A condizionare l’insufficienza mitralica ci sono diversi fattori.
Uno di questi è la compliance, cioè la distensibilità dell’atrio sinistro. L’atrio sinistro è scarsamente
distendibile per cui con un’insufficienza mitralica acuta causata ad esempio dalla rottura di un
muscolo papillare non c’è il tempo perché l’atrio si dilati per accomodare una grande quantità di
sangue e il malato muore di edema polmonare in mezz’ora, perché la pressione che si realizza in
atrio sinistro è altissima e l’atrio non è distensivo. Se invece l’insufficienza mitralica è cronica,
quindi comincia con una lieve, e si aggrava nel tempo, l’atrio si dilata lentamente, quindi anche se
è poco “compliante”, dilatandosi lentamente riesce ad accomodare una gran quantità di sangue
senza che vi sia un eccesso di pressione all’interno dell’atrio stesso. L’edema polmonare
sopraggiunge quando si rompe un muscolo papillare perché l’atrio è impreparato, il rigurgito di
sangue è massivo e nell’atrio si viene a creare una pressione come quella del ventricolo in sistole,
per cui altissima, perché ovviamente la valvola non funziona affatto.
Ecco cosa succede nell’insufficienza mitralica. Allora il problema è se l’insufficienza si instaura
acutamente, come con la rottura di un muscolo papillare o cronicamente, cioè comincia in
maniera molto lieve e poi progredisce nel tempo. Nelle forme acute il quadro è drammatico
perché la pressione atriale sinistra aumenta improvvisamente e l’atrio è rigido, il contrario accade
lentamente e progredisce nel tempo.
La stenosi aortica è il corrispettivo di quella mitrale, ma per un’altra valvola. Questa è dovuta ad
un restringimento dell’orificio valvolare, dovuto a sua volta a processi patologici che colpiscono i
lembi, le commissure o l’anello valvolare. Voi sapete che la valvola aortica è normalmente
composta da tre lembi, ma in alcuni soggetti possono essere due. La valvola stretta provoca una
difficoltà nello svuotamento del ventricolo sinistro, quindi il sangue ha difficoltà a passare dal
ventricolo sinistro all’aorta. Per ogni stenosi si crea un gradiente tra le due camere, in questo caso
tra il ventricolo e l’aorta, tanto maggiore quanto più stretta è la valvola, perché il gradiente serve
a superare l’ostacolo.
A differenza di quella che c’è nell’insufficienza mitralica, qui avremo un’ipertrofia da sovraccarico
di pressione, quindi sarà concentrica, perciò avremo un aumento dei sarcomeri in parallelo e non
in serie.
L’eziologia può essere congenita o acquisita, tuttavia spesso quella acquisita è in realtà congenita.
La valvola aortica ha tre cuspidi, ma un certo numero di soggetti è possibile che nasca con due
cuspidi perché due sono fuse tra loro. Questo non da alcun problema perché la valvola si apre e si
chiude ugualmente, non è stenotica né insufficiente. Solo che a causa dell’alterazione anatomica, il
trauma che la valvola soffre ad ogni sistole (e sono 100.000 al giorno) fa sì che si alteri nel tempo e
diventi stenotica o insufficiente, o entrambe le cose.
La cardiopatia congenita si rileva di rado in età infantile, spesso succede invece in età adulta o
avanzata, proprio perché la valvola aortica bicuspide degenera più facilmente (ma degenera anche
la tricuspide) perché negli anziani diventa non di rado stenotica a causa del continuo movimento
“apri/chiudi” che finisce per provocare un trauma. Avremo l’inspessimento, la fibrosi, la
calcificazione e infine la fusione a livello delle commissure, per la gittata di calcio che dal bulbo
aortico va a finire sui lembi. Noi oggi vediamo una gran quantità di anziani con stenosi aortica
degenerativa da fibrocalcificazione dei lembi; quella reumatica è molto rara, la riscontravamo
quando la malattia reumatica era in auge, ora è in ribasso. Al di sotto dei 70 anni la valvola
tricuspide è responsabile al 50% dei casi di stenosi aortica; al di sopra dei 70 la metà dei soggetti
con stenosi aortica ha una forma degenerativa da fibrocalcificazione dei lembi, mentre la forma da
valvola bicuspide è molto più rara.
L’area valvolare misura 1.6 /2.6 cm2; la riduzione dell’ostio a ¼ del normale o meno, provoca un
gradiente superiore a 50 mm Hg e voi comprenderete con facilità che più la valvola è stretta più
gradiente ci vuole, più ipertrofia ventricolare sinistra ci vuole, perché per superare quell’ostacolo
ci vuole un’ipertrofia marcata.
Il gradiente pressorio è proporzionale all’entità dell’ostruzione. Lo stimolo del sovraccarico di
pressione provoca un’ipertrofia concentrica.
L’insufficienza aortica è come il corrispettivo per la valvola mitrale: la condizione in cui la valvola
aortica non è in grado di impedire che il sangue torni indietro, cioè rigurgiti durante la diastole. La
valvola è fatta per permettere il flusso solo in senso anterogrado dal ventricolo sinistro ai tessuti,
attraverso tutto il circolo, non per tornare indietro. Ogni insufficienza valvolare ha lo stesso tipo di
situazione. Può essere congenita o acquisita, l’eziologia è essenzialmente simile a quella della
stenosi aortica con in più l’endocardite infettiva, malattia delle valvole che deriva dal fatto che dei
germi patogeni si localizzino in queste valvole e quindi provochino un’infezione. Si tratta di una
malattia molto grave, difficile da curare; molto spesso è anche colpa dei medici perché hanno il
vizio di dare l’antibiotico appena si presenta una febbre. In alcuni casi, purtroppo non pochissimi,
l’antibiotico mette per un po’ a tacere il germe, ma non lo uccide. Dopo alcuni giorni la febbre
torna, di nuovo danno l’antibiotico e di nuovo la febbre si riduce, e tutto questo fa sì che il
batterio piano piano distrugga la valvola. Perciò ricordate di non usare gli antibiotici in maniera
scriteriata, capiate prima cosa c’è sotto, perché dovete capire qual è l’antibiotico giusto per isolare
il germe e non è detto che lo azzecchiate, e poi con un’endocardite infettiva le cose vanno male.
L’insufficienza aortica è simile a un’insufficienza mitralica per le conseguenze emodinamiche
immediate.
Un’insufficienza acuta è quella che può verificarsi improvvisamente, come quando la valvola è
distrutta da un batterio, ed è molto grave perché una gran quantità di sangue rigurgita dall’aorta
in ventricolo sinistro in diastole e questo provoca un’ipertensione in diastole al livello del
ventricolo sinistro. In diastole deve arrivare il sangue dall’atrio e se in ventricolo c’è pressione alta,
in atrio deve essere ancora più alta, e così via nei capillari. Se l’insufficienza aortica acuta si
instaura senza che possa instaurarsi quel processo di ipertrofia eccentrica che è caratteristico del
sovraccarico di volume, ecco che la situazione è drammatica . Diversamente una forma cronica da
il tempo di dilatarsi al ventricolo sinistro, così aumenta in atrio la forza di contrazione secondo la
legge di Starling.
La dilatazione del ventricolo sinistro è un meccanismo entro certi limiti compensatorio, ma è
anche perverso, perché alla fine si conclude con uno scompenso cardiaco.
La pressione sistolica è aumentata, la diastolica è diminuita, infatti a volte si può fare la diagnosi
con la misurazione della pressione, perché in sistole una gran quantità di sangue invade l’albero
arterioso e quindi la pressione sistolica è alta, ma subito dopo il sangue se ne torna indietro in
ventricolo e quindi il circolo si svuota di sangue e la pressione diastolica sarà bassa. Se voi avete
200 sistolica su 40 di diastolica è quasi certo che il malato abbia un’insufficienza aortica.
La misurazione della pressione è uno dei grossi danni della nostra epoca, perché alla maggior parte dei
medici non è stata insegnata correttamente. Non è così semplice, perché non soltanto la tecnica non è
chiara a molti, si impara sul campo, così, e nessuno ti insegna. Vi ammonisco a non misurare la pressione a
tutti quanti perché bisogna stare attenti, un numero che voi dite può mettere in allarme una persona, e
magari è sbagliato.
La pressione sistolica è aumentata a causa dell’aumento della gittata sistolica, la diastolica è
diminuita perché il ventricolo si succhia il sangue in diastole e così via, e alla fine si può avere lo
scompenso del ventricolo sinistro, la dilatazione del ventricolo al di là di quanto è possibile
provoca una diminuzione della forza di contrazione e quindi finisce nello scompenso cardiaco.
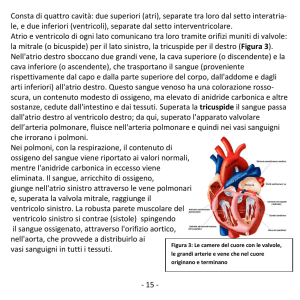
Adesso andiamo alle malattie della tricuspide e della polmonare che sono la copia del cuore
sinistro, solo che sono dall’altra parte.
La stenosi tricuspidale ormai è una malattia eccezionale. L’etiologia è quella reumatica
principalmente, mentre l’insufficienza tricuspidale è comunissima, dovuta a malattie del cuore
sinistro ma anche del destro.
La valvola tricuspide è la più grande del cuore, con un’area di 10 cm2. Fino a 1.5 cm2 non succede
nulla, al di sotto c’è la stenosi. Tenete conto che io non ho mai visto una stenosi tricuspidale.
Le generazioni più giovani potranno vederla in quelli che arrivano dall’Africa, dove la malattia
reumatica è ancora endemica. Non è mai isolata, ma associata ad un vizio mitralico; ci può essere
anche l’alterazione congenita della valvola, ma io non l’ho mai vista. Avete mai sentito parlare del
carcinoma? [non sono sicura che dica carcinoma]. È un tumoretto secernente serotonina
5idrossitriptamina che molto spesso è nel fegato, e da là arriva con facilità nel cuore destro.
Non vi sto a dire cosa succede nella stenosi tricuspidale, perché è analoga alla stenosi mitralica,
cioè c’è un aumento di pressione in atrio destro, per il gradiente di pressione che si stabilisce tra
l’atrio destro e il ventricolo destro. L’atrio destro si deve dilatare perché c’è un gradiente pressorio
e questo provoca un aumento di pressione a monte, cioè nelle vene cave, da qui nelle vene
sistemiche, quindi ci sarà la stasi venosa, cioè epatomegalie, turgore giugulare e così via.
L’insufficienza tricuspidale a differenza della stenosi è comunissima. Qui dentro siamo 200?
Almeno 150 hanno insufficienza tricuspidale. Ovviamente non sono forme cliniche. La tricuspide è
troppo grande per chiudersi bene, riscontriamo una valvola tricuspide incontinente in ¾ della
popolazione mondiale, quindi non è una forma clinica, lo diventa quando l’insufficienza è
importante, e abbiamo visto che le malattie del cuore sinistro, la stenosi mitralica in particolare,
possono dare un’insufficienza tricuspidale importante proprio perché con l’ipertensione
polmonare avremo un’ipertrofia ventricolare destra quindi dilatazione ventricolare destra,
insufficienza tricuspidale e questo consegue a malattie del cuore destro o del cuore sinistro come
forma secondaria; non vi dico alcuna definizione perché è la mancata funzione di uno dei
componenti dell’apparato valvolare tricuspidale, che poi sono identici a quelli dell’apparato
valvolare mitralico e quindi la valvola comporta un rigurgito mitralico.
Ovviamente l’aumento di pressione nell’atrio destro se l’insufficienza tricuspidale è importante
provoca un aumento pressorio in atrio destro, che provoca tutti quei sintomi e segni caratteristici
di questa condizione.
L’insufficienza tricuspidale è una malattia funzionale, cioè non si vede un’alterazione primitiva
della valvola. I lembi valvolari vanno bene, quello che si dilata è il ventricolo destro, in particolare
quando c’è un’ipertensione polmonare a prescindere dalla stenosi mitralica.
La stenosi polmonare è facilmente comprensibile perché è il corrispettivo della stenosi aortica, la
cui eziologia è una sola ed è congenita. La stenosi polmonare è un’alterazione strutturale dovuta
ad un’imperfetta organogenesi caratterizzata da una diminuzione dell’area valvolare polmonare,
dovuta a processi che colpiscono i lembi, le commissure o l’anello, come ogni stenosi valvolare. Il
gradiente pressorio è caratteristico di ogni stenosi, anche della stenosi valvolare polmonare,
perché ovviamente la necessità di far passare il sangue se la valvola è stretta comporta una
differenza di pressione tra la camera a monte e quella a valle della valvola stessa e quindi ci sarà
l’ipertrofia ventricolare destra concentrica, analoga a quella che c’è nella stenosi aortica; nessuna
differenza dal punto di vista fisiologico. Spesso è associata ad altri difetti congeniti, fa parte di un
quadro più complesso. Quello che succede è un sovraccarico di pressione del ventricolo destro,
un’ipertrofia del ventricolo destro che deve mantenere un gradiente pressorio, quindi uno
scompenso del ventricolo destro, che è una cosa abbastanza tardiva nelle cardiopatie valvolari.
Ultimo vizio di cui ci stiamo occupando è l’insufficienza polmonare, la condizione in cui la valvola
polmonare non tiene, nel senso che in diastole il sangue ritorna dall’arteria polmonare in
ventricolo. La condizione organica dell’insufficienza polmonare è molto rara, è quasi sempre
funzionale, proprio perché l’ipertensione polmonare provoca una dilatazione del tronco
dell’arteria polmonare, quindi allontana i lembi tra di loro. Quindi nell’ipertensione polmonare è il
trombo a provocare l’insufficienza e le conseguenze sono diverse, a seconda che si tratti di
un’insufficienza organica o funzionale. Un rigurgito polmonare è presente nel 100% degli esseri
umani, minimo però. L’insufficienza polmonare organica senza ipertensione polmonare è una
sciocchezza, cioè non è una vera malattia, è un’anormalità che non si traduce in nulla di clinico,
perché il gradiente pressorio tra l’arteria polmonare e il ventricolo destro è modesto, non
parliamo di grosse pressioni, parliamo di pressioni che normalmente nell’arteria polmonare di
sono 20, 25, 28 mm Hg, quindi il rigurgito non sarà mai massivo, che fa dilatare di tanto il
ventricolo; nelle forme funzionali invece è diverso, in una forma funzionale dell’ipertensione
polmonare, se nell’arteria polmonare ci sono 100 mm Hg, vedremo un rigurgito importante se la
valvola polmonare perde.
Clelia Filardo