I.I.S.S CAPIZZI sez. SCIENTIFICO
CLASSE IVD
anno scolastico 2012/2013
Prof. Santa Granuzzo
PROGRAMMA DI CHIMICA
MODULO 1
La materia e le sue trasformazioni
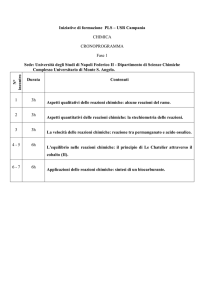
U.D 1 Le Soluzioni
- Che cosa è una soluzione
- La solubilità delle sostanze ( cosa accade quando una sostanza si scioglie in acqua )
- Dipendenza della solubilità dalla natura del soluto e del solvente
- Solubilità di composti covalenti polari e non polari
- Dipendenza della solubilità dei solidi dalla temperatura ( diagramma )
- Fattori che influenzano la solubilità dei gas: pressione e temperatura ( diagrammi )
- La concentrazione ( o titolo ) delle soluzioni
- Le concentrazioni percentuali ( la molarità, la molalità, la normalità, la frazione molare )
- Effetto del soluto sulle proprietà chimico-fisiche del solvente
- Effetto del soluto sulla tensione di vapore del solvente
- Effetto del soluto sul punto di ebollizione e di congelamento del solvente
- Le soluzioni e la pressione osmotica
U.D 2 Le Reazioni Chimiche
-
Cosa sono le reazioni chimiche
Rappresentazione grafica di una trasformazione chimica: l’equazione bilanciata
Alcuni tipi di reazioni ( le reazioni fra ioni )
Le reazioni di ossido-riduzione ( redox )
Il bilanciamento delle reazioni redox in forma molecolare e in forma ionica netta
La massa equivalente
Stechiometria delle reazioni
MODULO 2
Il controllo delle reazioni chimiche
U.D 3 Termochimica e spontaneità delle reazioni
- Le reazioni chimiche e l’energia
Il calore nelle reazioni chimiche
- L’energia delle molecole
- Il primo Principio della Termodinamica e le trasformazioni chimiche
- L’entalpia e il calore di reazione ( proprietà dell’entalpia )
- Le reazioni spontanee e l’energia
- Il secondo Principio della Termodinamica e le trasformazioni chimiche
- L’entropia
- Il meccanismo che premette le reazioni
U.D 4
-
La Velocità delle reazioni e il loro meccanismo
La velocità di reazione
I fattori che influenzano la velocità di una reazione
Natura dei reagenti, concentrazione dei reagenti, influenza della temperatura, presenza di
catalizzatori, stato di suddivisione dei reagenti
La meccanica di una reazione ( l’energia di attivazione ed il complesso attivato)
U.D 5
-
L’Equilibrio chimico
Le reazioni incomplete: lo stato di equilibrio chimico
La legge dell’azione di massa
Equilibrio ed energia libera
Il Principio di Le Chatelier e lo spostamento dell’equilibrio
Equilibri gassosi eterogenei
U.D 6
-
L’Equilibrio nelle soluzioni acquose
L’equilibrio degli elettroliti ( acidi, basi, sali )
La dissociazione ionica dell’acqua
La scala del pH
Ampliamento del concetto di acido e base ( Arrhenius, acidi e basi di Bronsted-Lowrj; acidi
e basi di Lewis )
La forza degli acidi e delle basi
La neutralizzazione
Teoria degli indicatori
I composti anfoteri
I sistemi tampone
Il pH nelle soluzioni saline: l’idrolisi
Gli ioni complessi e l’equilibrio
Equilibri di solubilità
-
U.D 7 Elettrochimica
- L’energia chimica si trasforma in energia elettrica: la pila
- Come funziona una cella elettrochimica: la pila Daniell
- Altri tipi di pile
- L’energia elettrica si trasforma in energia chimica: l’elettrolisi
- Elettrolisi di elettroliti fusi
- Elettrolisi delle soluzioni acquose
- Le leggi quantitative dell’elettrolisi ( Prima e Seconda legge di Faraday )
Docente: Prof. Santa Granuzzo
BRONTE ____________
ALUNNI……………………………………