Evoluzione del modello atomico
La scoperta degli elettroni aveva dato il via alla formulazione di ipotesi e modelli atomici. Tra i primi vi fu quello
“a cariche diffuse” proposto da William Thomson (Lord Kelvin) nel 1904, lo stesso
scienziato che ha dato il nome alla scala delle temperature assolute. L’atomo veniva
immaginato come una nube sferica di carica positiva all’interno della quale si
muovevano gli elettroni. Nel 1906, a seguito della scoperta del protone, Thomson
modificò il suo modello attribuendo natura corpuscolare anche a queste particelle.
Nel frattempo molti scienziati si erano dedicati alle ricerche sulla radioattività, scoperta
quasi per caso nel 1896 da Henry Becquerel.
Si dice radioattività l’insieme dei fenomeni di emissione spontanea di radiazioni α, β e γ da parte di alcun atomi
quali, ad esempio l’uranio. Precisiamo anche che per radiazione si intende l’emissione o trasmissione di energia
attraverso lo spazio, sotto forma di onde che si propagano, oppure di particelle che si proiettano
verso un obiettivo.
Le ricerche portarono alla scoperta che le particelle α, poco penetranti, erano costituite da ioni He+2, di massa
quattro volte maggiore di quella di H+; che le radiazioni β, anch’esse poco penetranti, erano costituite da elettroni
dotati di velocità enormemente maggiore di quella solita e, infine, che le radiazioni γ erano dotate di alta energia,
apparentemente prive di massa e risultavano molto penetranti ed elettricamente neutre.
a) le particelle α e β deviano in
presenza di un campo elettrico
b) il diverso potere penetrante
delle particelle α, β e γ.
Un nucleo instabile emette particella alfa e/o beta e/o raggi gamma per dare origine ad un nucleo più stabile; così
facendo subisce un processo di decadimento. Alcuni nuclei sono instabili per la loro stessa natura, altri, invece,
possono essere resi instabili per bombardamento con particelle accelerate.
Partendo dagli studi di radioattività, l’inglese Ernest Rutherford nel 1902 scriveva: “Non sembra irragionevole
sperare che la radioattività fornisca il mezzo adatto a ottenere informazioni sui processi che accadono all’interno
dell’atomo”. Da qui il suo interesse per i fenomeni di “scattering”: le deviazioni angolari a cui è sottoposta la
traiettoria di una particella carica, in seguito ad un urto con un’altra particella. Tra il 1906 e il 1911, insieme a due
suoi collaboratori, Rutherford eseguì moltissime rilevazioni di α-scattering, impiegando cioè delle particelle α che
venivano indirizzate contro una sottile lamina d’oro. L’esperimento rivelò che:
la maggior parte delle particelle α, positive, attraversava la lamina senza alcuna deviazione, come invece il
modello di Thomson avrebbe indotto a pensare (le cariche positive diffuse nell’atomo avrebbero dovuto respingere
la maggior parte degli ioni He+2 incidenti);
alcune particelle venivano deviate di angoli relativamente piccoli;
solo pochissime particelle venivano respinte come se avessero incontrato nel loro cammino delle cariche positive
di massa elevata.
Rutherford dichiarò qualche anno più tardi:”Fu senz’altro la cosa più incredibile che mi sia mai capitata nella vita.
Era quasi altrettanto incredibile che se avessi sparato un proiettile da 38 mm contro un foglio di carta velina, e mi
fosse rimbalzato addosso!”. Riflettendo su questi risultati Rutehrford ricavò una serie di conclusioni che si possono
sintetizzare come segue:
1) l’atomo è per la maggior parte vuoto, visto che la stragrande maggioranza
delle cariche positive incidenti lo oltrepassano senza incontrare ostacoli;
2) l’atomo non mostra cariche diffuse, ma sembra che quasi tutta la sua massa sia
racchiusa in un piccolo “nòcciolo”, o nucleo, dove è concentrata anche tutta la
carica positiva (si constatò poi che il nucleo ha un diametro centomila volte più
piccolo (10-15 m) di quello atomico (10-10 m));
3) gli elettroni, in numero tale da bilanciare
perfettamente le cariche dei protoni (l’atomo
nel suo insieme si mostrava neutro), ruotano
attorno al nucleo come i pianeti intorno al sole.
Proprio per questa ragione quello di Rutherford viene detto modello planetario, a
cui lo stesso scienziato cercò di conferire dignità razionale sostenendo che
l’equilibrio degli elettroni attorno al nucleo era garantito da orbite circolari
centrate sul nucleo dove la forza di attrazione nucleare è esattamente uguale alla forza centrifuga dovuta alla
rotazione.
Tuttavia questa teoria presentava varie contraddizioni che sembravano davvero insormontabili. Secondo le leggi
fisiche del tempo, una particella carica in movimento avrebbe dovuto perdere gradualmente l’energia sottoforma di
radiazione elettromagnetica e, venendo a prevalere la forza di attrazione nucleare su quella centrifuga, avrebbe
dovuto dar luogo a una traiettoria a spirale fino a cadere sul nucleo, portando alla distruzione dell’atomo.
Per capire meglio la portata dei problemi legati alla questione dell’emissione di radiazioni elettromagnetiche, è
necessario richiamare brevemente alcune nozioni fondamentali sulle radiazioni.
Esercizi
1) Completa correttamente
1897
……………...
scopre l’elettrone
1904
Thomsom
…………………..
………………….
………..
……………….
scopre la
radioattività
……………..
determina la carica
dell’elettrone
………..
Rutherford
…………………..
1932
………….
1909
scopre il neutrone
2) Completa scegliendo correttamente le caratteristiche relative ai fenomeni radioattivi.
raggi
emissione di
potere penetrante
carica
massa
onde/particelle
alto/basso
negativa/neutra/positiva
pari a ….
α
β
γ
3) Associa le seguenti affermazioni al corretto modello atomico, scegliendo tra quelli di Dalton, Thomson e
Rutherford.
a) prevede un atomo con carica positiva diffusa
………………………
b) è compatto e ben definito
………………………
c) vede al suo interno particelle con cariche e velocità diverse
d) prevede una distribuzione spaziale ben diversa per elettroni e protoni
………………………
………………………
e) è essenzialmente pieno
………………………
f) è costituito da un nocciolo centrale
………………………
Soluzioni: 1)Thomson, modello atomico a cariche diffuse, 1896, Becquerel, Millikan, 1911, scopre il nucleo, Chadwick 2)
particelle, basso, positiva, He; particelle, basso, negativa, e-; onde, alto, neutra, nulla
Le radiazioni elettromagnetiche
Esistono molti tipi di onde: quelle che si increspano sulla superficie del mare in
conseguenza di differenti valori di pressione tra una zona e l’altra, quelle di una
corda tesa mossa ad una delle due estremità oppure quelle che si producono quando
un oggetto vibra, per cui le molecole di aria che si trovano in prossimità della
vibrazione vengono compresse e spingono altre molecole vicine lasciando dietro di
sé zone di rarefazione. Ma ci sono anche delle onde che hanno alla base una variazione di un campo elettrico e di
un campo magnetico (come la luce e le onde radio) e che per esistere e propagarsi non richiedono la presenza di un
mezzo materiale. Esse sono dette onde elettromagnetiche e si propagano anche nel vuoto.
In tutti i casi le grandezze caratteristiche di un’onda sono:
la lunghezza d’onda λ (lamda), che si misura in nm (nanometri), rappresenta la distanza tra due massimi
consecutivi dell’onda;
la frequenza ν (ni) corrisponde al numero di vibrazioni nell’unità di tempo e si misura in Hertz ossia
cicli/secondo (ad esempio la frequenza è di 10 Hertz se in un secondo passano 10 creste consecutive);
l’ampiezza A esprime la distanza tra la linea mediana e il massimo dell’onda.
la velocità v è data dal prodotto tra la lunghezza d’onda λ e la frequenza ν:
Agli inizi del novecento la questione della natura delle “onde luminose” era ancora irrisolta: gli studiosi si erano
confrontati a lungo a partire da due teorie contrapposte: una che attribuiva alla luce natura particellare (teoria
corpuscolare), l’altra che le attribuiva una natura legata alla propagazione di energia (teoria ondulatoria).
Nel 1873 James Clerk Maxwell propose che la luce fosse costituita da radiazioni elettromagnetiche ognuna delle
quali formata da una coppia di onde: una che vibra in un campo elettrico, l’altra in un campo magnetico ad esso
perpendicolare. Maxwell sviluppò anche una serie di equazioni matematiche attraverso le quali è possibile
calcolare la quantità di energia che si propaga nello spazio sotto forma di vibrazione.
Le radiazioni elettromagnetiche si muovono a una velocità pari a 3∙108 m/s (cioè 300000 km/s), che corrisponde
alla velocità della luce nel vuoto indicata convenzionalmente con c, e che rappresenta la costante di proporzionalità
tra frequenza e lunghezza d’onda. Ne deriva una serie di equazioni tutte equivalenti:
c
c
c
E’ evidente allora che al crescere della lunghezza d’onda diminuisce la frequenza e viceversa. Nella figura che
segue vengono rappresentate onde di diversa frequenza e corrispondentemente diversa lunghezza d’onda.
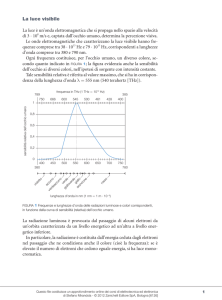
Lo spettro elettromagnetico è la disposizione ordinata di una serie di lunghezze d’onda. Nella figura che segue
sono rappresentate l’insieme di tutte le radiazioni elettromagnetiche e viene mostrato come molte di esse trovino
applicazione in importanti settori della vita quotidiana.
La disposizione ordinata delle lunghezze d’onda della luce solare o luce bianca, che comprende l’intervallo di λ
compreso tra 400 (violetto) e 700 nm (rosso), costituisce lo spettro continuo della luce visibile, e rappresenta solo
una piccola parte delle spettro elettromagnetico.
L’arcobaleno costituisce
uno spettro continuo
Esercizi
1) Le onde del mare che si infrangono sulla spiaggia sono 15 ogni 30 secondi mentre la distanza tra un’onda e
l’altra è di circa 5m. Calcola la velocità delle onde.
……………………………………………………………………………………………………………………..
2) La velocità della luce è di 300000 m/s. Calcola la frequenza di una onda radio di lunghezza d’onda pari a 10 m.
……………………………………………………………………………………………………………………..
3) Calcola la lunghezza d’onda di una radiazione infrarossa di frequenza pari a 3∙1012 cicli/secondo e velocità pari a
quella della luce.
……………………………………………………………………………………………………………………..
4) Una radiazione luminosa ha frequenza pari a 3∙1023 cicli/secondo; in che campo dello spettro si trova la
radiazione?
……………………………………………………………………………………………………………………..
5) Individua il colore rosso a partire dalla coppia di informazioni relative alla lunghezza d’onda e frequenza della
radiazione elettromagnetica che lo contraddistingue.
a) 700 nm; 4,3∙1014 cicli/s
b) 400 m; 7,5∙105 cicli/s
c) 300 nm; 4,3∙1014 cicli/s
d) 3,9∙10-7 m; 7,7∙1014 cicli/s
6) Ordina le radiazioni secondo un’energia crescente:
a) raggi X
b) raggi IR
c) onde radio
d) microonde
e) raggi UV
f) luce gialla
g) luce blu
7) Lo ione sodio colora la fiamma di una caratteristica e intensa luce giallo-arancione con lunghezza
d’onda 589 nm. Calcola la frequenza della radiazione.
………………………………………………………………………………………………………………………
8) Una radiazione monocromatica (cioè di un solo colore) è costituita da fotoni che hanno una lunghezza
d’onda di 450 nm. Quale sarà la frequenza? ………………………………………………………………
Quale la zona dello spettro a cui appartiene la radiazione? ……………………………………………….
Possiamo associare un colore a questa radiazione? Se si, quale? …………………………………………
Soluzioni: 1) 2,65m/s 2) 3·107 s-1 3) 1·10-4 m/ciclo 4) 1·10-\15 m/ciclo 5) a 6) c,d,b,f,g,e,a 7) 5,1·1014 s-1 8) 6,7·1014 s-1,
visibile, rosso
Problemi di risolvere
Il fisico Max Planck si era nel frattempo dedicato allo studio delle radiazioni emesse dai cosiddetti “corpi neri”
(sfere metalliche cave ricoperte di nero fumo) e si era reso conto che la teoria ondulatoria delle radiazioni
elettromagnetiche proposta da Maxwell non era in grado di predire la curva di emissione che era indipendente dal
tipo di materiale mentre dipendeva esclusivamente dalla temperatura del corpo. In particolare si osservava che la
curva presentava un massimo che, aumentando la temperatura, si spostava verso lunghezze d’onda minori.
Un altro problema che non trovava soluzione con la fisica classica erano gli spettri a righe, ottenuti analizzando la
radiazione emessa da sostanze gassose sottoposte ad una scarica elettrica.
La radiazione emessa era discontinua, cioè composta da alcune componenti monocromatiche caratteristiche della
sostanza analizzata. In figura ad esempio vengono analizzati i vapori di elio e pertanto lo spettro a righe così
ottenuto diventa una sorta di sua impronta digitale.
Alti esempi di spettri “a righe” o “discontinui” sono quelli emessi da lampade al mercurio o al neon.
Le leggi di Maxwell prevedevano che le radiazioni fossero il risultato di un’emissione continua di energia e non
spiegavano questi spettri che risultavano “a righe” (con λ caratteristiche e distinte), anziché continui (con tutti i
possibili valori di λ).
La quantizzazione dell’energia
Dopo esperimenti e riflessioni, Planck avanzò l’ipotesi che l’energia della radiazione non venisse emessa in modo
continuo ma per quantità finite e discrete che chiamò quanti o fotoni, di valore proporzionale alla frequenza
secondo una certa costante h, detta appunto costante di Planck (pari a 6,63∙10-34 J∙s). E’ questa la relazione su cui si
fonda la quantizzazione dell’energia:
ΔE=hν
Quando una pallina scivola verso il basso rotolando su un piano inclinato assume nel suo moto tutti i possibili
valori di energia potenziale: si ha cioè una diminuzione continua di energia. Secondo la fisica classica una
particella carica elettrica accelerata doveva irradiare la sua energia in modo continuo e cadere nel nucleo attraverso
un movimento a spirale. Se così fosse si avrebbe il collasso della materia dal momento che l’intero volume atomico
si ridurrebbe al solo nucleo.
Se la stessa pallina cade invece lungo una scala, assume solo alcuni particolari valori di energia potenziale in
corrispondenza dei vari scalini: in questo caso si ha una variazione discontinua di energia (la sua energia è
quantizzata e si dice perciò che assume solo valori discreti).
Quando il sistema da studiare ha massa piccola (dell’ordine degli uma) e velocità grandi (confrontabili con quella
della luce), si deve ammettere che la sua energia sia quantizzata.
Il concetto di quantizzazione ci è più famigliare di quanto non si pensi: è quantizzata la circolazione di denaro, la
materia che sappiamo essere costituita da atomi e molecole, la quantità di corrente che è sempre multiplo della
carica di un elettrone. Anche l’energia di una radiazione può essere pensata allora come una corrente di particelle (i
fotoni) che si propagano verso un obiettivo come fossero pallottole di una mitraglia: si tratta di un bombardamento
discontinuo o discreto.
La quantizzazione dell’energia descriveva perfettamente la radiazione emessa dal corpo nero e, grazie al contributo
di Einstein, permise di spiegare anche l’effetto fotoelettrico, che costituisce la prova più evidente della natura
corpuscolare della luce.
L’effetto fotoelettrico
L’effetto fotoelettrico è il fenomeno fisico caratterizzato dall’emissione di elettroni da una superficie, solitamente
metallica, quando questa viene colpita da una radiazione elettromagnetica, ossia da fotoni aventi una certa
lunghezza d’onda.
L’emissione di elettroni avviene soltanto se la radiazione incidente supera una frequenza minima di soglia.
All’aumentare dell’intensità della radiazione si osserva un aumento del fenomeno di emissione mentre se aumenta
l’energia della radiazione incidente, aumenta soltanto la velocità con cui gli elettroni vengono emessi.
Riassumendo:
Il catodo viene investito da una radiazione di frequenza v = v0.
Si ha emissione di elettroni da parte del catodo.
Il flusso di elettroni viene registrato dall'amperometro che segnala una
determinata intensità di corrente.
Aumentando l'intensità luminosa della radiazione incidente il catodo
viene colpito da un maggior numero di fotoni aventi frequenza v = v0.
Si ha un aumento del numero di elettroni emessi dal catodo.
L'amperometro segnala una intensità di corrente maggiore.
Utilizzando una radiazione di frequenza maggiore, il catodo viene colpito
da fotoni di energia maggiore.
Gli elettroni vengono espulsi con una energia cinetica maggiore pari a:
½·m·v2 = h·v - h·vo