Università degli Studi di Napoli
Federico II
Corso di abilitazione A049
Relazione
La rivoluzione del ‘900, la Meccanica Quantistica
e dualismo Onda-Particella
Elaborata dai corsisti
Dott.re Giuseppe Fico
Dott.re Michele Carannante
Dott.ssa Anna Di Lorenzo
La rivoluzione del ’900
Alla fine del secolo XIX le proprietà dell’Universo,
descritte dalla fisica, sembravano ormai delineate
grazie alla teoria di Newton, alla termodinamica e alla
teoria elettromagnetica di Maxwell,
esposta nell’opera Treatise on magnetism and electricity.
Le fondamentali leggi della Meccanica e dell’elettromagnetismo
consentivano di analizzare ed interpretare coerentemente
quasi tutti i fenomeni naturali conosciuti, da quelli meccanici a quelli termici,
da quelli ottici a quelli ondulatori.
I pilastri di questo edificio erano i principi di conservazione,
in particolare quelli relativi alla materia e all’energia,
i costituenti fondamentali dell’intero universo.
Osservazione sull’evoluzione del concetto di energia:
Inizialmente considerata solo come un attributo
o una caratteristica dei corpi materiali, in seguito,
grazie agli sviluppi del concetto di campo ed al fatto che l’energia,sotto forma
di onda elettromagnetica, può trasmettersi anche nel vuoto,
l’energia acquista la fisionomia di un’entità fisica,
dotata di una sua esistenza autonoma.
Nonostante ciò, i concetti di materia ed energia o
quelli analoghi di particella ed onda,
rimanevano sempre distinti, anzi, contrapposti:
l’energia non ha nulla di materiale,
una radiazione può essere costituita da particelle o,
al contrario, da onde.
In effetti, i corpi materiali opportunamente eccitati (portati, ad esempio,
all’incandescenza) emettono energia sotto forma di
onde elettromagnetiche (raggi infrarossi, luce, ecc..).
E’ chiaro che fenomeni di questo tipo devono essere legati all’intima struttura
delle particelle elementari, certamente più complesse
di quanto si potesse pensare fino alla seconda metà dell’Ottocento.
Ecco dunque i campi di ricerca che risultavano all’epoca
più significativi e promettenti:
•l’analisi approfondita delle radiazioni di ogni tipo;
• l’elaborazione di modelli atomici che spiegassero
tutti i fenomeni conosciuti e che rappresentassero
la sintesi della ricerca scientifica di quasi 3 secoli
Nessuno si aspettava che nei venti anni successivi
la fisica avrebbe subìto una vera e propria rivoluzione
Una delle prime tappe di questa rivoluzione fu la scoperta che
la velocità della luce non cambia mai, comunque si muova l’osservatore
(Michelson e Morley, 1887).
Questo fatto sperimentale costituì la base della teoria
della relatività di Einstein (1905) che portò alla conclusione che
spazi, tempi e masse non sono invarianti,
ma dipendono dalla velocità del sistema di riferimento.
Le idee di Einstein trovarono conferme sperimentali nell’ambito
delle ricerche sulla struttura degli atomi, e ciò,
oltre a costituire un fatto di straordinario rilievo,
evidenzia la necessità di andare oltre i limiti della fisica classica.
Ma altre scoperte ed altre elaborazioni teoriche,
collegate solo in parte con la Relatività,
condussero ad una visione del tutto nuova e sorprendente della realtà fisica.
Basti solo accennare al fatto che materia ed energia vengono a costituire
due aspetti di una stessa entità;
che, analogamente, uno stesso “oggetto” può risultare
un’onda oppure una particella; che l’intervento dell’osservatore
incide inevitabilmente sul comportamento di un sistema fisico microscopico;
che qualsiasi previsione sui fenomeni che si verificano su scala atomica
può avere soltanto un significato probabilistico.
Di qui si capisce quanto sia stata profonda
la rivoluzione concettuale dei primi decenni del Novecento
Le ricerche sulla struttura dell’atomo e sui rapporti tra materia ed energia
aprirono insospettate prospettive anche nello studio dei fenomeni celesti.
L’indagine scientifica sull’infinitamente piccolo
si saldò quindi con l’indagine sull’infinitamente grande
Evidenziamo, ora, alcuni fenomeni fisici non interpretabili
secondo la teoria dell’elettromagnetismo classico,
che hanno indotto ad “azzardare” una visione quantistica della fisica
e che meglio delineano il passaggio
dalla concezione classica a quella quantistica
1. La distribuzione spettrale di radiazioni di un corpo nero;
2. L’effetto fotoelettrico
LA RADIAZIONE
DEL CORPO NERO
La teoria quantistica ha origine dal tentativo di spiegare
la distribuzione di energia emessa da un corpo incandescente.
Tutti i corpi, riscaldati, anche a temperatura ordinaria, emettono radiazioni.
La radiazione emessa dà luogo ad uno spettro continuo,
ma la distribuzione dell’intensità delle varie parti di questo spettro
dipende dalla sostanza emittente
Se, però, questa è un corpo nero, ovvero un oggetto
capace di assorbire completamente onde elettromagnetiche
di qualunque lunghezza d’onda,
lo spettro risulta essere lo stesso
qualunque sia la sostanza e la forma del corpo
Nel 1860 Gustav Robert Kirchhoff dimostrò che si può ottenere
un dispositivo che si comporta come un corpo nero ideale
mantenendo a temperatura uniforme le pareti di un contenitore cavo
(in pratica, un forno) dalla superficie interna irregolare,
nel quale è praticato un piccolo foro.
Le pareti calde emettono ed assorbono
continuamente onde elettromagnetiche e solo una piccolissima frazione
di tale radiazione riesce ad uscire dalla cavità
Allo stesso modo, le onde provenienti dall’esterno e che giungono
in corrispondenza del foro
entrano nella cavità e, dopo diversi processi di diffusione sulle pareti,
vengono assorbite.
Come spiega l’elettromagnetismo classico l’emissione del corpo nero ?
Gli atomi delle pareti che emettono radiazioni
si possono schematizzare come oscillatori armonici,
oscillanti periodicamente con una certa frequenza,
indipendente dall’ampiezza e caratteristica di ciascun oscillatore,
ed emettenti radiazioni con la stessa frequenza
Inoltre, secondo le leggi della meccanica e dell’elettromagnetismo,
l’energia di ognuno di questi oscillatori può assumere qualsiasi valore che,
secondo la seguente legge di “Rayleigh e Jeans” vale
2 2
I 2
c
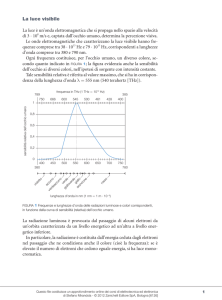
Osservando il grafico in figura, si può notare che per una data T,
la curva che rappresenta I in funzione di è una parabola
con il vertice nell’origine degli assi la quale, però,
coincide con la curva sperimentale
solo nel campo delle basse frequenze ma poi se ne discosta decisamente
per prendere tutt’altro andamento.
Inoltre, l’intensità totale dell’energia emessa sotto forma
di onde elettromagnetiche, data da
Id
0
rappresentata dall’area racchiusa dalla curva dell’intensità
e dall’asse delle ascisse, secondo la formula di Rayleigh-Jeans
dovrebbe essere infinita, ma ciò è ovviamente assurdo.
Fu nel 1899 che Planck scoprì quale era il punto in cui bisognava staccarsi
dalle leggi classiche per giungere ad un risultato
in totale accordo con l’esperienza.
Egli suppose, per puro artificio di calcolo, che ogni oscillatore
potesse emettere o acquistare energia non con continuità,
ma per salti di una certa grandezza ,
ed assegnando ad essa un valore finito
= h
proporzionale alla frequenza propria dell’oscillatore, con h costante,
si arriva alla formula di Planck:
2 2
I 2
c
h
e
h
KT
1
la quale, assegnando ad h il valore
h = 6.625 10-27 erg sec (nel sistema CGS)
rappresenta esattamente le curve sperimentali per ogni valore di T.
Si nota, inoltre, che per ciascuna curva sperimentale il massimo
si sposta verso frequenze più elevate al crescere della temperatura.
La prima interpretazione data da Planck alla sua formula fu che l’energia
avesse una struttura discontinua,
ovvero si presentasse sempre in quantità multipla di h,
quantità elementare che chiamò per l’appunto quanto;
di conseguenza, la teoria successiva che si sviluppò si chiamò teoria dei quanti.
EFFETTO FOTOELETTRICO
Il concetto di quanto di energia venne ripreso da Einstein nel 1905,
che lo utilizzò per superare altre contraddizioni tra teoria e fatti sperimentali.
Uno di questi era proprio l’Effetto Fotoelettrico
(un corpo colpito da radiazioni di frequenza elevata-raggi ultravioletti,
raggi x o raggi -emette elettroni),
che è ritenuto una delle più stringenti conferme della teoria quantistica.
Fu scoperto dal fisico tedesco Heinrich R. Hertz nel 1887
Egli scoprì che, illuminando con raggi ultravioletti una superficie metallica,
questa si caricava positivamente.
Successivamente il fisico tedesco Wilhelm Hallwachs scoprì che
illuminando con luce ultravioletta una superficie metallica carica negativamente,
questa perdeva tutta la sua carica negativa;
se invece la superficie era carica positivamente rimaneva carica.
Le cariche negative potevano quindi lasciare una superficie isolata,
mentre quelle positive no
Nel 1899 il fisico ungherese Philipp Lenard misurò il rapporto e/m
delle particelle strappate alla superficie metallica e scoprì che erano elettroni.
La luce ultravioletta passa attraverso la finestrella di quarzo
e colpisce la lastra metallica.
Gli elettroni che lasciano la lastra sono accelerati da una d.d.p.V
fino alla velocità v, secondo la relazione
e V = 1/2 m v2
Gli elettroni sono poi accolti nell’elettrodo.
Un campo magnetico B diretto perpendicolarmente al piano della slide
deflette gli elettroni su un altro elettrodo.
Vale allora la relazione
e v B = mv2 / R
con R raggio di deflessione
Ricavando v da questa seconda relazione
e sostituendola nella prima, in cui va isolato v2, si ha immediatamente
e / m = 2V / B2R2
in cui tutte la grandezze a secondo membro sono note o misurabili
e si può quindi calcolare il valore di e / m.
Lenard trovò anche le leggi sperimentali
che regolano l’Effetto Fotoelettrico
1. L’effetto ha luogo solo se la frequenza della radiazione incidente supera
un certo valore 0 ( “soglia fotoelettrica”).
Per frequenze maggiori l’energia degli elettroni emessi è pari a
Ee ~ ( vr – v0)
La frequenza di soglia dipende dal tipo di materiale
utilizzato per realizzare la lastra
2. Gli elettroni escono dal metallo con una energia cinetica,
e quindi con una velocità di fuga,
che può variare da zero ad un valore massimo Tmax
che dipende solo dalla frequenza
della radiazione incidente e non dalla sua intensità,
contrariamente a quanto prevede la teoria classica dell’elettromagnetismo;
Precisamente si ha:
Tmax= h(-0) (relazione di Einstein) dove h è la costante di Planck.
3. Il numero di elettroni emessi per cm e per secondo è proporzionale
all’intensità della radiazione incidente
mentre l’energia massima degli elettroni è indipendente da questa.
4. L’intensità del fascio influenza solo l’intensità della corrente.
Interpretazione del fenomeno basata sull’elettromagnetismo classico
la radiazione incidente penetra negli strati più superficiali del metallo
e investe gli elettroni in esso contenuti,
sottoponendoli ad un campo elettrico rapidamente alternato;
gli elettroni vengono, così, costretti ad oscillare e,
se le oscillazioni sono abbastanza ampie,
essi vengono strappati dall’atomo cui appartengono e lanciati fuori dal corpo
Secondo questa teoria,
gli elettroni dovrebbero essere lanciati con velocità tanto maggiore
quanto più forte è il campo elettrico della radiazione, e,
quindi, quanto più questa è intensa (a parità di frequenza ),
il che, invece, non avviene affatto.
I risultati sperimentali
diventano
invece comprensibili
grazie all’ipotesi di Einstein.
Secondo la teoria di Einstein quindi ogni radiazione
(e quindi anche la luce di una data frequenza v consiste di particelle di etere)
è costituita da corpuscoli, detti fotoni,
ciascuno dotato di una quantità di energia
Efotone = h (il famoso quanto di Planck)
Sulla base di questa teoria “corpuscolare” della luce,
la spiegazione dell’effetto fotoelettrico è immediata.
Un atomo, colpito da un fotone, riceve, tutta in una volta,
l’energia h, sotto forma di energia cinetica.
Muovendosi attraverso il metallo, l’elettrone perde parte della sua energia:
tale energia è una costante tipica del metallo
ed è chiamata “lavoro di estrazione”
(W0 lavoro per strappare un elettrone dall’atomo e farlo uscire dal metallo).
L’energia “netta” che possiede quindi un elettrone è data da
E = h - W0
Se la frequenza della radiazione incidente è sufficientemente elevata
allora risulta
h> W0 e quindi E > 0
L’elettrone può pertanto lasciare il metallo
e la sua energia di fuga sarà tanto maggiore
quanto maggiore è la frequenza della radiazione incidente.
L’elettrone verrà espulso con una energia
Tmax = h - W0
ed, essendo W0 = h0,
risulta
Tmax = h - h0 = h( - 0)
in accordo con le osservazioni sperimentali.
Questo è il valore massimo
perché l’elettrone può sprecare un po’ di energia in urti all’interno del metallo.
Se invece la frequenza è troppo bassa allora risulta
h < W0 e quindi E < 0
l’elettrone non riesce a lasciare il metallo
resta pertanto giustificata
l’esistenza
della frequenza di soglia
0 =
W0
h
Dualismo Onda – Corpuscolo
E’il concetto secondo il quale una radiazione elettromagnetica
si può propagare come un’onda,
quando le dimensioni degli ostacoli sono confrontabili
con la lunghezza dell’onda,
ma può scambiare con gli altri corpi dotati di massa
la propria energia e la quantità di moto come un’effettiva particella,
benché priva di massa.
Quindi particelle dotate di massa
come gli elettroni,
sotto determinate condizioni,
si propagano nello spazio
presentando fenomeni di diffrazione.
Il dualismo onda – corpuscolo è quindi applicabile a
1. radiazione elettromagnetica che scambia energia quantizzata con la materia,
comportandosi come una particella priva di massa (il fotone),
2. particelle con massa che si propagano
manifestando effetti tipicamente ondulatori
come l’interferenza o la diffrazione
(le onde elettromagnetiche).
Le scoperte sperimentali e le idee innovative e rivoluzionarie di Einstein
Favorirono la teoria corpuscolare della luce di Newton
Quindi nella fisica classica, se un fenomeno è descritto
dal modello corpuscolare,
ciò esclude a priori la possibilità
che possieda caratteristiche proprie delle onde,
e vale anche il viceversa.
Un’onda, se è tale, è un profilo
che si sposta trasportando energia, ma non materia,
pertanto non può avere caratteristiche corpuscolari.
Tali modelli non devono essere accettati in modo esclusivo,
ma si applicano a seconda delle condizioni
in cui avviene il fenomeno
Un’onda può essere trattata come una particella o un insieme di particelle
se la lunghezza d’onda è molto minore degli ostacoli
o delle fenditure che incontra;
se invece la lunghezza dell’onda è dello stesso ordine di grandezza degli ostacoli,
allora il modello ondulatorio spiega la diffrazione e l’interferenza
Anche per le particelle è lo stesso:
quando le lunghezze d’onda a loro associate
sono molto minori
delle dimensioni degli oggetti con cui la particella interagisce,
quest’ultima mantiene le caratteristiche corpuscolari;
se invece le lunghezze d’onda sono confrontabili con quelle atomiche
si manifestano fenomeni di diffrazione e interferenza da fenditure
Questa proprietà di dualità
che si presenta in natura
solitamente viene chiamata
dualismo onda-corpuscolo
(onda-particella).
La Fisica dei quanti ha avuto il merito di evidenziare
sia le caratteristiche corpuscolari della luce e delle radiazioni,
in genere classicamente considerate onde,
sia le caratteristiche ondulatorie della materia,
trattata invece dal punto di vista classico come singola particella
o come agglomerato di particelle.
LA RELAZIONE DI DE BROGLIE
Louis Victor Pierre de Broglie
(Dieppe 1892 – Louveciennes 1987),
fisico sperimentale, sviluppò in forma organica
l’idea originale del dualismo onda-corpuscolo
nella sua tesi di dottorato (1924),
per la quale fu insignito del premio Nobel nel 1929.
Successivamente divenne convinto sostenitore
delle applicazioni della meccanica quantistica
in ambito biofisico.
Nel 1961 fu insignito della prestigiosa onorificenza
della Gran Croce della Legion D’onore.
Morì all’età di 94 anni.
Secondo la teoria classica dell’elettromagnetismo
le radiazioni elettromagnetiche
si propagano come un’onda
che nel vuoto ha velocità
c = 3 108 m/s
Secondo la teoria dei quanti
Se le radiazioni interagiscono
con la materia
possono essere considerate
particelle
dotate di energia e impulso
Ipotesi di De Broglie:
Come i fenomeni luminosi,
anche le particelle ammettono
la natura ondulatoria.
De Broglie pensava che il moto delle particelle materiali
fosse “guidato” da “onde pilota”
che si propagano nello spazio insieme alle particelle.
Per lui gli elettroni (onde elettroniche) hanno lunghezza d’onda
λ = h/q = h/mv (h=6.626 10-34Js costante di Planck)
Questa equazione è detta Relazione di De Broglie
La frequenza delle onde è legata all’energia
E = hf (energia della luce quantizzata di ciascun fotone)
dell’elettrone dalla relazione
f = E/h.
Il momento angolare di un
corpo puntifome di massa m
che
si muove con velocità v è
Dalla quantizzazione
del momento angolare
si ottiene
mvrn = nh/2π → qrn= nh/2π
q = h/ λ → qrn=( h/ λ)rn = nh/2 π →
nλ = 2πrn = Cn
L = mR x v = R x p
dove R è il vettore posizione
e
p = mv è la quantità di moto
In definitiva, si ottiene
nλ = Cn
cioè
l’n-esima orbita (circolare) del Modello di Bohr
deve contenere un numero intero
di lunghezze d’onda.
. In pratica, per n = 1 la prima orbita è descritta
da un’onda di lunghezza λ,
per n = 2 la seconda orbita
contiene due lunghezze d’onda,
per n = 3 tre lunghezze d’onda
e così via
La situazione è perfettamente analoga
al semplice caso della corda vibrante.
Se L è la lunghezza della corda,
si possono associare le onde stazionarie
con lunghezza d’onda
λ = 2L/n
Le onde stazionarie corrispondono a energie quantizzate
Fine