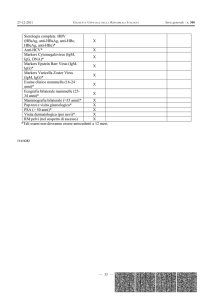
Anaplasma phagocytophilum
IFA IgM
(In Italiano)
IFA per IgM anti-Anaplasma
phagocytophilum
REF IF1450M
Rev. H
Saggio di immunofluorescenza indiretta (IFA) per la
ricerca di anticorpi umani di classe IgM specifici per
gli Anaplasma phagocytophilum
Questo foglietto illustrativo è associato esclusivamente ai
prodotti per l'esportazione e non è destinato alla
distribuzione negli Stati Uniti.
Al di fuori degli Stati Uniti:
per uso diagnostico in vitro
APPLICAZIONI
Il test di immunofluorescenza indiretta della Focus Diagnostics per la ricerca di anticorpi (IFA) di classe IgM specifici per Anaplasma phagocytophilum viene
usato per l'individuazione e la semi-quantificazione nel siero umano degli anticorpi di classe IgM specifici per gli Anaplasma phagocytophilum e come strumento
nella diagnosi di Anaplasmosis granulocitica umana (Human Granulocytic Anaplasmosis = HGA).
SOMMARIO E SPIEGAZIONE DEL TEST
In 2001, Dumler et al hanno proposto di classificare l’agente responsabile dell’HGA come Anaplasma phagocytophila1. Al termine di una revisione della
nomenclatura, Anaplasma phagocytophilum è stato accettato come nome corretto. I generi Anaplasma, Ehrlichia, Cowdria, Neorickettsia e Wolbachia
comprende un gruppo di batteri precedentemente classificati secondo caratteristiche morfologiche, ecologiche, epidemiologiche a cliniche. Al contrario, analisi
genetiche condotte recentemente hanno proposto che i generi siano suddivisi pressapoco come segue:
1.
2.
3.
4.
Anaplasma (comprendente i gruppi Ehrlichia phagocytophila, Ehrlichia platys ed Ehrlichia bovis)
Ehrilichia (comprendente Cowdria ruminantium)
Wolbachia
Neorickettsia (comprendente Ehrlichia sennetsu e Ehrlichia risticii)
Non esistono differenze tra E. phagocytophila, Ehrlichia equi e l’agente dell’ehrlichiosi granulocitica umana (HGE) tali da giustificare una definizione di specie
separata.
A. phagocytophilum fu identificato per la prima volta tra il 1990 e il 1993 in Minnesota e in Wisconsin, dove si osservarono un certo numero di pazienti affetti da
una malattia febbrile acuta. Nonostante l'esame microscopico dei granulociti di questi pazienti rivelasse delle microcolonie associate alle membrane (morule),
tutti gli sforzi iniziali per ottenere delle colture di questi microrganismi non ebbero successo. Chen et al. sono riusciti ad identificare l'agente come un membro
del genogruppo E. phagocytophila2 mediante l'utilizzo della PCR, mentre il suo isolamento da cellule HL60 fu realizzato in seguito da parte di Goodman et al3.
L'anaplasmosis granulocitica umana è una zoonosi trasmessa da zecche adulte e in forma di ninfe: in particolare Ixodes scapularis, la zecca dei cervi, negli Stati
Uniti e la zecca Ixodes ricinus in Europa4,5. Negli U.S.A. l'agente eziologico della A. phagocytophilum è stato riconosciuto nelle regioni medio-occidentali
superiori, in quelle nord-orientali e nella California settentrionale. In Europa i tassi di sieropositività variano dal 3 al 17% dei pazienti che dichiarano di essere
stati morsi dalle zecche Ixodes in Italia, Svezia e Svizzera6. A causa dell'artropode vettore in comune, si possono verificare coinfezioni con Borrelia burgdorferi,
l'agente eziologico della malattia di Lyme7.
Nella maggior parte dei pazienti le manifestazioni cliniche dell'HGA si rivelano inizialmente con sintomi simili a quelli dell'influenza, inclusi febbre, dolori
muscolari, rigidità, cefalea e, spesso, eritemi. Le indagini di laboratorio rivelano valori leggermente elevati di aspartasi-aminotrasferasi, lattato-deidrogenasi,
creatinina e velocità di sedimentazione degli eritrociti. Bakken et al. hanno riportato dei dati in cui si dimostra l'esistenza di una correlazione inversa tra la
probabilità di infezione di HGA e i valori del numero assoluto dei globuli bianchi e/o delle piastrine8. L'HGA risponde in maniera favorevole al trattamento con
doxiciclina o tetraciclina, con cessazione della febbre entro 48 e guarigione completa entro sette giorni.
I pazienti con A. phagocytophilum mostrano spesso una risposta immunitaria decisa contro questa malattia. In genere, quando non si effettua alcun trattamento, si
osserva un aumento dei livelli di IgM, che diventano individuabili in genere 3 – 5 giorni dopo l'inizio dell'infezione o 24 ore dopo la prima insorgenza della
febbre. Tali livelli si riducono fino a raggiungere valori al di sotto della soglia di individuabilità in circa 30 – 60 giorni. I livelli di IgG sono invece individuabili
soltanto 7 – 10 giorni dopo l'inizio dell'infezione, raggiungono un massimo a circa 14 – 21 giorni e persistono per circa un anno. I tassi di sieropositività rispetto
sia alle IgG che alle IgM tendono a raggiungere dei picchi in luglio, agosto e settembre.
L'osservazione diretta dell'agente eziologico della A. phagocytophilum nei granulociti periferici è possibile soltanto nel 20% dei pazienti esaminati8 e perciò non
rappresenta un test diagnostico sufficientemente sensibile. Più affidabili sono invece le metodiche di sierologia, incluso il western blot e l'immunofluorescenza
indiretta. La tecnica più usata per la diagnosi di HGA è il test di IFA, che deve includere la ricerca degli anticorpi specifici sia di classe IgG che IgM per
garantire il massimo possibile di sicurezza.
Il saggio di IFA della Focus Diagnostics per la ricerca di IgM specifiche per gli antigeni dell' Anaplasma phagocytophilum utilizza cellule HL60 infette del ceppo
HGE-1. Ogni vetrino contiene dodici pozzetti.
PRINCIPIO DEL TEST
Il saggio di immunofluorescenza indiretta (IFA) è un procedimento in due fasi, del tipo "sandwich". Nella prima fase il siero del paziente viene inizialmente
diluito nella soluzione di pre-trattamento per IgM, per poi essere depositato negli appositi pozzetti sul vetrino, a contatto col substrato, e infine incubato.
Successivamente all'incubazione il vetrino viene lavato in PBS per rimuovere gli anticorpi del siero che non si sono legati. Nella seconda fase i pozzetti con gli
antigeni vengono ricoperti con anticorpi fluorescinati anti-IgM umane. Il vetrino viene poi incubato per consentire ai complessi antigene-anticorpo di reagire con
gli anticorpi fluorescinati anti-IgM. Dopo essere stato lavato, asciugato e montato, il vetrino viene esaminato usando un microscopio a fluorescenza. Le reazioni
positive appaiono come morule fluorescenti, di un brillante verde mela. I valori limite di titolazione, semiquantitativi, vengono ottenuti esaminando diluzioni
seriali dei campioni positivi.
IFA per IgM anti-Anaplasma phagocytophilum
Pagina 2
MATERIALE INCLUSO
Il kit per il test IFA della Focus Diagnostics per lea ricerca di IgM anti- A. phagocytophilum contiene reagenti a sufficienza per eseguire 120 analisi.
Vetrini con substrato per IgM
REF
IF1404
Ag
IgM Substrate Slides
Dieci vetrini contenenti dodici pozzetti ciascuno. Ciascun pozzetto contiene cellule inattivate infettate con A. phagocytophilum. Quando conservati a 2 – 8°C i
vetrini sigillati rimangono stabili fino alla data riportata sull'etichetta dei pacchetti. Per evitare la condensa, portare i vetrini a temperatura ambiente prima di
aprire i pacchetti sigillati.
Coniugato per IgM, 3.3 mL
REF
IF0002-3
CONJ
IgM
IgM Conjugate, 3.3 mL
Una boccetta di anticorpi fluorescinati di capra contro le IgM umane, specifici per la catena mu, purificati per affinità. Contiene il colorante Evan's Blue insieme
a stabilizzatori di proteine e conservanti. Il coniugato è stabile a 2 – 8°C fino alla data riportata sull'etichetta. portare a temperatura ambiente prima dell'uso. Cicli
ripetuti di congelamento e scongelamento sono deleteri e dovrebbero essere evitati.
Controllo Rilevabile per IgM, 0.3 mL
REF
IF1412
CONTROL
>
IgM Detectable Control, 0.3 mL
Una boccetta di siero umano preparata alla diluizione da usare nel saggio. Contiene conservanti. Quando conservato a 2 – 8°C il controllo Rilevabile è stabile
fino alla data riportata sull'etichetta. Per conservazioni a lungo termine, preparare aliquote di 25 µL e conservarle a ≤ –70°C. Non usare in caso di torbidità,
decolorazione o altri segni di contaminazione batterica. portare a temperatura ambiente prima dell'uso. Cicli ripetuti di congelamento e scongelamento sono
deleteri e dovrebbero essere evitati.
Controllo Non Rilevabile, 0.25 mL
REF
IF1411
CONTROL
<
Non-Detectable Control, 0.25 mL
Una boccetta di siero umano preparato alla diluizione da usare nel saggio (cioè di 1:20). Contiene conservanti. Quando conservato a 2 – 8°C è stabile fino alla
data riportata sull'etichetta. Non usare in caso di torbidità, decolorazione, o altri segni di contaminazione batterica. portare a temperatura ambiente prima dell'uso.
Non diluire. Cicli ripetuti di congelamento e scongelamento sono deleteri e dovrebbero essere evitati.
Soluzione di pre-trattamento per IgM, 12 mL
REF
IF0609
DIL
IgM
IgM Pretreatment Diluent, 12 mL
Una boccetta di PBS contenente siero di capra monospecifico contro le IgG umane, con conservanti. Stabile a 2 – 8°C fino alla data di scadenza riportata
sull'etichetta. portare a temperatura ambiente prima dell'uso.
Mezzo di montaggio, 2.5 mL
REF
IF0007
REAG
MONT
Mounting Medium, 2.5 mL
Una bottiglia contagocce contenente glicerolo tamponato con PBS a pH 7.2 ± 0.1. Contiene conservanti. Stabile a 2 – 8°C fino alla data di scadenza riportata sull'
etichetta. portare a temperatura ambiente prima dell'uso.
PBS
REF
IF0005
BUF
PBS
Una boccetta di fosfato tamponato salino (PBS) in polvere. Ricostituire in 1 Litro di acqua distillata (o purificata). La soluzione così ottenuta è un tampone 0.01
M con pH 7.2 ± 0.1. Prima e dopo della ricostituzione conservare il PBS a 2 – 8°C. portare a temperatura ambiente prima dell'uso. Non usare in caso di
torbidità, decolorazione o altri segni di contaminazione batterica.
MATERIALE RICHIESTO MA NON INCLUSO
1.
2.
3.
4.
5.
6.
7
8.
9.
10.
11.
12.
13.
14.
24 x 50 mm vetrini coprioggetto
Tubi da test e relativi portatubi, tubi per microcentrifuga oppure piastre per microtitolazione per diluire il siero
Centrifuga clinica
Un incubatore o un bagnetto termostatato a 35 – 37°C per incubare i vetrini
Un frigorifero a 2 – 8°C
Bottiglie di plastica per i lavaggi
Pipette calibrate o pipettatori del tipo “a pistone” con punte usa e getta
Vaschetta di Coplin o piastra di colorazione per vetrini con il porta-vetrini
Beute o cilindri graduati puliti da 1 Litro
Camera umida per l'incubazione dei vetrini
Acqua distillata o purificata
Timer
Carta assorbente per asciugare i vetrini
Microscopio a fluorescenza, parametri raccomandati
Filtro eccitatore
470 – 490 nm
Filtro di sbarramento
520 – 560 nm
Sorgente luminosa
HBO 100W, mercurio
Obiettivo
20 – 40X, per fluorescenza, high dry
DURATA E USO
1.
2.
3.
I kit sono stabili fino alla fine del mese indicato sulla data di scadenza se conservati alla temperatura di 2 – 8°C.
Non usare il kit o i singoli reagenti oltre la data di scadenza.
Non esporre i reagenti ad una forte sorgente luminosa durante la conservazione o l'incubazione.
IFA per IgM anti-Anaplasma phagocytophilum
Pagina 3
AVVERTENZE E PRECAUZIONI
1.
2.
3.
4.
5.
6.
7.
8.
9.
Questo foglietto illustrativo è associato esclusivamente ai prodotti per l'esportazione e non è destinato alla distribuzione negli Stati Uniti. Al di fuori degli
Stati Uniti questo kit è per uso diagnostico in vitro.
Tutti i derivati del sangue devono essere maneggiati come potenzialmente infettivi. Il materiale di provenienza di questo prodotto (compreso il controllo
non rilevabile) è stato analizzato, in conformità con i metodi approvati dall'FDA, per la presenza di antigeni di superfice dell'epatite B, anticorpi per l'epatite
C e per l'HIV-1/2 (AIDS) ed è risultato negativo. Poiché nessun metodo di analisi può comunque fornire il 100% di garanzia che i derivati del sangue
umano non trasmettano questi o altri agenti infettivi, tutti i controlli, i campioni di siero e le attrezzature che vengono in contatto con questi campioni,
devono essere considerati potenzialmente infettivi e quindi vanno decontaminati. Per questo materiale bisogna inoltre adoperare le procedure di raccolta e
smaltimeno specifiche per i materiali classificati come rischio biologico.9, 10, 11
Il substrato dei vetrini è dato da cellule inattivate infettate con A. phagocytophilum. È tuttavia consigliabile considerare tali vetrini come potenzialmente
infettivi e maneggiarli di conseguenza.
Il blu di Evans è una sostanza cancerogena; tuttavia, la sua concentrazione in questo prodotto è inferiore alla soglia da segnalare (inferiore allo 0,1%).
Non sostituire o mescolare i reagenti di questo kit con quelli di altre partite o altre ditte.
Usare solo i protocolli descritti in questo opuscolo. Tempi di incubazione o temperature diversi da quelli indicati possono determinare risultati erronei.
La contaminazione crociata dei campioni di pazienti su un vetrino può determinare dei risultati erronei. Quindi, dopo aver depositato ciascuno dei
campioni, maneggiare il vetrino con cura per evitare il mescolamento con i sieri già presenti negli altri pozzetti o che ancora devono essere caricati.
La contaminazione batterica dei campioni di siero o dei reagenti può provocare dei risultati erronei. Lavorare in condizioni di sterilità per evitare la
contaminazione da microbi.
Mezzo di Montaggio contiene una percentuale di glicerolo compresa tra 30 e 60% che può causare irritazione in caso di inalazione o di contatto con la
pelle. In caso di inalazione o di contatto, prendere le misure di primo soccorso.
RACCOLTA E PREPARAZIONE DEL CAMPIONE
La fonte preferita del campione è il siero. Non è stato fatto alcun tentativo per stabilire la compatibilità di questo saggio con altri tipi di campione. Risultati
erronei possono derivare dall'uso di sieri iperlipemici, emolizzati o contaminati, che devono quindi essere evitati.
Raccolta e manipolazione del campione
I campioni vanno raccolti in condizioni asettiche da personale qualificato e con tecniche approvate per il prelievo in vena.9, 10, 11 Lasciare che il sangue coaguli a
temperatura ambiente prima di centrifugare. Trasferire il siero asetticamente in un contenitore sterile a chiusura stagna per la conservazionea 2 – 8°C. Nel caso
non si preveda di effettuare il test prima di 5 giorni, il campione va congelato a –20°C o a temperature inferiori. Il congelamento-scongelamento può provocare
dei danni ai reagenti se si usano freezer auto-defrosting. I campioni vanno scongelati e mescolati bene prima dell'uso.
Preparazione del campione
Gli anticorpi di classe IgG del siero possono competere con le IgM e provocare così dei falsi risultati negativi. Dei falsi risultati positivi possono essere invece
determinati dalla presenza del fattore reumatoide (IgG complessate) nel campione di siero. Di conseguenza è altamente raccomandabile di effettuare il pretrattamento del siero allo scopo di rimuovere sia le IgG libere che quelle in complessi.
Per pre-trattare il campione di siero e portarlo alle diluizioni da usare nel test diluire il campione 1:20 nel modo seguente: mescolare 5 µL di siero del paziente
con 95 µL di soluzione di pre-trattamento per IgM in tubi da microcentrifuga o in una piastra per microtitolazione. Lasciare incubare per 5 minuti affinché
possa avvenire la reazione di immunoprecipitazione. Il campione può essere usato così com'è o si può centrifugare per eliminare il precipitato dal siero. Il
precipitato non interferisce con il buon funzionamento del saggio.
Dove si richieda la determinazione dei valori limite di diluizione, diluire serialmente le diluizioni del test nel PBS ricostituito.
PROTOCOLLO DEL TEST
1.
Rimuovere i vetrini dal frigorifero. Prima di aprire i pacchetti consentire ai vetrini di raggiungere la temperatura ambiente per evitare la formazione di
condensa.
2. Depositare 25 µL del controllo Rilevabile per IgM, prelevandolo direttamente dalla boccetta, nell'apposito pozzetto sul vetrino. Usare PBS per preparare
diluizioni di 2 volte seriali del controllo Rilevabile fino ad una diluizione di 1:32. Depositare 25 µL di ogni diluizione seriale negli appositi pozzetti.
3. Depositare 25 µL di controllo Non Rilevabile, prelevandolo direttamente dalla boccetta, nell'apposito pozzetto sul vetrino.
4. Aggiungere negli appositi pozzetti sul vetrino circa 25 µL di campione diluito (vedi sopra: Preparazione del campione) per ogni siero di paziente da
analizzare. Usare un sistema di notazioni per identificare i vari pozzetti al momento di leggere i risultati.
5. Incubare il/i vetrino/i in camera umida per 90 ± 2 minuti a 35 – 37°C.
6. Rimuovere i vetrini dalla camera umida e sciacquarli delicatamente, facendo scorrere del PBS su un vetrino alla volta, badando bene a non versare il PBS
direttamente sui pozzetti. Sciacquare una fila alla volta per evitare il mescolamento dei campioni. Lavare poi i vetrini immergendoli per 10 minuti in
vaschette di Coplin o in vaschette di colorazione per vetrini contenenti PBS.
7. Immergere brevemente i vetrini lavati in acqua distillata o purificata, poi farli asciugare all'aria.
8. Aggiungere circa 25 µL di coniugato per IgM in ogni pozzetto del vetrino.
9. Incubare i vetrini in camera umida per 30 ± 2 minuti a 35 – 37°C.
10. Ripetere le fasi di lavaggio 6 e 7.
11. Mettere qualche goccia del mezzo di montaggio sul vetrino e coprire con un vetrino copri-oggetto di 24 x 50 mm. Eliminare eventuali bolle d'aria e
l'eccesso di mezzo di montaggio usando della carta assorbente.
12. Guardare i pozzetti ad un ingrandimento finale di 400X con un microscopio a fluorescenza adeguatamente equipaggiato. Leggere i vetrini lo stesso giorno
in cui si effettua il saggio per un risultato di fluorescenza ottimale. Se questo non fosse possibile, i vetrini si possono conservare al buio at 2 – 8°C fino a 24
ore.
CONTROLLO DI QUALITÀ
Ogni analisi (ogni volta che si tratta un vetrino o un gruppo di vetrini) dovrebbe includere entrambi i controlli, quello Rilevabile e quello Non Rilevabile.
1.
2.
Il controllo Rilevabile diluito 1:8 dovrebbe determinare il valore limite (fluorescenza 1+). Comunque a causa delle differenti condizioni di laboratorio e di
strumentazione, i valori limite possono essere ottenuti a differenti diluizioni del controllo, che possono variare da 1:4 a 1:16.
Il controllo Non Rilevabile dovrebbe mostrare una reattività trascurabile o assenza di reattività su tutti i pozzetti in cui viene applicato. Una fluorescenza
che non corrisponde al quadro fluoroscopico del controllo Rilevabile va considerata non rilevabile.
Se i controlli non mostrano questi risultati non bisogna considerare validi i risultati del test del paziente e bisogna ripetere il saggio.
INTERPRETAZIONE DEI RISULTATI DEL TEST
I valori limite di titolazione e l'intensità della fluorescenza saranno determinati, nel complesso, dall'ottica del microscopio e dalle condizioni e tipo della sorgente luminosa.
Per essere sicuri di ottenere un'interpretazione corretta dei risultati si raccomanda in ogni esperimento di leggere i pozzetti di controllo per primi.
IFA per IgM anti-Anaplasma phagocytophilum
Pagina 4
Lettura dei vetrini
Leggere l'intensità della fluorescenza della morula in ogni spot e attribuirle i seguenti valori:
da 2 a 4+
1+
Negative
Fluorescenza verde-mela delle morula da moderata a intensa.
Fluorescenza netta ma debole, uguale a quella che si osserva per il controllo Rilevabile al suo valore limite di titolazione di riferimento.
Fluorescenza assente o intensità di fluorescenza uguale a quella che si osserva nel pozzetto con il controllo Non Rilevabile (o minore che il
valore limite di titolazione).
Interpretazione dei risultati con i campioni dei pazienti
Il valore limite di titolazione è definito come il reciproco della più alta diluizione del siero che mostra una netta (1+) fluorescenza verde-mela della morula.
≥1:20
<1:20
Valori limite di titolazione uguali o superiori a 1:20 delle IgM specifiche in campioni di siero sono considerati come una prova di infezione in
atto o recente dovuta all'agente eziologico della HGA.
Valori limite di titolazione inferiori a 1:20 delle IgM specifiche in campioni di siero suggeriscono che il paziente non ha un'infezione acuta
dovuta all'agente eziologico della HGA.
Qualsiasi innalzamento di quattro volte o più dei titoli di IgM specifiche osservato tra campioni di siero prelevati dallo stesso paziente a 1 – 2 settimane di
distanza, ed analizzati contemporaneamente, è da considerarsi una prova di infezione recente o in atto da parte dell'agente eziologico della HGA.
LIMITAZIONI
1.
2.
3.
È estremamente importante che tutti i risultati ottenuti dalle indagini sierologiche specifiche per A. phagocytophilum vengano poi correlati con il quadro
clinico del paziente e con gli altri dati a disposizione del medico curante.
I valori limite di titolazione e l'intensità della fluorescenza saranno determinati, nel complesso, dall'ottica del microscopio e dalle condizioni e tipo della
sorgente luminosa. Per essere sicuri di ottenere un'interpretazione corretta dei risultati si raccomanda in ogni esperimento di leggere l'intensità di
fluorescenza dei pozzetti di controllo prima di quella di tutti gli altri pozzetti.
Campioni ottenuti troppo precocemente durante l'infezione primaria possono non presentare titoli anticorpali al di sopra della soglia di individuabilità. Se
c'è un sospetto di HGA si deve ottenere un secondo campione di siero dallo stesso paziente 10 – 21 giorni dopo il prelievo del primo e analizzarlo
concomitantemente all'originale.
VALORI ATTESI
I tassi di sieropositività tra campioni provenienti da individui che dichiarano di essere stati morsi dalla zecca Ixodes in Italia, Svezia e Svizzera varia dal 3 al
17%6.
LE CARATTERISTICHE DI ESECUZIONE
Per clienti non residenti in USA le performances del prodotto vengono fornite in un foglietto illustrativo separato.
BIBLIOGRAFIA
1.
Dumler JS, Barbet AF, Bekker CP, Dasch GA, Palmer GH, Ray SC, Rikihisa Y, Rurangirwa FR. Reorganization of genera in the families Rickettsiaceae
and Anaplasmataceae in the order Rickettsiales: unification of some species of Ehrlichia with Anaplasma, Cowdria with Ehrlichia and Ehrlichia with
Neorickettsia, descriptions of six new species combinations and designation of Ehrlichia equi and 'HGE agent' as subjective synonyms of Ehrlichia
phagocytophila. Int J Syst Evol Microbiol 2001 Nov;51(Pt 6):2145-65.
2. Chen, S., J.S. Dumler, J.S. Bakken and D.H. Walker. 1994. Identification of a granulocytic Ehrlichia species as the etiologic agent of human disease.
Jour. Clin. Micro, 32:589-595.
3. Goodman, J.L., C. Nelson, B. Vitale, J.E. Madigan, J.S. Dumler, T.J. Kurtti and U.G. Munderloh. 1996. Direct cultivation of the causative agent of
Human Granulocytic Ehrlichiosis. New Eng. Jour. Med., 334:209-215.
4. Fritz, C.L., A.M. Kjemtrrup, P.A. Conrad, G.R. Flores, G.L. Campbell, M.E. Schriefer, D. Gallo and D.J. Vugia. 1997. Seroepidemiology of emerging
tickborne infectious diseases in a northern California community. Jour. Infect. Dis., 175:1432-1439.
5. von Stedingki, L.V., M. Gurtelschmid, S.H. Hanson, R. Gustafson, L. Dotevall, E.O. Engvall and M. Granstrom. 1997. The Human Granulocytic
Ehrlichiosis (HGE) agent in Swedish ticks. Clin. Micro. Infect., 3:573-574.
6. Brouqui, P.O., J.S. Dumler, R. Leinhard, M. Brossdard and D. Raoult. 1995. Human Granulocytic Ehrlichiosis in Europe. Lancet, 346:782-783.
7. Wormser, G.P., H.W. Horowitz, J. Nowakowski, D. McKenna, J.S. Dumler, S. Varde, I. Schwartz, C. Carbonaro and M. Aguero-Rosenfeld. 1997.
Positive Lyme disease serology in patients with clinical and laboratory evidence of Human Granulocytic Ehrlichiosis. Am. J. Clin. Pathol., 107:142-147.
8. Bakken, J.S., J. Krueth, C. Wilson-Nordskog, R.L. Tilden, K. Asanovich and J.S. Dumler. 1996. Clinical and laboratory characteristics of Human
Granulocytic Ehrlichiosis. Jour. Amer. Med. Assoc., 275:199-205.
9. Procedures for the Handling and Processing of Blood Specimens; Approved Guideline. CLSI/NCCLS H18-A3. 3rd ed.
10. CDC. Biosafety in Microbiological and Biomedical Laboratories. 5th ed. (2007).
11. Protection of Laboratory Workers from Occupationally Acquired Infections; Approved Guideline. CLSI/NCCLS M29-A3. 3rd ed.
Questo inserto del pacchetto è disponibile in francese, tedesco, italiano e lo Spagnolo a
distributore locale.
www.focusdx.com ed è disponibile in altre lingue dal vostro
RAPPRESENTANTE AUTORIZZATO
mdi Europa GmbH, Langenhagener Str. 71, 30855 Langenhagen-Hannover, La Germania
INFORMAZIONI PER ORDINARE
Telefono:
(562) 240-6500 (International)
Fax:
(562) 240-6510
PI.IF1450M.OUS-IT
Rev. H
Data scritta: 17 ottobre 2016
ASSISTENZA TECNICA
Telefono:
(562) 240-6500 (International)
Fax:
(562) 240-6526
Visitate il nostro sito web a: www.focusdx.com
Cypress, California 90630, U.S.A.