29/04/2012
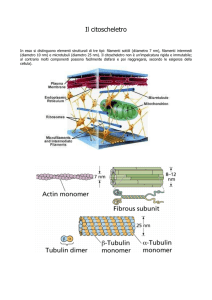
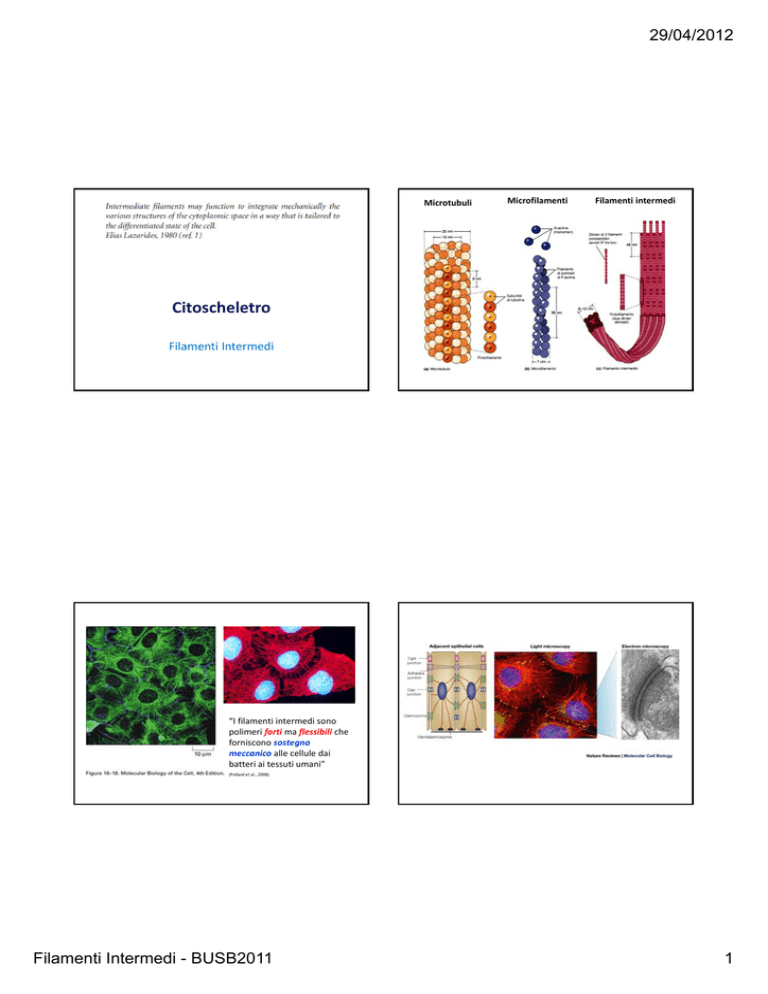
Microtubuli
Microfilamenti
Filamenti intermedi
Citoscheletro
Filamenti Intermedi
“I filamenti intermedi sono polimeri forti ma flessibili che forniscono sostegno meccanico alle cellule dai batteri ai tessuti umani”
(Pollard et al., 2008)
Filamenti Intermedi - BUSB2011
1
29/04/2012
FILAMENTI INTERMEDI (1)
FILAMENTI INTERMEDI (2)
Hanno diverse proprietà carattereristiche che li distinguono dai microfilamenti e dai microtubuli:
Sono biochimicamente molto più eterogenei:
Esistono subunità dei filamenti intermedi diverse , ma correlate evolutivamente, che sono spesso
espresse in modo tessuto‐dipendente.
Hanno grande forze tensile; es:
Peli e unghie: consistono principalmente di filamenti intermedi delle cellule morte
NON hanno una polarità intrinseca come i microfilamenti e i
microtubuli, e le loro unità costituenti NON si legano ad un nucleotide.
Dato che non hanno polarità intrinseca e non si conoscono
proteine motori che li usino come rotaie
Nonostante siano dinamici in termini di scambio di subunità, sono molto più stabili dei microfilamenti e i microtubuli dato
cha la velocità di scambio è molto più lenta.
NON si trovano in tutti gli eucarioti:
I funghi e le piante non hanno filamenti intermedi
Gli insetti hanno soltanto una classe, rappresentata da due geni che esprimono le lamine A/C e B (FI che sorreggono
l’involucro nucleare).
Caratteristiche dei Filamenti Intermedi
Stabili, resistenti
8 – 10 nm di diametro
Prominenti nelle cellule che debbono resistere a stress meccanici
Insolubili in soluzioni concentrate di sali e detergenti non ionici
IFs caratteristici e specifici per i diversi tipi di tessuti
Si possono sciogliere con urea (potente denaturante per le proteine)
Filamenti Intermedi - BUSB2011
Filamenti intermedi
Struttura
2
29/04/2012
FI: Struttura (1)
Ogni isoforma delle proteine dei FI ha una sequenza
aminoacidica caratteristica, ma tutti hanno un dominio a bastoncello fra i domini di testa e coda con dimensione
variabile presenti alle due esteremità. Il bastoncello è un “coiled‐coil” parallelo di due α‐eliche, di solito lungo circa 47 nm.
Come gli altri “coiled‐coils”, i domini a bastoncello dei FI hanno una ripetizione di sette AA, in cui il primo e quarto residui forniscono una riga continua di interazioni idrofobiche
lungo la l’interfaccia delle due eliche.
FI: Struttura (2)
Zone di carica positiva e negativa si alternano lungo il
bastocello.
Quando sfalsate in modo corretto, queste zone forniscono
legami elettrostatici complementari per l’assemblaggio dei
filamenti.
Circa 20 residui altamente conservati ad ogni estremità del bastoncello sono essenziali per l’allungamento del filamento
mediante interazioni testa‐coda fra molecole dimeriche. Studi con proteine mutante suggeriscono che queste parti del bastoncello contribuiscono alle associazioni laterali all’interno
dei filamenti.
Sequenze aminoacidiche indicano la presenza di tre
interruzioni nel “coiled‐coil”
Filamenti Intermedi - BUSB2011
3
29/04/2012
Didascalia della Fig. precedente:
Le proteine dei filament intermedi hanno domini testa e coda di dimensioni variabili che fiancheggiano un dominio centrale a bastoncello.
I domini a bastoncello consistono in un “coiled‐coil” di circa 310 residui e sono lunghi 46,5 nm.
Le lamìne hanno 42 residui addizionali nel bastoncello (λ).
I residui più importanti per l’assemblaggio si trovano all’inizio e alla fine del bastoncello.
I domini terminali differiscono in sequenza e dimensione da 6 a 1200 residui.
ETEROGENEITÀ MOLECOLARE DEI FILAMENTI INTERMEDI - 1
Mentre i filamenti di actina e i microtubuli sono polimeri di un unico tipo di proteina (actina e tubulina, rispettivamente), i filamenti intermedi (FI) sono composti da una gran varietà di proteine che sono espresse da tipi cellulari diversi.
Sono stati identificati più di 65 proteine diverse di FI, che sono state classificate in sei gruppi in base alle somiglianze di sequenze aminoacidiche.
Proprietà meccaniche dei polimeri di actina, tubulina e filamenti
intermedi
Le reti composte da microtubuli, filamenti di actina o dei filamenti intermedi chiamati
vimentina, tutti alla stessa concentrazione, furono esposti a forze di taglio in un viscosimetro, e il grado di stiramento è stato
misurato. I risultati mostrano che le reti di microtubuli sono facilmente deformabili
ma si rompono (illustrato dall’asterisco
fucsia) e cominciano a fluire senza limite
quando stirati oltre il 150% della loro
lunghezza primitiva. Le reti di filamenti di actina sono molto più rigide, ma anche
esse si rompono facilmente. Viceversa, le reti di filamenti intermedi non solo si
deformano facilmente ma inoltre resistono
a elevati stress e tensioni senza rompersi; perciò essi sono ben adatti a sostenere
l’integrità della cellula. http://www.ncbi.nlm.nih.gov/books/NBK26862/figure/A2985/?report=objectonly
Filamenti Intermedi - BUSB2011
4
29/04/2012
Filamenti intermedi
Polimerizzazione
Lunghe subunità sfalsate: predominano i contatti laterali.
http://www.ncbi.nlm.nih.gov/books/NBK26862/figure/A2963/
Filamenti Intermedi - BUSB2011
5
29/04/2012
Livelli di organizzazione ed assemblaggio
dei filamenti intermedi (1)
http://www.ncbi.nlm.nih.gov/books/NBK26862/figure/A2984/
http://www.ncbi.nlm.nih.gov/books/NBK21560/figure/A5550/
Livelli di organizzazione ed assemblaggio
dei filamenti intermedi (2)
Le proteine dei filamenti intermedi (IF) formano omo‐ ed eterodimeri con un dominio altamente conservato ad alfa‐
elica e code e teste non elicoidali, che hanno dimensione e sequenza di aminoacidi variabili. Il dominio “core” centrale contiene tre elementi spaziatori non elicoidali. Un tetramero si forma mediante aggregazione sfalsata, antiparallela di due dimeri identici. Schematic representation of the three major phases of cytoplasmic IF assembly.
In phase 1, eight tetrameric subunits made from two antiparallel, half-staggered coiled-coil
dimers associate laterally to form ULFs after initiation of assembly. Every single vimentin
molecule is represented by one cylinder; coil 1 of each molecule is colored dark red, and coil
2 is colored yellow.
In phase 2, ULFs and short filaments longitudinally anneal to other ULFs and filaments.
In phase 3, after about ten minutes of assembly, filaments have radially compacted to a
diameter of approximately 11 nm.
I tetrameri si aggregano coda contro coda, formando un protofilamento; successivamente copie di protofilamenti si associano lateralemente formano una protofibrilla. L’associazione laterale di quattro protofibrille forma un cilindro con 10 nm di spessore.
http://www.jci.org/articles/view/38214/figure/4
Filamenti Intermedi - BUSB2011
6
29/04/2012
ETEROGENEITÀ MOLECOLARE DEI FILAMENTI INTERMEDI - 3
ETEROGENEITÀ MOLECOLARE DEI FILAMENTI INTERMEDI - 2
• I tipi I e II consistono in due gruppi di cheratine, ciascuno consistente di circa 15 proteine diverse, che sono espresse nelle cellule epiteliali.
Ogni tipo cellulare sintetizza almeno un tipo di cheratina I (acide) e un tipo di tipo II (basiche, neutre), che copolimerizza per formare filamenti.
Alcuni tipi di cheratine di tipo I e II (dette cheratine dure) sono usate per produrre strutture dure quali i capelli, le unghie e le corna.
Altri tipi di cheratina (cheratine molli) sono abbondanti nel citoplasma delle cellule epiteliali; nei vari tipi di cellule epiteliali sono espresse combinazioni diverse.
Adattato da: Cooper GM & Hausman RE: The Cell: A Molecular Approach”, 4th ed, ASM Press, Sinauer Associates
Adattato da: Cooper GM & Hausman RE: The Cell: A Molecular Approach”, 4th ed, ASM Press, Sinauer Associates
L’ampia e
complessa
distribuzione
dei FI nei
tessuti umani
Omary MB. "IF-pathies": a broad
spectrum of intermediate filamentassociated diseases. J Clin Invest.
2009 Jul;119(7):1756-62.
Omary MB. "IF-pathies": a broad spectrum of intermediate filament-associated diseases. J Clin Invest. 2009 Jul;119(7):175662.
Filamenti Intermedi - BUSB2011
7
29/04/2012
IFs and human disease.
The involvement of IFs with human disease occurs at several levels. First, mutations in genes encoding IF proteins may either precipitate or predispose to a wide range of human diseases. It is also possible that natural selection has favored unique variants that may serve a protective role (16), although this hypothesis remains to be tested. Second, IF proteins, as a group, are essential for the formation of a variety of cell‐specific inclusions that represent hallmarks of various diseases. Formation of these inclusions is generally independent of the presence of an IF mutation but does occur in the context of GFAP mutation in Alexander disease (18). Third, antibodies specific for IF proteins are routinely used in pathology laboratories across the world to help identify the origin of poorly differentiated tumors and are beginning to be used to assess tissue injury (directly in tissues, in blood, or in cerebrospinal fluid [CSF]) (16, 18). In addition, antibodies specific for IF proteins have been observed in the context of some autoimmune disease (16). ALS, amyotrophic lateral sclerosis; NIFID, neuronal IF inclusion disease. Principali funzioni cellulare dei filamenti intermedi citoplasmatici -1
Sostegno meccanico: L’epidermide è un buon esempio per illustrare questa funzione che è condivisa dalla
maggior parte dei filamenti intermedi. I filamenti intermedi di tipo cheratina sono abbondanti nei cheratinociti, con un range fra > 10% del contenuto totale di proteine nelle cellule progenitrici basali fino a > 70% nelle cellule di differenziamento più avanzato. I cambiamenti nel colore dei filamenti riflettono l’espressione differenziale e la composizione delle cheratine nelle cellule basali, di differenziamento precoce e di differenziamento tardivo (la freccia indica il differenziamento). Le reti di filamenti di cheratina si estendono attraverso tutto il citoplasma dei
singoli cheratinociti e sono integrate fra cellule mediante collegamento alle giunzioni cellula‐cellula di tipo
desmosomi (punti rossi) e fra le cellule basali e la lamina basale mediante collegamento ad emi‐desmosomi
(punti gialli). Questa organizzazione massimizza il sostegno meccanico fornito dai filamenti di cheratina.
Filamenti Intermedi - BUSB2011
8
29/04/2012
Principali funzioni cellulare dei filamenti intermedi citoplasmatici ‐2
Citoarchittetura. Nei motoneuroni, la crescita radiale dei processi assonali richiede la loro
interazione con neurofilamenti (blu chiaro) in modo da trovare la corretta stechiometria fra le subunità “light” (NF‐L), media (NF‐M) e “heavy” (NF‐H). I grandi domini della coda C‐terminale delle
subunità NF‐H (rosso) e NF‐M (arancione) sono iperfosforilati e si proiettano al di fuori della zona
centrale del filamento, così determinando la spaziatura fra I filamenti e il calibro dell’assone. Gli
abbondanti neurofilamenti interagiscono con I microtubuli meno abbondanti (blu scuro) e con I filamenti di actina subcorticali (verde scurto) mediante proteine linker del citoscheletro, quali la plectina e la BPAG1 (giallo). Un ruolo citoarchitteturale è stato inoltre dimostrato per le lamine
nucleari ed altri filamenti intermedi citoplasmatici quali la desmina e le cheratine. Principali funzioni cellulare dei filamenti intermedi citoplasmatici - 3
(c)
Cell migration. In circulation, lymphocytes resist haemodynamic and mechanical
stresses, owing in part to their vimentin intermediate filament network … , which is organized in a
cage configuration at the cytoplasmic periphery (left cell). After chemokine-induced chemotaxis, for
example at sites of active inflammation, vimentin intermediate filaments are rapidly moved to the
perinuclear region at the cell uropod. This is made possible partly through the site-specific
phosphorylation of vimentin subunits (depicted by a change in filament colour in the cell, right), and
correlates with a softening of the viscoelastic properties of the cytoplasm, presumably to allow the
pliability needed during extravasation. The same general principles underlie the ability of epithelial
cells to migrate into a wound site after injury.
Principali funzioni cellulare dei filamenti intermedi citoplasmatici - 4
Signal modulation. Cytoplasmic intermediate filaments can bind and modulate the activity of signalling
proteins, thereby influencing the flow of extracellular signals to relevant terminal effectors inside the cell.
Two possible mechanisms are shown.
a.
Left, interactions of intermediate filaments with cell surface receptors, such as Fas, modulate
their density and function
b.
Right, regulated interactions between intermediate filaments and an adaptor protein, such as
TRADD (pink), near the cell surface limits the availability of this adaptor to a ligand-bound receptor that is
poised to transmit a signal to the cell. Regulation of either type of interaction, conveyed here by a local
change in filament colour (blue or red), can be mediated by dynamic post-translation modifications,
association with other proteins or local differences in the composition of intermediate-filament subunits.
Both of these mechanisms may participate in regulating the response of epithelial cells to pro-apoptotic
signals and other signalling events.
Filamenti Intermedi - BUSB2011
Filamenti Intermedi
CITOCHERATINE
9
29/04/2012
Citocheratine: epidermide, peli, capelli, lana, zoccoli, artigli
TIPI DI FILAMENTI INTERMEDI ‐ 1 CITOCHERATINE
Questo è il primo tipo di filamento intermedio a comparire durante la segmentazione dello zigote ed è già rivelabile allo stadio di 8 cellule. Più tardi, durante l’embriogenesi, la famiglia delle citocheratine è presente nelle cellule epiteliali.
Gli epiteli semplici, monostratificati o le cellule epiteliali in rapida divisione contengono le citocheratine di PM più basso, mentre gli epiteli complessi, con cellule altamente differenziate contengono citocheratine di dimensioni maggiori, con terminali aminico e carbossilico idrofobici. Questi interagiscono con una proteina citoplasmatica strettamente associata, la filaggrina, per formare un complesso insolubile ma molto malleabile che fornisce la barriera protettiva della pelle.
Le citocheratine sono anche associate ai desmosomi, le giunzioni che collegano le cellule epiteliali.
Adattato da Smith and Wood: Cell Biology, Chapman & Hall, London, 1992
CITOCHERATINE ‐ 1
(adattato da da Newsletter della Biomeda, Summer 1996, Volume 1, Issue 1)
N.B. Escludendo le cheratine di tipo “hair”, o “dure”, presenti nei peli, zoccoli, artigli, ecc.
Gruppo più vasto e più complesso dei filamenti intermedi.
E’ composto di molti polipeptidi diversi, distribuiti nelle cellule normali degli epiteli e nelle cellule neoplastiche di origine epiteliale
La gel elettroforesi delle citocheratine estratte dai tessuti epiteliali e dalle cellule epiteliali in cultura ha rivelato una famiglia di 19 polipeptidi che variano in peso molecolare da 40 kD a 68 kD. In seguito, è stata inclusa nella famiglia delle citocheratine la citocheratina 20 (46 kD), nota anche come “citocheratina IT”.
Tutte le citocheratine sono state divise in due sottofamiglie: le citocheratine di tipo I, che sono più acidiche, e le citocheratine di tipo II, più basiche.
Filamenti Intermedi - BUSB2011
CITOCHERATINE ‐ 2
I membri delle subfamiglie di tipo I e di tipo II sono di solito espressi in coppia nei vari tipi di epiteli; ogni citocheratina di tipo I ha una correspondente citocheratina di tipo II.
La subfamiglia di tipo II consiste nelle citocheratine ad alto peso molecolare, dalla CK1(68 kD) fino alla CK6 (56 kD), che stanno entro il range di pH 7.8 a 7.2.
La subfamiglia di tipo I comprende le citocheratine a basso peso molecolare, dalla CK9 (64 kD) alla CK 19 (40kD), con pH da 5.4 a 5.2.
Le citocheratine CK7 (54 kD) e CK 8 (52.2 kD) sono considerate di tipo e carica elettrica intermedio, con pH 6.0‐6.1.
La citocheratina CK20 (46 kD) ha pH 6.1.
10
29/04/2012
CITOCHERATINE ‐ 3
Il contenuto in citocheratine dei vari tessuti dipende dal tipo
di tessuto e dal grado di differenziamento delle cellule. Ci sono citocheratine primarie che compaiono negli epiteli normali nei primi stadi dello sviluppo, e citocheratine secondarie che sono espresse negli epiteli più differenziati.
Le citocheratine CK8 e CK18 sono le citocheratine primarie per gli epiteli semplici.
Le citocheratine CK5 e CK 14 sono primarie per gli epiteli stratificati; si trovano negli strati basali dei vari tipi di epiteli squamoso e non‐squamoso. Tutti gli altri membri della famiglia delle citocheratine sono secondarie; sono espresse negli strati soprabasali dei vari epiteli.
I polipeptidi di citocheratine sono di solito conservati nei derivati tumorali delle cellule epiteliali normali.
Didascalia figura precedente
• Schematic representation of skin tissue and detailed view of the bottom portion of the epidermis, highlighting the cytoplasmic network of keratin IFs attached to hemidesmosome cell‐ECM and desmosome cell‐cell contacts in basal keratinocytes. The plane of tissue rupture seen in the simplex, junctional, and dystrophic forms of EB are highlighted. The molecular configuration of the K5/K14 coiled‐
coil heterodimer, the smallest subunit participating in the formation of 10‐nm IFs, is shown in a schematic manner. The main secondary structure elements are: N‐terminal head and C‐terminal tail domains; α‐helical coils 1A, 1B, 2A, and 2B; and linkers L1, L12, and L2.
Filamenti Intermedi - BUSB2011
11
29/04/2012
Cheratine
LA CHIMICA DELLA PERMANENTE
http://www.elmhurst.edu/~chm/vchembook/568hairwave.html
Filamenti Intermedi - BUSB2011
12
29/04/2012
TIPI DI FILAMENTI INTERMEDI ‐ 3 TIPI DI FILAMENTI INTERMEDI ‐ 2
NEUROFILAMENTI
Queste tre proteine, NF‐L, NF‐M e NF‐H sono sintetizzate nei neuroni.
Non sono distribuite in modo uguale:
i corpi cellulari contengono soprattutto NF‐L e NF‐H.
gli assoni esprimono preferenzialmente NF‐M e NF‐H
Hanno residui carbossilici altamente carichi.
VIMENTINA
Questo filamento intermedi è espresso dai tessuti mesenchimali ed è tipica delle cellule primitive.
Le cellule in coltura ritornano ad esprimere vimentina anche se questo non è il loro filamento intermedio del tessuto maturo, forse come risultato della stimolazione a migrare e a dividersi rapidamente.
Adattato da Smith and Wood: Cell Biology, Chapman & Hall, London, 1992
Filamenti Intermedi - BUSB2011
DESMINA
Questa proteina è espressa dalle cellule muscolari scheletriche,
aumentando negli stadi più tardivi di differenziamento, quando
l’espressione della vimentina cessa.
La desmina e la vimentina sembrano aiutare i microfilamente ad
allinearsi in registro nelle fibre muscolari scheletriche ed entrambe
rimangono come componenti minori nel muscolo scheletrico maturo.
La desmina è presente nella muscolatura liscia ed anche in cellule
non muscolari con attività contrattile, come i periciti, le cellule stellate
del fegato, le cellule mio-epiteliali e i podociti del rene.
E’ anche presente in altre cellule non muscolari come le cellule
endoteliali.
Quindi, l’espressione di desmina non è interamente muscolospecifica.
Adattato da Smith and Wood: Cell Biology, Chapman & Hall, London, 1992
13
29/04/2012
Desmina: cellule muscolari
Desmina nel muscolo
http://www.cellsignal.com/products/image
s/4024_iff_md_071214.jpg
Questi filamenti intermedi di tipo III avvolgono il disco Z e fanno ulteriori
collegamenti con i dischi Z vicini. I filamenti di desmina orientati
longitudinalmente fanno da ponte tra dischi Z sulla stessa miofibrilla. L’allineamento dei filamenti di desmina con il sarcomero muscolare è reso
possibile da diverse proteine associate ai filamenti intermedi (IFAPs) che
includono la schelemina nella linea M e la sinemina nel disco Z. http://www.ncbi.nlm.nih.gov/books/NBK21560/figure/A5561/
Architettura molecolare di un miocito, in cui sono evidenziate le proteine coinvolte nelle miopatie scheletriche e cardiache
La desmina è la principale proteina dei FI del muscolo. Interagisce con altre proteine per sostenere le miofibrille a livello dei dischi Z e forma una rete continua di citoscheletro che mantiene i rapporti spaziali fra l’apparato contrattile e gli altri elementi strutturali della cellula. La desmina mantiene l’integrità cellulare, la trasmissione di forza, e il segnalamento meccanochimico. Mutazioni in altre proteine sarcomeriche e citoscheletriche (plectina, miotilina, filamina, αB‐cristallina, «Z band alternatively spliced PDZ‐motif protein [ZASP]», e «BCL2‐associated athanogene 3 [BAG3]» provocano disordini neuromuscolari.)
Tragedy in a heartbeat: malfunctioning desmin causes skeletal and cardiac muscle disease Lev G. Goldfarb, Marinos C. Dalakas J Clin Invest. 2009; 119(7):1806–1813 Filamenti Intermedi - BUSB2011
Questi filamenti intermediari di tipi III avvolgono il disco Z e fanno
contatti ulteriori con i circostanti dischi Z della stessa miofibrilla. L’allineamento dei filamenti di desmina con il sarcomero del muscolo è mantenuto da numerose proteine associate ai filamenti intermedi
(IFAPs, “intermediate filaments‐associated proteins”), che includono la schelemina nella linea M e la sinemina nel disco Z. http://www.ncbi.nlm.nih.gov/books/NBK21560/figure/A5561/
Coulombe PA, Wong P. Cytoplasmic intermediate filaments revealed as dynamic and multipurpose scaffolds. Nat Cell Biol. 6: 699‐706, 2004.
• I filamenti intermedi sono polimeri citoscheletrici codificati da una grande famiglia di geni espressi in modo differenziale che forniscono un sostegno strutturale
cruciale al citoplasma e al nucleo degli eucarioti superiori. • Perturbazioni della loro funzione spiegano diverse patologie determinate geneticamente in cui le cellule fragilizzate non sono in grado di reggere stress meccanici e non‐meccanici. • Studi recenti chiariscono come il sostegno strutturale sia modulato per affrontare le necessità mutevoli delle cellule e rivelano un nuovo ruolo tramite il quale i filamenti intermedi influenzano la crescita e la morte cellulare mediante interazioni dinamiche con proteine non‐
strutturali.
Adattato da Newsletter della Biomeda, Summer 1996, Volume 1, Issue 1
14
29/04/2012
Vimentina: cellule di origine mesenchimale
Vimentina: cellule di origine mesenchimale
The vimentin intermediate filament network (red) extends into the lamella where tetramers colocalize with the actin‐bundling protein, fimbrin (green). These fluorescent foci are specialized focal adhesions found in osteoclasts and macrophages called podosomes.
http://www.sigmaaldrich.com/prodimages/c/c1801‐if.jpg
http://web.wi.mit.edu/matsudaira/pub/fimbrin.shtml
Neurofilamenti
Confocal immunofluorescent image of mouse cerebellum labeled with Neurofilament‐
H (RMdO 20) Mouse mAb (green) and Calbindin Antibody #2136 (red). Blue pseudocolor = DRAQ5™ (fluorescent DNA dye).
http://www.cellsignal.com/products/2836.html
http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=bnchm&part=A569&rendertype=table&id=A578
Filamenti Intermedi - BUSB2011
15
29/04/2012
Neurofilamenti
http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=bnchm&part=A569&rendertype=figure&id=A574
http://www.encorbio.com/cpolyclonal/CPCA‐NF‐H.htm
Didascalia della figura sul citoscheletro degli assoni e dei dendriti - 1
I citoscheletri degli assoni e dei dendriti differiscono sia in composizione che in organizzazione.
Le principali differenze sono illustrate diagrammaticamente in questa Figura. Con una eccezione, tutte le proteine citoscheletriche sono sintetizzate su polisomi liberi nel corpo cellulare, e successivamente trasportate ai loro differenti compartimenti cellulari. L’eccezione è la MAP2, che è la principale proteina associata ai microtubuli dei dendriti. Mentre una certa parte della MAP2 è sintetizzata nel corpo cellulare, il mRNA per la MAP2 è specificamentente arricchito nel compartimento dendritico e si ritiene che una frazione significativa sia sintetizzata in quel sito. Si crede che i microtubuli dei corpi cellulari, dei dendriti e degli assoni siano nucleati nel centro organizzatore dei microtubuli (MTOC), e quindi rilasciati e consegnati ai dendriti oppure all’assone. Filamenti Intermedi - BUSB2011
Didascalia della figura sul citoscheletro degli assoni e dei dendriti - 2
Nel dendrite, i microtubuli spesso hanno polarità miste con sia estremità le “meno” che le “più” presenti nella parte distale rispetto al corpo cellulare
La conseguenza funzionale di tale organizzazione è incerta ma potrebbe aiutare a spiegare come mai i dendriti assumono una forma affusolata mentre si allontano dal corpo cellulare. Vice‐versa, tutti i microtubuli degli assoni sono orientati con l’estremità “più” in posizione distale rispetto al corpo cellulare ed esibiscono una distribuzione uniforme lungo l’assone. Nonostante una certa quantità di proteina tau possa essere identificata nei corpo cellulari e nei dendriti, i microtubuli assonali sono arriccchiti in tau e la tau assonale è fosforilata in modo diverso
16
29/04/2012
Didascalia della figura sul citoscheletro degli assoni e dei dendriti - 3
La MAP2 sembra essere assente dall’assone. I neurofilamenti
sono in gran parte esclusi dai compartimenti dendritici ma sono abbondanti negli assoni di grandi dimensioni. Il distanziamento dei neurofilamenti è sensibile al livello di fosforilazione. Le principali proteine
dei filamenti intermedi
dei neuroni e cellule
gliali
Sia i microtubuli che i neurofilamenti si fermano ed iniziano nell’assone piuttosto e non proseguono nel corpo cellulare. I microfilamenti hanno un’organizzazione più dispersa e possono essere di difficile visualizzazione nel neurone maturo. Essi sono principalmente abbondanti vicino alla membrana plasmatica ma sono anche molto abbondanti nei terminali pre‐sinaptici e nelle spine dendritiche. GA: apparato di Golgi. http://www.jci.org/articles/view/38003/figure/1
Didascalia figura precedente
Aspetti morfologici di aggregati proteici gliali e neuronali
nella malattia di Alexander e Charcot-Marie-Tooth
disease.
• A “typical” IF protein consists of an N‐terminal head region, a rod region that contains four α‐helical regions (helices 1A, 1B, 2A, and 2B), and a C‐
terminal tail region. Different isoforms of GFAP are shown: GFAP‐α and GFAP‐β are full‐length GFAP proteins; the mRNAs encoding these two proteins differ in the 5′ UTR. GFAP‐γ is encoded by an mRNA that has an alternate start site and is missing exon 1. The mRNAs encoding GFAP‐δ, GFAP‐ε, and GFAP‐κ are generated by alternative splicing of intron 7, with variable use of exon 7+, to create proteins with different C‐terminal tail sequences. Only single isoforms of α‐internexin, NFL, NFM, and NFH are shown. The gray areas in NFM and NFH contain multiple phosphorylation sites. Full‐length peripherin (Per58) is shown as well as Per61, a mouse isoform that retains intron 4 (96), and Per28, which is a mouse and human isoform that retains introns 3 and 4, resulting in a truncated peripherin
(97).
Liem RK, Messing A. Dysfunctions of neuronal and glial intermediate filaments in disease. J Clin Invest. 2009 Jul;119(7):1814-24.
Filamenti Intermedi - BUSB2011
17
29/04/2012
Liem RK, Messing A. Dysfunctions of neuronal and glial intermediate filaments in disease. J Clin Invest. 2009 Jul;119(7):1814-24.
Didascalia figura precedente
Glial Fibrillary Acidic Protein (GFAP)
• (A) Rosenthal fibers concentrated in the astrocytic endfeet surrounding a blood vessel (V) in the brain stem of a 1‐year‐old child with Alexander disease. H&E stain, paraffin section (reproduced with permission from Elsevier [102]). Original magnification, ×62. (B) Rosenthal fibers surrounded by IFs in an astrocyte cell body from a 17‐month‐old child with Alexander disease, viewed by transmission electron microscopy (reproduced with permission of Wiley‐Liss Inc., a subsidiary of John Wiley & Sons Inc. [103]). N, nucleus. (C) Sural nerve biopsy from a CMT patient with an L286P mutations in NFL. The figure shows a giant axon with a cluster of organelles (arrow) and irregular whorls of neurofilaments. (D) Sural nerve biopsy of a CMT patient with an NFL del322C–326N mutation. The figure shows a fiber whose axoplasm consists almost exclusively of microtubules; note the loosening of the external myelin lamellae (panels C and D were reproduced with permission from Brain: a journal of neurology [79]). Scale bars: 1 μm (B); 2 μm (C and D). http://encorbio.com/cpolyclonal/CPCA‐GFAP.htm
Filamenti intermedi
DESMOSOMI, EMIDESMOSOMI
Filamenti Intermedi - BUSB2011
18
29/04/2012
This schematic of the epidermis shows that proteins are expressed in a differentiationdependent manner. For example, in the case of desmosomal cadherins, desmoglein (Dsg) 1
and desmocollin (Dsc) 1 are patterned in a gradient, with the highest level in the superficial
layers and tapering off in the basal layers. Desmoglein 3 and desmocollin 3 show an opposite
pattern. Likewise, the armadillo family member plakophilin (PKP) 1 is concentrated in
junctions of the superficial layers, whereas PKP2 is found in desmosomes deeper in the
epidermis.
http://www.nature.com/nrm/journal/v1/n3/fig_tab/nrm1200_208a_F3.html
Involucro nucleare (2)
Lamìne
Lamina nucleare
La scorsa decade ha visto un complete ripensamento della tradizionale visione dell’involucro nucleare come soltanto un involucro passivo per i cromosomi.
La convergenza di diverse linee di ricerca di base e clinica ha rivelato ruoli addizionali sia nel segnalamento che nella progressione mitotica. Sta diventando evidente che l’involucro nucleare definisce
non solo l’organizzazione nucleare ma anche quella del citoscheletro e in questo modo, integra sia l’archiettetura nucleare che quella citoplasmatica. (Stewart et al., Science, 2007)
Filamenti Intermedi - BUSB2011
19
29/04/2012
Lamina nucleare
Lamina Nucleare
(Scanning Electron Microscopy)
http://userpage.chemie.fu-berlin.de/biochemie/agknaus/SNE.html
Schema di una molecola di lamìna
La regione interna elicoidale è lunga circa 50 nm ed è fiancheggiata da domini
non elicoidali.
I triangoli indicano siti di fosforilazione.
NLS: “Nuclear Localization Signal”
CaaX box: sito di modificazioni post-traduzionali.
Freccia: indica sito specifico di proteolisi della lamìna A.
(Smith & Wood, Cell Biology, Stanley Thornes, Cheltenham, 2nd edition, 1999).
Filamenti Intermedi - BUSB2011
20
29/04/2012
Modello di assemblaggio delle lamìne
I polipeptidi delle lamìne formano dimeri in cui le regioni centrali ad α-elica si
avvolgono una rispetto all’altre. Ulteriore assemblaggio può coinvolgere
un’associazione testa-coda dei dimeri per formare polimeri lineari e associazioni
laterali di polimeri per formare filamenti.
Lamina nucleare _1
La membrane interna dell’involucro nucleare si trova vicino ad uno strato di filamenti sottili che circonda il nucleo ovunque tranne che all’altezza dei pori nucleari. Questi possono anche fungere da filamenti di stabilizzazione. Questa struttura è detta lamina nucleare. Ha le seguenti caratteristiche strutturali e funzionali: Consiste di "filamenti intermedi ", di spessore 30‐100 nm.
Questi filamenti intermedi sono polimeri di lamìne, con pesi molecolare 60‐75 kD .
Le lamìne di tipo‐A si trovano all’interno, verso il nucleoplasma. Le lamìne di tipo B si trovano vicino alla membrana nucleare (interna) e possono legarsi a proteine integrali all’interno della membrana. http://www.ncbi.nlm.nih.gov/books/NBK9927/figure/A1328/
Lamina nucleare _2
Le lamìne possono essere coinvolte nell’organizzazione strutturale del nucleo.
Esse possono giocare un ruolo nell’assemblaggio e disassemblaggio prima e dopo la mitosi. La loro fosforilazione provoca il disassemblaggio della lamina e provoca la disgregazione dell’involucro nucleare in vescicole. La defosforilazione rovescia questo processo e permette al nucleo di riformarsi. Se si iniettano anticorpi contro le lamine nelle cellule, il nucleo non si può riformare dopo la divisione. Quindi le lamine sono essenziali per il riassemblaggio. Filamenti Intermedi - BUSB2011
Lamina nucleare & Lamìne - 1
La lamina nucleare è compostada un gruppo di proteine chiamate lamìne A . B e C che hanno un PM di circa 60‐70 kD.
Il gruppo A è espresso sopratutto nelle cellule differenziate
Le lamìne B sono prodotte costitutivamente
Le lamìne C sono identiche ai tipo A. ad eccezione di un’estensione di ulteriori 90 AA, che deriva dllo splicing alternativo del prodotto genico nelle cellule dei mammiferi.
Si conoscono diversi tipi di lamìne B, tutti prodotti di geni diversi. (Smith & Wood, Cell Biology, Stanley Thornes, Cheltenham, 2nd edition, 1999).
21
29/04/2012
Lamina nucleare & Lamìne - 2
Le lamìne appartengono alla famiglia di proteine dei Filamenti Intermedi e presumibilmente tutte queste proteine sono evolute da un antenato comune.
Le lamìne hanno le caratteristiche molecolare strutturali tipiche della famiglia dei FI:
Una regione interna di PM 40 kD contenente circa 350 residui di AA che formano un dominio ad α‐elica a forma di bastoncino.
Questo dominio è fiancheggiato da regioni non‐elicoidali ad entrambe le estremità N‐ e C‐ terminali di PM 40 kDa e 20‐30 kDa, rispettivamente.
Le lamìne B differiscono dalle lamìne A in quanto hanno una porzione C‐terminale più piccola.
Questi dimeri si aggregano per formare lunghe fibre con diametro di circa 10 nm, che si associano per formare la rete della lamina nucleare.
(Smith & Wood, Cell Biology, Stanley Thornes, Cheltenham, 2nd edition, 1999)
Lamina nucleare & Lamìne - 4
Lamina nucleare & Lamìne - 3
Le lamìne differiscono dalle proteine citoplasmatiche dei FI in quanto hanno un segnale di localizzazione nucleare, e una cosidetta “CaaX box” vicino al C‐terminale.
La box è il sito di tre successive modificazioni post‐
traduzionali:
(a) Isoprenilazione di un residuo di cisteina
(b) La rimozione proteolitica di tre residui di AA nel C‐
terminale
(c) La cabossimetilazione del residuo di cisteina isoprenilato.
Queste modificazioni aumentano l’idrofobicità del C‐
terminale e sono necessarie per indirizzare le lamìne di nuova sintesi verso la membrana nucleare interna.
Siti potenziali di fosforilazione sono presenti ad entrambe le estremità della regione elicoidale.
(Smith & Wood, Cell Biology, Stanley Thornes, Cheltenham, 2nd edition, 1999)
Laminopatie (1)
Le lamìne di tipo A sono soggette a proteolisi specifica che rimuove il C‐
terminale modificato post‐traduzionalmente, ma le lamìne B trattengono questa estremità modificate e si sa che legano un gruppo di proteine sulla faccia nucleare della membrana nucleare interna chiamata complesso p58.
La proteina p58 (PM 58 kDa) legante la lamìna B forma un oligomero con i polipeptidi p18.
Si ritiene che sia p58 che p18s siano proteine integrali della membrana nucleare interna.
Altre proteine del complesso includono una p58 chinasi, p34 e p150 (PM 34 e 150 kDa, rispettivamente) e le lamìne A e B che probabilmente sono tutte proteine periferiche di membrana.
Non si hanno informazioni specifiche su come le lamine del compleso interagiscono con la cromatina. Si sa che in vivo la lamìna A in particolare si lega alla cromatina e che queste interazioni coinvolgono i C‐terminali delle lamìne e le fibre cromatiniche di 30 nm.
(Smith & Wood, Cell Biology, Stanley Thornes, Cheltenham, 2nd edition, 1999)
Filamenti Intermedi - BUSB2011
22
29/04/2012
Laminopatie (2)
Worman HJ, Fong LG, Muchir A, Young SG. Laminopathies and the long strange trip from basic cell biology to therapy. J Clin Invest. 119:1825‐1836, 2009. ASSEMBLAGGIO DELL’INVOLUCRO NUCLEARE
DURANTE LA TELOFASE
FRAMMENTAZIONE DELL’INVOLUCRO NUCLEARE
Mentre la lamina nucleare si dissocia, l’involucro nucleare si frammenta in vescicole. Le lamìne di tipo B rimangono legate a queste vescicole, mentre le lamine A e C vengono rilasciate come dimeri liberi.
Rottura e ri‐formazione dell’involucro nucleare
durante la mitosi
Vescicole dell’involucro nucleare, generate dalla
rottura dell’involucro durante la profase, si
associano con i cromosomi in fase di decondensazione e quindi si fondono. I complessi dei subpori si riassemblano nei pori
nucleari, formando mininuclei individuali detti
cariomeri. I cromosomi da essi racchiusi si decondensano
ulteriormente e la subseguente fusione degli
involucri nucleari di tutti i cariomeri all’altezza dei
poli del fuso forma un nucleo singolo contenente
un corredo completo di cromosomi. Il riassemblaggio della lamina nucleare non è indicato.
http://www.ncbi.nlm.nih.gov/books/NBK21704/figure/A3523/
Filamenti Intermedi - BUSB2011
/
http://www.ncbi.nlm.nih.gov/books/NBK26932/figure/A2174
23
29/04/2012
Dissoluzione della lamina nucleare
La lamina nucleare consiste in una rete di filamenti di lamina. Nella mitosi, la Cdc2 ed altre proteina chinasi fosforilano le lamine, provocando la dissociazione dei filamenti in dimeri di lamina liberi.
LA FOSFORILAZIONE DELLE LAMINE PORTA ALLA
DEGRADAZIONE DELL’INVOLUCRO NUCLEARE -1
L’involucro nucleare è una estensione circondata da una doppia membrana del reticolo endoplasmico ruvido che contiene molti complessi dei pori nucleari. Il doppio strato lipidico della membrana interna è sostenuto dalla lamina nucleare, una rete di filamenti di lamine localizzato sotto la faccia interna dell’involucro nucleare. Le tre lamine nucleari (A, B, e C) presenti nelle cellule dei Vertebrati appartengono alla classe dei filamenti intermedi delle proteine del citoscheletro, che sono cruciali per sostenere le membrane cellulari.
http://www.ncbi.nlm.nih.gov/books/NBK9890/figure/A1377/?report=objectonly
LA FOSFORILAZIONE DELLE LAMINE PORTA ALLA
DEGRADAZIONE DELL’INVOLUCRO NUCLEARE -2
Le lamìne A e C, che sono codificate dalla stessa unità di trascrizione e prodotte per splicing alternativo di un singolo pre‐mRNA, sono identiche, all’eccezione di una regione di 133 residui nel C‐ terminale della lamìna A, che è assente nella lamìna C.
La lamìna B, codificata da una unità trascrizionale diversa, viene modificata post‐traduzionalmente mediante l’aggiunta di un gruppo isoprenilico idrofobico vicino al C‐ terminale. Questo acido grasso viene incorporato nel foglietto interno del bilayer lipidico che forma la membrana nucleare interna, ancorando così la lamina nucleare alla membrana. LA FOSFORILAZIONE DELLE LAMINE PORTA ALLA
DEGRADAZIONE DELL’INVOLUCRO NUCLEARE -3
All’inizio della mitosi, il Mitosis Promoting Factor (MPF) fosforila
residui di serina specifici in tutte tre le lamine, provocando la
depolimerizzazione dei filamenti intermedi della lamina. I dimeri
fosforilati di lamìne A e C vengono rilasciati in soluzione, mentre i
dimeri fosforilati di lamìne B rimangono associati alla membrana
nucleare mediante la loro ancora isoprenilica.
La depolimerizzazione delle lamìne nucleari porta alla
disintegrazione della rete della lamina nucleare e contribuisce alla
rottura dell’involucro nucleare in piccole vescicole.
Tutte tre le lamìne nucleari formano dimeri che contengono una sezione centrale bastoncellare ad α‐elica e domini di testa e di coda globulari; la polimerizzazione di questi dimeri mediante associazioni testa‐a‐testa e coda‐a‐coda genera i filamenti intermedi che compongono la lamina nucleare.
Filamenti Intermedi - BUSB2011
24
29/04/2012
Ri‐formazione dell’involucro nucleare
Il primo passo del riassemblaggio
dell’involucro nucleare consiste nel
legame di vescicole di membrana
ai cromosomi, che può essere
mediato sia da proteine integrali di membrana che da lamìne di tipo B. Le vescole allora si fondono, la lamina nucleare si riassembla e i
cromosomi decondensano. http://www.ncbi.nlm.nih.gov/books/NBK9890/figure/A13
82/
Proprietà generali delle lamine nucleari
Le lamine nucleari sono state inizialmente descritte come componenti proteiche principali delle frazioni altamente resistenti al trattamento con i detergenti della “lamina” di nuclei di fegato di ratto e di eritrociti di pollo. In seguito, è stato visto che esse sono membri della famiglia di proteine dei Filamenti Intermedi.
I geni delle lamine si trovano in tutti i metazoi finnora osservati, ma sono assenti nelle piante e negli organismi unicellulari.
Le lamine sono suddivise in tipi A e B in base a omologie di sequenza.
Nei mammiferi sono stati caratterizzati due principali tipi di lamìna A (lamìne A e C) e due principali tipi di lamìne B (lamìne B1 e B2), oltre alle isoforme minori lamina A_10 e lamina C2 specifica delle cellule germinali. Mentre le lamìne B1 e B2–B3 sono codificate da geni diversi (LMNB1 e LMNB2, rispettivamente), le lamine di tipo A sono derivate per splicing alternativo da un singolo gene (LMNA).
Lamìne A e B
Negli scorsi anni è diventato evidente che proteine della famiglia dei filamenti intermedi, le lamìne A e B, non solo forniscono un’impalcatura strutturale per il nucleo, ma sono inoltre essenziali per molti aspetti delle funzioni normali del nucleo.
Conoscenze più approfondite sulle funzioni delle lamine sono state derivate da studi del numero notoriamente elevato di mutazioni patogene nel gene delle lamìne. Questo review fornisce una panoramica aggiornata delle funzioni delle lamine nucleari, enfatizzando il loro ruolo nell’epigenetica, organizzazione della cromatina, replicazione del DNA, trascrizione e riparo del DNA. Inoltre, discutiamo prove recenti che supportano l’importanza delle lamine nelle infezioni virali. Dechat T, Pfleghaar K, Sengupta K, Shimi T, Shumaker DK, Solimando L, Goldman RD. Nuclear lamins: major
factors in the structural organization and function of the nucleus and chromatin. Genes Dev. 22: 832-853,
2008
Lamina nucleare & Lamìne - 1
La lamina nucleare è compostada un gruppo di proteine chiamate lamìne A . B e C che hanno un PM di circa 60‐70 kD.
Il gruppo A è espresso sopratutto nelle cellule differenziate
Le lamìne B sono prodotte costitutivamente
Le lamìne C sono identiche ai tipo A. ad eccezione di un’estensione di ulteriori 90 AA, che deriva dllo splicing alternativo del prodotto genico nelle cellule dei mammiferi.
Si conoscono diversi tipi di lamìne B, tutti prodotti di geni diversi. (Smith & Wood, Cell Biology, Stanley Thornes, Cheltenham, 2nd edition, 1999).
Dechat T, Pfleghaar K, Sengupta K, Shimi T, Shumaker DK, Solimando L, Goldman RD. Nuclear lamins: major
factors in the structural organization and function of the nucleus and chromatin. Genes Dev. 22: 832-853,
2008
Filamenti Intermedi - BUSB2011
25
29/04/2012
Lamina nucleare & Lamìne - 2
Le lamìne appartengono alla famiglia di proteine dei Filamenti Intermedi e presumibilmente tutte queste proteine sono evolute da un antenato comune.
Le lamìne hanno le caratteristiche molecolare strutturali tipiche della famiglia dei FI:
Una regione interna di PM 40 kD contenente circa 350 residui di AAche formano un dominio ad α‐elica a forma di bastoncino.
Questo dominio è fiancheggiato da regioni non‐elicoidali ad entrambe le estremità N‐ e C‐ terminali di PM 40 kDa e 20‐30 kDa, rispettivamente.
Le lamìne B differiscono dalle lamìne Ain quanto hannouna porzione C‐terminale più piccola.
Questi dimeri si aggregano per formare lunghe fibre con diametro di circa 10 nm, che si associano per formare la rete della lamina nucleare.
(Smith & Wood, Cell Biology, Stanley Thornes, Cheltenham, 2nd edition, 1999)
Lamina nucleare & Lamìne - 3
Le lamìne differiscono dalle proteine citoplasmatiche dei FI in quanto hanno un segnale di localizzazione nucleare, e una cosidetta “CaaX box” vicino al C‐terminale.
La box è il sito di tre successive modificazioni post‐traduzionali:
(a) Isoprenilazione di un residuo di cisteina
(b) La rimozione proteolitica di tre residui di AA nel C‐terminale
(c) La cabossimetilazione del residuo di cisteina isoprenilato.
Queste modificazioni aumentano l’idrofobicità del C‐terminale e sono necessarie per indirizzare le lamìne di nuova sintesi verso la membrana nucleare interna.
Siti potenziali di fosforilazione sono presenti ad entrambe le estremità della regione elicoidale.
(Smith & Wood, Cell Biology, Stanley Thornes, Cheltenham, 2nd edition, 1999)
Lamina nucleare & Lamìne - 4
• Le lamìne di tipo A sono soggette a proteolisi specifica che rimuove il C‐
terminale modificato post‐traduzionalmente, ma le lamìne B trattengono questa estremità modificate e si sa che legano un gruppo di proteine sulla faccia nucleare della membrana nucleare interna chiamata complesso p58.
• La proteina p58 (PM 58 kDa) legante la lamìna B forma un oligomero con i polipeptidi p18.
– Si ritiene che sia p58 che p18s siano proteine integrali della membrana nucleare interna.
• Altre proteine del complesso includono una p58 chinasi, p34 e p150 (PM 34 e 150 kDa, rispettivamente) e le lamìne A e B che probabilmente sono tutte proteine periferiche di membrana.
• Non si hanno informazioni specifiche su come le lamine del compleso interagiscono con la cromatina. Si sa che in vivo la lamìna A in particolare si lega alla cromatina e che queste interazioni coinvolgono i C‐terminali delle lamìne e le fibre cromatiniche di 30 nm.
(Smith & Wood, Cell Biology, Stanley Thornes, Cheltenham, 2nd edition, 1999)
Filamenti Intermedi - BUSB2011
26
29/04/2012
Regolazione delle proteine della famiglia delle cheratine
DIAGNOSI DEI TUMORI UMANI IN BASE
ALLA LORO ESPRESSIONE DI FILAMENTI INTERMEDI - 1
Normalmente quando i pazienti con tumori sono trattati con
radiazione o farmaci, la decisione sul tipo di trattamento è basata
sulla diagnostica del tumore.
Per esempio, alcuni tipi tumorali respondono al trattamento con
la radizione mentre altri sono resistenti.
Man mano i tumori crescono le caratteristiche strutturali del tessuto
normale scompaiono e le singole cellule spesso perdono le loro
carateristiche proteine di membrana, il che rende la loro
identificazione molto difficile.
Tuttavia, tumori di origine sconosciuta possono essere diagnosticati
mediante l’identificazione dei loro filamenti intermedi con anticorpi
specifici. Questo perchè l’espressione dei filamenti intermedi è
cellula-specifica, ossia, ogni proteina di filamento intermedio è
associata ad un tipo cellulare particolare.
Ad esempio, i tumori che esprimono citocheratine possono
essere classificati come carcinomi (di origine epiteliale) e distinti
dai sarcomi (di origine mesenchimale) che esprimono vimentina.
Coulombe PA, Omary MB. 'Hard' and 'soft' principles defining the structure, function and regulation of keratin intermediate filaments. Curr Opin Cell Biol. 14:110‐122, 2002.
DIAGNOSI DEI TUMORI UMANI IN BASE
ALLA LORO ESPRESSIONE DI FILAMENTI INTERMEDI - 2
Il successo di questo metodo dipende moltissimo dall’assoluta
specificità dell’anticorpo per un determinato tipo di filamento
intermedio.
Un altro fattore critico per la diagnostica è che le cellule tumorali
non sempre ubidiscono alle “regole” dell’espressione tissutale. E’
stato dibattuto vivacemente ed ora accettato che, al contrario delle
cellule normali non cancerose, le cellule tumorali possono coesprimere due tipi di filamenti intermedi, ad esempio citocheratine e
vimentina. Tuttavia, queste non co-polimerizzano in filamenti, ma
esistono come reti separate.
Immunohistochemi
cal tumor differentiation (1)
Se le limitazioni di cui sopra sono tenute in considerazione,
l’espressione dei filamenti intermdi dai tumori rimane un metodo per
la loro diagnosi.
(Adattato da: Smith and Wood: Cell Biology, Chapman & Hall, London, 1992)
Filamenti Intermedi - BUSB2011
27
29/04/2012
FILAMENTI INTERMEDI & DIFFERENZIAMENTO
CELLULE DEI MAMMIFERI
Immunohistochemical tumor differentiation (2)
(Adattato da: Smith and Wood: Cell Biology, Chapman & Hall, London, 1992)
Didascalia della figura di Herrmann
Rappresentazione schematica dell’interazione fra I microfilamenti (MF), I microtubuli (MT) e I filamenti
intermedi (IF) che coinvolge la proteina plectina con I suoi domini terminali che legano l’actina (ABD) e
I microtubuli (MBD). Mentre il MBD della plectina non è ancora stato definito in termini molecolari, è
stato chiaramente visualizzato mediante microscopia elettronica. Per la BPAG1, un’altra plachina,
l’esistenza di un MBD è stato direttamente dimostrata. E’ stato dimostrato che il dominio carbossiterminale della plectina si lega ai Ifs direttamente, probabilmente mediato da un processo di
fosforilazione. In quest’ultimo contesto, si è visto che delle chinasi strettamente associate al
citoscheletro fosforilano la plectina in modo altamente specifico sia in vitro che in vivo. Per quanto
riguardano gli IF, è stato evidenziato un eterodimero vimentina (giallo)/nestina (blu). Il lungo carbossi.terminale non ad α-elica potrebbe ospitare sequenze di tipo sia MBD che ABD, così legando in modo
stabile gli Ifs ai MTs e/o ai MFs. Come si può inferire da lavoro di Prahlad et al. [1998] and Yoon et al.
[1998], le chinesino possono collegare gli Ifs ai MTs per facilitare le interazioni dinamiche. (X, Y e Z)
marcano altri potenziali motivi di legame all’interno del dominio pre-bastocello nell’amino-terminale
della plectina e nestina, rispettivamente. Il ABD e MBD della nestina sono are evidenziati da un punto
interrogativo che indica che I corrispondenti motivi di legame non sono ancora stati identificati. I
diametri relativi dei tre filamenti citoscheletrici sono stati disegnati in scala approssimata. I segmenti
“coiled-coil” della chinesina e della plectina sono stati disegnati in modo incompleto come indicato
dalla line atrattegiata doppia.
Herrmann H, Aebi U. Intermediate filaments and their associates: multi-talented structural elements specifying
cytoarchitecture and cytodynamics. Curr Opin Cell Biol. 12(1):79-90, 2000.
Filamenti Intermedi - BUSB2011
28
29/04/2012
Herrmann H, Strelkov SV, Burkhard P, Aebi U. Intermediate filaments: primary
determinants of cell architecture and plasticity. J Clin Invest. 119:1772-1783,
2009.
I filamenti intermedi (IFs) sono i principali costituenti del citoscheletro e
dell’interfaccia col nucleo delle cellule animali.
Svolgono ruoli di importanza fondamentale nell’organizzazione degli elementi
strutturali.
A seconda del tipo cellulare, proteine morfologicamente simili ma distinte
biochimicamente formano filamenti ad elevata viscoelasticità che svolgono
molteplici funzioni nanomeccaniche.
Oltre al loro ruolo primario nella plasticità cellulare e alla loro funzione già ben
stabilita di attutenti per gli stress cellulari, alterazioni geniche recentemente
identificate hanno elucidato che le alterazioni strutturali degli IFs possono
influenzare il loro coinvolgimento sia nel signaling che nelle reti di geni
regolatori.
In questo articolo evidenziamo le proprietà strutturali e funzionali basiche degli IFs e
ricaviamo un concetto su come le mutazioni possano influenzare l’archittetura cellulare e
perciò la costruzione e la fisiologia dei tessuti.
Herrmann et al., 2007
Nell’ipotetica cellula epiteliale illustrate, i tre sistemi di filamenti chiave del citoscheletro, i
microfilamenti (MFs), i microtubuli (MTs) e i filamenti intemedi (IFs) sono collegati
uno all’altro mediante complessi dimerici di molecole di tipo plachina, quali la plectina e la
BPAG1. Inoltre, si ritiene che una gran varietà di proteine associate ai microtubul e di
legame con l’actina, incluso proteine motrici, aumentino la complessità delle interazioni.
Gli IFs sono accoppiati alle placche di ancoraggio degli IFs nelle giunzion cellulari
(desmosomi) dalla desmoplacchina, che è una molecola tipica delle placche (ossia una
placchina), e alle placche delle giunzioni cellula-matrice (emidesmosomi) dalla plectina e
della BPAG1. Le proteine transmembrana che mediano il contattoi con le cellule vicine e
con la matrice extracellulare (ECM) sono le caderine dei desmosom e le integrine,
rispettivamente. Inoltre, gli IFs sono accoppiati alla membrana nucleare esterna (“outer
nuclear membrane”, ONM) dalla plecina e dalla nesprina-3, mentre la nesprina-2 ancora il
sistema degli IFs al nucleo. Dal lato interno dell’involucro nucleare, uno strato di proteine
degli IFs (lamìne) è collegata ai pori e alle proteine della membrana nucleare interna
(“inner nuclear membrane”INM) ed anche alla cromatina. Le proteine di membrana della
INM potrebbero essere collegate a quelle della ONM e perciò fornire un continuo
meccanico che va dalla matrice extracellulare (ECM) alla cromatina. ER: reticolo
endoplasmatico; MTOC: centro organizzatore dei microtubuli; NPC: complesso di pori
nucleari.
Filamenti Intermedi - BUSB2011
29
29/04/2012
Schematic diagram of a human cell showing the nucleus and other
selected structures (not to scale).
Didascalia Fig. 1 Gruenbaum
The nuclear lamina comes of age
Yosef Gruenbaum, Ayelet Margalit, Robert D. Goldman, Dale K. Shumaker & Katherine L. Wilson
Nature Reviews Molecular Cell Biology 6, 21-31 (January 2005)
•
Filamenti Intermedi - BUSB2011
The nuclear envelope (NE) has two membranes (inner and outer; INM and ONM, respectively), which join to form 'pores' that are occupied by nuclear pore complexes (NPCs; not depicted). For clarity, only two nuclear pores are depicted. NPCs mediate traffic in and out of the nucleus, as indicated by the double‐headed arrows. The NE is continuous with the endoplasmic reticulum (ER) network. Microtubules, which originate at the centrosome (or microtubule organizing center; MTOC), and microtubule‐dependent motors (not shown) regulate the position of the nucleus by attaching to lamin‐dependent protein complexes (shown as blue interlocking shapes) at the NE. Certain ONM‐localized members of the nesprin protein family attach to actin filaments (red). The proposed nuclear actin network (to which emerin and A‐type lamins bind) is depicted in Fig. 5. The lamin‐filament network near the INM is shown in purple; internal lamins are not shown. Lamin‐dependent complexes that are formed by integral INM proteins, such as emerin (blue triangle) and MAN1 (blue U‐shape) are shown in Figs 5,6, respectively. In normal cells, proteins that localize specifically to the INM (or ONM) give bright fluorescent signals at the NE when they are stained by indirect immunofluorescence (not depicted). In cells that lack A‐type lamins (not depicted), many of these proteins are not retained at the NE but instead drift throughout the NE/ER networ 30