Esercizio 1
CO2
heat capacity
Quando 2.0 moli di
CO2
sono riscaldate alla pressione costante di 1.25 atm la loro temperatura passa da
−1
−1
250 K a 277 K. La capacità termica molare a P costante della CO2 è 37.11 J K
mol .
Calcolare q , ∆H e ∆U .
Solution
The units of the solution below for
qP , ∆H
and
∆U
In the excercise is not indicated explicitly that the
−1
should be J not J mol
Cp,m
can be considered constant with
temperature interval is small, this is a reasonable choice.
T,
but since the
Esercizio 2
∆G
a
P
costante
La variazione di energia libera di Gibbs di un certo processo a
P
cost. è ben rappresentata dall'espressione:
∆G/J = −85.40 + 36.5 × T /K.
Calcolare il ∆S del processo.
Solution
Il modo corretto di impostare la soluzione è il seguente.
Si può anche ragionare, più semplicemente, partendo dalla denizione di energia libera di Gibbs
∆G = ∆H − T ∆S
e confrontandola con l'espressione proposta
∆G/J = −85.40 + 36.5 × T /K
che riscriviamo come
∆G = −85.40
Si vede subito che il termine corrispondente a
J
+ 36.5
−T ∆S
J
× T /K.
è rappresentato dal termine
−T ∆S = +36.5
J
× T /K
da cui
∆S = −36.5 J/K
+36.5
J
× T /K,
ovvero
Esercizio 3
Stima temperatura fusione acqua ad alta
P
La densità del ghiaccio alla pressione di 10 MPa è di 0.915 g cm
−1
Il ∆H molare di fusione dell'acqua è 6.01 kJ mol .
−3
e quella dell'acqua è di 0.998 g cm
−3
.
Stimare a quale temperatura si ha la solidicazione dell'acqua a questa pressione.
Solution
Dato che viene chiesta una stima, è possibile integrare direttamente l'equazione di Clapeyron in forma
dierenziale
dP =
assumendo che non solo
∆Hf,m
e
∆Vf,m
∆Hf,m
dT,
Tf ∆Vf,m
siano indipendenti da
T
e
P,
ma che la temperatura stessa vari
molto poco e quindi possa essere considerata costante.
A rigore, questo approccio sembra contraddittorio dato che si sta cercando un
∆T
assumendo che
T
non
vari.
Tuttavia, se il valore ottenuto di
∆T
si rivelerà eettivamente piccolo, l'assunzione sarà stata corretta e
l'approssimazione accettabile.
Integrando in questo modo semplicato l'equazione di Clapeyron, si ottiene quindi
Esplicitando il
∆T
∆P =
∆Hf,m
∆T.
Tf ∆Vf,m
∆T =
Tf ∆Vf,m
∆P.
∆Hf,m
si ha
Assumendo di avere 1 mole di acqua, è possibile esprimere il
∆Vf,m
in funzione delle densità.
Infatti, per una mole di ghiaccio
ρ
ice
dove
M
=
M
V
da cui
V
m,ice
=
m,ice
M
,
ρ
ice
è la massa di una mole di ghiaccio (o di acqua. . . ).
Si ha, quindi
∆Vf,m = V
Sostituendo nel calcolo del
∆T ,
m,water
−V
m,ice
=M
1
ρ
water
1
−
ρ
ice
si ottiene
Tf ∆P
∆T =
M
∆Hf,m
1
ρ
water
1
−
ρ
ice
.
.
Come si vede, il valore del
∆T
è eettivamente inferiore ad 1 K, quindi l'approssimazione appare accetta-
bile.
Per avere un risultato più accurato, si sarebbe potuta usare l'equazione di Clapeyron nella forma integrata
P = P0 +
Di quanto dierisce il valore del
∆T
T
∆Hf,m
ln .
∆Vf,m
T0
calcolato in questo secondo modo dal valore precedente?
Esercizio 4
Variazione punto di fusione naftalene
Considerare una soluzione formata da 5.0 g di una certa sostanza sciolti in 250 g di naftalene.
Il punto di congelamento della soluzione è di 0.780 K più basso del solvente puro.
−1
Sapendo che L'entalpia molare di fusione del naftalene è 19.1 kJ mol
e la temperatura di fusione è 351.3
K, stimare la massa molare della sostanza.
Solution
Si parla di abbassamento crioscopico, quindi la formula che dovremo usare sarà. . . ?
Questa:
∆T ≈
dove
∆T = T ∗ − T
è l'abbassamento crioscopico,
RT ∗2
xs ,
∆Hf,m
T∗
è il punto di fusione del solvente puro e
∆Hf,m
è
l'entalpia molare di fusione.
Dall'eq. precedente otteniamo
xs = 0.0145.
In alternativa, si può usare la costante crioscopica (cryoscopic constant) empirica,
tabulati e per il naftalene
Kf .
I valori sono
Kf = 6.94.
∆T = Kf ms
Ci ricordiamo che il
∆T
può anche essere espresso in funzione della molalità del soluto,
ms
RT ∗2
∆T ≈
Mnaft 1 × 10−3 ms .
∆Hv,m
Dal confronto tra le due espressioni precedenti, si vede che la costante crioscopica per il naftalene può
essere stimata come
Kf ≈
dove
Mnaft
RT ∗2
Mnaft 1 × 10−3 ,
∆Hv,m
è la massa molare del naftalene.
La massa molare della sostanza incognita si calcola come segue.
Esercizio 5
Dierenza campo locale acetaldeide
Nella molecola acetaldeide, il protone del gruppo
CHO
ha un chemical shift
CH3
ha un chemical shift
δ = 2.20
mentre il protone
δ = 9.80.
(a) Come è possibile spiegare questa dierenza?
Vengono fatte due misure, la prima usando uno strumento che produce un campo magnetico di 14.1 T, la
seconda con un campo di 21.2 T.
(b) Quale dei due protoni sente un campo eettivo maggiore nei due casi?
(c) Calcolare la dierenza tra il campo eettivamente sentito dal protone del gruppo
protone
CH3
CHO
nei due casi.
(d) Quale dei due strumenti è preferibile? Perché?
Solution
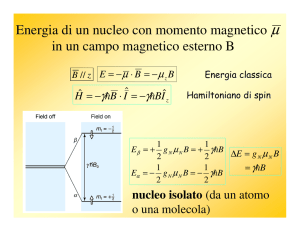
Ci ricordiamo che il campo magnetico locale totale,
Bloc ,
è dato da:
Bloc = B0 + δB = (1 − σ)B0
Dato che ci interessa la di. tra due campi locali, calcoliamo quanto vale ogni campo locale:
Bloc,CH3 = (1 − σCH3 )B0
Bloc,CHO = (1 − σCH2 )B0
da cui
Bloc,CH3 − Bloc,CHO = (1 − σCH3 )B0 − (1 − σCHO )B0 = σCHO − σCH3 B0
e quindi
∆Bloc = ∆σB0
Quindi ci serve trovare la costante di schermo, ma ci vengono dati i chem shift.
Ci ricordiamo la relazione tra chemical shift e costante di schermo:
δ ≈ (σ ◦ − σ) × 106
Se ci interessa un
∆δ ,
si ha
δCH3 − δCHO ≈ σ ◦ − σCH3 − σ ◦ + σCHO × 106
da cui
δCH3 − δCHO ≈ σCHO − σCH3 × 106
e quindi
∆σ = δCH3 − δCHO × 10−6 = −7.6 × 10−6
La dierenza di campo magnetico locale,
∆Bloc ,
tra le due regioni della molecola sarà
∆Bloc = −7.6 × 10−6 × 14.1 = 1.07 × 10−4 T
∆Bloc = −7.6 × 10−6 × 21.2 = 1.61 × 10−4 T
rispetto al
Esercizio 6
Parametri di Arrhenius da tempo di dimezzamento
La reazione del primo ordine
SO2 Cl2 −→ SO2 + Cl2
ha un tempo di dimezzamento di 9.00 ore alla temperatura di 593 K e una costante cinetica k = 4.02
×10−5 s−1 a 600 K.
Calcolare i parametri di Arrhenius della reazione.
(aiuto:
scrivere le eq.
di Arrhenius in forma logaritmica alle due temperature, sottrarre membro a
membro. . . )
Solution
Ci servono i valori della costante cinetica alle due
T.
Un valore ci viene dato.
L'altro lo possiamo calcolare dal tempo di dimezzamento
t1/2 =
ln 2
k
da cui:
k=
ln 2
ln 2
=
= 2.14 × 10−5 s−1 .
t1/2
32400s
Avendo i valori delle due costanti cinetiche alle relative temperature,
k1 =
k2 =
2.14×10
−5 −1
s
a 593 K,
4.02×10
−5 −1
s
a 600 K,
si può quindi applicare l'equazione ottenuta sottraendo membro a membro le eq. di Arrhenius in forma
logaritmica alle due temperature, ovvero
Ea
k1
=
ln
k2
R
1
1
−
T2 T1
,
da cui, riarrangiando, si ottiene il valore dell'energia di attivazione
k1
Ea = R ln
k2
Il fattore preesponenziale,
A,
T1 T2
T1 − T2
= 266432
J mol
.
può essere calcolato dall'eq. di Arrhenius in forma esponenziale usando una
delle due costanti cinetiche.
Ad es., usando
−1
k2
Ea
A = k2 e RT2 = 6.31 × 1018 s−1 .