Fotosintesi
Copyright © 2001-2012 by Giorgio Sartor.
I01 - Versione 2.0 – jan 2012
All rights reserved.
v. 2.0 © gsartor 2001-2012
Fotosintesi
-2-
1
v. 2.0 © gsartor 2001-2012
Fotosintesi
-3-
Decomposizione dell’acqua
• La decomposizione dell'acqua in idrogeno ed ossigeno in
condizioni standard è una reazione sfavorita in termini
termodinamici, poiché entrambe le semireazioni che
intervengono hanno potenziali negativi
Anodo (ossidazione):
2H2O(l) → O2(g) + 4H+(aq) + 4e- E0ox= +1,23 V
Catodo (riduzione):
4H2O + 4e- → 2H2 + 4OH- E0ox= -0,83 V
• Utilizzando l'equazione ΔG = − nFE, l'energia libera di
Gibbs per il processo in condizioni standard vale 474.4
kJ, il che traduce la non spontaneità della reazione.
v. 2.0 © gsartor 2001-2012
Fotosintesi
-4-
2
Decomposizione dell’acqua
v. 2.0 © gsartor 2001-2012
Fotosintesi
-5-
Ossidazione dell’acqua
v. 2.0 © gsartor 2001-2012
Fotosintesi
-6-
3
Ossidazione dell’acqua
2H2O → O2 + 4H+ +4e-
ΔG° = + 474.4 kJ
v. 2.0 © gsartor 2001-2012
Fotosintesi
-7-
Ossidazione dell’acqua
?
?
?
2H2O → O2 + 4H+ +4e-
ΔG° = + 474.4 kJ
v. 2.0 © gsartor 2001-2012
Fotosintesi
-8-
4
Ossidazione dell’acqua
hυ 2NADPH + 2H+
2H2O → O2 + 4H+ +4e-
ΔG° = + 474.4 kJ
v. 2.0 © gsartor 2001-2012
Fotosintesi
-9-
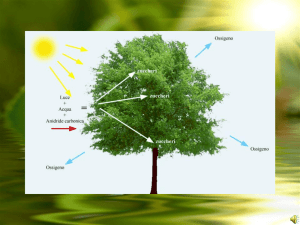
Fotosintesi
È il processo che permette di formare carboidrati da
CO2 a spese dell’energia luminosa.
hυ
6CO2 + 6H2O → C6H12O6 +O2
FISSAZIONE DELL’ANIDRIDE CARBONICA
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 10 -
5
Fotosintesi
• La fotosintesi viene assimilata alla fissazione
della CO2,
• L’energia chimica derivata dall’energia
luminosa può essere utilizzata per altri
processi cellulari (assimilazione di azoto e
zolfo).
• Il processo
6CO2 + 6H2O → C6H12O6 +O2
• È il contrario del metabolismo dei carboidrati,
• È un processo endoergonico che avviene nei
cloroplasti.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 11 -
Cloroplasti
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 12 -
6
Cloroplasti
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 13 -
Cloroplasti
• La fotosintesi avviene all’interno del tilacoide,
• La membrana del tilacoide è come la
membrana mitocondriale
– Impermeabile a ioni e molecole
• Come i mitocondri i cloroplasti hanno un
proprio DNA, RNA e ribosomi
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 14 -
7
Processo fotosintetico
• La fotosintesi è un processo che è formato da
due serie di reazioni:
Conversione di energia
luminosa in
Alla luce
O2
Energia chimica
Fissazione della CO2 CO2
Al buio
Formazione di zuccheri
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 15 -
Processo fotosintetico
Fase luminosa
nhυ
2H2O + 2NADP+ + xADP + xPi →
→ O2 + 2NADPH + 2H+ + xATP + xH2O
Fase buia
12NADPH + 12H+ + 18ATP + 6CO2 + 12H2O →
→ C6H12O6 + 12NADP+ + 18ADP + 18Pi
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 16 -
8
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 17 -
Processo fotosintetico
Fase buia
nhυ
12NADPH + 12H+ + 18ATP + 6CO2 + 12H2O →
→ C6H12O6 + 12NADP+ + 18ADP + 18Pi
• In questo caso è l’acqua il donatore finale di
elettroni, più in generale:
CO2 +2H2A → (CH2O)n + 2A + H2O
• Nei solfobatteri fotosintetici, per esempio:
CO2 +2H2S → (CH2O)n + 2S + H2O
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 18 -
9
Fotosintesi
CO2
ADP
Fase luminosa
ATP
H2O
O2
Ciclo di
Calvin/Benson
(Fase buia)
NADP+
NADPH
v. 2.0 © gsartor 2001-2012
Glucoso
Fotosintesi
- 19 -
Clorofilla
• I pigmenti fotosintetici in grado di assorbire luce sono,
principalmente, le clorofille:
CH3
R
H
NH
Mg++
H
N
HN
HH
H 2C
H 3C
H
R = -CH3 Clorofilla a
R = -CHO Clorofilla b
O
N
CH3
O
CH3
O
O
O
CH3
H3C
CH3
CH3
CH3
Catena laterale idrofobica di fitolo
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 20 -
10
Pigmenti accessori
• Ci sono poi altri pigmenti fotosintetici “accessori” che
permettono una maggiore efficienza dell’assorbimento:
H3C
CH3
CH3
CH3
CH3
CH3
O
H3C
CH3
H3C
CH3
β-carotene
H
N
H
N
CH3
CH3
CH3
O
H
N
N
CH3 CH3
O
O
CH2
CH3
O
Ficocianobilina
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 21 -
Spettri di assorbimento
• I pigmenti assorbono luce nel blu e nel rosso dello
spettro del visibile, riflettono luce nell’intervallo del
verde.
• I pigmenti sono associati a proteine.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 22 -
11
Spettri di assorbimento
• I pigmenti assorbono luce nel blu e nel rosso dello
spettro del visibile, riflettono luce nell’intervallo del
verde.
• I pigmenti sono associati a proteine.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 23 -
Spettri di assorbimento
• L’efficienza della fotosintesi è massima alle estremità
dello spettro della luce visibile
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 24 -
12
Le transizioni elettroniche
Stato di singoletto eccitato
Energia
S1
Assorbimento
Emissione
S0
Stato fondamentale
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 25 -
Disattivazione dello stato eccitato
Allo stato eccitato
di un’altra molecola
Reazione
redox
Energia
S1
S0
Dissipazione
Trasferimento di
termica
energia
Emissione
Fotossidazione
(Fluorescenza)
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 26 -
13
Reazioni allo stato eccitato
• Assorbimento, formazione dello stato eccitato:
A + hυ → A* (τ =10-15 s)
• Disattivazione dello stato eccitato:
– Energy transfer:
A* + B → A + B* (τ = 10-8-10-10 s);
– Emissione di luce (fluorescenza):
A* → A + hυ’ (τ = 10-8 s; υ’ < υ );
– Reazione redox:
A* + B → A+ + B- (τ = 10-6-10-8 s);
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 27 -
Transizioni elettroniche
• Le transizioni elettroniche
avvengono, nei pigmenti
fotosintetici, nel visibile a causa
della presenza di sistemi
elettronici π coniugati.
• È fondamentale, nel
funzionamento del processo
fotosintetico, la trasduzione
dell’energia luminosa in energia
chimica,
• Ciò avviene a causa del
potenziale redox diverso tra lo
stato fondamentale e lo stato
eccitato della clorofilla:
Chl + hυ → Chl* →
CH3
R
+
HN
O
HH
H3C
H
No Mg++
R = -CH3 Feofitina a
R = -CHO Feofitina b
CH3
O
H2C
CH3
O
O
CH3
CH3
CH3
H3C
H 3C
CH3
CH3
CH3
H3C
CH3
CH3
CH3
CH3
• Il
non cambia numero di
ossidazione.
H 3C
CH3
β-carotene
H
N
H
N
CH3
CH3
CH3
H
N
N
e-
Mg++
v. 2.0 © gsartor 2001-2012
Mg++
N
Mg++
R = -CH3 Clorofilla a
R = -CHO Clorofilla b
O
N
NH
H
O
Chl·+
H
O
CH3 CH3
O
O
CH2
CH3
O
Ficocianobilina
Fotosintesi
- 28 -
14
Transizioni elettroniche
• Le transizioni elettroniche
avvengono, nei pigmenti
fotosintetici, nel visibile a causa
della presenza di sistemi
elettronici π coniugati.
• È fondamentale, nel
funzionamento del processo
fotosintetico, la trasduzione
dell’energia luminosa in energia
chimica,
• Ciò avviene a causa del
potenziale redox diverso tra lo
stato fondamentale e lo stato
eccitato della clorofilla:
Chl + hυ → Chl* →
CH3
R
Mg++
N
+
H
No Mg++
R = -CH3 Feofitina a
R = -CHO Feofitina b
CH3
O
CH3
O
O
CH3
CH3
CH3
H3C
H 3C
CH3
H3C
CH3
CH3
CH3
CH3
CH3
CH3
H 3C
CH3
β-carotene
H
N
H
N
CH3
CH3
CH3
H
N
N
e-
Mg++
• Il
non cambia numero di
ossidazione.
v. 2.0 © gsartor 2001-2012
O
HH
HN
H2C
H3C
Mg++
R = -CH3 Clorofilla a
R = -CHO Clorofilla b
O
N
NH
H
O
Chl·+
H
O
CH3 CH3
O
O
CH2
CH3
O
Ficocianobilina
Fotosintesi
- 29 -
Riduzione e ossidazione
• La fotosintesi consiste nella riduzione del NADP+ a spese degli eceduti dall’acqua all’ossigeno e attivati dalla luce.
NADP+/NADPH E’0 = -0.32 V
• Per ridurre il NAD+ è necessario un riducente con E’0 < -0.32 V.
O2/H2O E’0 = +0.82 V
• Per ossidare l’acqua ad ossigeno è necessario un ossidante con
E’0 > 0.82 V.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 30 -
15
Riduzione e ossidazione
Fotosistema
I (PSI)
• La fotosintesi consiste nella riduzione del NADP+ a spese degli eceduti dall’acqua all’ossigeno e attivati dalla luce.
NADP+/NADPH E’0 = -0.32 V
• Per ridurre il NAD+ è necessario un riducente con E’0 < -0.32 V.
O2/H2O E’0 = +0.82 V
• Per ossidare l’acqua ad ossigeno è necessario un ossidante con
E’0 > 0.82 V.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 31 -
Riduzione e ossidazione
• La fotosintesi consiste nella riduzione del NADP+ a spese degli eceduti dall’acqua all’ossigeno e attivati dalla luce.
NADP /NADPH E’ = -0.32 V
Fotosistema
II (PSII)
+
0
• Per ridurre il NAD+ è necessario un riducente con E’0 < -0.32 V.
O2/H2O E’0 = +0.82 V
• Per ossidare l’acqua ad ossigeno è necessario un ossidante con
E’0 > 0.82 V.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 32 -
16
hn
2NADP+
2NADPH
OUT
4e-
PSII
Cyt b6/f
PSI
IN
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 33 -
hν
hν
2NADP+
2NADPH
OUT
4e-
4e -
PSII
Cyt b6/f
PSI
IN
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 34 -
17
hν
hν
2NADP+
2NADPH
OUT
4e-
4e -
PSII
Cyt b6/f
PSI
4e -
IN
2H2O
2H+ + O2
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 35 -
hν
hν
2NADP+
2NADPH
OUT
4e -
4e-
PSII
Cyt b6/f
PSI
4e-
IN
2H2O
v. 2.0 © gsartor 2001-2012
2H+ + O
2
Fotosintesi
- 36 -
18
hν
hν
2NADP+
2NADPH
OUT
PSII
4e -
OH
4e-
4eOH
Cyt b6/f
O
PSI
O
4e-
IN
2H+
2H+ + O
2H2O
2
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 37 -
hn
hn
2NADP+
2H+
OUT
4e-
Cyt b6/f
1e-
4e-
IN
4e-
4e-
PSII
2NADPH
PSI
Pc
2H+
2H2 O
v. 2.0 © gsartor 2001-2012
2H+ + O
2
2H+
Fotosintesi
- 38 -
19
hn
hn
2H+
2NADP+
OUT
4e-
PSII
OH
4e-
4e-
OH
Cyt b6/f
O
2NADPH
PSI
O
1e-
4e-
IN
Pc
Pc
2H+
2H+ + O
2H2 O
2
2H+
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 39 -
hn
hn
2NADP+
2H+
OUT
4e-
Cyt b6/f
1e-
4e-
IN
4e-
4e-
PSII
2NADPH
Pc
PSI
Pc
1e-
2H+
2H2 O
v. 2.0 © gsartor 2001-2012
2H+ + O
2
2H+
Fotosintesi
- 40 -
20
NADPH
ATP
H+
ADP + Pi
OUT
Cyt b6/f
PSII
PSI
IN
H+
v. 2.0 © gsartor 2001-2012
Fotosintesi
Ciclo di Calvin Benson
6CO2
ATP
NADPH
- 41 -
C6H12O6
H+
ADP + Pi
OUT
PSII
Cyt b6/f
PSI
IN
6H2O
H+
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 42 -
21
C6H12O6
Ciclo di Calvin Benson
ATP
NADPH
6CO2
ADP + Pi
H+
OUT
Cyt b6/f
PSII
PSI
IN
6H2O
H+
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 43 -
Riduzione e ossidazione
ATP
PS-II
PS-I
hυ < 680 nm
hυ > 700 nm
P680
H 2O
ADP + Pi
CF1CFo
ATP sintasi
Ossidante
forte
E'o > 0.8V
1/2 O2
nH+stroma
nH+lume
P700
Ossidante
debole
E'o ~ 0.45V
Riducente
debole
PQ
E'o ~ 0V
NADP+
Riducente
forte
E'o < -0.6V
NADPH
• La produzione di equivalenti riducenti (NADPH) è associata
alla traslocazione di protoni dallo stroma al lume del tilacoide
con formazione di un gradiente di pH e di carica,
• Attraverso una ATP-sintasi i protoni vengono riportati
all’interno dello stroma a favore di gradiente con accoppiata la
sintesi di ATP.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 44 -
22
Riduzione e ossidazione
ATP
PS-II
PS-I
hυ < 680 nm
hυ > 700 nm
P680
H2O
ADP + Pi
CF1CFo
ATP sintasi
Ossidante
forte
E'o > 0.8V
1/2 O2
nH+stroma
nH+lume
P700
Ossidante
debole
E'o ~ 0.45V
Riducente
debole
PQ
E'o ~ 0V
NADP+
Riducente
forte
E'o < -0.6V
NADPH
• In alcuni casi invece di procedere alla riduzione del
NADP+, P700 viene “cortocircuitata” per la produzione di
gradiente protonico.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 45 -
2005
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 46 -
23
2006
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 47 -
2006
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 48 -
24
La fotosintesi e
fotofosforilazione
Dalla luce all’ATP e NADPH
Unità fotosintetica
• Non tutte le molecole
di clorofilla svolgono
la funzione di donatori
di elettroni allo stato
eccitato.
Molecole antenna
(LHC)
hυ
• Il trasferimento di
energia tra le
molecole antenna al
centro di reazione
avviene per risonanza
(energy transfer).
v. 2.0 © gsartor 2001-2012
Centro di reazione
(PS)
Fotosintesi
- 50 -
25
Light harvesting complex
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 51 -
Light harvesting complex
Clorofilla A
• La luce viene
raccolta dal
sistema antenna
(Light harvesting
complex)
attraverso i
pigmenti:
Clorofilla B
– Clorofille (A e B)
– Caroteni
• L’energia luminosa
viene trasferita via
energy transfer al
centro di reazione.
Caroteni
Lipidi
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 52 -
26
Ficocianobilina
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 53 -
Ficocianobilina
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 54 -
27
Centri di reazione
• Negli eucarioti esistono due diversi centri di
reazione: PS-I e PS-II
• Nei due fotosistemi avvengono reazioni
diverse.
• I due fotosistemi hanno diversa sensibilità alla
luce .
• In uno dei due (PS-II) avviene l’ossidazione
dell’acqua ad ossigeno.
• La clorofilla nelle cellule vegetali è associata a
proteine integrali della membrana del
tilacoide.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 55 -
Potenziali redox
•
I valori dei
potenziali redox
permettono il
trasferimento di
elettroni dall’H2O
al NADP+:
7
1. E’o = + 0.85 V
6
2
2. E’o = + 1.20 V
3. E’o ≈ 0 V
4. E’o = + 0.40 V
5. E’o = + 0.75 V
6. E’o = - 1.20 V
5
3
4
1
7. E’o = - 0.70 V
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 56 -
28
Potenziali redox
•
I valori dei
potenziali redox
permettono il
trasferimento di
elettroni dall’H2O
al NADP+:
1. E’o = + 0.85 V
2. E’o = + 1.20 V
- 0.80
Plastochinone
FX
Feofitina
QA
QB
0
5. E’o = + 0.75 V
6. E’o = - 1.20 V
+
Fd
Fp
(FAD)
3
7
(Cyt b6)n
NADP+ + H+
PQ
FeS
hυ
Cyt f
H2O
1
2H+est
Mn2+
+ 1.20
P680
1/2 O2
NADPH
(Cyt b6)p
+ 0.40
+ 0.80
4. E’o = + 0.40 V
Ferredossina-
reduttasi
6 NADP
EC 1.18.1.2
P680*
- 0.40
hυ
3. E’o ≈ 0 V
P700*
A0
A1
FA
FB
PS-II
E'o
Ferredossina
PS-I
Complesso
Cyt b - Cyt f
EC 1.10.99.1
- 1.20
2
PC
4
P700
5
2H+int
Plastocianina
+ 2H+
+ 1.60
(rilasciati
nell'interno)
7. E’o = - 0.70 V
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 57 -
Schema a Z
- 0.80
P700*
A0
A1
FA
FB
Plastochinone
FX
PS-II
FerredossinaNADP+ reduttasi
EC 1.18.1.2
Fd
Fp
(FAD)
P680*
- 0.40
E'o
Ferredossina
PS-I
Complesso
Cyt b - Cyt f
EC 1.10.99.1
- 1.20
(Cyt b6)n
Feofitina
QA
QB
0
NADP+ + H+
PQ
FeS
+ 0.40
hυ
Cyt f
PC
hυ
+ 0.80
2H+est
H 2O
Mn2+
+ 1.20
1/2 O2
P680
NADPH
(Cyt b6)p
P700
2H+int
Plastocianina
+ 2H+
+ 1.60
(rilasciati
nell'interno)
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 58 -
29
Trasporto di H+
•
Nel trasporto di
elettroni
dall’acqua al
NADP+ vengono
anche trasportati
4H+ nel lume del
tilacoide
(all’interno) dalla
cavità stromale
(dall’esterno).
•
2H+ vengono
prodotti nel lume
a seguito della
ossidazione
dell’acqua.
v. 2.0 © gsartor 2001-2012
2H+
4H+
Fotosintesi
- 59 -
Fotosistema II (PS-II)
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 60 -
30
PS-II
• I due elettroni vengono trasferiti al plastochinone legato
al PS-II attraverso una serie di reazioni redox di gruppi
prostetici.
Stroma
hυ
P680
P680*
QA
QB
(red)
Feofitina
(ox)
Tyr+.
Feofitina
(red)
P680+
QA
QB
(ox)
Tyr
2H2O
Lume del
tilacoide
O2 + 4H+
(rilasciati nell'interno)
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 61 -
PS-II
• I due elettroni vengono trasferiti al plastochinone legato
al PS-II attraverso una serie di reazioni redox di gruppi
prostetici.
Stroma
hυ
P680
P680*
Feofitina
O
pQB
Pheo
+
pQA-.
TyrZ
OH
P680+.
Pheo-.
pQA
pQB-
2H2O
Lume del
tilacoide
O2 + 4H+
(rilasciati nell'interno)
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 62 -
31
1s5l
v. 2.0 © gsartor 2001-2012
Clorofilla
Fotosintesi
- 63 -
PS-II
Eme
4Mn++
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 64 -
32
PS-II
β-carotene
Feofitina
Feofitina
v. 2.0 © gsartor 2001-2012
Clorofilla
Fotosintesi
- 65 -
PS-II
Eme
β-carotene
4Mn++
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 66 -
33
PS-II
Plastochinone-9
β-carotene
Feofitina
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 67 -
Fotosintesi
- 68 -
1s5l
v. 2.0 © gsartor 2001-2012
34
Centro di reazione
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 69 -
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 70 -
35
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 71 -
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 72 -
36
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 73 -
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 74 -
37
PCET
• Proton-coupled electron transfer
H
O
H
O
H
N
H
.
O
H
PCET
N
His190
TyrZ
O
H
TyrZ
v. 2.0 © gsartor 2001-2012
N
+
N
His190
Fotosintesi
- 75 -
PS-II Complesso Manganese
• È il sito dove avviene la reazione:
H2O → ½ O2 + 2H+ + 2e• I due elettroni vengono trasportati al P680+ (attivato dal
P680 per assorbimento di un fotone)
Mn++
H
O
H
Mn++
4 hυ
H
+ O2 + 4H+ + 4e-
O
Mn++
Mn++
H
e-
hυ
e-
hυ
S2
S1
e-
hυ
S3
S0
hυ
S4
eO2 +4H+
v. 2.0 © gsartor 2001-2012
2H2O
Fotosintesi
- 76 -
38
PS-II Complesso Manganese
*
*
O
O Mn
*
O
*
O
4+
O
Mn
O
2+
O
4+
O
O
O
H
H
Mn
*
Tyr
*
O
H
H
O
*
Mn
H
3+
*
O
2+
O
O
Ca
O
*
v. 2.0 © gsartor 2001-2012
Cl
*
*
*
*
Fotosintesi
- 77 -
PS-II Complesso Manganese
*
*
O
O Mn
*
O
*
O
O
Mn
O
S0
4+
O
Mn
H
H
O
O
O
Mn
*
e-, H+
*
Tyr
*
O
4+
*
2+
O Mn
H O
H
H
3+
*
O
O
Ca
O
*
*
O
*
O
Cl
*
O
*
O
2+
S1
4+
H
*
Tyr
*
Mn
3+
*
O
2+
O
O
Ca
O
*
*
O
*
O
Cl
*
*
*
*
O Mn
H
O
H
H
O
*
O
3+
O
O
O
e-, H+
*
Mn
O
O
Mn
O
*
4+
4+
Tyr
*
O
H
Mn
O
H
H
O
O
O
*
S2
*
4+
Mn
O
O
Mn
O
*
4+
3+
O
*
O
2+
Ca
O
*
*
*
Cl
*
O
*
*
*
O2
2H2O
*
O Mn
*
*
O
O
Mn
O
Mn
*
Mn
*
*
Cl
O Mn
*
O
H
3+
O
*
*
Ca
O
*
v. 2.0 © gsartor 2001-2012
*
Cl
*
O
O
*
O
Tyr
O
4+
O
O
4+
O
O
O
S4
e-, H+
*
O
4+
2+
*
O
O
S3
O
O
Mn
O
*
4+
*
*
*
O
4+
O
H
O Mn
Tyr
Cl
O
*
*
2+
O
O
Ca
O
*
Fotosintesi
*
Cl
*
Mn
O
*
S2
4+
*
4+
O
O
*
4+
Mn
O
O
O
*
H
4+
Mn
O
*
O
O
4+
O
O
e-, H+
*
Mn
H
O
H
H
O
Mn
Tyr
Cl
O
3+
O
*
2+
Ca
O
*
Cl
*
O
O
*
*
*
- 78 -
39
Stroma
Stroma
hυ
P680
1
hυ
P680*
Tyr+.
P680+
QA
QB
(red
Feofitina
(ox)
P680
Feofitina
(red)
QA
QB
(ox)
Tyr
*
*
O
O Mn
*
O
4+
2+
Lume del
tilacoide
O
H
H
O
Mn
*
S0
QA
QB
(ox)
3+
O
H
*
*
O
*
O
Cl
*
O
O
Ca
O
*
4+
O Mn
O
2+
Mn
O
H
H
H
O
O
3+
*
O
Mn
O
O
H
*
O
*
O
Cl
*
O
Ca
O
*
4+
O Mn
O
*
*
*
O
Tyr
*
O
4+
*
S1
*
*
*
3+
Mn
O
O
Lume del
tilacoide
H+
*
O
Tyr
*
O
H
H
4+
Mn O
O
*
*
Mn
O
O
Feofitina
(red)
P680+
eH+
O
QA
QB
(red
Feofitina
(ox)
Tyr
e-
*
P680*
2
Tyr+.
2+
O
O
Tyr
*
O
H
H
O
O
3+
*
O
Mn
O
H
4+
Mn
O
*
S2
*
*
4+
Mn
O
O
*
*
Cl
*
O
Ca
O
*
2+
*
*
*
O2
Stroma
Stroma
hυ
hυ
P680
4
P680*
Tyr+.
2H2O
P680+
QA
QB
(red
Feofitina
(ox)
Feofitina
(red)
P680
QA
QB
(ox)
Tyr
*
*
O
O Mn
*
O
4+
Mn
O
Mn
O
*
O
O
Feofitina
(red)
H
3+
Mn
O
*
Cl
*
O
O
Ca
O
*
*
O Mn
O
2+
*
O
*
O
O
*
S3
*
4+
O
O
4+
Mn O
O
*
Mn
4+
*
v. 2.0 © gsartor 2001-2012
*
H
4+
Mn
O
O Mn
O
O
*
H
*
Cl
*
O
O
*
*
4+
Tyr
Mn
Cl
O
O
H
H
H
O
*
4+
O
Mn O
3+
Cl
O
*
O
Mn
*
O
2+
*
O
Ca
*
O
S2
O
*
*
*
O
Tyr
Cl
O
Ca
O
*
*
QA
QB
(ox)
Lume del
tilacoide
H+
O
Tyr
Cl
QA
QB
(red
e-
*
*
O
4+
S4
4+
O
O
Feofitina
(ox)
Tyr
Lume del
tilacoide
H+
O
P680*
P680+
e-
*
3
Tyr+.
2+
*
*
*
O
4+
O
O
Fotosintesi
- 79 -
PS-II
• I due elettroni vengono trasferiti al plastochinone legato
al PS-II attraverso una serie di reazioni redox di gruppi
prostetici.
Stroma
hυ
P680
P680*
Feofitina
(ox)
Tyr+.
P680+
Tyr
Feofitina
(red)
QA
QB
(red)
QA
QB
(ox)
H2O
Lume del
tilacoide
1/2 O2 + 2H+
(rilasciati nell'interno)
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 80 -
40
Plastochinone
2H+ + 2e-
O
H3 C
OH
H3 C
CH3
7
CH3
O
H3C
H3C
CH3
CH3
7
CH3
CH3
OH
CH3
CH3
• Il plastochinone 9 (nove unità isoprenoidi) è un
trasportatore mobile di elettroni,
• Due molecole di plastochinone 9 (QA e QB) sono legati al
PS-II e sono l’ultimo anello della catena redox interna al
PS-II.
• Gli elettroni vengono quindi trasferiti al pool di
plastochinone che funziona come il CoQ nei mitocondri:
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 81 -
Plastochinone
O
OH
H3C
H3C
H3C
n
O
H
e-
H3C
e- + 2H+
CH3
n
OH
H
CH3
O
H3C
CH3
H3C
n
O
H
CH3
• Quando è legato al proprio sito il PQ può accettare un eper formare un radicale semichinone (PQ·-).
• Quindi il PQ, come FMN, può trasferire uno o due e- fra
donatori e accettori.
• Il PQ funziona come un trasportatore mobile di eall’interno della membrana.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 82 -
41
Q cycle
2H+
SPAZIO INTERMEMBRANA
Cyt c
O
O
MeO
CH3
MeO
CH3
MeO
R
MeO
R
O
e-
Cyt bH
e-
Fe S
Cyt c1
O
Complesso III
Cyt bL
e-
O
eOH
O
MeO
CH3
MeO
CH3
MeO
MeO
R
MeO
R
MeO
O
CH3
R
OH
O
MATRICE
2H+
• Il “Q cycle” è il meccanismo con il quale avviene la ossidoriduzione del
CoQ e dipende da:
— La mobilità del CoQ nella membrana
— L’esistenza di un sito di legame che stabilizza il radicale
semichinonico CoQ·-.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 83 -
Q cycle
2H+
SPAZIO INTERMEMBRANA
Cyt c
O
O
MeO
CH3
MeO
CH3
MeO
R
MeO
R
O
e-
Cyt bH
e-
Fe S
Cyt c1
O
Complesso III
1
Cyt bL
e-
O
MeO
MeO
O
e-
O
CH3
MeO
R
MeO
CH3
MeO
R
MeO
O
OH
OH
CH3
R
MATRICE
2H+
• Il CoQH2 è legato al proprio sito nella proteina.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 84 -
42
Q cycle
2H+
SPAZIO INTERMEMBRANA
Cyt c
O
MeO
CH3
MeO
MeO
R
MeO
O
e-
Cyt bH
O
O
CH3 e-
Fe S
R
2
Cyt c1
Complesso III
Cyt bL
e-
O
e-
O
MeO
CH3
MeO
CH3
MeO
MeO
R
MeO
R
MeO
O
O
OH
OH
CH3
R
MATRICE
2H+
• Il CoQH2 cede un e- al Fe+++ dell’eme bL
• Si forma il semichinone carico negativamente
• 2 H+ sono rilasciati nello spazio intermembrana.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 85 -
Q cycle
2H+
SPAZIO INTERMEMBRANA
Cyt c
O
O
MeO
CH3
MeO
CH3
MeO
R
MeO
R
O
e-
Cyt bH
3a
e-
Fe S
Complesso III
e-
Cyt bL
MeO
MeO
O
O
eCH3 MeO
R
MeO
O
O
Cyt c1
O
eOH
CH3
MeO
R
MeO
CH3
R
OH
MATRICE
2H+
• Un e- passa dal Fe++ del gruppo eme bH al Fe+++ del gruppo eme bL.
• L’ e- va quindi a ridurre un CoQ ossidato (proveniente dal pool dei
chinoni) a semichinone
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 86 -
43
Q cycle
2H+
SPAZIO INTERMEMBRANA
Cyt c
O
O
MeO
CH3
MeO
CH3
MeO
R
MeO
R
O
e-
Cyt bH
3b
e-
Fe S
Complesso III
e-
Cyt bL
e-
O
MeO
MeO
CH3
MeO
R
MeO
O
O
O
Cyt c1
O
e-
CH3
MeO
R
MeO
OH
OH
CH3
R
MATRICE
2H+
• Un e- passa dal Fe++ del gruppo eme bH al Fe+++ del gruppo eme bL.
• In alternativa (secondo le necessità) l’ e- va quindi a ridurre un CoQ-·
per riformare il CoQH2 con due H+ provenienti dalla matrice.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 87 -
Q cycle
2H+
SPAZIO INTERMEMBRANA
Cyt c
O
MeO
MeO
O
CH3
MeO
R
MeO
e-
Cyt bH
O
O
CH3 e-
Fe S
R
Cyt c1
Complesso III
4
Cyt bL
e-
O
MeO
CH3
MeO
R
O
eOH
O
MeO
MeO
CH3
MeO
R
MeO
CH3
R
OH
O
MATRICE
2H+
• Il CoQ-·, formato per semiossidazione al passo 2, cede un e- al Fe+++
del complesso Fe-S.
• Si forma il CoQ ossidato che va a confluire nel pool.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 88 -
44
Q cycle
2H+
SPAZIO INTERMEMBRANA
Cyt c
O
O
MeO
CH3
MeO
CH3
MeO
R
MeO
R
O
e-
Cyt bH
e-
Fe S
e-
Cyt c1
O
Complesso III
5
Cyt bL
e-
O
eOH
O
MeO
CH3
MeO
CH3
MeO
MeO
R
MeO
R
MeO
O
CH3
R
OH
O
MATRICE
2H+
• Il Fe++ del complesso Fe-S cede un e- al Fe+++ del cit c1 legato alla
proteina.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 89 -
Q cycle
2H+
SPAZIO INTERMEMBRANA
Cyt c
O
e-
O
MeO
CH3
MeO
CH3
MeO
R
MeO
R
O
e-
Cyt bH
eFe
S
e-
Cyt c1
O
Complesso III
6
Cyt bL
e-
O
MeO
CH3
MeO
R
O
eOH
O
MeO
MeO
CH3
MeO
R
MeO
CH3
R
OH
O
MATRICE
2H+
• Il Fe++ del cit c1 legato alla proteina cede un e- al Fe+++ del cit c
mobile.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 90 -
45
Complesso Cyt b - Cyt f (EC 1.10.99.1)
• Gli elettroni provenienti dal pool dei chinoni vengono trasferiti
al complesso Cyt b6/f che contiene due gruppi eme: Cyt b6
(E’0 = -0.06 V) e Cyt f (E’0 = +0.365 V).
• Gli elettroni vengono quindi convogliati alla plastocianina.
• In alcune situazioni il Cyt b6 serve per “cortocircuitare” il
P700* per produrre gradiente protonico aggiuntivo piuttosto
che NADPH.
H+int
H+est
QA
QB
(red)
QA
QB
(ox)
v. 2.0 © gsartor 2001-2012
PQ
PQH2
Cyt f (Fe++)
Cyt f (Fe+++)
PC (Cu++)
PC (Cu+)
Fotosintesi
- 91 -
Complesso Cyt b - Cyt f (EC 1.10.99.1)
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 92 -
46
Complesso Cyt b - Cyt f (EC 1.10.99.1)
Eme
Clorofilla a
Complesso FeS
β-carotene
Plastochinone-9
Lipidi
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 93 -
Complesso Cyt b - Cyt f (EC 1.10.99.1)
Complesso FeS
β-carotene
eme
Plastochinone-9
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 94 -
47
Plastocianina
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 95 -
Plastocianina
• La plastocianina è un
trasportatore mobile di
elettroni (un elettrone
per volta) simile al Cyt c
nella catena respiratoria.
• L’elettrone viene
trasportato dallo ione
rame che si presenta
nella forma ossidata
(Cu++) e ridotta (Cu+).
Met
Cu++
His
Cys
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 96 -
48
Plastocianina
• Lo ione rame è legato
alla proteina da quattro
legami di coordinazione
(sp3) che coinvolgono gli
atomi di azoto di due
residui di His adiacenti e
gli atomi di zolfo di un
residuo di Cys e di un
residuo di Met.
v. 2.0 © gsartor 2001-2012
His85
Cys82
His39
Met90
Fotosintesi
- 97 -
Fotosistema I (PS-I)
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 98 -
49
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 99 -
Fotosintesi
- 100 -
1jb0
v. 2.0 © gsartor 2001-2012
50
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 101 -
Centro FeS
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 102 -
51
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 103 -
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 104 -
52
1bj0
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 105 -
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 106 -
53
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 107 -
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 108 -
54
PS-I
Lume del
tilacoide
Stroma
P700+
<10 ps
PChla-
200 ps
0.17 ps
PQ
FeS
(Ox)
PC (Cu+)
PChla
PQ-
FeS
(Red)
P700*
PC (Cu++)
P700
hυ
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 109 -
Ferredossina – Ferredossina reduttasi
(EC 1.18.1.2)
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 110 -
55
Ferredossina
• La ferredossina è un
trasportatore mobile di
elettroni che sfrutta la
presenza di un cluster
Fe2S2.
• La ferredossina accetta
un elettrone dal PS-I e lo
trasferisce al NADP+.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 111 -
Ferredossina reduttasi (EC 1.18.1.2)
• Il trasferimento di
elettroni dalla
ferredossina al NADP+ è
catalizzato da una
ferredossina-reduttasi.
• È una flavoproteina che
lega la ferredossina
correttamente orientata.
• Il FAD è convertito in
FADH2,
• Gli elettroni sono quindi
trasferiti al NADP+ nello
stroma.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 112 -
56
Ferredossina reduttasi (EC 1.18.1.2)
• Il trasferimento di
elettroni dalla
ferredossina al NADP+ è
catalizzato da una
ferredossina-reduttasi.
• È una flavoproteina che
lega la ferredossina
correttamente orientata.
• Il FAD è convertito in
FADH2,
• Gli elettroni sono quindi
trasferiti al NADP+ nello
stroma.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 113 -
hν
hν
Stroma
OUT
4e-
PSII
OH
OH
O
2NADP+
2H+
4e-
4e-
Cyt b6/f
PSI
O
1e-
4e-
IN
Pc
2H+
2H2O
v. 2.0 © gsartor 2001-2012
2H+ + O
2
2NADPH
Pc
1e-
Lume
2H+
Fotosintesi
- 114 -
57
Ciclo o non
ciclo?
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 116 -
58
Out of thin air
Nature Vol 445 Feb 2009
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 117 -
Via ciclica
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 118 -
59
Via ciclica nei Rhodobacter
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 119 -
Via ciclica nei Rhodobacter
ATPasi
ADP3- + H+ + Pi2-
Accettore
primario di
elettroni
ATP4-
Complesso
citocromo bc1
H+
2H+
3H+
IN
QB
QA
QB
Pheo
QB
QH2
QH2
e-
OUT
Clorofilla
2H+
Centro di
reazione
hν
v. 2.0 © gsartor 2001-2012
H+
3H+
Citocromo
Fotosintesi
- 120 -
60
Schema a Z
- 0.80
P700*
A0
A1
FA
FB
Plastochinone
FX
PS-II
FerredossinaNADP+ reduttasi
EC 1.18.1.2
Fd
Fp
(FAD)
P680*
- 0.40
E'o
Ferredossina
PS-I
Complesso
Cyt b - Cyt f
EC 1.10.99.1
- 1.20
(Cyt b6)n
Feofitina
QA
QB
0
NADP+ + H+
PQ
FeS
+ 0.40
hυ
Cyt f
PC
hυ
+ 0.80
2H+est
H 2O
Mn2+
+ 1.20
1/2 O2
P680
NADPH
(Cyt b6)p
P700
2H+int
Plastocianina
+ 2H+
+ 1.60
(rilasciati
nell'interno)
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 121 -
Via fotosintetica non ciclica
2H2O + 2NADP+ → O2 + 2H+ + 2NADPH
H2S + NAD+ → S + H+ + NADH
H2 + NAD+ → H+ + NADH
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 122 -
61
cF1Fo ATP Sintasi
Meccanismo della sintesi di ATP
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 123 -
ATP sintasi
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 124 -
62
ATP sintasi
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 125 -
ATP sintasi
• La ATP sintasi, presente
nella membrana del
tilacoide.
• È composta di sue
principali unità catalitiche:
– F1: costituita da cinque
polipeptidi con
stechiometria α3β3γδε.
– Fo: proteina di
membrana che gestisce
il trasporto di protoni.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 126 -
63
Inibitori ATP sintasi
Oligomicina A
• Bloccano il trasporto di H+
accoppiato alla sintesi o
all’idrolisi di ATP.
H 3C
– Oligomicina A, un
antibiotico.
HO
OH
– Dicicloesilcarbodiimide
(DCCD) è un reagente dei
gruppi carbonilici in
ambiente idrofobico per
formare un addotto
covalente.
CH3
O
CH3 CH3
O
CH3
H
O
H
CH3
O
CH3
OH
CH3
H
CH3
• Entrambi bloccano il flusso di
H+ nella membrana inibendo la
sintesi di ATP attraverso
l’interazione con Fo.
OH
OH
H 3C
N
N
Dicicloesilcarbodiimide
(DCCD)
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 127 -
Meccanismo di sintesi
• Il meccanismo di legame e di sintesi accoppiata è stata
proposta da Boyer e Walker (Nobel).
• Per semplicità sono riportate solo le subunità catalitiche β.
– È stato proposto che una struttura proteica di forma
irregolare (γ) sia legata a Fo e ruoti relativamente alle tre
subunità catalitiche β.
– La rotazione di γ è pilotata dal flusso protonico attraverso
Fo.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 128 -
64
Meccanismo di sintesi
The Nobel Prize in Chemistry 1997
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 129 -
Meccanismo di sintesi
ATP
ADP + Pi
ATP
P
AT
Pi
P+
AD
O
T L
Pi
•
L
AD
P+
•
T
AT
P
•
O
O
T
AT
P
P
AT
L
La conformazione di ogni subunità catalitica β cambia sequenzialmente a
seguito dell’interazione con la subunità γ che ruota (al centro).
Ogni subunità catalitica β ha una conformazione diversa per ogni passo
del ciclo catalitico
Per esempio la subunità verde è sequenzialmente:
– In conformazione L (loose) nella quale il sito attivo lega debolmente ADP + Pi
– In conformazione T (tight) nella quale il substrato è legato fortemente e si
forma ATP.
– In conformazione O (open) nella quale viene rilasciato l’ATP.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 130 -
65
Struttura di F1
• F1 consiste di
cinque polipeptidi
con stechiometria
α3, β3, γ, δ, ε (in
ordine
decrescente di
peso molecolare).
• Le subunità α e β
sono omologhe.
v. 2.0 © gsartor 2001-2012
α
β
γ
β
α
α
β
β
α
β α
γ
ε
δ
Fotosintesi
- 131 -
Struttura di F1
• F1 consiste di
cinque polipeptidi
con stechiometria
α3, β3, γ, δ, ε (in
ordine
decrescente di
peso molecolare).
• Le subunità α e β
sono omologhe.
β
α
γ
β
α
Fotosintesi
β
β
α
ε
v. 2.0 © gsartor 2001-2012
α
γ
δ
- 132 -
66
Struttura di F1
ATP Mg++
• Ci sono tre siti catalitici.
ADP Mg++
• Sono localizzati alle
interfacce αβ con
predominanza nella
subunità β.
• Ognuna delle tre subunità α
contiene un ATP legato alla
proteina ed inattivo nella
catalisi.
• I nucleotidi adenilici si
legano alle subunità α e β
complessati con Mg++.
ADP Mg++
v. 2.0 © gsartor 2001-2012
Fotosintesi
ATP Mg++
- 133 -
Struttura di F1
ATP Mg++
• Ci sono tre siti catalitici.
ADP Mg++
• Sono localizzati alle
interfacce αβ con
predominanza nella
subunità β.
• Ognuna delle tre subunità α
contiene un ATP legato alla
proteina ed inattivo nella
catalisi.
• I nucleotidi adenilici si
legano alle subunità α e β
complessati con Mg++.
ADP Mg++
v. 2.0 © gsartor 2001-2012
Fotosintesi
ATP Mg++
- 134 -
67
Struttura di F1
ATP Mg++
• Ci sono tre siti catalitici.
ADP Mg++
• Sono localizzati alle
interfacce αβ con
predominanza nella
subunità β.
• Ognuna delle tre subunità α
contiene un ATP legato alla
proteina ed inattivo nella
catalisi.
• I nucleotidi adenilici si
legano alle subunità α e β
complessati con Mg++.
ADP Mg++
v. 2.0 © gsartor 2001-2012
Fotosintesi
ATP Mg++
- 135 -
Struttura di F1
• La subunità γ
include un
ripiegamento
dell’elica che
costituisce una
“camma”
incastrata tra le
subunità α e β.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 136 -
68
Struttura di F1
• La subunità γ
include un
ripiegamento
dell’elica che
costituisce una
“camma”
incastrata tra le
subunità α e β.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 137 -
F1
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 138 -
69
Subunità Fo
• La subunità c di Fo ha una struttura
ripiegata (hairpin) con due α-eliche
transmembrana connesse da un
corto loop.
• È un peptide molto idrofobico.
• Una delle due α-eliche ha un
residuo acido (Asp o Glu) che è il
sito di reazione del DCCD.
• Tale residuo è essenziale per il
trasporto dei H+ attraverso Fo.
Asp61
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 139 -
F0
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 140 -
70
Il rotore
• È stato proposto che la
subunità a di Fo formi due
mezzi canali per il trasporto
dei protoni.
Subunità
γ
Subunità c
• Il trasporto avverrebbe
attraverso la ionizzazione di
gruppi ionizzabili o attraverso
molecole d’acqua contenute
nei canali.
• La variazione di ionizzazione
(Asp61 in c) al passaggio dei
protoni indurrebbe il
movimento rotatorio del
Subunità a
rotore trasmesso poi,
attraverso γ a F1.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 141 -
Motori molecolari
• Che la rotazione di una
parte della proteina
avvenga in seguito
all’idrolisi di ATP è stato
dimostrato
sperimentalmente:
– Le subunità β di F1 sono
state “saldate” ad una
superficie.
– Un filamento di actina
opportunamente marcato
con colorante fluorescente
è stato legato alla porzione
di γ che protrude dalla F1.
– Fornendo ATP nella
soluzione si ha la rotazione
(visibile) del braccio di
actina in senso antiorario.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 142 -
71
Motori molecolari
• Alcune osservazioni indicano
che la rotazione indotta da
ATP avviene in passi discreti
di 120° con pause tra un
passo e l’altro.
• Sembra inoltre che ogni
passo di 120° avvenga con
sosta in sottopassi di 90° e
30° intervallati da pause più
brevi.
• È stato proposto che questi
sottopassi siano connessi a
passaggi del ciclo catalitico
come il legame di ATP e il
rilascio di ADP e Pi.
• http://www.res.titech.ac.jp/~seibutu/main_.html
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 143 -
Struttura
• Questo è il massimo di
risoluzione ottenuta fino ad
ora della definizione della
intera struttura dell’ATP
sintasi.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 144 -
72
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 145 -
FASE BUIA
73
FASE BUIA
NADPH + ATP + CO2 → C6H12O6
Fissazione della CO2
• Solo gli organismi fototrofi possono fissare la CO2, gli animali,
pur potendo legare la CO2 in molecole più complesse, non
sono in grado di accumulare composti organici da CO2.
• Nelle piante e nei batteri fotosintetici la CO2 viene convertita,
in prima istanza, in 3-fosfoglicerato.
O
O
O
P O
O
O
P O
O
OH
OH
HO
HO
O
O
P
H+
O
O
Ribulosio 1,5
difosfato
O
P O
O
O
O
O
O
CO2
O
P
O
O
O
2,3-enediolo
P O
O
O
O
O
2
OH
HO
O
O
O
O
HO
O
O
H2O
O
P
O
O
O
2-carbossi,
3-cheto ribitolo
O
O
O
H+
P
OH
O
P
O
O
O
3-fosfoglicerato
ENZIMA
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 148 -
74
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 149 -
Fissazione della CO2
• Queste reazioni sono
catalizzate dall’enzima: Dribuloso 1,5-difosfato
carbossilasi (EC 4.1.1.39),
RUBISCO.
• Un enzima stromale dal
peso molecolare di 550kD
(α8β8).
• Si ritiene che sia l’enzima
maggiormente presente
sulla terra.
• Responsabile della
selezione isotopica.
3-fosfoglicerato
α4β4
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 150 -
75
Rubisco (EC 4.1.1.39)
3-fosfoglicerato
α4β4
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 151 -
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 152 -
76
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 153 -
Ciclo di Calvin-Benson
The Nobel Prize in Chemistry 1961
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 154 -
77
Ciclo di Calvin-Benson
Ribulosio 1,5
difosfato
(RuBP)
O
PO3--
3-fosfoglicerato
(3PG)
6CO2
PO3--
O
1,3-bifosfoglicerato
(BPG)
12ATP
12ADP
12NADPH
O
HO
O
O
OH
PO3-O
O
PO3--
O
O
PO3--
HO
O
HO
Gliceraldeide-3-fosfato
(G3P)
12NADP+
O
HO
O
H
PO3--
PO3--
HO
O
O
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 155 -
Ciclo di Calvin-Benson
Ribulosio 1,5
difosfato
(RuBP)
O
PO3--
3-fosfoglicerato
(3PG)
6CO
6C
1
2
PO3--
O
1,3-bifosfoglicerato
(BPG)
12ATP
12ADP
O
HO
O
6C5OH
HO
O
12C
O
3
O
O
PO3--
12NADPH
PO3--
Gliceraldeide-3-fosfato
(G3P)
12NADP+
PO3--
HO
12C
3
O
O
PO3-O
12C3O
HO
H
PO3--
HO
O
O
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 156 -
78
Ciclo di Calvin-Benson
Ribulosio 1,5
difosfato
(RuBP)
O
PO3--
3-fosfoglicerato
(3PG)
6CO2
12ATP
PO3--
O
12NADPH
O
HO
O
O
OH
O
Ribulosio-1,5
difosfato
carbossilasi HO
(RUBISCO)
O
12NADP+
PO3--
PO3-O
HO
O
HO
Gliceraldeide-3-fosfato
(G3P)
1,3-bifosfoglicerato
(BPG)
12ADP
O
PO3--
HO
O
H
PO3--
PO3--
Gliceraldeide-3
fosfato
deidrogenasiasi
Fosfoglicerato
chinasi
O
O
v. 2.0 © gsartor 2001-2012
O
Fotosintesi
- 157 -
Ciclo di Calvin-Benson
12NADPH
6CO2
O
12ATP
PO3--
O
6
O
OH
HO
12
PO3--
HO
O
12NADP+
12ADP
O
12
PO3--
PO3--
12
HO
O
3-fosfoglicerato
(3PG)
O
H
PO3--
Gliceraldeide-3-fosfato
(G3P)
1,3-bifosfoglicerato
(BPG)
Ribulosio
1,5
difosfato
O
HO
O
O
O
PO3--
6ADP
6ATP
10
2
Glucosio-6
fosfato
(G6P)
Fruttosio
6-fosfato
(F6P)
O
Fruttosio
1,6-difosfato
(FBP)
HO
O
H
HO
O
OH
HO
OH
HO
OH
O
v. 2.0 © gsartor 2001-2012
PO3--
OH
O
PO3--
Fotosintesi
PO3--
O
OH
HO
OH
O
PO3--
- 158 -
79
Ciclo di Calvin-Benson
12NADPH
6CO
6C
12ATP
2
PO3--
O
O
30C
6
12
OH
HO
12NADP+
12ADP
PO3--
O
36C
O
O
36C
12
HO
O
O
H
PO3--
Gliceraldeide-3-fosfato
(G3P)
1,3-bifosfoglicerato
(BPG)
Ribulosio
1,5
difosfato
O
HO
O
3-fosfoglicerato
(3PG)
PO3--
PO3--
36C
12
HO
O
O
PO3--
6ADP
6ATP
30C10
Glucosio-6
fosfato
(G6P)
Fruttosio
6-fosfato
(F6P)
O
6C
2
Fruttosio
1,6-difosfato
(FBP)
HO
O
OH
OH
HO
HO
OH
O
OH
PO3--
O
v. 2.0 © gsartor 2001-2012
PO3--
O
H
HO
O
OH
HO
OH
PO3--
O
PO3--
Fotosintesi
- 159 -
Ciclo di Calvin-Benson
6ATP
6ADP
O
Diidrossi
acetonfosfato
(DHAP)
PO3--
Gliceraldeide-3-fosfato
(G3P)
PO3--
O
OH
HO
PO3--
O
Ribulosio-1,5
difosfato
(RuBP)
O
O
OH
O
HO
O
H
PO3--
Eritrosio-4
fosfato
(E4P)
HO
O
OH
HO
Fruttosio
1,6-difosfato
(FBP)
Ribulosio-5
fosfato
(Ru5P)
O
PO3-OH
OH
O
O
HO
OH
HO
Glucosio-6
fosfato
(G6P)
OH
OH
HO
PO3--
O
H
H
O
H
O
O
PO3--
O
PO3--
PO3-O
3HPO4--
HO
O
HO
HO
O
OH
OH
HO
O
Ribosio-5
fosfato
(RuP)
PO3--
PO3-O
H
OH
HO
O
Xilulosio-5
fosfato
(Xu5P)
PO3--
HO
Fruttosio
6-fosfato
(F6P)
O
HO
Sedoeptuloso
1,7-difosfato
(SBP)
OH
O
OH
PO3--
HO
OH
O
2HPO4--
PO3--
OH
O
HO
OH
HO
Sedoeptuloso
7-fosfato
(S7P)
OH
O
v. 2.0 © gsartor 2001-2012
Fotosintesi
PO3--
- 160 -
80
Ciclo di Calvin-Benson
6ATP
Diidrossi
acetonfosfato
(DHAP)
6ADP
O
PO3--
PO3--
6C5
O
6C3
O
Ribulosio-1,5
difosfato
(RuBP)
OH
HO
O
OH
Gliceraldeide-3-fosfato
(G3P)
12C3
PO3--
O
O
HO
O
H
PO3--
Eritrosio-4
fosfato
(E4P)
HO
O
Fruttosio
1,6-difosfato
(FBP)
6C5
OH
HO
Ribulosio-5
fosfato
(Ru5P)
O
O
PO3--
HO
OH
OH
OH
O
OH
3C6
HO
HO
Glucosio-6
fosfato
(G6P)
2C4
H
OH
1C6
PO3--
O
H
PO3--
O
H
O
O
O
PO3--
PO3-O
3HPO4--
2C5 4C5
HO
O
H
HO
HO
O
OH
HO
O
HO
HO
Xilulosio-5
fosfato
(Xu5P)
O
PO3--
2C7
OH
OH
Ribosio-5
fosfato
(RuP)
PO3-O
Fruttosio
6-fosfato
(F6P)
O
HO
O
OH
3C6
PO3--
Sedoeptuloso
1,7-difosfato
(SBP)
OH
PO3--
HO
OH
O
2HPO4--
PO3--
OH
O
2C7
HO
OH
HO
Sedoeptuloso
7-fosfato
(S7P)
OH
O
v. 2.0 © gsartor 2001-2012
PO3--
Fotosintesi
- 161 -
Ciclo di Calvin-Benson
6C1
6ATP
Diidrossi
acetonfosfato
(DHAP)
6C5
5C3
6ADP
Ribulosio-1,5
difosfato
(RuBP)
Glicolisi
Ribosio
6C5
…
Amido
12C3
Gliceraldeide-3-fosfato
(G3P)
Eritrosio-4
fosfato
(E4P)
2C4
3C
6 Cellulosa
1C6
Fruttosio
1,6-difosfato
(FBP)
Ribulosio-5
fosfato
(Ru5P)
Glucosio-6
fosfato
(G6P)
2C5 4C5
Ribosio-5
fosfato
(RuP)
Xilulosio-5
fosfato
(Xu5P)
3HPO 4--
Fruttosio
6-fosfato
(F6P)
3C6
2C7
Sedoeptuloso
1,7-difosfato
(SBP)
2HPO 4--
Sedoeptuloso
7-fosfato
(S7P)
2C7
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 162 -
81
Ciclo di Calvin-Benson
6ATP
6ADP
O
Diidrossi
acetonfosfato
(DHAP)
PO3--
PO3--
O
OH
HO
Ribulosio-1,5
difosfato
(RuBP)
O
Gliceraldeide-3-fosfato
(G3P)
Trioso fosfato
epimerasi
O
PO3-O
OH
O
HO
O
Fosforibuloso
chinasi
H
PO3--
Aldolasi
Eritrosio-4
fosfato
(E4P)
HO
O
Fruttosio
1,6-difosfato
(FBP)
Ribulosio-5
OH
fosfato
(Ru5P)
HO
O
OH
HO
epimerasi
PO3-OH
OH
O
O
PO3--
Aldolasi
PO3--
Fruttosio
difosfatasi
Fosfopentoso
isomerasi
O
3HPO4--
HO
O
O
HO
OH
PO3--
HO
Glucosio-6
Fosfopentoso fosfato
(G6P)
OH
H
O
H
O
O
OH
OH
Ribosio-5
fosfato
(RuP)
O
PO3--
HO
O
PO3-O
H
HO
HO
O
H
PO3--
O
HO
Fosfogluco
isomerasi
OH
HO
Xilulosio-5
fosfato
(Xu5P)
O
PO3--
HO
Fruttosio
6-fosfato
(F6P)
Sedoeptuloso
1,7-difosfato
(SBP)
OH
OH
O
OH
Sedoeptuloso
difosfatasi
PO3--
HO
O
2HPO4--
PO3--
Transchetolasi
OH
O
Sedoeptuloso
7-fosfato
(S7P)
HO
Transchetolasi
OH
HO
OH
O
v. 2.0 © gsartor 2001-2012
PO3--
Fotosintesi
- 163 -
Epimerasi (EC 5.1.3.1 )
D-ribuloso-5-fosfato
D-xiluloso-5-fosfato
O
O
O
P
O
O
Ribuloso-fosfato
3-epimerasi
(EC 5.1.3.1)
OH
HO
O
P
D-riboso-5-fosfato
O
OH
Riboso-5-fosfato
isomerasi
(EC 5.3.1.6)
HO
O
O
O
O
O
OH
O
P
O
OH
O
HO
OH
OH
Struttura ad “α−β barrel”
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 164 -
82
Isomerasi (EC 5.3.1.6)
D-ribuloso-5-fosfato
D-xiluloso-5-fosfato
O
O
O
P
Ribuloso-fosfato
3-epimerasi
(EC 5.1.3.1)
O
O
O
P
O
D-riboso-5-fosfato
O
OH
OH
Riboso-5-fosfato
isomerasi
(EC 5.3.1.6)
HO
HO
O
O
O
O
O
P
OH
O
O
OH
HO
OH
OH
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 165 -
Isomerasi (EC 5.3.1.6)
D-ribuloso-5-fosfato
D-xiluloso-5-fosfato
O
O
O
P
O
O
O
Ribuloso-fosfato
3-epimerasi
(EC 5.1.3.1)
OH
HO
O
P
D-riboso-5-fosfato
O
O
O
OH
HO
O
O
O
P
OH
O
O
HO
OH
OH
OH
H+
O
O
Intermedio enediolato
P
O
Riboso-5-fosfato
isomerasi
(EC 5.3.1.6)
O
O
H+
O
P
OH
HO
OH
HO
O
H
OH
H
OH
v. 2.0 © gsartor 2001-2012
O
O
O
Fotosintesi
- 166 -
83
Transchetolasi (EC 2.2.1.1 )
• Le transchetolasi e le
transaldolasi catalizzano,
rispettivamente, il
trasferimento di frammenti di
due o tre atomi di carbonio da
un chetoso donatore ad un
aldoso accettore.
• La transchetolasi trasferisce un
frammento 2-C dal xiluloso-5fosfato (chetoso) sia al riboso5-fosfato che all’ eritroso-4fosfato (aldosi).
D-xiluloso-5-fosfato
O
O
P
O
D-riboso-5-fosfato
O
O
O
OH
O
HO
P
OH
O
O
OH
HO
O
OH
OH
Transchetolasi
(EC 2.2.1.1)
O
O
H
+
OH
HO
OH
O
O
P
O
OH
O
OH
O
D-gliceraldeide-3-fosfato
O
P
O
O
D-sedoeptuloso-7-fosfato
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 167 -
Transchetolasi (EC 2.2.1.1 )
D-xiluloso-5-fosfato
O
O
P
O
D-riboso-5-fosfato
O
O
O
OH
O
HO
P
OH
O
O
OH
HO
O
OH
OH
Transchetolasi
(EC 2.2.1.1)
O
O
H
+
OH
O
O
P
O
Ca++
OH
O
O
P
O
Eritroso-4-fosfato
v. 2.0 © gsartor 2001-2012
OH
OH
O
D-gliceraldeide-3-fosfato
TPP
HO
Fotosintesi
O
D-sedoeptuloso-7-fosfato
- 168 -
84
Transchetolasi (EC 2.2.1.1 )
D-xiluloso-5-fosfato
D-eritroso-4-fosfato
O
P
O
O
O
H
O
OH
HO
OH
HO
O
O
O
O
OH
OH
Transchetolasi
(EC 2.2.1.1)
O
O
H
HO
+
OH
OH
O
O
P
O
Ca++
v. 2.0 © gsartor 2001-2012
OH
O
OH
O
D-gliceraldeide-3-fosfato
O
P
O
TPP
O
P
O
D-sedoeptuloso-7-fosfato
Eritroso-4-fosfato
Fotosintesi
- 169 -
Tiaminapirofosfato
• La transchetolasi utilizza come
gruppo prostetico il TPP
(tiaminapirofosfato) derivato
dalla vitamina B1.
H C
• Il TPP si lega nel sito attivo
piegato a “V”.
• Il protone tra gli atomi di azoto
e zolfo nell’anello tiazolico è
acido e dissocia.
TPP
• Il gruppo aminico dell’anello
aminopiridino è vicino al protone
dissociabile e serve come
accettore (base).
• Il trasferimento del protone è
favorito dalla presenza di un
residuo di Glu adiacente
Ca++
all’anello pirimidinico.
3
v. 2.0 © gsartor 2001-2012
Fotosintesi
H3C
O
+
N
S
N
O
P
O
O
OO
P
O
H
N
NH2
Eritroso-4-fosfato
- 170 -
85
Tiaminapirofosfato
H3C
• Il carbanione attacca il
carbonile del xiluloso-5-P
per formare un intermedio
di addizione.
• Il N+ nell’anello tiazolico
agisce come un accettore di
elettroni favorendo la
rottura del legame C-C.
O
O
+
N
H3C
S
C
N
C
H2
P
O
O
NH3+ HO
OO
O
P
N
O
OH
D-xiluloso-5-fosfato
HO
O
O
P
O
O
H3C
O
O
+
P
N
S
N
OO
O
P
O
CH2OH
O
HO
H3C
N
NH3+
OH
HO
Intermedio
O
O
P
O
O
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 171 -
Tiaminapirofosfato
H3C
• Si forma l’aldoso a tre
atomi di carbonio
gliceraldeide-3-P che viene
rilasciato, il frammento a 2C rimane legato al TPP.
• Il frammento 2-C condensa
con un aldoso (eritroso-4-P
o riboso-5-P) per formare
un chetoso-P.
– Il trasferimento del
frammento 2-C sul
riboso-5-P forma il
sedoeptuloso-7-fosfato.
O
+
N
S
CH2OH
N
O
P
OO
O
O
P
O
HO
H3C
N
NH3+
HO
OH
HO
D-riboso-5-fosfato
O
OH
O
O
P
O
HO
OH
O
OH
O
H
O
O
OH
O
O
P
O
P
O
O
O
HO
OH
O
D-gliceraldeide-3-fosfato
OH
OH
O
O
P
O
O
D-sedoeptuloso-7-fosfato
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 172 -
86
Tiaminapirofosfato
H3C
• Si forma l’aldoso a tre
atomi di carbonio
gliceraldeide-3-P che viene
rilasciato, il frammento a 2C rimane legato al TPP.
• Il frammento 2-C condensa
con un aldoso (eritroso-4-P
o riboso-5-P) per formare
un chetoso-P.
– Il trasferimento del
frammento 2-C sul
eritroso-4-P forma il
fruttoso-6-7-fosfato.
v. 2.0 © gsartor 2001-2012
O
O
+
S
CH2OH
N
OO
O
P
N
P
O
O
HO
H3C
N
NH3+
OH
HO
O
H
D-eritroso-4-fosfato
OH
O
O
O
P
HO
HO
O
O
O
O
H
P
O
O
OH
O
OH
HO
O
O
OH
P
O
O
O
D-gliceraldeide-3-fosfato
O
D-fruttoso-6-fosfato O
P
Fotosintesi
O
- 173 -
Transaldolasi (EC 2.2.1.2)
OH
O
• La transaldolasi trasferisce la
porzione 3-C (diidrossiacetone) dal
sedoeptuloso-7-fosfato alla
gliceraldeide-3-fosfato.
• Il gruppo ε-aminico della
transaldolasi reagisce con il
carbonile del sedoeptuloso-7fosfato.
NH2
Lys
D-sedoeptuloso-7-fosfato
HO
OH
OH
OH
O
O
P
O
O
+
N
H
OH
OH
O
OH
HO
O
P
O
O
Intermedio
base di Shiff
OH
• Si forma la base di Shiff protonata.
D-eritroso-4-fosfato
• Si libera l’eritroso-4-fosfato. La
base di Shiff stabilizza il carbanione
in C3.
• La reazione prosegue con l’attacco
del carbanione al carbonile della
gliceraldeide-3-fosfato per formare
fruttoso-6-fosfato.
N
OH
H
H
HO
+
H
O
H
OH
Fotosintesi
O
HO
O
OH
HO
OH
O
O
P
O
O
D-gliceraldeide-3-fosfato
O
O
O
v. 2.0 © gsartor 2001-2012
O
P
O
H
C
OH
O
OH
O
+
P
O
D-fruttoso-6-fosfato
- 174 -
87
Transaldolasi (EC 2.2.1.2)
• La transaldolasi ha
una struttura α,β
barrel.
Lys
Lys
base di Shiff
ridotta
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 175 -
Transaldolasi (EC 2.2.1.2)
• La transaldolasi ha
una struttura α,β
barrel.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 176 -
88
Bilancio
• Delle 18 molecole di ATP 12 sono usate per la
fosforilazione 12 (6x2) molecole di 3PG e 6
per ricostituire 6 molecole di RuBP.
• Le 12 molecole di NADPH servono per ridurre il
BPG a G3P.
• Quasi tutti gli enzimi del ciclo di Calvin-Benson
sono comuni con la glicolisi e con il ciclo dei
pentosi, una differenza è che la gliceraldeide 3-fosfato deidrogenasi è NADPH specifica
mentre nella glicolisi è NAD+ dipendente.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 177 -
Bilancio
• Da un punto di vista termodinamico il ciclo di
Calvin-Benson è una reazione favorita.
• La reazione aldolasica nella glicolisi ha un ΔG’o
di +24 kJ·mole-1, nel ciclo di Calvin-Benson
avviene in senso opposto.
• Nella fase buia avvengono anche la glicolisi, il
ciclo di Krebs e la fosforilazione ossidativa per
produrre energia.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 178 -
89
Bilancio
• Non è un ciclo futile.
• Futile è produrre C6H12O6
scindendo ATP per
rigenerarlo consumando
ATP.
• Gli enzimi del ciclo di
Calvin-Benson
rispondono
indirettamente alla luce:
sono attivati quando le
cellule sono illuminate.
ADP + Pi
C6H12O6
Glicolisi,
Ciclo di Krebs
ATP
Fotosintesi,
Ciclo di
Calvin-Benson
6CO2 + 6H2O
ATP
ADP + Pi
hυ
Fotosintesi
ATP + NADPH
Fissazione CO2
Buio
O2 + C6H12O6
v. 2.0 © gsartor 2001-2012
ATP + NADH + CO2
Fotosintesi
- 179 -
Un po’ di altro …
90
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 181 -
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 182 -
91
Organizzazione delle membrane
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 183 -
• Le proteine del tilacoide
sono etichettate al loro
bersaglio da un peptide
segnale e da una via
secretoria nel
cloroplasto.
• Molte delle proteine del
tilacoide sono codificate
dal genoma nucleare e
necessitano di due
segnali per raggiungere
il bersaglio: un segnale
N-terminale e un
segnale per il bersaglio
all’interno del tilacoide.
v. 2.0 © gsartor 2001-2012
Fotosintesi
- 184 -
92
Crediti e autorizzazioni all’utilizzo
• Questo materiale è stato assemblato da informazioni raccolte dai seguenti testi di
Biochimica:
– CHAMPE Pamela , HARVEY Richard , FERRIER Denise R. LE BASI DELLA
BIOCHIMICA [ISBN 978-8808-17030-9] – Zanichelli
– NELSON David L. , COX Michael M. I PRINCIPI DI BIOCHIMICA DI LEHNINGER Zanichelli
– GARRETT Reginald H., GRISHAM Charles M. BIOCHIMICA con aspetti molecolari
della Biologia cellulare - Zanichelli
– VOET Donald , VOET Judith G , PRATT Charlotte W FONDAMENTI DI BIOCHIMICA
[ISBN 978-8808-06879-8] – Zanichelli
– Jeremy N BERG, John L TYMOCZKO, Lubert STRYER BIOCHIMICA Sesta edizione
2008
• E dalla consultazione di svariate risorse in rete, tra le quali:
– Kegg: Kyoto Encyclopedia of Genes and Genomes http://www.genome.ad.jp/kegg/
– Brenda: http://www.brenda.uni-koeln.de/
– Protein Data Bank: http://www.rcsb.org/pdb/
– Rensselaer Polytechnic Institute:
http://www.rpi.edu/dept/bcbp/molbiochem/MBWeb/mb1/MB1index.html
Questo ed altro materiale può essere reperito a partire da:
http://www.ambra.unibo.it/giorgio.sartor/ oppure da http://www. gsartor.org/
Il materiale di questa presentazione è di libero uso per didattica e ricerca e può essere usato
senza limitazione, purché venga riconosciuto l’autore usando questa frase:
Materiale ottenuto dal Prof. Giorgio Sartor
Università di Bologna a Ravenna
Giorgio Sartor - [email protected]
93