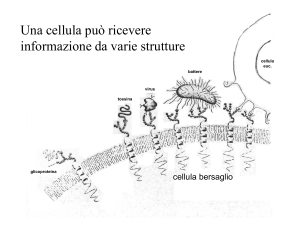
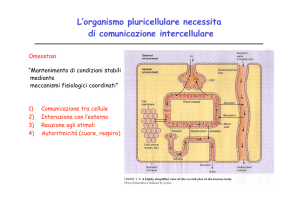
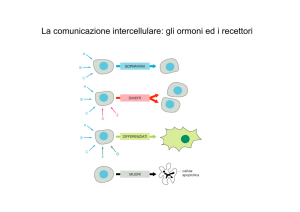
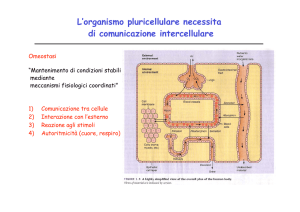
IMMUNOLOGIA
Scienza che studia i meccanismi
molecolari e cellulari con i quali il nostro
organismo si difende da ogni tipo di
invasione
SISTEMA IMMUNE
l’ insieme di
• cellule
• sistemi solubili
• mediatori solubili
• organi e tessuti linfoi
linfoidi
di
RISPOSTA IMMUNITARIA
“
Reazione coordinata delle cellule e delle molecole
contro
microorganismi infettivi
o cellule
“
Antigene
-
Immunogeno”
DA CHI ?
IMMUNITA’
= ESENZIONE
IN CHE MODO ?
DA CHI ?
Dall’ invasione o presenza di:
di
MICROBI
CELLULE ESTRANEE
CELLULE MUTATE
GENI ESTRANEI
IN CHE MODO ?
Schematicamente, attraverso tre strategie di difesa:
1. BARRIERE
2. IMMUNITA’ INNATA
3. IMMUNITA’ ADATTATIVA
Le risposte immunitarie che proteggono gli individui
nei confronti delle infezioni
Immunità innata (o naturale):
* Sempre presente nell’organismo
* Blocca l’ingresso dei microrganismi
* Elimina quelli che sono riusciti a penetrare nei tessuti
dell’ospite
* Riconosce i microbi ma non reagisce contro sostanze
di natura non infettiva
* Potenzia la risposta immunitaria acquisita.
Immunità acquisita (o adattativa o specifica):
*Si sviluppa lentamente e media la fase più tardiva ed
efficace della difesa contro gli agenti infettivi.
*Viene innescata dai microbi che invadono i tessuti
*Viene “acquisita” solo a seguito del contatto con i
patogeni estranei
I M M U N O P A T O L O G I A
Analizza i casi in cui il sistema immunitario
non funziona correttamente
Reazioni di ipersensibilità
Malattie autoimmuni
Immunodeficienze
Immunità innata (o naturale)
BARRIERE
cute e mucose
prima risposta dell’ ospite ai microbi:
blocca l’ ingresso dei microbi
Le barriere più resistenti nei confronti delle infezioni sono
cute, capelli, unghie; quelle più vulnerabili le mucose
Vie di infezione dei patogeni
EFFICACIA protettiva della cute e delle mucose
mucose::
meccanismi
FISICI
CHIMICI
BIOLOGICI
ANTIBIOSI
Meccanismi FISICI
CUTE: Integrità
Continuo ricambio delle cellule
VIBRISSE : nelle cavità nasali,
Tosse
Starnuto
MUCO
CILIA VIBRATILI: sulle pareti dei bronchi
Meccanismi BIOLOGICI
LISOZIMA : lacrime, saliva, sudore
PEPSINA
ENZIMI PROTEOLITICI:
PROTEOLITICI: bile
PROTEINE CHELANTI DEL SIERO:
(lattoferrina, transferrina):
DEFENSINE
Meccanismi CHIMICI
Fondamentali per ostacolare la replicazione dei
microbi sulla cute e sulle mucose.
• pH acido :
cute : ghiandole sebacee (ac. grassi e ac. lattico)
stomaco: ac. cloridrico
vagina: lattobacilli
DEFENSINE
Numeroso gruppo di peptidi antimicrobici prodotti da
cellule di molti mammiferi.
Nell’uomo:
alpha-defensine
prodotti principalmente dai PMN e dalle cellule Paneth
dell’intestino tenue
beta-defensine
Prodotti principalmente dalle cellule dell’apparato
respiratorio, del tessuto urogenitale, dal pancreas, dal
rene e dai cheratinociti
cheratinociti..
Le alpha
alpha--defensine
agiscono su batteri gram positivi e negativi
negativi,, su miceti e
sull’envelope
sull’
envelope di alcuni virus.
Le beta
beta--defensine soprattutto sui batteri gram negativi e
miceti..
sui miceti
Si legano sulla superficie esterna dei batteri:
nei gram positivi interagiscono con gli acidi tecoici e con
gruppi anionici esterni al peptidoglicano
peptidoglicano;;
nei gram negativi si legano alla porzione polianionica
polianionica--LPS
Sono prodotte in tutte le aree anatomiche che in
qualche modo possono venire per primi a contatto con
patogeni esterni.
La beta defensina 1 (DEFB1), ad esempio, è prodotta in
tutti le mucose formando una sorta di prima barriera che
impedisce l’ingresso dei microbi all’interno del nostro
organismo.
I geni che codificano le defensine presentano
polimorfismi genetici noti per avere un effetto sulla
regolazione della produzione di altri peptidi
Le defensine contribuiscono a formare le prime difese
non specifiche contro l’invasione di qualsiasi tipo di patogeno.
Tali difese fanno parte del nostro
sistema immune naturale o innato.
Meccanismi di ANTIBIOSI
Microrganismi residenti in un certo distretto
impediscono la colonizzazione di germi patogeni,
competendo per lo spazio e per il nutrimento,
Batteriocine,,
Batteriocine
Flora Intestinale
Flora Intestinale
• Nell’intestino umano albergano circa 400 specie
batteriche
(bifidobatteri),
), principalmente nel
• sia anaerobiche (bifidobatteri
colon,,
colon
• che aerobiche (lattobacilli
(lattobacilli),
), concentrate in modo
particolare nel tenue
tenue..
Oltre alla flora batterica, presenti anche miceti
miceti,,
clostridi e virus
virus,, che in condizioni di equilibrio non
esercitano alcun effetto patogeno.
Tratto
Conta microbica totale (UFC)
(UFC)
Gruppi microbici principali
Esofago
/
Non possiede un proprio microbiota
Stomaco
104 /g
Helicobacter spp.
spp. Lattobacilli e
Streptococchi acidoacido-tolleranti
Duodeno
e Digiuno
103-104 /g
Ileo
107-108 /g
O2
Colon
1010-1011 /g
Lattobacilli e Streptococchi
acido--tolleranti
acido
Bacteroides,Clostridium,
Bacteroides,
Clostridium,
Enterobacterium,,
Enterobacterium
Enterococcus,, Lactobacillus
Enterococcus
Bacteroides, Bacillus,
Bacteroides,
Bacillus, Clostridium
Clostridium,,
Ruminococcus,, Streptococcus,
Ruminococcus
Streptococcus,
Enterococcus,, Eubacterium,
Enterococcus
Eubacterium,
Lactobacillus,, Fusobacterium,
Lactobacillus
Fusobacterium,
Bifidobacterium
Cellule epiteliali intestinali
barriera meccanica
cellule interconnesse
e polarizzate
(tight junctions )
Enterociti o
colonociti
Paneth cells
Cellule M
Le comuni porte d’ ingresso dei microbi
nel nostro organismo
Cute
Apparato respiratorio
Tratto gastrogastro-enterico
Tratto urogenitale
Questi apparati sono protette da un “epitelio continuo”
che funge da
barriera fisica e chimica
MALT
(Tessuto Linfoide Associato alle Mucose)
DIFESE
COSTITUTIVE
DELL’OSPITE
1. Barriere
anatomiche,ecc..
anatomiche,ecc
2. Proteine,
peptidi, enzimi
antimicrobici
Adesione dei batteri ai tessuti dell’ospite
Malattia infettiva
E’ “LA RISULTANTE” TRA L’AZIONE
PATOGENA DEL MICRORGANISMO E
LA RISPOSTA DIFENSIVA
DELL’OSPITE
AZIONE TOSSICA DEI BATTERI
• Natura proteica
• Alto potere immunogeno
• Attività enzimatica
• Azione citotossica (specifica o ampia)
• Azione a “lungo raggio”
• E’ possibile ottenere dei tossoidi
Cholera toxin
Diphtheria toxin
Pertussis toxin
E. coli heat
heat--labile toxin LT
E. coli heat stable toxin ST
Shiga toxin
Pseudomonas Exotoxin A
Botulinum toxin
Tetanus toxin(A/B
Bordetella pertussis
Anthrax toxin
TOSSINE PRODOTTE DA S.AUREUS
α-tossina: shock settico
β, δ-tossin
γ-tossina e leucocidina: la prima emolitica, la
seconda necrotica
Enterotossine:: emesi
Enterotossine
TSSTTSST
-1: shock tossico
ET: sindrome da desquamazione cutanea
INFIAMMAZIONE ACUTA
Meccanismo di difesa precoce finalizzato a
contenere l’infezione e
prevenirne la diffusione dal sito iniziale
Segnale per successive risposte immunitarie specifiche.
Apparente paradosso
Infiammazione é un essenziale
processo protettivo per
eliminare la fonte del danno e
le conseguenze
Infiammazione é
potenzialmente dannosa:
dannosa:
- Ipersensibilità a punture
insetti, tossine, farmaci
- Malattia croniche
- Cicatrici sfiguranti,
-Ostruzione intestinali,
- Problemi articolari
- cancro?
Infezione induce
liberazione di fattori chemiotattici e vasoattivi
aumento del flusso sanguigno e della permeabilità
capillare
attività antimicrobica
afflusso di
essudato
globuli bianchi e formazione di
Leucociti
Fagociti:
Neutrofili
Caratteristiche: nucleo,
Fagocitosi
Killing intracellulare,
infiammazione e danno
tissutale
granulociti neutrofili: le granulazioni
Piccoli granuli specifici
Grossi granuli azzurofili
Granuli terziari
Granuli specifici enzimi necessari per la loro funzione
antimicrobica: proteasi
proteasi,, fosfolipasi e altri enzimi litici
Granuli azzurofili sono dei lisosomi contenenti idrolasi
acide, lisozima e un fattore che aumenta la
permeabilità (BPI - BACTERICIDAL PERMEABILITY
INCREASING PROTEIN)
Granuli terziari: gelatinasi che idrolizza la membrana
basale permettendo alle cellule di penetrare nel
connettivo
granulociti neutrofili
neutrofili:: funzioni
Migrano nel connettivo delle zone invase dai
microorganismi..
microorganismi
Penetrano
nella regione infiammata aderendo
inizialmente agli endoteli per mezzo di recettori
specifici..
specifici
Tale
adesione
stimola
la
produzione
di
interleuchinainterleuchina
-1 e del fattore di necrosi tumorale
che inducono le cellule endoteliali ad esprimere una
molecola di adesione detta ICAM
ICAM-1 ,alla quale si
legano le integrine dei neutrofili
granulociti eosinofili
2- 4% dei leucociti totali
Numerosi nei tessuti (pelle, mucosa
intestinale, respiratoria, genitale).
Vita media 18 ore nel sangue, giorni o
settimane nei tessuti
Granuli specifici e granuli azzurrofili
Contiene agenti proteici
antiparassitari e una neurotossina
Granulociti basofili
Rappresentano meno
dell’1% dei leucociti totali
Possiedono un nucleo ad S
mascherato da numerosi
granuli
Sulla membrana
Granuli specifici e
azzurofili
Contengono eparina
istamina
e
plasmatica presentano
recettori ad alta affinità
per le Immunoglobuline E
(IgE
IgE)
MASTOCITI
FUNZIONI MOLTEPLICI
ATTIVAZIONE DEI MASTOCITI DA PARTE DI PATOGENI.
ATTIVAZIONE DEI MASTOCITI NELL’IMMUNITÀ INNATA E ACQUISITA
Immunità Innata
Bersaglio
Segnale di attivazione
Batteri
E. Coli,Tossine
PGN →TLR2
LPS →TLR4
CR1, CR2, CR3, C3aR, C5aR
Superantigeni Batterici
(Proteina A di S. Aureus)
Virus
RNA doppia elica →TLR3
RNA singola elica →TLR7
Superantigeni virali
(Fv di HBV e HCV)
Parassiti
Schistosoma mansoni
Promastigotidi L.Major
Immunità specifica
Segnale di attivazione
?
RSV*, IgE specifiche →FcεRI
Hemaphysalis longicornis,
IgE specifiche →FcεRI
Veleni animali Mastoparan(vespe), MCDP
(api da miele)
Allergeni
IgE crosslinking→FcεRIs
Mastociti (e Macrofagi):
capaci di monitorare i segni di stress del
microambiente, e rilasciare mediatori solubili in grado
di
i) mobilizzare e richiamare nel sito altri leucociti
(infiammazione),,
(infiammazione)
ii)
ii) di modificare le funzioni di fibroblasti e cellule vascolari
per iniziare la riparazione locale.
Macrofagi
fagocitosi, killing intracellulare ed
extra--cellulare
extra
• riparo tissutale
• presentazione antigene (APC)
• CD14 membrane marker.
marker
MACROFAGI
Abbondanti nei tessuti
Vita relativamente lunga
Traggono energia dai
mitocondri
Producono citochine
(ILIL-1; ILIL-8; TNFa
TNFa;; ILIL-12 ecc.)
Fagociti professionali
neutrofili
macrofagi
INGLOBARE E
DISTRUGGERE I
MICRORGANISMI
Fasi della fagocitosi
•RICONOSCIMENTO
•INGESTIONE E
FORMAZIONE DEL
FAGOSOMA
•FORMAZIONE DEL
FAGOLISOSOMA
•DIGESTIONE
Natural Killer (NK) cells
Circa il 55-10 % dei linfociti del
sangue periferico
Si sviluppano dalla linea linfoide
ma sono privi del marcatore
CD3 e del TCR
Note anche come “cellule a
grandi granuli “ (LGL)
Natural Killer (NK) cells
Si identificano mediante i
marcatori CD56 & CD16, e
assenza del CD3
“LAK cells “
quando attivate con IL2 e
IFN--γ
IFN
Linfociti NK
capacità innata di uccidere
cellule tumorali,
cellule infettate da virus, e
anche cellule normali,
senza una precedente
sensibilizzazione
recettori attivatori KAR ( Killer Activation Receptor
Receptor))
recettori inibitori KIR ( Killer Inhibition Receptor)
LINFOCITI NKT
Sottopopolazione delle cellule T che si sviluppa nel Timo
Condividono alcune caratteristiche funzionali
con le NK cells
Esprimono un TCR riarrangiato con un repertorio
estremamente limitato.
LINFOCITI NKT
A differenza delle cellule T convenzionali, le cellule
NKT rispondono lipidi
lipidi,, ai glicolipidi o ai peptidi
idrofobici presentati da una molecola MHC I non
CD1d..
classica, CD1d
Secernono grandi quantità di citochine
citochine,, in particolare
ILIL-4
Le cellule NK e le NKT fanno da ponte fra i sistemi
immunitari innato e adattativo.
Cellula Dendritica
(DC)
Cellule Dendritiche
Cellule di derivazione midollare
Caratterizzate morfologicamente da sottili
prolungamenti citoplasmatici.
Cellule presentanti l’antigene (APC) professioniste
Cellule
Dendritiche
localizzazione
di Langerhans (cute e mucose)
dendritiche interstiziali
interstiziali (cuore,fegato,polmone,GI)
dendritiche interdigitati (aree T-dipendenti di
timo e linfonodi)
dendritiche circolanti (sangue e linfa) : 2 subsets
di DCs immature: CD11c+ e CD11cCD11c-
ricoprono il ruolo di vere e proprie 'sentinelle'.
La CD
rappresenta il principale
sistema
di connessione tra la
risposta immunitaria innata
e quella acquisita
Cellule Dendritiche
PROPRIETA’
Il tipo di antigene e la capacità migratoria
delle DCs permettono ai linfociti T vergini di
entrare in contatto con antigeni periferici che
non potrebbero incontrare.
Capacità di percepire stimoli ambientali (antigeni) e
decidere il destino dei linfociti T in risposta agli
antigeni (maturazione DCs
DCs).
).
Producono
roducono un vasto numero di citochine
citochine,, tra cui ILIL-12,
che promuove una risposta immunitaria di tipo
citotossico attraverso la differenziazione delle cellule
Th0 in cellule Th1, producenti interferon (IFN)
(IFN)--γ e IL
IL--2.
Stimoli infiammatori, come TNF
TNF--α e ILIL-1β,
1β, batteri,
prodotti batterici (LPS
LPS)) e virus
virus,, inducono la migrazione
delle cellule dendritiche, che hanno “caricato” l’antigene
dai tessuti periferici agli linfoidi secondari.
Durante la migrazione, le DC subiscono un processo di
maturazione:: incremento della capacità di attivare le
maturazione
cellule T che consiste nell’ aumentata espressione di
membrana di alcune molecole chiave nell’interazione tra
APC e linfocita:
molecole di adesione (LFA
LFA--3, ICAMICAM-1, ICAMICAM-3)
molecole del sistema HLA (MHC di classe II -DR, -DQ,DQ,-DP)
molecole di costimolazione (CD80, CD86, CD40),
CELLULE DENDRITICHE FOLLICOLARI (FDC)
Captano antigeni legati ad anticorpi o fattori del
complemento
Presenti solo nel centro germinativo di linfonodi, milza e
MALT
Come le cellule del S.I. riconoscono
i microbi ?
STRATEGIE di Riconoscimento
Riconoscimento del
“nonnon-self
self””
Identificazione del
“missingmissing-self
self””
Identificazione del “
“self alterato”
Riconoscimento del non
non-self
Identificazione di strutture molecolari che
sono caratteristiche del microbo
PAMP
(Pathogen Associated Molecular Patterns)
Patterns)
Profili molecolari associati al patogeno
IDENTIFICAZIONE DEL NONNON-SELF
PAMP
• Essenziali per il metabolismo, la
sopravvivenza e patogenicità del
microbo e quindi non possono
mutare: altamente conservati
•Sono presenti in diversi patogeni
• Possono essere zuccheri,
lipidi,, ac. nucleici o
proteine,, lipidi
proteine
combinazioni di essi.
• Es
Es.. Residui di Mannosio, LPS,
Peptidoglicano
Le cellule del S.I riconoscono
Recettori differenti :
PAMP attraverso
PRRs (Pattern Recognition Receptors
Receptors))
Recettori di riconoscimento del profilo
PRRs
CLASSIFICAZIONE
Recettori “spazzino” ( Scavenger)
Scavenger)
Recettori fagocitici
Recettori Toll
Toll-like (TLR)
Recettori Scavenger
Localizzati sulla membrana dei macrofagi, per lo piu con
struttura trimerica
trimerica,,
Mediano il legame di polisaccaridi, lipoproteine, ac nucleici
attivando fagocitosi
Reagiscono con le lipoproteine contenute nel siero, legano
per esempio LDL ossidate e per questo si ritiene abbiano un
ruolo nella patogenesi della arteriosclerosi.
Si conoscono due famiglie di scavenger
scavenger,denominate
,denominate A e B.
Del tipo B il rappresentante maggiore è una glicoproteina
CD36,, la quale risiede su
di 88 kD
kD,, conosciuta come CD36
numerosi tipi di cellule, tra cui l'endotelio e i macrofagi.
Il CD36 è una molecola multifunzionale, in grado di legare
agenti virali (HCV) e protozoari (il plasmodio della malaria).
Recentemente, è stato dimostrato che la P proteina
fibrillare bb-amiloide, che tipicamente si accumula nelle
pareti vascolari cerebrali dei malati di Alzheimer, si associa
a una ridotta espressione di CD36 nella microglia,
analogamente a quanto si osserva per l'accumulo di LDL
nelle placche ateromasiche
RECETTORI FAGOCITICI NON OPSONICI
SCAVENGER RECEPTORS - struttura
RECETTORI FAGOCITICI NON OPSONICI
SCAVENGER RECEPTORS
- Recettori implicati nel riconoscimento e nella eliminazione
delle cellule apoptotiche;
apoptotiche;
- uno dei ligandi conosciuti sulle cellule apoptotiche è la
fosfatidil--serina
fosfatidil
serina..
Legano anche l’acido lipotecoico,
lipotecoico, LPS, RNA a doppia elica.
RECETTORI FAGOCITICI NON OPSONICI:
OPSONICI:
IL RECETTORE PER IL MANNOSIO (MR
MR))
MR lega strutture ricche in mannosio nei patogeni ma può
anche legare ligandi endogeni come idrolasi lisosomiali e
mieloperossidasi
Recettore transmembrana a 7 eliche
• espresso su leucociti
• riconosce microbi,
• ma anche mediatori lipidici,
• chemochine (IL(IL-8),
• componenti del complemento (C5a),
• PAF.
In risposta allo stimolo si ha migrazione cellulare e
produzione di sostanze ad azione microbicida
RECETTORI “ FAGOCITICI “
OPSONICI o Opsonine
Presenti sulla superficie dei:
macrofagi
macrofagi,, neutrofili e cellule dendritiche
riconoscono molecole dell’ospite poste sulla superficie
del microbo
FAGOCITOSI MEDIATA DA RECETTORI
Le opsonine più
importanti sono:
IgG, frammenti
del complemento e
collectine
I recettori per
opsonine sono:
FcγRI,
CR1, CR3 e CR4
e recettori per le
collectine
RECETTORI FAGOCITICI OPSONICI
OPSONICI::
I RECETTORI PER IL COMPLEMENTO
( CR1, CR4 )
Continua…
Proteine della fase acuta positive
Proteine la cui concentrazione aumenta in fase acuta
a1
a1--antitripsina, amiloide A sierica, aptoglobina, α1antichimotripsina, α2-macroglobuline,ceruloplasmina,
proteina CC-reattiva, fibrinogeno, transferrina,
b -lipoproteine
Funzioni: regolazione della risposta infiammatoria,
Rimozione di prodotti del catabolismo cellulare
(danno o infiammazione),
Modulazione della risposta immunitaria
Produzione può aumentare poche ore dopo l’insorgenza della
malattia e persistere fino alla sua scomparsa.
Affezioni epatiche acute (a e b)
Patologie cutanee
PRRs
RECETTORI DI SECREZIONE
Riconoscono i PAMPs sulla superficie del patogeno
“segnalandolo”
o ai fagociti
o attivano il complemento
Es. Pentrassine
(proteine di fase acuta)
PENTRASSINE
Famiglia proteica
Omopentameri a simmetria circolare con alta
omologia di sequenza e struttura (lectin fold), dotati
di un sito di legame (calcio(calcio-dipendente) per vari
ligandi.
Filogeneticamente antico
Componente P dell’ amiloide o SAP (Serum Amyloide P
component) e proteine della fase acuta (PRC Ccomponent)
CReactive Protein,
Protein, SAA (Serum Amyloid A Protein)
Protein)
PCR e SAP
• Legano molte specie di batteri e funghi
• Ligandi sui patogeni sono la fosforicolina e la
fosfastidil-etanolamina
PCR: opsonina ⇒ lega il C1q ⇒ attiva Complemento
via Classica
RECETTORI DI “SECREZIONE
SECREZIONE””
COLLECTINE
Molecole oligomeri formati da triple eliche
proteiche con domini di lectina di tipo C.
Legano i carboidrati in modo Ca++-dipendente e
riconoscono una ampia varietà di PAMPs
Es. MBL (Mannan(Mannan-binding lectin) e Ficoline
COLLETTINE
⇒ MBL (lectina che lega il mannosio):
mannosio): esamero
simile al C1q, opsonina ⇒ fagocitosi
⇒ Proteine surfattanti polmonari (SP
SP-A e SP
SP-D)
(alveoli polmonari) opsonina ⇒ fagocitosi
FICOLINE
Proteine plasmatiche strutturalmente simili alle
collettine.
opsonizzano o attivano il Complemento
ligandi: NN-acetilglucosamina e l’ ac. Lipotecoico
(Gram positivi)
Struttura di MBL e Ficolina
RECETTORI DI SEGNALE
• Inducono una risposta dell’ospite attraverso
trasmissione del segnale intracellulare
• Si trovano sulla superficie cellulare:
delle cellule dell’immunità innata
• o su cellule epiteliali
• oppure nel citosol
dove riconoscono patogeni che riescono ad entrare
nella cellula (TLR
(TLRss a NOD)
Ruolo dei TLRs:
Meccanismo primitivo di riconoscimento dell’Ag:
identificano molecole comunemente associate
ad organismi pericolosi o dannosi
Sono espressi da DCs, macrofagi, neutrofili, cellule
epiteliali ed endoteliali
PAMPs: LPS
Peptidoglicano
A. lipoteicoico
TOLLTOLL
- LIKE RECEPTORS
(TLRs)
Il primo recettore della famiglia Toll è stato identificato nella
Drosophila come un componente che controlla l’orientamento dorsodorsoventrale degli embrioni.
I Recettori Toll sono proteine con una porzione extraextra-cellulare ed un
dominio citoplasmatico simile a quello del recettore per l’ILl’IL-1 dei
mammiferi
Entrambe le vie (Toll e IL1IL1-R) portano all’attivazione del fattore di
trascrizione NFκB.
Membri di questa famiglia hanno un ruolo chiave nell’induzione della
risposta immune e infiammatoria nei mammiferi e anche nella
Drosophila sono coinvolti nella difesa antimicrobica.
STRUTTURA E TRASMISSIONE
DEL SEGNALE DEI TLR
Leucine–rich repeats(LRR)
Toll/interleukin-1 receptors(TIR)
I Toll-like receptors
Toll-like receptors
Meccanismo primitivo di riconoscimento
dell’Ag: identificano molecole comunemente
associate ad organismi pericolosi o dannosi
Sono espressi da DCs, macrofagi, neutrofili, cellule
epiteliali ed endoteliali.
Fino ad oggi si conoscono 10 differenti proteine
transmembrana appartenenti alla famiglia TLRs
TLR2,TLR4,TLR9: partecipano al riconoscimento delle
diverse forme fungine
REGOLAZIONE NEGATIVA
DELL’ATTIVAZIONE DEI TLRs
La produzione esagerata di citochine infiammatorie
stimolata dall’attivazione dei TLRs può indurre pesanti
conseguenze sistemiche come lo shock settico indotto dal
LPS.
Gli organismi hanno evoluto dunque meccanismi atti a
modulare gli effetti dell’attivazione incontrollata dei TLRs.
SOCS1 (Suppressor of Cytokine Signalling) insieme ad
altri mediatori regola negativamente le vie di attivazione
citochiniche e sembra essere coinvolto anche nello
“spegnimento”delle vie di attivazione TLRTLR-mediate
DIFFERENTI CLASSI DI RECETTORI
PRESENTI SUI LEUCOCITI
INTERAZIONE TRA BATTERIO E FAGOCITI
Il riconoscimento dunque coinvolge combinazioni
diverse di famiglie recettoriali
La precisa natura dell’interazione determina la
secrezione di citochine e l’innesco dell’appropriato
meccanismo di uccisione.
IL LEGAME DEL PATOGENO AL MACROFAGO PUÒ
ESSERE DIRETTO O INDIRETTO
I Fagociti intervengono quando si attiva l’ Infiammazione
I SEGNALI di ALLERTA
N-formil-methionina
Prodotti Complemento e
Coagulazione
Proteine della fase acuta
RISPOSTA FAGOCITICA
Chemiotassi
Adesione
Diapedesi
Attivazione
Fagocitosi ed eliminazione
Il sistema innato è caratterizzato da:
-assenza di specificità, in quanto è
attivo contro un largo spettro di
microorganismi;
-assenza di memoria;
-velocità di risposta, dovuta
all’immediata disponibilità dei peptidi
immagazzinati ed alla loro rapida
sintesi e diffusione;
-assenza di un meccanismo di
riconoscimento del "self":
l’autodistruzione è evitata dalla
compartimentalizzazione cellulare dei
peptidi che sono conservati in granuli
con membrane resistenti e/o sotto
forma di propeptidi;
-basso costo energetico, in quanto i
peptidi necessitano per la sintesi di
una quantità di energia inferiore a
quella richiesta all’animale per la
complessa attivazione dell’immunità
clonata.
Immunità Innata o aspecifica
É la prima linea di difesa del nostro corpo verso le
infezioni.
Immunità Innata
Immediata 0:4 h
Immunità innata
Risposta
indotta
Precoce 4:96
h
Risposta
immune
adattativa
tardiva dopo
96 h
è presente fin dalla nascita, non necessita di un
precedente contatto con la sostanza lesiva e
non dà luogo a memoria immunitaria
L’immunità innata:
1) esercita un’azione effettrice diretta
volta all’eliminazione del patogeno e
all’inibizione
della
sua
crescita
attraverso il processo di fagocitosi e il
rilascio di composti ad azione microbicida
2) dall’altro stimola e coordina la
risposta immunitaria adattativa Agspecifica
mediante il rilascio
di
chemochine e citochine, l’induzione
dell’attività costimolatoria da parte dei
fagociti e il meccanismo di processazione
e presentazione degli antigeni estranei.
Fasi
Infezione batterica
Attivazione Recettori su macrofagi
Rilascio di mediatori dell’infiammazione
Richiamo liquido e leucociti (neutrofili) dal
sangue (essudato)
Attivazione dei neutrofili
Eliminazione del patogeno/danni collaterali
Riparo
La capacità della fibronectina di legare i
recettori dipende da una sequanza specifica
Ogni catena è organizzata in domini.
di aminoacidi, RGA (arginina-glicinaAlcuni riconoscono e legano una o
aspartato). Questa sequenza è comune a
più molecole della MEC, altri riconoscono
e legano recettori sulla membrana cellulare. tutte le proteine adesive della MEC ed è
riconosciuta dalle integrine
La fibronectina costituisce una molecola ponte tra le proteine della MEC e la
superficie delle cellule. Essa è coinvolta sia nel mantenimento della forma cellulare
che nel movimento cellulare
Laminina
Glicoproteina costituita da tre catene
polipeptidiche, α, β e γ.
Le tre catene formano una struttura a croce
stabilizzata da ponti disolfuro.
Come la fibronectina, presenta domini capaci
di legare: collagene di tipo IV,eparina,
proteoglicani e superfici cellulari.
funge da ponte tra le cellule e le lamine basali.
Tra gli altri meccanismi di elusione
della risposta immunitaria
ricordiamo:
• il cambiamento della struttura
antigenica del batterio
• la produzione di enzimi o proteine
contro le immunoglobuline
• l’inattivazione del complemento
• la distruzione dei fagociti
• l’inibizione della chemiotassi e della
fagocitosi
• l’elusione dal killing intracellulare
attraverso:
- l’inibizione della fusione
fagolisosomica
- la resistenza agli enzimi lisosomiali
- l’adattamento alla replicazione
intracitoplasmatica
NEWS Evasione dell'immunità
umorale
Batteri aderenti alle superfici mucose
hanno sviluppato strategie per
eludere le
difese specifiche umorali dell'ospite.
Il ruolo protettivo svolto dalle IgA a
livello
delle mucose può essere annullato
dalla secrezione, da parte di alcuni
patogeni
(Neisseria meningitidis e
gonorrhoeae, Haemophilus
influenzae, Streptococcus
sanguis, Streptococcus pneumoniae,
Proteus mirabilis), di proteasi capaci
di
scindere le IgA.
Alcune metalloproteasi secrete da
Pseudomonas aeruginosa
degradano IgG e IgM.
Alcuni batteri hanno la capacità di
legare proteine dell'ospite,
mascherando
quindi i loro antigeni di superficie non
più in grado di evocare una risposta
immunitaria (mascheramento
antigenico).
L'adesina FHA di Bordetella pertussis
lega molecole dell'ospite, quali
eparina, glicoproteine, glicolipidi. Il
batterio può
inoltre produrre molecole di superficie
che mimano i normali costituenti
30
dell'ospite (mimetismo antigenico).
Ad es. Helicobacter pylori esprime un
carboidrato superficiale, Lewis X, che
riduce la risposta delle cellule T
essendo
riconosciuto come antigene self.
Neisseria meningitidis gruppo B
esprime un
antigene capsulare che cross-reagisce
con le proteine dell'ospite. L'acido
ialuronico di Streptococcus pyogenes
presenta determinanti antigenici
comuni
all'acido ialuronico presente nel
tessuto connettivale.
Una frequente strategia
per evadere la risposta immunitaria
umorale è rappresentata dalle
variazioni
antigeniche di alcune strutture come
pili, flagelli, LPS, capsula, strato S,
proteine della membrana esterna o di
alcuni prodotti solubili, es. enzimi.
Tali variazioni si osservano
frequentemente nei batteri che
colonizzano le
superfici mucose rispetto a quelli che
crescono nel compartimento
intracellulare.
Una delle più frequenti variazioni
antigeniche riguarda i pili di Neisseria
gonorrhoeae.
Nel cromosoma, Neisseria presenta
numerosi geni che codificano
per diversi pili. Evidentemente si
verificano continuamente
riarrangiamenti
genetici che condizionano
l'espressione fenotipica di geni silenti
e la comparsa
di una diversa pilina. Tali variazioni
sono responsabili di infezioni
recidivanti che
si osservano in soggetti guariti da
precedenti infezioni.
Le variazioni antigeniche delle
proteine della membrana esterna di
Borrelia
recurrentis condizionano il particolare
andamento della malattia (febbre
ricorrente). Un meccanismo
addizionale per eludere le difese
anticorpali è
rappresentato dalla capacità di
sintetizzare proteine leganti le
immunoglobuline: ad es., proteina A
di Staphylococcus aureus, proteina G
e
proteina H di Streptococchi e la
proteina legante la fibronectina (Fn)
di
Streptococcus pyogenes: tali proteine
leganti la regione Fc delle IgG
rappresentano esempi di un
meccanismo che favorisce l'evasione
immunitaria.
Superantigene:
I superantigeni sono proteine
batteriche ad azione toxin-like che
attivano le cellule T CD4+ senza
presenza di Ag specifico, legandosi al
Tcell receptor e all’MHC di classe II.
Questo meccanismo di attivazione
aspecifico stimola un incontrollato
rilascio di citochine con danni cellulari
irreversibili ed alterazioni nella
risposta immunitaria
Legame del superantigene alle regioni
extracellulari del recettore delle
cellule T (TCR) e del complesso
maggiore di istocompatibilità (MHC)
di classe II
Esempi di alcuni superantigeni di
origine microbiologica
Toxic shock syndrome toxin-1 (TSST-1), prodotta da alcuni ceppi
di Staphylococcus aureus che causano la sindrome dello shock tossico
(TSS).
Tossine pirogeniche dello Streptococcus pyogenes
Le enterotossine stifilococciche di
Staphylococcus aureus
Cellule epiteliali intestinali
barriera meccanica
cellule interconnesse
e polarizzate
(tight junctions )
Enterociti o
colonociti
Paneth cells
Cellule M
Sono prodotte in tutte le aree anatomiche che in
qualche modo possono venire per primi a contatto con
patogeni esterni.
La beta defensina 1 (DEFB1), ad esempio, è prodotta in
tutti le mucose formando una sorta di prima barriera che
impedisce l’ingresso dei microbi all’interno del nostro
organismo.
I geni che codificano le defensine presentano
polimorfismi genetici noti per avere un effetto sulla
regolazione della produzione di altri peptidi