IL CUORE
Ruolo generale
Cuore sinistro circolazione
sistemica (grande circolo)
Cuore destro circolo
polmonare (piccolo
circolo)
Aorta
Vena cava superiore
Arterie polmonari destre
Semilunare polmonare
Arterie polmonari sinistre
Vene polmonari sinistre
Atrio destro
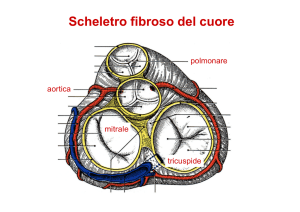
Mitrale
Corde tendinee
Tricuspide
Muscoli papillari
Vena cava inferiore
Ventricolo destro
Ventricolo sinistro
Aorta discendente
Valvole cardiache
Valvole cardiache
Azione ritmica: si contrae e si rilascia in modo coordinato durante
un ciclo cardiaco, per assicurare un’efficace azione di pompa.
Contrazione e rilasciamento sono capacità intrinseche del
muscolo cardiaco
La contrazione avviene in maniera sincrona: prima si
contraggono gli atri e poi si contraggono i ventricoli
I ventricoli si devono contrarre dall’apice alla base per assicurare
una efficiente eiezione del sangue.
Il muscolo cardiaco, al contrario di quello scheletrico per contrarsi non
necessita di stimoli da parte del SNC
Le contrazioni del miocardio sono indotte da segnali che si originano
dentro il muscolo stesso (attività miogena)
L’abilità del cuore a generare segnali che attivano le sue contrazioni è
detta autoritmicità
L’attività contrattile può essere regolata da vari fattori (SNA, ormoni
ecc.)
Dal punto di vista morfologico e funzionale nel cuore
si distinguono tre tipi di fibre muscolari
• Fibre del miocardio da lavoro (miocardo contrattile, atri e
ventricoli):
Si contraggono quando vengono invase dal potenziale d’azione condotto
dagli elementi vicini, permettono il lavoro meccanico di pompa
• Fibre del sistema specifico di eccitamento (tessuto nodale):
Dotate di autoeccitabilità, generano spontaneamente il potenziale d’azione
• Fibre del sistema specifico di conduzione:
Comprendono le fibre atriali internodali, il fascio di His ed il sistema di
Purkinje.
Permettono la propagazione rapida del potenziale d’azione per garantire
l’attivazione sequenziale delle varie parti del cuore
Struttura del muscolo
cardiaco
(miocardio contrattile)
Le fibre muscolari cardiache
formano una rete ramificata
che permette la rapida
propagazione dell’eccitazione
nelle varie parti del cuore.
Questo determina la
contrazione simultanea della
muscolatura di atri e ventricoli.
Il cuore si comporta come un
sincizio funzionale
Struttura del muscolo cardiaco
(miocardio contrattile)
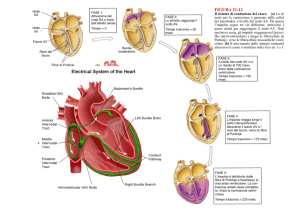
Origine del battito cardiaco
Sistema di eccitamento e conduzione
Il sistema è composto da cellule
muscolari cardiache modificate
Quando il
potenziale d’azione
si genera diffonde
rapidamente
attraverso le fibre di
conduzione.
Queste provocano
un’onda di
eccitazione, che si
muove prima
attraverso gli atri,
depolarizzandoli e
poi contrendoli,
dopo attraverso i
ventricoli.
Proprietà del sistema di conduzione
Autoeccitabilità
le diverse componenti del sistema di conduzione mostrano tutte
depolarizzazione spontanea del p.m. di riposo
frequenza intrinseca d’insorgenza del p. d’azione:
SA node (70/min, ritmo sinusale), AV node (40/min, ritmo
nodale), Purkinje fibers (20/min, ritmo idioventricolare)
perciò il nodo SA è il generatore primario (pace-maker) dell’attività
cardiaca
Velocità di conduzione
Estremamente lenta a livello del nodo AV (ritardo nella
propagazione dell’impulso ~ 100 msec):
ritardo nella contrazione dei ventricoli rispetto agli atri
Etremamente rapida nel sistema di Purkinje:
contrazione sincrona delle varie porzioni muscolari del ventricolo
I potenziali d’azione delle cellule del tessuto nodale e
quelli del tessuto di conduzione e del tessuto
contrattile sono diversi:
• Il potenziale d’azione nel tessuto nodale insorge
spontaneamente, è lento e dipende dal Ca2+
• Il potenziale d’azione nel tessuto di conduzione e in
quello contrattile è rapido e dipende dal Na+
Potenziale d’azione nel tessuto contrattile
(ventricolo
ventricolo))
R.M.P. stabile (principalmente determinato
dal K+)
depolarizzazione: canali Na+ aperti/inattivati
plateau :
canali Ca++ perti, canali K+ chiusi
ripolarizzazione:
canali Ca++ chiusi, canali K+ aperti
Periodo refrattario ~250 millisecondi
Basi ioniche del potenziale d’azione nelle
cellule contrattili
1. Depolarizzazione rapida (0)
2. Lieve ripolarizzazione (1)
3. Plateau (2)
4. Ripolarizzazione (3)
5. Potenziale di riposo (4)
1. Apertura canali sodio (Ingresso
ioni Na)
2. Inattivazione canali sodio
(Diminuzione ingresso di Na);
iniziano ad aprirsi i canali del K
(rettificanti tardivi)
3. Canali del K chiusi (rettificanti in
entrata) (diminuzione uscita K)
Apertura canali Ca tipo L
(Ingresso Ca)
4. Canali tardivi e rettificanti in
entrata del K aperti (uscita K)
Chiusura canali Ca tipo L (
diminuzione ingresso Ca)
5. Elevata PK, canali Na e Ca
chiusi (Uscita K ingresso pochi
Na e Ca)
Il potenziale d’azione nel ventricolo, nell’atrio e
nel sistema di Purkinje ha le seguenti
caratteristiche:
• Potenziale di membrana di riposo stabile
tranne per le fibre che si comportano come
pacemaker
• Lunga durata e quindi un lungo periodo
refrattario
• Plateau: periodo di prolungata depolarizzazione
da cui dipende la complessiva lunga durata
Potenziale d’azione nel tessuto nodale
(Canali L)
(Canali T)
Basi ioniche del potenziale d’azione delle
cellule pacemaker
1. Fase iniziale di
depolarizzazione
spontanea subliminare
2. Fase successiva di
depolarizzazione fino al
valore soglia
3. Fase di depolarizzazione
rapida
4. Fase di ripolarizzazione
1. Apertura dei canali funny
(ingresso ioni Na uscita
ioni K)
2. Apertura dei canali del
calcio di tipo T (ingresso di
ioni Ca)
3. Apertura dei canali del
calcio di tipo L (ingresso
ioni Ca)
4. Apertura dei canali del
potassio ( uscita ioni K);
chiusura dei canali del
calcio
Accoppiamento eccitazioneeccitazione-contrazione nel
miocardio
Inibita da
glicosidi
(digitale)
Accoppiamento eccitazione contrazione:
muscolo cardiaco vs. muscolo scheletrico
Muscolo scheletrico:
Ca++ enters cytosol from sarcoplasmic reticulum → contraction
Muscolo cardiaco:
Ca++ from T tubules stimulates opening of ryanodine receptor Ca++ channel
Ca++ enters cytosol from sarcoplasmic reticulum → contraction
La contrazione cardiaca, in particolare quella dei
ventricoli, è finalizzata a spostare il sangue verso
l’aorta (ventricolo sinistro) e l’arteria polmonare
(ventricolo destro).
Perché questo avvenga è necessario che la
pressione del ventricolo sia superiore alla
pressione diastolica dell’aorta e dell’arteria
polmonare.
Queste pressioni rappresentano
POSTCARICO per i ventricoli.
quindi
il
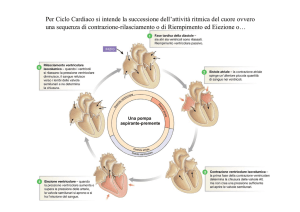
Il ciclo cardiaco
Sistole = contrazione (~ *0.3 sec)
Diastole = rilasciamento (~ *0.5 sec)
1. Riempimento ventricolare
AV valves
A&P valves
-
atrial P > ventricular P∴ AV valves open
aortic P > ventricular P∴ A&P valves
closed
atrial contraction adds ~15% more blood
2. Contrazione ventricolare isovolumetrica
ventricular P > atrial P ∴ AV valves closed
aortic P > ventricular P ∴ A&P valves
closed
1st heart sound: closing of AV valves
3. Eiezione ventricolare
AV valves
A&P valves
ventricular P > atrial P ∴ AV valves
closed
ventricular P > aortic P ∴ A&P valves
open
4. Rilasciamento ventricolare isovolumetrico
ventricular P > atrial P ∴ AV valves
closed
aortic P > ventricular P ∴ A&P valves
close
2nd heart sound: closing of A&P valves
Toni cardiaci
1°TONO dovuto alla chiusura
delle valvole atrio-ventricolari.
Coincide con l’inizio della
sistole ventricolare.
Focolaio valvola
aortica
Focolaio della
polmonare
Bassa frequenza 33-110/sec.
Durata 0.09-0.16 sec
Onomatopeicamente
rappresentato da:
“tùm”
2° TONO dovuto alla chiusura
delle valvole semilunari.
Coincide con la fine della sistole
ventricolare.
Focolaio della
mitrale
Focolaio della
tricuspide
Breve e acuto. Alta frequenza
50/sec. Durata 0.1 sec 33110/sec. Durata 0.09-0.16 sec
Onomatopeicamente
rappresentati da:
“(tà)”
Curva dei massimi
III Sistole isotonica
II Sistole isometrica
IV Diastole isometrica
(Stiramento a riposo)
I diastole isotonica
DIASTOLE (530 msec)
• Fase isometrica o isovolumetrica (80 ms)
• Fase isotonica (450 ms)
• Protodiastole (120 ms), riempimento rapido
• Diastasi (220 ms) riempimento lento
• Presistole (110 ms), sistole atriale, completa il riempimento
ventricolare
SISTOLE (270 msec)
• Fase isovolumetrica (50 msec)
• Fase isotonica (220 ms)
• Eiezione rapida (90ms)
• Eiezione lenta (130 ms)
Eventi nel cuore destro
Note:
gli eventi ed i tempi sono gli stessi del cuore sinistro, a cambiare è
la pressione generata, che nel ventricolo destro è inferiore a causa
delle minori resistenze periferiche (polmonari).
Gittata cardiaca & frazione di eiezione
Gittata cardiaca = gittata sistolica x frequenza cardiaca
Gittata sistolica = (EDV) – (ESV)
gittata cardiaca = (EDV – ESV) x frequenza cardiaca (f.c.)
In condizioni basali EDV = ~130 ml, ESV = 60 ml, f.c = 70/min
gittata cardiaca = (130 – 60) x 70 = 4900 ml/min = ~5L/min
Frazione di eiezione = percentuale di sangue espulso ad ogni battito
= gittata sistolica /EDV = 70/130 = 54%
EDV= volume di sangue nei ventricoli al termine della diastole (volume
telediastolico)
ESV= volume di sangue nei ventricoli al termine della sistole (volume
telesistolico)
La misurazione della Gittata cardiaca (GC) può
essere effettuata applicando il Principio di Fick
In un organo, la quantità Q di sostanza assorbita dal tessuto è uguale alla
differenza tra la quantità apportata e la quantità eliminata.
Esprimendo la quantità di sostanza trasportata nell’unità di tempo come il
prodotto tra il flusso F e la concentrazione della sostanza C risulta:
Q = FC1-FC2 = F (C1-C2)
nota: C = Q/V da cui Q = CV
F = Q/ (C1-C2)
Questa relazione può essere utilizzata per determinare il flusso di sangue F
che attraversa il polmone, cioè la GC, utilizzando come indicatore naturale
l’O2 .
In questo caso, la quantità di sostanza è il VO2 (Volume di O2) prelevato
nell’unità di tempo a livello polmonare (misurato con uno spirometro), e C1C2 la differenza di concentrazione di O2 tra sangue arterioso e sangue
venoso (CaO2 - CvO2). Per cui:
GC = VO2 / (CaO2 - CvO2)
MISURA DELLA
GITTATA CARDIACA:
METODO DIRETTO DI
FICK
Regolazione della gittata cardiaca
Frequenza cardiaca:
attività del sistema simpatico
Epinefrìna (Adrenalina)
attività del sistema parasimpatico
ritorno venoso (riflesso di Bambridge; effetto meccanico)
Gittata sistolica:
volume telediastolico (effetto Frank-Starling)
postcarico-precarico
attività del sistema simpatico (contrattilità)
ruolo del parasimpatico
epinefrìna (contrattilità)
regolazione omeometrica (fenomeno della scala)
Regolazione della frequenza cardiaca: SNA &
epinefrìna
la stimolazione simpatica a livello del nodo SA o adrenalina circolante:
↑ funny Na+ (e del Ca2+) →↑ velocità di depolarizzazione (cAMP 2nd
messaggero)
la stimolazione parasimpatica a livello del nodo SA o adrenalina circolante
AcCh→ ↑apre canali K+ (iperpolarizzazione), ↓ funny Na+ →↓ frequenza
Regolazione della gittata cardiaca
Frequenza cardiaca:
attività del sistema simpatico
Epinefrìna
attività del sistema parasimpatico
ritorno venoso (riflesso di Bambridge; effetto meccanico)
Gittata sistolica:
volume telediastolico (effetto Frank-Starling)
postcarico-precarico
attività del sistema simpatico (contrattilità)
epinefrìna (contrattilità)
attività del sistema parasimpatico (poco rilevante)
regolazione omeometrica (fenomeno della scala)
La Tensione effettivamente prodotta ad una determinata lunghezza è la
risultante della tensione passiva (PRECARICO) e della tensione attiva
b
a
Volume ventricolare diastolico (ml)
Nel
cuore
la
relazione
lunghezza-tensione
diventa
una
relazione
VolumePressione.
La
lunghezza
delle
fibre
muscolari ventricolari è, infatti,
determinata dal volume del
ventricolo
alla
fine
della
diastole (volume telediastolico).
La tensione passiva alle diverse
lunghezze, determina il valore
di pressione del ventricolo
durante la diastole.
La tensione attiva e passiva,
alle
diverse
lunghezze,
determina il valore di pressione
nel ventricolo durante la sistole
isometrica (isovolumetrica)
Il volume telediastolico determina quindi la tensione
passiva delle fibre miocardiche = PRECARICO
La contrazione cardiaca si sviluppa in condizioni
isometriche (isovolumetriche) finché non viene
raggiunta la tensione (Pressione) sufficiente a vincere il
carico applicato al cuore = POSTCARICO,
rappresentato dalla pressione arteriosa diastolica.
Una volta raggiunta questa tensione, la contrazione
diventa isotonica ed è associata ad espulsione del
sangue dal ventricolo.
Relazione V/P in condizioni di isometria nel cuore
isolato, fu dimostrata da Otto Frank nel 1884 e
successivamente enunciata da Starling nel 1918
Legge di Frank-Starling o Legge del cuore:
La forza di contrazione sviluppata dalle fibre
cardiache durante la sistole e quindi la quantità di
sangue espulsa dal ventricolo dipendono dalla
lunghezza iniziale delle fibre, cioè dal volume
telediastolico.
Il volume telediastolico, che dipende dal ritorno
venoso, determina la gittata sistolica
Pressione
Il maggior riempimento del ventricolo, durante la diastole
(maggiore VTD), determina un maggior sviluppo di tensione
durante la sistole (maggior Pressione sistolica)
Regolazione della gittata sistolica: effetto
Frank--Starling
Frank
•
•
•
L’ ↑↑ del VTD provoca un ↑↑ della forza di
contrazione ad opera di 2 meccanismi:
La lunghezza ottimale del miocardio è
superiore alla lunghezza di riposo, quindi se ↑↑
la lunghezza ogni volta che cresce il VTD si
porta la lunghezza delle fibre sempre più vicino
alla loro lunghezza ottimale
Lo stiramento delle fibre ↑↑ l’affinità della
troponina per il Ca quindi aumentano il numero
di ponti trasversali attivi ad ogni contrazione
La legge di Laplace
P
• P*S = F
• Fs (forza che spinge contro
la parete) = P*πr2
• Fc = T 2πr d = Fc (forza che
avvicina e restringe la
parete)= T 2πr d
• All’equilibrio Fs= Fc
• Cioè P*πr2 = T2rπd
• Risolvendo per P
• P = 2Td/r (Laplace)
• T = Pr/2d
T
r = raggio
d = spessore
T = tensione distendente
P = pressione interna
Il ventricolo per produrre al suo interno una certa P deve
quindi sviluppare una tensione T nella parete il cui valore
dipende dallo spessore d e dal raggio r della camera
ventricolare. P = 2td/r oppure T = Pr/2d. Nel caso di
dilatazione ventricolare il cuore è pertanto svantaggiato.
Condizione
svantaggiosa
P=P
d
d
P
r
r
T
P = 2td/r
Dilatazione
ventricolo
P
T
P = 2t(↑
↑)d(↓
↓/r(↑
↑)
Ta = P.( r/2 d)
Pa
d
Dilatazione
ventricolo
Pv
r
Ta = Pv.(r/2d)
T
Nella dilatazione ventricolare
l’aumento del raggio del
ventricolo r e la diminuzione
dello spessore della parete d,
creano per la Legge di Laplace
uno svantaggio meccanico in
quanto
è
richiesta
una
maggiore tensione muscolare,
(Ta) per ottenere la Pv
necessaria.
Per ridurre il carico cardiaco
devono essere evitate le condizioni
di aumento di lavoro
Aumento RPT
Pa
d
Pv
Ta = Pv.(r/2d)
r
Pa
T
d
Dilatazione
ventricolo
Pv
r
Ta = Pv.(r/2d)
T
L’aumento delle RPT porta
all’aumento della Pa.
Per avere eiezione di sangue è
necessaria una maggiore Pv.
Il muscolo cardiaco deve quindi
sviluppare una maggiore
tensione (Ta) durante la sistole
isometrica
ADATTAMENTO AD UN CARICO ACUTO DI PRESSIONE
Pressione intraventricolare, mmHg
Variazione del postpost-carico
Riduzione gittata sistolica
120
2
100
80
Aumento PA =
Aumento Postcarico
3
1
GS 1 = GS 3
P1 < P3
60
Volume
telesistolico
130
Volume
telediastolico
Volume intraventricolare, ml
Regolazione della gittata sistolica
sistolica:: SN
simpatico & epinefrina
Aumenta la contrattilità
Effetto della stimolazione simpatica
Aumenta la contrattilità
• la contrattilità è la capacità di sviluppare
tensione indipendentemente dalla lunghezza
delle fibre muscolari.
•la contrattilità della fibra muscolare cardiaca è
regolata dalla concentrazione del Ca2+
all’interno della fibra stessa.
• Tutti i fattori che aumentano la concentrazione
del Ca2+ nella fibra cardiaca aumentano la sua
contrattilità, e quindi la forza di contrazione.
Questi fattori si dice che hanno un effetto
inotropo positivo.
• Hanno effetto inotropo positivo sostanze
come le catecolamine (Noradrenalina ed
Adrenalina), che aumentano l’ingresso di Ca2+
durante il potenziale d’azione, e farmaci
(glicosidi cardioattivi), che riducono la quantità
di Ca2+ espulso dalla cellula alla fine della
contrazione
• Hanno
effetto inotropo negativo sostanze
come l’Acetilcolina (neurotrasmettitore del
vago) e farmaci (Calcio antagonisti), che
inibiscono l’ingresso di Ca2+ durante il
potenziale d’azione
REGOLAZIONE OMEOMETRICA
(diversa dalla regolazione eterometrica F/L)
La contrattilità cardiaca può variare con il variare della frequenza
frequenza, perché si
modifica la concentrazione del Ca 2+ intracellulare
Fenomeno della scala: La forza sviluppata aumenta progressivamente con
l’aumento della frequenza.
L’aumento progressivo e indefinito della
frequenza può considerarsi sempre vantaggioso
in termini di gittata cardiaca?
Effetto dell’aumento di frequenza cardiaca sulla
gittata cardiaca
1: Situazione teorica in cui aumenta
solo la frequenza e la GS rimane
costante, la GC aumenta all’infinito
2: In un cuore isolato stimolato
elettricamente, la GC aumenta con la
frequenza fino ad un valore oltre il
quale diminuisce. La riduzione è
dovuta alla diminuzione di GS
conseguente all’accorciamento della
diastole
3: In un cuore in vivo, stimolato dal
simpatico, la riduzione di GS avviene
a frequenze maggiori perché l’effetto
del minor riempimento diastolico è
controbilanciato dal contemporaneo
incremento della contrattilità
Frank Starling vs. SN simpatico /epinefrìna
/epinefrìna
Alcuni esempi:
Condition
EDV
ESV
Gittata
sistolica
Frazione di
eiezione
Normale
120 ml
48 ml
72 ml
60%
Effetto Frank Starling
150 ml
60 ml
90 ml
60%
SN simpatico-epinefrìna
120 ml
30 ml
90 ml
75%
Frank Starling: ↑ EDV → ↑ gittata sistolica
SN simpatico-epinefrìna: ↑ gittata sistolica a parità di EDV
S. N. SIMPATICO: EFFETTI
-BATMOTROPO POSITIVO (AUMENTO DELL’ECCITABILITA’) IL LEGAME
ADRENALINA RECETTORI β1 FAVORISCE L’INGRESSO DI IONI Ca+ +
-CRONOTROPO POSIVO (AUMENTO DELLA FREQUENZA DI CONTRAZIONE)
DOVUTO AL LEGAME ADRENALINA RECETTORI β1 DELLE CELLULE
DEL N.S.
-DROMOTROPO POSITIVO (AUMENTO DELLA VELOCITA’ DI CONDUZIONE)
-INOTROPO POSITVO (AUMENTO DELLA CONTRATTILITA’) PER AUMENTO
DELLA CONDUTTANZA AL Ca++ STIMOLATA DAL LEGAME ADRENALINA
RECETTORI β1 SIA ATRIALE CHE VENTRICOLARE
Regolazione della gittata cardiaca
Regolazione della
gittata cardiaca
Metabolismo energetico
•Il cuore adatta l’utilizzo dei
substrati all’offerta
•ATP è in concentrazione bassa ed
è presente la fosfocreatina,
a spese della quale si forma l’ATP. La
fosfocreatina è dunque
un importante indicatore dell’apporto di
ossigeno e substrati.
Regolazione della pressione
arteriosa
Pa = GC . RPT
Pressione arteriosa media, 100 mmHg
Resistenza periferica totale, 20 mmHg/l/min
Gittata cardiaca, 5l/min
Arteriole
Ventricolo sinistro
Arterie
elastiche
Il volume di sangue nelle arterie determina il valore di Pa. Esso
dipende dal volume immesso nel sistema dal cuore (GC), e dal
volume di sangue che riesce ad andare in periferia, a sua volta
dipendente dal valore delle RPT
Condizioni che aumentano il volume di sangue nelle arterie determinano
aumenti della Pa:
Ventricolo sn
Arteriole
+V
+V
+V
Aumento delle resistenze
arteriolari (vasocostrizione)
Aumento della GC
Aumento della volemia
Aumenti della Pa si verificano anche quando, a parità di volume, si riduce la
compliance arteriosa
+P
Diminuzione della
compliance vasale
Barocettori
Attività dei barocettori
↑ pressione arteriosa →↑ frequenza di scarica
La MAP è controllata da meccanismi a feedback negativo
attraverso i barocettori arteriosi
• I barocettori rispondono a variazioni della Pa con un
cambiamento della loro frequenza di scarica:
> Pa = > Frequenza, saturazione a 140-160 mmHg
< Pa = < Frequenza, azzeramento a Pa < 60 mmHg.
• Attivi alla Pa normale con oscillazioni della frequenza in
corrispondenza delle variazioni sistolica (120 mmHg)
diastolica (80 mmHg).
• Elevata sensibilità alla velocità con cui si modifica la Pa,
rispondono meglio a rapide variazioni della Pa piuttosto che a
pressioni elevate, ma stazionarie.
• Presentano adattamento (se persiste l’incremento di Pa la
loro frequenza di scarica si riduce progressivamente fino ai
valori pre rialzo pressorio = resetting recettoriale)
Risposta all’emorragia
emorragia →↓ p. s.
↓ p. s. → attività dei barocettori
A breve termine
Riflesso barocettivo
A lungo termine
Controllo volume ematico
Quota introduzione
liquidi
RPT
GC
Pa
Volume
liquidi
corporei
Rene
Diuresi
Un modo per regolare la Pa è quello di
aggiungere o sottrarre volume al sistema
circolatorio chiuso. Sottrazione avviene per:
1) Deposito nel letto venoso
2) Aumento della diuresi
•Volocettori venosi, atriali, ventricolari e
recettori polmonari
•Corteccia cerebrale ed ipotalamo
•Propriocettori
Chemocettori
Sono attivati dall’ipossia
e dall’ipercapnia:
Una riduzione della pressione
dell’O2 ed un aumento della CO2
possono essere legati a riduzione
di perfusione e quindi della
pressione
Arteriosa. Inducono diminuzione
della frequenza cardiaca ed
aumento della resistenza periferica
Elettrocardiogramma
Variazioni di potenziale misurate
extracellularmente durante le diverse
fasi dell’eccitamento ventricolare
(ECG)
Corrispondenti fasi dell’eccitamento
registrate intracellularmente
Le immagini tratte fanno riferimento ai seguenti volumi:
William J. Germann, Cindy L. Stanfield, Fisiologia, ed. EdiSES.
Widmaier [et. al.], Vander’s Human Physiology. McGraw-Hill, (10th ed.),
2006.
Silverthorn D.U., Fisiologia, Copyright 2005, 2000 Casa Editrice
Ambrosiana.
AAVV, Fisiologia dell’uomo, ed. edi-ermes, 2007 (rist.).