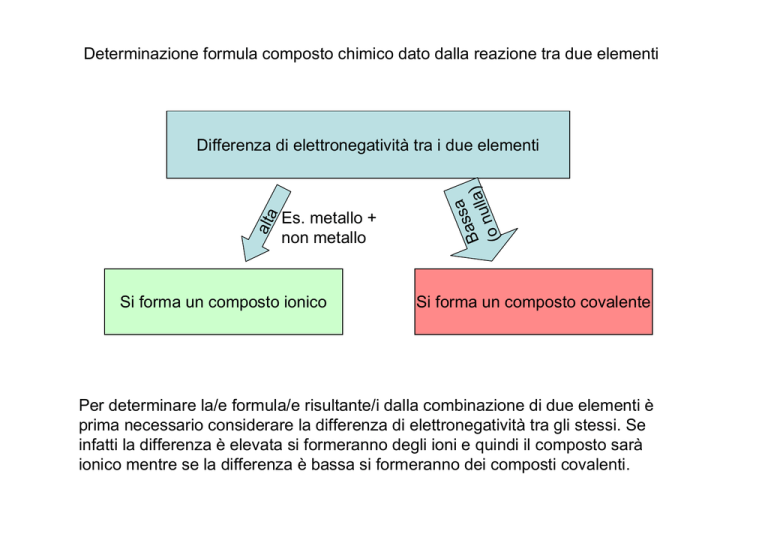
Determinazione formula composto chimico dato dalla reazione tra due elementi
Es. metallo +
non metallo
Si forma un composto ionico
sa
s
a
B
la)
l
u
(o n
alta
Differenza di elettronegatività tra i due elementi
Si forma un composto covalente
Per determinare la/e formula/e risultante/i dalla combinazione di due elementi è
prima necessario considerare la differenza di elettronegatività tra gli stessi. Se
infatti la differenza è elevata si formeranno degli ioni e quindi il composto sarà
ionico mentre se la differenza è bassa si formeranno dei composti covalenti.
Regole per la determinazione delle formule dei composti ionici
L’elemento più elettronegativo acquisterà elettroni caricandosi negativamente
mentre l’elemento meno elettronegativo li perderà caricandosi positivamente
Il numero di elettroni persi/acquistati dipende dal numero di elettroni esterni. Gli
elementi perderanno/acquisteranno elettroni in modo da raggiungere la
configurazione esterna del gas nobile più vicino (regola dell’ottetto).
Es.: Ca + O
Si scrive la configurazione elettronica di entrambi:
Ca: [Ar]4s2
O: [He]2s22p4
Poiché il calcio è meno elettronegativo tenderà a perdere elettroni mentre
l’ossigeno ad acquistarli.
Il calcio può perdere 2 elettroni formando lo ione Ca2+ che è isoelettronico all’argon.
L’ossigeno può acquistare 2 elettroni formando l’anione O2- che è anch’esso
isoelettronico dell’argon.
Ora bisogna combinare i due ioni in modo da avere un composto CaxOy con carica
= 0 utilizzando come coefficienti x,y i numeri interi più piccoli.
In questo caso semplicemente x=y=1 e la formula risulta quindi CaO
Regole per la determinazione delle formule dei composti covalenti
Innanzitutto bisogna scrivere la configurazione elettronica di entrambi gli elementi:
Es.: N2 + Cl2
N: [He]2s22p3
Cl: [Ne]3s23p5
Successivamente, per ogni elemento, si disegna il riempimento degli orbitali per gli
elettroni più esterni. Per far questo si seguono le regole di riempimento degli
orbitali (quando esistono più orbitali con la stessa energia prima si dispone un
elettrone per ogni orbitale e poi si appaiono quelli successivi).
Infatti quello di cui abbiamo bisogno è il numero di elettroni spaiati presenti negli
orbitali. I legami covalenti si effettuano infatti dall’unione di due elettroni spaiati
presenti sui due elementi. E’ utile poi scrivere le formule di Lewis a partire da
queste configurazioni
N:
Cl:
p
N
s
p
s
Cl
Regole per la determinazione delle formule dei composti covalenti (2)
A questo punto si ‘costruisce’ un composto utilizzando tutti gli elettroni spaiati presenti.
Nel nostro caso l’azoto, che ha più elettroni spaiati, può fungere da elemento centrale
Cl
N
Cl
Cl
Abbiamo quindi scritto la formula NCl3. Dobbiamo scrivere una reazione bilanciata
tra N2 e Cl2 che dia questo composto:
N2 + 3Cl2
2NCl3
Ora, grazie alla VSEPR, possiamo determinare la geometria molecolare. Si conta
quindi il numero di nubi elettroniche (una nube elettronica è un legame semplice,
doppio o triplo o un doppietto di non legame). La molecola di tricloruro di azoto ha 4
nubi elettroniche, quindi la sua geometria sarà tetraedrica (cfr. tabella VSEPR).
Inoltre, poiché i legami N-Cl sono polarizzati (il cloro è più elettronegativo dell’azoto),
possiamo studiare la polarità della molecola:
Regole per la determinazione delle formule dei composti covalenti (3)
Clδ−
N 3δ+
Clδ−
Clδ−
I
3
vettori
di
polarizzazione
dei
legami
N-Cl
si
sommano tra loro. Il
vettore risultante, non
nullo,
conferisce
polarità alla molecola.
δ−
Cl
N 3δ+
δ−
δ−
Cl
Cl
Bisogna sempre considerare la possibilità di avere un’espansione dell’ottetto. I
composti dal terzo gruppo (compreso) in avanti possiedono orbitali d vuoti, che
possono partecipare alla formazione di legami. Nei casi che vedremo ci
occuperemo dell’espansione del solo elemento meno elettronegativo.
Nell’esempio appena visto, infatti, il cloro appartiene al 3° periodo ma è
l’elemento più elettronegativo (rispetto all’azoto) e quindi non ci preoccuperemo
della su espansione.
Regole per la determinazione delle formule dei composti covalenti (4)
Il caso è differente se il cloro è l’elemento meno elettronegativo, come accade con la
reazione:
Cl2 + O2
Scriviamo le configurazioni elettroniche, riempimento e formula di Lewis per ogni
elemento:
Cl: [Ne]3s23p5
Cl:
O: [He] 2s22p4
O:
p
s
p
s
Cl
O
In questo caso l’elemento più elettronegativo è l’ossigeno, pertanto il primo ossido di
cloro avrà la seguente struttura tetraedrica (e sarà polare):
2δ−
Clδ+
O
Clδ+
Quindi esistono altri ossidi del
cloro dove il cloro darà
espansione dell’ottetto. Infatti
è
l’elemento
meno
elettronegativo dei due e
appartiene al 3°periodo
d
Cl:
p
s
d
Cl:
Cl
p
s
d
Cl:
Cl
Cl
p
s
Questi atomi di cloro daranno origine a diversi ossidi aventi rispettivamente come
formula Cl2O3, Cl2O5, Cl2O7
Per costruire le formule di questi composti sono necessarie regole aggiuntive. La
prima è che non si formano mai legami ossigeno-ossigeno (porterebbe a dei
perossidi instabili). La seconda regola è che 2 atomi di cloro non sono mai legati
assieme direttamente.
O
O
O
Cl
Cl
O
O
Cl
O
Come si vede, il cloro e l’ossigeno hanno
sempre geometria tetraedrica.
O
Cl
O
O
O
O
Cl
O
O
Cl
O
O











