SEZIONE SCIENTIFICA - Patologia in pillole
PATOLOGIA IN PILLOLE
Nr. 67
D. Soldini
Storia clinica
Un uomo di 42 anni si presenta con
multiple linfoadenopatie 2 mesi dopo
trapianto di midollo allogenico per
leucemia linfoblastica acuta a cellule
B. Si procede ad exeresi di un linfonodo per accertamenti diagnostici.
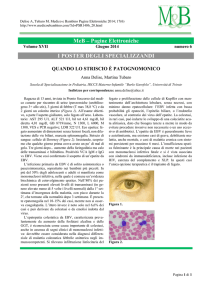
All’esame istologico, il linfonodo
mostra architettura totalmente sovvertita, con perdita della regione
midollare e corticale e focali aree di
necrosi (Figura 1a). A forte ingrandimento si nota un quadro polimorfo
con numerosi elementi blastici di
taglia media, una pronunciata differenziazione plasmocitica ed alcuni ele-
menti di taglia grande simili a cellule
Reed-Sternberg (Figura 1b).
All’esame immunoistochimico si nota
predominanza degli elementi blastici
della linea B (espressione di CD20;
Figura 1c), frammisti pure a minor
numero di elementi di taglia media
della linea T (CD3) riferibili ad immunoblasti. Segni d’infezione da EpsteinBarr Virus (EBV) con espressione focale di LMP1 (Figura 1d). Monoclonalità
per le catene leggere delle immunoglobuline kappa e frazione di proliferazione (ki67) > dell’80%.
Fig. 1a
Fig. 1b
Fig. 1c
Fig. 1d
Indica la diagnosi corretta:
a Recidiva linfonodale di leucemia
linfoblastica acuta
b Mononucleosi
c Malattia linfoproliferativa
post-trapiano
d Malattia Graft versus Host
e Linfoma di Hodgkin
77 GENNAIO 2012
TRIBUNA MEDICA TICINESE
27
SEZIONE SCIENTIFICA - Patologia in pillole
Diagnosi
Malattia linfoproliferativa
post-trapianto
Commento
Le malattie linfoproliferative post-trapianto
(PTLD,
post-transplant
lymphoproliferative disorders) sono
delle proliferazioni linfoidi o plasmocitiche che si sviluppano in seguito ad
immunosoppressione in pazienti sottoposti a trapianto allogenico di un
organo solido, midollare o di cellule
staminali. Il gruppo delle PTLD comprende uno spettro di lesioni che
varia dalle proliferazioni policlonali
legate in genere alla riattivazione del
virus Epstein-Barr (EBV) fino alle proliferazioni clonali (associate o meno a
EBV) indistinguibili da alcuni tipi di
linfoma della linea B, raramente della
linea T, che appaiono altrimenti in
pazienti immunocompetenti.
Epidemiologia. Essendo la maggior
parte delle PTLD legate ad un’infezione da EBV, il fattore di rischio più
importante è una sierologia negativa
per questo virus al momento del trapianto. Raramente le PTLD sono
negative per EBV e in questo caso le
cause non sono ben conosciute,
anche se si suppone un ruolo da
parte del virus HHV8.
È interessante notare come negli
adulti il rischio di sviluppare una PTLD
dipenda dal regime immunosoppressivo. Per questo motivo i pazienti sottoposti a trapianto renale mostrano
la frequenza più bassa, mentre i trapiantati di cuore, polmoni e intestino
sono i più colpiti. Per quanto riguarda i bambini l’incidenza è molto
maggiore ed associata in genere ad
un’infezione primaria di EBV posttrapianto.
Pazienti dopo trapianto di midollo o
cellule staminali mostrano un rischio
molto basso di PTLD (attorno all’1%)
e questo è minore in caso di compatibilità per HLA.
La maggior parte delle PTLD nei tra-
28
TRIBUNA MEDICA TICINESE
pianti di organi solidi è di origine del
ricevente, mentre il contrario va
detto per i trapianti di midollo allogenico.
Clinica. Le PTLD mostrano un quadro
molto variabile ed inizialmente i
pazienti possono presentare sintomi
non specifici quali stanchezza, sonnolenza, perdita di peso e febbre.
Frequenti sono pure le linfoadenopatie. Inoltre il quadro clinico dipende
dagli organi coinvolti, quali per esempio polmoni, tratto gastrointestinale
e fegato. Il sistema nervoso centrale è
coinvolto solo di rado.
Nel caso di trapianti allogenici di
organi solidi è spesso problematico
discernere i sintomi di una PTLD da
un rigetto acuto o un’infezione.
I casi negativi per EBV compaiono in
genere più tardi rispetto alle PTLD
EBV positive, le quali si presentano in
genere nei primi 6 mesi dopo il trapianto, in particolare nel caso di trapianto di midollo allogenico.
Istologia. Le PTLD vengono suddivise in tre categorie, le quali sono da
considerare come fasi di uno spettro
continuo.
Le fasi iniziali (o con aspetti da mononucleosi infettiva) appaiono in genere in pazienti giovani che vengono
infettati dal virus EBV dopo il trapianto. Queste lesioni interessano linfonodi e tonsille e mostrano all’esame
istologico le caratteristiche di una
mononucleosi infettiva con la presenza di numerosi elementi blastici della
linea B e T nonché numerose plasmacellule. Agli esami di biologia molecolare vengono riscontrate delle
popolazioni policlonali.
Nelle fasi polimorfe delle PTLD, il tessuto linfatico coinvolto mostra un’architettura completamente sovvertita
da una popolazione della linea B.
Questa mostra elementi blastici che
“maturano” in elementi di taglia
media-piccola ed infine in plasmacellule, rendendo quindi un quadro poli-
77 GENNAIO 2012
morfo che può pure mostrare elementi simili alle cellule di ReedSternberg e aree di necrosi. Agli
esami di biologia molecolare possono
apparire quadri di clonalità.
Infine, la fase monomorfa delle PTLD
viene diagnostica quando il quadro
istologico è monomorfo e adempie a
tutti i criteri di una linfoma B o T/NK
riscontrati in pazienti immunocompetenti, con clonalità agli esami di biologia molecolare. I linfomi più frequenti comprendono i linfomi diffusi
a grandi cellule B, i linfomi di Burkitt,
i mielomi, mentre per la linea T vanno
citati i linfomi T periferici non altrimenti specificabili ed il linfoma T epatosplenico. In rari casi, la fase monomorfa si presenta sottoforma di linfoma di Hodgkin classico.
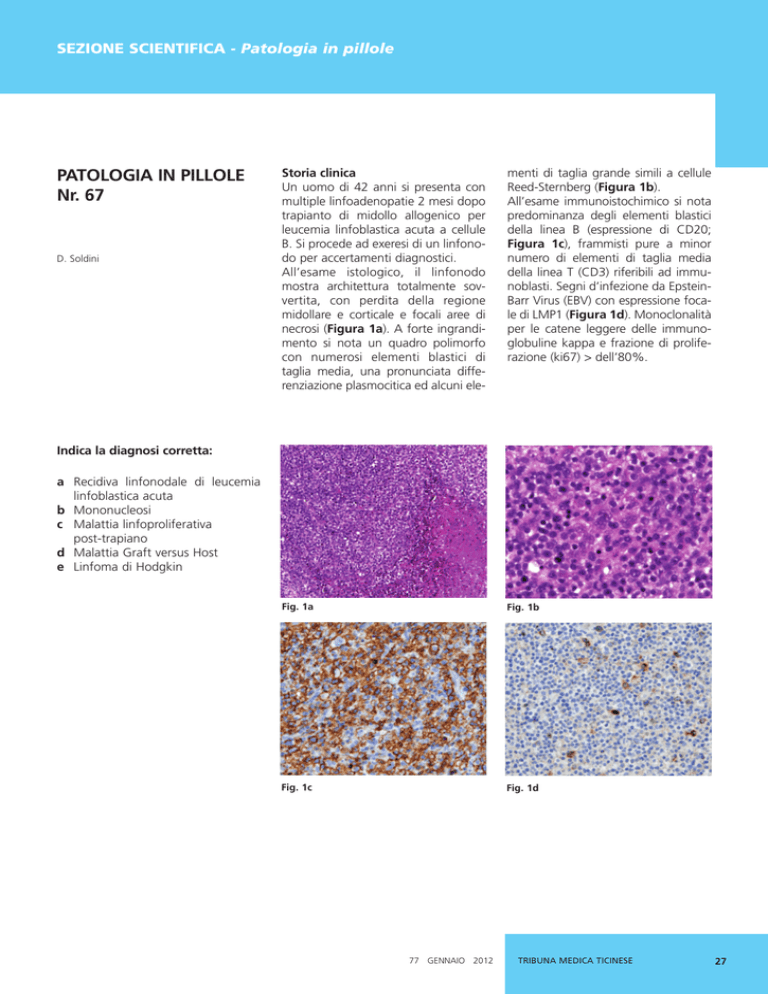
Per identificare la presenza del virus
EBV a livello istologico, vengono utilizzate due metodiche: immunoistochimica e tecniche di ibridazione in situ.
Per l’immunoistochimica vengono
impiegati anticorpi specifici contro proteine codificate nel genoma virale e
sintetizzate in caso di una riattivazione
del virus in seguito ad uno stato di
immunosuppressione.
L’anticorpo
maggiormente utilizzato riconosce la
proteina transmembrana LMP1 (latent
membrane protein-1), necessaria per
la trasformazione tumorale dei linfociti. Per le tecniche di ibridazione, vengono usate sonde di RNA capaci di
legare in modo specifico e sensibile a
RNA nucleare virali (EBER-1 e EBER-2).
Queste sonde posso essere rese visibili
in situ sul taglio istologico, permettendo quindi anche una correlazione morfologica (Figura 2).
Prognosi. Il decorso delle PTLD dipende dalla fase in cui si presenta il
paziente. Le lesioni iniziali spesso
regrediscono in seguito a diminuzione dell’immunosoppressione e, se
non sopraggiunge un rigetto, la prognosi è eccellente. Le fasi polimorfe e
monomorfe possono pure regredire
SEZIONE SCIENTIFICA - Patologia in pillole
Fig. 2: Ibridazione in situ con sonde specifiche per RNA virale nucleare (EBER)
con riduzione della terapia antirigetto, ma in modo meno frequente. In
casi refrattari, vanno introdotte terapie aggiuntive quali anticorpi monoclonali (per es. Rituximab) e chemioterapia. Casi negativi per EBV
mostrano un decorso più aggressivo,
come anche un’età avanzata ed una
comparsa tardiva delle PTLD. Inoltre, i
trapiantati di midollo osseo hanno in
genere una prognosi peggiore rispetto ai pazienti sottoposti a trapianto di
organi solidi.
D. Soldini
Istituto Cantonale di patologia, Locarno
Bibliografia
Swerdlow, S.H., Campo, E., Harris, N.L., Jaffe,
E.S., Pileri, S.A., Stein, H., Thiele, J., Vardiman,
J.W.: WHO Classification of Tumours of
Haematopoietic and Lymphoid Tissues, Fourth
Edition, IARC: Lyon 2008.
Cohen, J.I., Kimura, ., Nakamura, S., Ko, Y.-H.,
Jaffe, E.S., Epstein-Barr virus-associated
lymphoproliferative disease in immunocompromised hosts: a status report and summary
of international meeting, 8-9 September
2008, Annals of Oncology 20:1472-1482,
2009.
77 GENNAIO 2012
TRIBUNA MEDICA TICINESE
29