POINT BREAK
I diuretici nell’insufficienza cardiaca
e il tacchino di Karl Popper
Gennaro Cice
Cattedra di Cardiologia, Seconda Università degli Studi, Napoli
Heart failure and renal failure often coexist in the same patient. This condition is commonly referred to as cardiorenal syndrome. When this occurs, patient survival worsens significantly with increasing degree of renal dysfunction. Management of this complex patient poses treatment challenges because of unstable hemodynamics (the problem is to reduce congestion without affecting organ perfusion) and very high mid-term inhospital mortality. Congestion is a typical feature of this syndrome, and use of diuretics is mandatory. Loop
diuretics should be administered first. However, poor attention to pharmacodynamic and pharmacokinetic
properties of loop diuretics may contribute to the development of diuretic resistance leading to iatrogenic hyponatremia. Accordingly, emphasis is given to the importance of sequential nephron blockade to reduce the
number of non-responder patients to diuretics and to recognize a possible role for acquaretics.
Key words. Congestion; Diuretics; Heart failure; Renal failure.
G Ital Cardiol 2015;16(10):
-
PREMESSA
Forte di una esperienza ripetuta per mesi, un tacchino può formulare la legge pur cui ogni volta che arriva il contadino riceverà da mangiare. Ma arriva un giorno, subito prima di Natale,
in cui la legge è tragicamente smentita.
La metafora di Karl Popper, filosofo della scienza e noto per
la critica dell’induzione1, mi torna in mente ogni qual volta al
centro della discussione è posta la terapia della congestione
nell’insufficienza cardiaca (IC) e il “perverso” rapporto tra diuretici e resistenza. Anche alla luce del recente referendum sull’uso dei diuretici nell’IC proposto online dall’Associazione Nazionale Medici Cardiologi Ospedalieri (ANMCO), appare chiaro
che questo argomento è tutt’altro che condiviso e, quindi, meritevole di riflessione.
I concetti che seguono esprimono una visione dell’argomento che, partendo necessariamente dal rapporto di inter-dipendenza tra cuore e rene nell’IC, tendono a proporre una gestione terapeutica razionale che veda l’uso dei diuretici in associazione e sin dall’inizio nella terapia nel paziente con IC congestizia. Più che una rassegna sull’argomento, quanto segue
mira a stimolare, se non altro, una discussione costruttiva.
RENE E INSUFFICIENZA CARDIACA
IC e insufficienza renale spesso coesistono nello stesso paziente. Comunemente questa condizione viene definita “sindrome
cardio-renale”2, anche se al momento non vi sono dimostrazioni metodologicamente solide che supportino la creazione e
© 2015 Il Pensiero Scientifico Editore
Ricevuto 24.03.2015; nuova stesura 13.07.2015; accettato 20.07.2015.
Gli autori dichiarano nessun conflitto di interessi.
Per la corrispondenza:
Dr. Gennaro Cice Cattedra di Cardiologia, Seconda Università
degli Studi, c/o A.O. V. Monaldi, Via L. Bianchi, 80131 Napoli
e-mail: [email protected]
l’esistenza di una nuova sindrome3,4. Comunque, la presenza di
un link cardio-renale aumenta significativamente la mortalità
del paziente in parallelo al grado di disfunzione renale5. Nella
metanalisi di Smith et al.6, dove sono stati valutati più di 80 000
pazienti ricoverati per IC, la sola presenza di insufficienza renale incrementava la mortalità di 1.5 volte rispetto al gruppo di
controllo. Se l’insufficienza renale era severa (velocità di filtrazione glomerulare stimata <30 ml/min/1.73 m 2) la mortalità
triplicava.
Da notare che non è solo una alterata funzione renale presente al ricovero per IC che impatta sulla mortalità ma anche e
soprattutto il suo peggioramento, quando anche si verifichi in
un paziente a funzione renale inizialmente normale7. Tale peggioramento (“worsening renal failure” [WRF], con terminologia
anglosassone) è sicuramente la forma di disfunzione renale più
frequente nella quale si imbatte il clinico, spesso quella più difficile da diagnosticare ed interpretare (non abbiamo, ad oggi,
una “troponina” del rene)8 e la cui diagnosi è ancora essenzialmente clinica9. Per una completa chiave di lettura fisiopatologica dell’argomento si rimanda a specifiche e più dettagliate pubblicazioni10-12.
Convenzionalmente il WRF viene ricollegato a numerosi fattori, dalla ridotta gittata cardiaca all’attivazione neurormonale,
alla terapia farmacologica10. Sinteticamente è qui utile ricordare che il rene è in grado di compensare in parte la riduzione di
flusso tipica della bassa portata da IC attraverso la costrizione
dell’arteriola glomerulare efferente mediata dall’angiotensina
II per preservare la filtrazione glomerulare13. La coesistenza di
una severa riduzione della portata cardiaca, dell’attivazione
neurormonale e delle concomitanti terapie cardiologiche (particolarmente inibitori dell’enzima di conversione dell’angiotensina e sartani) può compromettere la capacità del rene di compensare la ridotta perfusione. Inoltre, la congestione di per sé
gioca un ruolo fondamentale aumentando la pressione venosa
e la pressione addominale, con conseguente aumento del postcarico renale. Le patologiche alterazioni delle pressioni intraG ITAL CARDIOL | VOL 16 |
1
G CICE
renali e l’aumento della pressione interstiziale renale contribuiscono al progredire dell’insufficienza renale14. L’osservazione
che molti pazienti ospedalizzati con WRF presentino una conservata frazione di eiezione ed una normale pressione arteriosa, conferma l’importanza della congestione, dell’ipertensione
venosa renale e dell’aumento della pressione intra-addominale nella stabilizzazione del quadro emodinamico generale15,16.
I numerosi biomarcatori proposti17 per una diagnosi precoce ed una stratificazione prognostica dell’insufficienza renale
acuta non presentano, attualmente, dati che ne giustifichino
l’uso routinario8,17.
Tutto quanto premesso sottende un paziente complesso,
difficile da trattare perché instabile (il problema è ridurre la congestione senza peggiorare ulteriormente la perfusione degli organi) e che ha una mortalità intraospedaliera ed a medio termine difficile da abbattere18. La condizione indicata come “sindrome cardio-renale”19, a mio parere, potrebbe essere interpretata come una tappa spesso obbligata, addirittura prevedibile nel deterioramento di due organi, cuore e rene, che sono
strettamente interdipendenti nel mantenimento dell’omeostasi cardiocircolatoria. Entrambi questi organi sono dominati dal
sistema nervoso simpatico e dal sistema renina-angiotensinaaldosterone (SRAA) marcatamente attivati20,21 e marker prognostici di mortalità sia nell’IC che nell’insufficienza renale22,23.
Inoltre i farmaci che solitamente si utilizzano in questa condizione (diuretici, vasodilatatori, inotropi, ecc.) migliorano lo
stato emodinamico, ma possono peggiorare la prognosi, soprattutto se utilizzati in maniera inappropriata. Questo è un importante concetto, abbastanza noto per gli inotropi24, ma poco considerato per i diuretici. Questi farmaci infatti, indipendentemente dall’essere utilizzati in bolo o in infusione continua25, sono somministrati a dosaggi sempre più elevati per decongestionare il paziente, soprattutto quando si noti una progressiva riduzione dell’effetto diuretico. Purtroppo ciò può comportare una ulteriore riduzione della perfusione renale che, amplificando l’attività del SRAA, determina un ulteriore riassorbimento di acqua e sale in un individuo di per sé già congesto26.
In questo contesto un cenno merita la serelaxina che ha effetti sulla compliance arteriosa, sulla gittata cardiaca e sul flusso ematico renale e che sembrerebbe controbilanciare i cam-
biamenti disadattativi del WRF in corso di IC acuta. Nel RELAXAHF27, l’uso di serelaxina (30 mg/kg/die) entro 16h dalla presentazione di IC acuta ha dimostrato un miglioramento statisticamente significativo della dispnea ed un minor numero di
morti a 180 giorni, anche se quest’ultimo è stato un risultato
secondario. Ma quello che è interessante è che più pazienti trattati con placebo avevano peggioramento della funzione renale rispetto a quelli trattati con serelaxina. In una successiva pubblicazione28, i ricercatori hanno confermato l’effetto favorevole della serelaxina sulla funzione renale.
Essendo comunque la congestione caratteristica saliente di
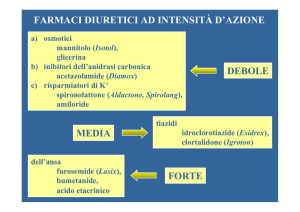
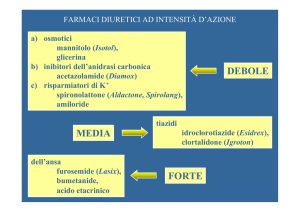
questa sindrome, l’uso dei diuretici è irrinunciabile (Figura 1). Il
più usato ed il primo da usare è certamente il diuretico dell’ansa.
Nell’IC acuta è consuetudine far seguire ad un bolo iniziale dosaggi incrementali della stessa molecola. Dirò subito che questa modalità d’uso, ancorché consolidata, può non essere del
tutto corretta e non sempre si associa ad un aumento dell’effetto. Si configura, quindi, una condizione di “resistenza” che
finisce per divenire iatrogena. Confido che le note che seguiranno contribuiranno a chiarire meglio questi concetti.
DIURETICI DELL’ANSA E CONGESTIONE
I diuretici dell’ansa agiscono direttamente sugli scambi ionici
attraverso strutture mirabili denominate “canali sodio-potassio-2cloro” localizzate a livello del tratto spesso ascendente dell’ansa di Henle29. Sono strutture endoluminali, quindi la quota
di diuretico attiva non è quella plasmatica ma quella che è presente nel lumen. È utile ricordare che i diuretici dell’ansa non
raggiungono il lume per filtrazione glomerulare, in quanto hanno un forte legame farmacoproteico, ma per secrezione tubulare attiva attraverso i trasportatori OAT (“organ anion transporters”) delle cellule del tubulo prossimale. Se un rene è ipoperfuso, poco sangue arriverà ai capillari peritubulari, dai quali le cellule del tubulo prossimale pescano il diuretico attivamente per secernerlo nel lume. Questo di fatto ne riduce l’efficacia nell’IC in quanto risente della ridotta perfusione renale
dovuta alla bassa portata cardiaca.
Inoltre, nel meccanismo d’azione è insito il loro limite. Se infatti paragoniamo le curve dose-effetto dei diuretici dell’ansa
Figura 1. Schema del nefrone con i siti di attacco dei diversi diuretici.
TCD, tubulo contorto distale; TCP, tubulo contorto prossimale.
2
G ITAL CARDIOL | VOL 16 |
DIURETICI E INSUFFICIENZA CARDIACA
nel paziente cardio-renale rispetto al normale (Figura 2), notiamo che esse sono spostate a destra e in basso30 a segnalarci
quanto segue: che a parità di dose l’effetto diuretico sarà minore; che dovremo incrementare progressivamente il dosaggio
per mantenere o aumentarne l’efficacia (curva ad “esse”) e
che, comunque, raggiungeremo un “plateau” ove anche dosaggi industriali di diuretico risulteranno inefficaci. Tale condizione viene definita “resistenza ai diuretici”31 e viene vissuta
dai clinici con angoscia perché impatta sulla mortalità32. La resistenza ai diuretici ha molti “attori” (Figura 3) ma un unico regista: il famigerato SRAA che enormemente ed inappropriatamente attivato21, andando ad agire su tutti i siti funzionali del
rene, costringe e consiglia il rene a ridurre progressivamente la
sua funzione fino all’anuria. Uso questa sorta di ossimoro verbale (costringe/consiglia) perché la “resistenza ai diuretici”, comunemente considerata evento avverso, può essere letta coma la “normale” risposta fisiologica del rene nell’IC quando
questo venga stimolato dai soli diuretici dell’ansa. Bisogna considerare infatti che nell’IC la ridotta perfusione renale comporta che tutti i siti funzionali del rene sono attivati, essenzialmente
Figura 2. Curva dose-effetto della furosemide e dei diuretici dell’ansa.
IC, insufficienza cardiaca; IR, insufficienza renale.
dal SRAA, a riassorbire acqua e sale per sostenere la volemia
efficace. È quindi un meccanismo di sopravvivenza! Andare a
stimolare il rene con i soli diuretici dell’ansa, per quanto usati
ai dosaggi e nelle tempistiche giuste, fa sì che, per un meccanismo di feedback, tutti gli altri siti funzionali che rispondono
a diuretici diversi e che quindi non sono bloccati, possano attivarsi aumentando la loro velocità d’azione o iper-esprimendosi ove non presenti (come nel caso delle acquaporine), annullando progressivamente l’effetto natriuretico fino all’oliguria.
D’altra parte è noto come in ogni organo la presenza di una ridotta perfusione comporti una progressiva riduzione di funzione per rispondere anche ad un principio di sopravvivenza. Ed è
questo il senso del termine “consiglia”. Ne consegue che una
corretta gestione della congestione nello scompenso cardiaco
debba necessariamente veder presente sin dall’inizio l’associazione di diuretici diversi che agiscano su siti diversi con effetto
sinergico. Questo concetto viene espresso convenzionalmente
come “blocco sequenziale del nefrone” (Figura 4).
BLOCCO SEQUENZIALE DEL NEFRONE
La scelta dei diuretici da associare dovrà tener conto chiaramente delle caratteristiche cliniche dei pazienti privilegiando le
diverse classi in base all’entità della congestione, alla rapidità
con la quale vogliamo agire, alla presenza di comorbilità.
Nel paziente acuto fortemente congesto, e limitatamente
alla terapia diuretica, è nostro protocollo terapeutico agire sin
dall’inizio con l’associazione di almeno tre classi di diuretici diversi. All’infusione continua di diuretici dell’ansa (es. furosemide 10-40 mg/h) che segue l’irrinunciabile bolo (es. furosemide
60-80 mg) da subito aggiungiamo un tiazidico, usualmente il
metolazone (5-20 mg/die per os) titolato ad almeno a 10
mg/die per 3-4 giorni33. Il metolazone, come tutti i diuretici tiazidici, può dare direttamente iposodiemia in quanto determina
una diuresi ipertonica, soprattutto se il paziente non è a restrizione idrica. Il monitoraggio degli elettroliti ci potrà consentire
tale terapia anche per periodi prolungati. La sua lunga emivita
ci sarà comunque di valido aiuto. Terza classe di farmaci che
solitamente associamo sono gli antialdosteronici, peraltro indicati in tutti i pazienti con scompenso cardiaco avanzato34. La
Figura 3. Meccanismi causa di resistenza ai diuretici.
FANS, farmaci antinfiammatori non steroidei.
G ITAL CARDIOL | VOL 16 |
3
G CICE
Figura 4. Blocco sequenziale del nefrone.
nostra scelta privilegia il canrenone (fino a 200 mg e.v. x 2/die)
monitorando strettamente la potassiemia. Al di là dell’effetto
diuretico di per sé limitato, il razionale fisiopatologico di questi
farmaci è dettato anche dalla presenza di un iperaldosteronismo secondario tipico di questi pazienti. Ulteriore opzione terapeutica è rappresentata dagli inibitori dell’anidrasi carbonica, tipicamente l’acetazolamide (250-500 mg per os)35. Il suo
uso consente di modulare l’equilibrio acido-base, limitando o
evitando l’alcalosi metabolica indotta dagli altri diuretici. Questo diuretico un po’ dimenticato e che abbiamo “regalato” ai
colleghi oculisti per la gestione del glaucoma, diviene, in associazione, un formidabile alleato.
Una terapia diuretica aggressiva è comunque da provare
perché sembra farci guadagnare in prognosi. Nel complesso
rapporto tra timing del peggioramento della funzione renale,
uso dei diuretici e prognosi fa fede lo studio di Testani et al.36
che ha rilevato che durante la gestione aggressiva con diuretici dell’IC acuta una precoce emoconcentrazione è stata sì associata ad un peggioramento della funzione renale, ma con un
significativo miglioramento della sopravvivenza a 180 giorni.
Un’ulteriore possibilità ci viene offerta, infine, da una particolare classe di farmaci di formidabile efficacia, gli acquaretici. Del tolvaptan, unico disponibile per uso clinico, ma non approvato in Italia nell’IC, discuteremo più avanti. Anche nel paziente ambulatoriale viene confermata la stessa impostazione
concettuale, con dosaggi chiaramente modulati sull’entità della congestione. Questo modo di agire mira a ridurre l’incidenza di pazienti non responder e ci ha permesso di riconsiderare
i parametri che configurino una “vera” resistenza ai diuretici
(Tabella 1).
Se quindi riconsideriamo i meccanismi renali coinvolti nell’IC comprendiamo perché da sempre la letteratura scientifica
abbia messo in relazione i dosaggi incrementali di diuretico dell’ansa con una “resistenza” che in ultima analisi, frequentemente, è da considerarsi iatrogena. E la stessa iposodiemia, costantemente messa in relazione con una aumentata mortalità37
e penalizzata da una definizione che può solo generare confu-
4
G ITAL CARDIOL | VOL 16 |
Tabella 1. Condizioni per definire la resistenza ai diuretici.
Paziente ambulatoriale
Incremento ponderale 2-3 kg/settimana
Restrizione idrica (<1 l/die) e sodica (<3 g/die)
Furosemide 250 mg bid + antialdosteronico ± tiazidico
Paziente ospedalizzato
Inadeguata perdita di peso
Volume urinario <1000 ml/24h
Restrizione idrica (<750 ml/die) e sodica
Furosemide 40 mg/h in infusione
Metolazone 5-10 mg/die ± acetazolamide 250 mg bid
Antialdosteronico
sione, è nella massima parte dei casi da leggersi come disturbo
da eccesso di acqua rispetto al sodio più che da carenza di sodio da correggere. I dati in letteratura sono coerenti, ma la chiave di lettura proposta è solo parzialmente vera. Si è finito per
considerare la resistenza ai diuretici come conseguenza ineluttabile della malattia e non come conseguenza di una terapia
dettata dalla consuetudine piuttosto che rispettosa della fisiologia renale e dei principi di farmacocinetica e farmacodinamica di questi farmaci.
GLI ACQUARETICI
Gli acquaretici sono antagonisti non peptidici del recettore per
la vasopressina38. Un incremento del livello circolante di vasopressina è presente nei pazienti con IC, è proporzionale alla sua
severità e contribuisce alla ritenzione idrica e all’iponatremia,
entrambe correlate ad una prognosi peggiore. La vasopressina
è prodotta a livello ipotalamico ed agisce su almeno due tipi di
recettori: V1, cardiaci e vascolari, con aumento della contrattilità e delle resistenze periferiche mediate dall’aumento del calcio intracellulare, dalla proliferazione vascolare del tessuto muscolare e dall’iperaggregabilità piastrinica; V2, localizzati a li-
DIURETICI E INSUFFICIENZA CARDIACA
vello del dotto collettore renale, che determinano in modo specifico il riassorbimento di acqua libera ed antidiuresi. Questa
azione diviene di enorme importanza proprio nell’IC. Nessun
diuretico delle classi abitualmente utilizzate può interferire su
questo meccanismo di riassorbimento dell’acqua.
In conseguenza di ciò sono state sviluppate varie molecole
in grado di legarsi ai recettori per la vasopressina39 ed inibirne
l’azione allo scopo di aumentare la diuresi40. L’unico attualmente disponibile ed utilizzato nella pratica clinica è il tolvaptan41. La sua azione selettiva a livello dei recettori V2 comporta una potentissima escrezione di acqua libera, da cui il nome
“acquaretici”. L’incremento della diuresi non è accompagnato
da una perdita di elettroliti, a differenza di quanto causato dai
diuretici tradizionali definiti appunto “saluretici”.
Il trial di riferimento nell’IC è lo studio studio EVEREST (Efficacy of Vasopressin Antagonism in Heart Failure Outcome Study With Tolvaptan), dove è stato dimostrato un indiscutibile effetto sulla congestione e su alcuni parametri emodinamici, pur
non raggiungendo una significatività sugli outcome42. Questo
non ha permesso che il tolvaptan, peraltro dal costo elevato,
avesse l’indicazione nell’IC in Italia, dove viene utilizzato per il
trattamento delle iponatremie e nelle sindromi da inappropriata secrezione di vasopressina. Indubbiamente, anche se in questo trial i risultati sono stati inferiori alle attese, il tolvaptan ha
dimostrato un’efficacia diuretica che meriterebbe ulteriori ricerche, semmai con endpoint diversi.
CONCLUSIONI
Per noi clinici il destino del tacchino, facendo nostra l’ironia di
Maurizio Ferraris in un articolo su Karl Popper43, è sconsolante
anche da un punto di vista scientifico. Se infatti molte della nostre azioni ancora oggi sono la generalizzazione di esperienze,
verrà sempre un giorno in cui il nostro agire che crediamo affi-
dabile potrà rivelarsi illusorio o sbagliato. Quello scienziato potenziale che era il tacchino, a mio parere, aveva sbagliato due
volte: la prima quando aveva pensato (come gli empiristi) che
la semplice esperienza fosse sufficiente a formulare una teoria,
come nel caso dell’uso dei diuretici dell’ansa a dosaggio incrementale; ma il secondo errore è stato ancora più fatale, visto
che aveva pensato che una serie di consuetudini potessero verificare una teoria, come nel caso dell’imprescindibile nesso tra
diuretici e resistenza vissuto come evento ineluttabile.
E che le cose stiano così lo dimostra non solo la morte del
tacchino, ma anche la storia della scienza medica che è stata
spesso un susseguirsi più di errori che di verità.
RIASSUNTO
Insufficienza cardiaca e insufficienza renale spesso coesistono nello
stesso paziente. Comunemente questa condizione viene definita
“sindrome cardio-renale”. Quando questo accade la mortalità del
paziente aumenta significativamente in parallelo al grado di disfunzione renale. La presenza di un link cardio-renale sottende un paziente complesso, difficile da trattare perché instabile (il problema è
ridurre la congestione senza peggiorare ulteriormente la perfusione
degli organi) e che ha una mortalità intraospedaliera ed a medio termine difficile da abbattere. La congestione è caratteristica saliente di
questa sindrome e l’uso dei diuretici è irrinunciabile e tra questi i più
comunemente utilizzati sono i diuretici dell’ansa. Purtroppo, la scarsa attenzione ai principi della farmacodinamica e della farmacocinetica dei diuretici dell’ansa può concorrere a determinare una condizione di “resistenza” che finisce per diventare iatrogena. Di conseguenza viene sottolineata l’importanza del blocco sequenziale del
nefrone per ridurre il numero di pazienti non responder ai diuretici
e viene riconosciuto un possibile ruolo agli acquaretici.
Parole chiave. Congestione; Diuretici; Insufficienza cardiaca; Insufficienza renale.
BIBLIOGRAFIA
1. Karl Popper. The logic of Scientific discovery. Hutchinson & Co, first English edition published 1959.
2. Bongartz LG, Kramer MJ, Doevendans
PA, Joles JA, Braam B. The severe cardiorenal syndrome: “Guyton revisited”. Eur
Heart J 2005;26:11-7.
3. Zoccali C, Goldsmith D, Agarwal R, et
al.; European Renal and Cardiovascular
Medicine Working Group of the European
Renal Association-European Dialysis and
Transplant Association (ERA-EDTA). The
complexity of the cardio-renal link: taxonomy, syndromes, and diseases. Kidney Int
Suppl 2011;1:2-5.
4. Braam B, Joles JA, Danishwar AH, Gaillard CA. Cardiorenal syndrome - current understanding and future perspectives. Nat
Rev Nephrol 2014;10:48-55.
5. McAlister FA, Ezekowitz J, Tonelli M,
Armstrong PW. Renal insufficiency and
heart failure: prognostic and therapeutic implications from a prospective cohort study.
Circulation 2004;109:1004-9.
6. Smith GL, Lichtman JH, Bracken MB, et
al. Renal impairment and outcomes in heart
failure: systematic review and meta-analysis. J Am Coll Cardiol 2006;47:1987-96.
7. Cowie MR, Komajda M, MurrayThomas T, Underwood J, Ticho B; POSH Investigators. Prevalence and impact of worsening renal function in patients hospitalized
with decompensated heart failure: results of
the prospective outcomes study in heart
failure (POSH). Eur Heart J 2006;27:121622.
8. Fiaccadori E, Maggiore U, Di Motta T, et
al. Valutazione e significato delle alterazioni della funzione renale nell’insufficienza
cardiaca in fase di scompenso acuto. G Ital
Nefrol 2013;30(3).
9. Li Z, Cai L, Liang X, et al. Identification
and predicting short-term prognosis of early cardiorenal syndrome type 1: KDIGO is
superior to RIFLE or AKIN. PLoS One 2014;
9:e114369.
10. ter Maaten JM, Valente MA, Damman
K, Hillege HL, Navis G, Voors AA. Diuretic
response in acute heart failure - pathophysiology, evaluation, and therapy. Nat Rev
Cardiol 2015;12:184-92.
11. House AA. Cardiorenal syndrome:
new developments in the understanding
and pharmacologic management. Clin J Am
Soc Nephrol 2013;8:1808-15.
12. Haase M, Müller C, Damman K, et al.
Pathogenesis of cardiorenal syndrome type
1 in acute decompensated heart failure:
workgroup statements from the eleventh
consensus conference of the Acute Dialysis
Quality Initiative (ADQI). Contrib Nephrol
2013;182:99-116.
13. Damman K, Voors AA, Navis G, van
Veldhuisen DJ, Hillege HL. The cardiorenal
syndrome in heart failure. Prog Cardiovasc
Dis 2011;54:144-53.
14. Mullens W, Abrahams Z, Francis GS, et
al. Importance of venous congestion for
worsening of renal function in advanced
decompensated heart failure. J Am Coll
Cardiol 2009;53:589-96.
15. Damman K, Navis G, Smilde TD, et al.
Decreased cardiac output, venous congestion and the association with renal impairment in patients with cardiac dysfunction.
Eur J Heart Fail 2007;9:872-8.
16. Mullens W, Abrahams Z, Skouri HN, et
al. Elevated intra-abdominal pressure in
G ITAL CARDIOL | VOL 16 |
5
G CICE
acute decompensated heart failure: a potential contributor to worsening renal function? J Am Coll Cardiol 2008;51:300-6.
17. Maisel SA, Katz N, Hillege HL, et al.;
Acute Dialysis Quality Initiative Consensus
Group. Biomarkers in kidney and heart disease. Nephrol Dial Transplant 2011;26:6274.
18. Adams KF Jr, Fonarow GC, Emerman
CL, et al.; ADHERE Scientific Advisory Committee and Investigators. Characteristics
and outcomes of patients hospitalized for
heart failure in the United States: rationale,
design, and preliminary observations from
the first 100,000 cases in the Acute Decompensated Heart Failure National Registry (ADHERE). Am Heart J 2005;149:20916.
19. Ronco C, Haapio M, House AA,
Anavekar N, Bellomo R. Cardiorenal syndrome. J Am Coll Cardiol 2008;52:1527-39.
20. Schrier RW, Abraham WT. Hormones
and hemodynamics in heart failure. N Engl
J Med 1999;341:577-85.
21. Brewster UC, Perazella MA. The reninangiotensin-aldosterone system and the
kidney: effects on kidney disease. Am J Med
2004;116:263-72.
22. Cohn JN, Levine TB, Olivari MT, et al.
Plasma norepinephrine as a guide to prognosis in patients with chronic congestive
heart failure. N Engl J Med 1984;311:81923.
23. Szymanski MK, Damman K, van Veldhuisen DJ, van Gilst WH, Hillege HL, de Boer
RA. Prognostic value of renin and prorenin
in heart failure patients with decreased kidney function. Am Heart J 2011;162:487-93.
24. Elkayam U, Tasissa G, Binanay C, et al.
Use and impact of inotropes and vasodilator
therapy in hospitalized patients with severe
heart failure. Am Heart J 2007;153:98-104.
25. Felker GM, Lee KL, Bull DA, et al.;
NHLBI Heart Failure Clinical Research Network. Diuretic strategies in patients with
6
G ITAL CARDIOL | VOL 16 |
acute decompensated heart failure. N Engl
J Med 2011;364:797-805.
26. Mentz RJ, Stevens SR, DeVore AD, et
al. Decongestion strategies and renin-angiotensin-aldosterone system activation in
acute heart failure. JACC Heart Fail 2015;
3:97-107.
27. Teerlink JR, Cotter G, Davison BA, et
al.; RELAXin in Acute Heart Failure (RELAXAHF) Investigators. Serelaxin, recombinant
human relaxin-2, for treatment of acute
heart failure (RELAX-AHF): a randomised,
placebo-controlled trial. Lancet 2013;381:
29-39.
28. Metra M, Cotter G, Davison BA, et al.;
RELAX-AHF Investigators. Effect of serelaxin on cardiac, renal, and hepatic biomarkers in the Relaxin in Acute Heart Failure (RELAX-AHF) development program: correlation with outcomes. J Am Coll Cardiol
2013;61:196-206.
29. Haas M. The Na-K-Cl cotransporters.
Am J Physiol 1994;267(4 Pt 1):C869-85.
30. Felker GM, Mentz RJ. Diuretics and ultrafiltration in acute decompensated heart
failure. J Am Coll Cardiol 2012;59:2145-53.
31. Ellison DH. Diuretic therapy and resistance in congestive heart failure. Cardiology
2001;96:132-43.
32. Eshaghian S, Horwich TB, Fonarow
GC. Relation of loop diuretic dose to mortality in advanced heart failure. Am J Cardiol
2006;97:1759-64.
33. Jentzer JC, DeWald TA, Hernandez AF.
Combination of loop diuretics with thiazidetype diuretics in heart failure. J Am Coll Cardiol 2010;56:1527-34.
34. Paul S. Balancing diuretic therapy in
heart failure: loop diuretics, thiazides, and
aldosterone antagonists. Congest Heart Fail
2002;8:307-12.
35. Knauf H, Mutschler E. Sequential
nephron blockade breaks resistance to diuretics in edematous states. J Cardiovasc
Pharmacol 1997;29:367-72.
36. Testani JM, Chen J, McCauley BD,
Kimmel SE, Shannon RP. Potential effects of
aggressive decongestion during the treatment of decompensated heart failure on renal function and survival. Circulation
2010;122:265-72.
37. Klein L, O’Connor CM, Leimberger JD,
et al.; OPTIME-CHF Investigators. Lower
serum sodium is associated with increased
short-term mortality in hospitalized patients
with worsening heart failure: results from
the Outcomes of a Prospective Trial of Intravenous Milrinone for Exacerbations of
Chronic Heart Failure (OPTIME-CHF) study.
Circulation 2005;111:2454-60.
38. Greenberg A, Verbalis JG. Vasopressin
receptor antagonists. Kidney Int 2006;69:
2124-30.
39. Thibonnier M, Coles P, Thibonnier A,
Shoham M. Molecular pharmacology and
modeling of vasopressin receptors. Prog
Brain Res 2002;139:179-96.
40. Costello-Boerrigter LC, Smith WB,
Boerrigter G, et al. Vasopressin-2-receptor
antagonism augments water excretion
without changes in renal hemodynamics or
sodium and potassium excretion in human
heart failure. Am J Physiol Renal Physiol
2006;290:F273-8.
41. Schrier RW, Gross P, Gheorghiade M,
et al.; SALT Investigators. Tolvaptan, a selective oral vasopressin V2-receptor antagonist, for hyponatremia. N Engl J Med
2006;355:2099-112.
42. Konstam MA, Gheorghiade M, Burnett JC Jr, et al.; Efficacy of Vasopressin Antagonism in Heart Failure Outcome Study
With Tolvaptan (EVEREST) Investigators. Effects of oral tolvaptan in patients hospitalized for worsening heart failure: the EVEREST Outcome Trial. JAMA 2007;297:131931.
43. Ferraris M. Karl Popper. Se il falso è la
sola verità. 15 settembre 2014. www.repubblica.it.