RICERCA SULLA NATURA DEL
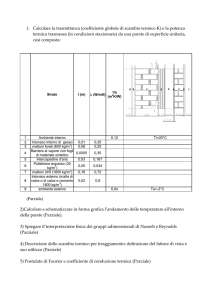
CALORE
Luca Chericoni
Tiziano Diodati
VCCL
RICERCA DI UNA DEFINIZIONE DI CALORE
Sebbene il concetto di calore risulti intuitivamente comprensibile a tutti perché
associato alla nostra esperienza quotidiana, non è altrettanto facile fornirne
una definizione scientifica e rigorosa.
Si potrebbe infatti pensare che il calore sia una forma di materia; difatti
bruciando un pezzo di legno ottengo delle ceneri la cui massa finale
dovrebbe essere minore di quella iniziale.
Tuttavia tale ipotesi viene subito smentita dalla legge di Lavoisier, la quale
afferma invece che all'interno di una reazione chimica (tale è la combustione)
la massa dei prodotti è uguale a quella dei reagenti. Nel nostro caso risulta
evidente come il vapore acqueo che si libera dalla reazione di combustione
non venga conteggiato nel calcolo della massa finale.
Si potrebbe allora assumere temporaneamente come valida la definizione,
seppur vaga, fornita dal chimico francese, secondo cui il calore altro non è
che un fluido che si diffonde da un corpo all'altro.
A questo punto occorre però stabilire una legge che determini la direzionalità
e l'eventuale reversibilità di questo passaggio di calore.
Comunemente è ritenuto valido il principio in base al quale il calore passa dai
corpi cosiddetti “caldi” a quelli “freddi”, definizioni, queste ultime, che non
consentono in ogni caso di uscire da un'ottica prettamente soggettivista e
sensoriale. Sarà infatti noto a tutti che la percezione del livello termico di un
corpo da parte del nostro organismo è piuttosto imprecisa e dipende dal
nostro stesso livello termico iniziale, che non è sempre uguale. Per misurare
dunque il livello termico di un corpo, che si definisce “temperatura”, è
necessario affidarsi a misure di carattere indiretto, che possono ad esempio
sfruttare la proprietà di un liquido di dilatarsi all'aumentare della temperatura
stessa, espediente che si pone alla base di strumenti quali il termometro ad
alcool o a mercurio.
E'comunque possibile notare come il calore si diffonda effettivamente dai
corpi che hanno una temperatura maggiore a quelli caratterizzati da una
minore.
Si apre a questo punto la possibilità di fornire una definizione operativa del
calore studiando non tanto il calore di per sé, ma analizzandone il passaggio
attraverso alcuni esperimenti.
OSSERVAZIONI
Assunta come valida la conclusione del paragrafo precedente, ponendo che
il calore all' interno dell'universo sia costante, si dovrebbe, attraverso il
passaggio di calore, giungere alla fine ad una temperatura uniforme.
Considerando che questo non è avvenuto nel corso di 15 miliardi di anni, si
potrebbe ipotizzare che la quantità di calore presente nell'universo non sia
costante, ma aumenti o diminuisca in maniera complessiva o parziale: difatti
anche la diminuzione di una certa quantità di calore in una zona determinata,
compensata da un aumento della stessa uguale e contrario ma differito nello
spazio, sarebbe sufficiente a determinare un passaggio di calore.
ESPERIENZA 1
L'intento della prima esperienza è quello di studiare l'aumento della
temperatura di una massa di acqua allo stato liquido all'aumentare del calore
somministratogli tramite un fornello a metano.
Pur non essendo in grado di determinare la quantità di calore che si diffonde
da questo, è comunque possibile considerare che essa sia direttamente
proporzionale al tempo, a parità di gas combusto.
Dati dunque i simboli Q(calore), Δt(differenza di tempo) e una costante di
proporzionalità indicata con la lettera “a”, risulterà che Q=a* Δt.
La strumentazione utilizzata per la misura della temperatura è costituita da un
termometro ad alcool preciso al grado centigrado attraverso il cui movimento
all'interno dell'acqua si intendeva omogeneizzare la temperatura dell'acqua,
essendo prevedibile che altrimenti la parte di acqua più vicina al fornello
avrebbe assunto una temperatura maggiore.
Il risultato dell'esperienza è riportato nel grafico sottostante.
curva temperatura
45
temperatura
40
35
30
25
20
15
10
5
0
0
10
20
30
tempo
N.B. Le misure sono riportate in secondi e gradi Celsius.
Il grafico ottenuto è dunque approssimabile ad una retta.
40
50
Detta T la temperatura e T0 la temperatura iniziale, abbiamo dunque che:
T=k Δt+T0
Q=a* Δt
T-T0=k/a*Q
Rimane ora da stabilire da cosa dipenda k/a.
A tal fine l'esperienza è stata ripetuta due volte; la prima utilizzando una
quantità doppia di acqua, la seconda impiegando un'analoga quantità di una
soluzione di acqua e cloruro di sodio (NaCl).
Nei grafici sottostanti sono riportati i risultati rispettivamente della prima e
della seconda ripetizione.
Variazione di massa
Curva della temperatura
35
temperatura (°C)
30
25
20
15
10
5
0
0
10
20
30
40
50
tempo(s)
Risulta evidente come il raddoppiamento della massa di acqua incida sul
coefficiente angolare della retta, che si dimezza, evidenziando una relazione
di proporzionalità inversa tra massa riscaldata e velocità di riscaldamento.
Difatti, definito M come ΔT/Δt, risultando
M1=0'28
m2= 2m1,
e
M2=0,15
ne consegue che M1*m1=M2*m2.
Ne concludiamo che la costante k/a=M, che in seguito alle equazioni
precedentemente esposte è il coefficiente angolare della retta, dipende dalla
massa del corpo riscaldato.
Variazione di sostanza
temperatura(°C)
Curva della temperatura
29,5
29
28,5
28
27,5
27
26,5
26
25,5
25
24,5
0
10
20
30
40
50
tem po(s)
In questo caso, sebbene il trend lineare risulti meno preciso, il coefficiente
angolare della retta, uguale a k/a, risulta visibilmente minore, cosicché
appare evidente come k/a dipenda da una costante relativa alla sostanza.
OSSERVAZIONI
Si noti come in entrambi gli esperimenti condotti con massa doppia rispetto a
quella iniziale, i grafici evidenziano una prima fase, della durata di circa 10
secondi, all'interno della quale la temperatura rimane invariata. Tale
situazione potrebbe forse presentare delle analogie con la forza di attrito
statico: come all'aumentare della massa aumenta la forza di distacco
necessaria a mettere in moto un corpo, così
forse aumenta la quantità di calore necessaria ad indurre un cambiamento di
temperatura.
DEFINIZIONE OPERATIVA DEL CALORE
In base alle considerazioni esposte nel paragrafo precedente possiamo
scrivere:
k/a=1/c*m
dove m è la massa del corpo e c una costante relativa al materiale da cui è
composto.
Avremo pertanto:
T-T0=k/a*Q
T-T0=(1/m*c)*Q
Q=(T-T0)*m*c
Pur non sapendo dunque cosa effettivamente il calore sia, è possibile darne
una definizione operativa relativa alla sua quantità.
Definiremo infatti la “grande caloria”(Cal) come la quantità di calore
necessaria ad aumentare di 1 grado la temperatura di una massa di 1kg di
acqua.
SCAMBI TERMICI
Il calore si diffonde dai corpi con una temperatura maggiore a quelli con
temperatura minore. Rimane però da stabilire attraverso un esperimento se
all'interno di questo passaggio il calore si conservi o meno. Se così fosse, la
relazione Q=(T-T0)*m*c potrebbe essere utilmente impiegata per calcolare la
temperatura al termine dello scambio termico, detta temperature di equilibrio
(Te), oppure per individuare la sostanza di cui un corpo si compone tramite il
calcolo di c.
ESPERIMENTO 2
Obiettivo
L'obiettivo di questo esperimento è quello di provare che la quantità di calore
all'interno di uno scambio termico si conserva, in quanto il calore acquisito dal
corpo meno caldo è uguale alla quantità di calore ceduta da quello più caldo.
Procedimento e strumentazione
Il procedimento consiste nel riscaldamento su fornello elettrico dell'acqua
calda e nella miscelazione della stessa con l'acqua fredda, che si trova a
temperatura ambiente, all'interno del contenitore metallico di riscaldamento.
L'omogenizzazione dell'acqua è ottenuta tramite un mestolo di legno, per la
sua scarsa conducibilità termica, mentre le misure della temperatura vengono
prese con un termometro ad alcool preciso al grado centigrado.
Dati iniziali
T01 acqua fredda=21°C
T02 acqua calda=72°C
m1 acqua fredda=0,22kg
m2 acqua calda=0,25 kg
Discussione del risultato
La temperatura finale ricavata dall'esperimento è di 49°C.
Calcoliamo ora quella che dovrebbe essere se l'ipotesi fosse vera:
Qceduto+Qacquisito=0
m2*c*(Te-T02)+m1*(Te-T01)*c=0
N.B. E'possibile eliminare c dividendo entrambi i membri per c, in quanto le due masse sono formate
dalla stessa sostanza.
Dal momento che
T02>Te>T01
avremo che:
Qceduto<0<Qacquisito
Svolgendo i calcoli otteniamo:
Te=48,2°C
La temperatura teorica si discosta da quella reale di meno del 2%, pertanto,
l'ipotesi risulta verificata.
Proviamo però ad individuare i possibili errori sistematici.
Pur trascurando infatti quelli casuali, risulta tuttavia evidente come sussista la
trasmissione di calore dal contenitore, più caldo dell'acqua, all'acqua già
miscelata e come la presenza di un coperchio non sia tuttavia sufficiente ad
isolare l'acqua dall'atmosfera.