1
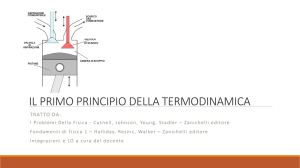
Il lavoro nelle trasformazioni termodinamiche
Le trasformazioni termodinamiche di un gas perfetto
Le grandezze che identificano lo stato termodinamico di una data quantità di un gas perfetto sono il
volume, la pressione e la temperatura. Queste grandezze sono legate tra loro dall’equazione di
stato dei gas perfetti, cosicché note due di esse la terza risulta automaticamente determinata. Per
questo motivo possiamo rappresentare lo stato di una data quantità di un gas come un punto in un
sistema di assi cartesiani in cui sulle ascisse abbiamo il volume e sulle ordinate la pressione. Tale
piano si chiama piano di Clapeyron. Una trasformazione termodinamica è rappresentata da una
linea che unisce due punti, dotata di un verso che va dallo stato iniziale a quello finale. Vediamo
quali sono le principali trasformazioni.
Trasformazione a volume costante. La trasformazione a volume costante si chiama isovolumica o
isocora. Essa si rappresenta nel piano di Clapeyron con un segmento verticale orientato verso l’alto
se la pressione finale è più alta di quella iniziale, verso il basso altrimenti.
Trasformazione a pressione costante. La trasformazione a pressione costante si chiama isobara.
Essa si rappresenta nel piano di Clapeyron con un segmento orizzontale orientato verso destra se il
volume finale è maggiore di quello iniziale (espansione), verso sinistra altrimenti (compressione).
Trasformazione a temperatura costante. Ricordando che a temperatura costante l’equazione di stato
dei gas perfetti si riduce alla legge di Boyle p·V = cost., la trasformazione a temperatura costante, o
isoterma, si rappresenta nel piano di Clapeyron con un tratto di iperbole (la curva della
proporzionalità inversa), orientato da destra/alto a sinistra/basso nel caso di espansione, in maniera
opposta nel caso di compressione.
Il lavoro nelle trasformazioni termodinamiche
Consideriamo un gas contenuto in un cilindro disposto verticalmente chiuso da un pistone
scorrevole. Mettiamo dei pesi sul cilindro e forniamo calore al gas. A causa del riscaldamento il gas
si espanderà alzando i pesi e quindi compiendo lavoro contro la forza peso. Abbiamo così
evidenziato una caratteristica generale delle trasformazioni termodinamiche: il lavoro compiuto da
un gas è sempre associato ad una variazione di volume, esso è positivo nel caso di espansione e
negativo nel caso di compressione. Una immediata conseguenza di questo principio è che: in una
trasformazione a volume costante il lavoro è zero.
Per scoprire come si calcola il lavoro in una trasformazione termodinamica consideriamo dapprima
l’espansione a pressione costante di un gas contenuto in un cilindro di area di base A chiuso da un
F
pistone scorrevole su cui agisce la forza esterna costante F . La pressione esterna è P = ;
A
supponiamo che la pressione del gas sia di poco superiore a questo valore in modo da poter
considerare il processo un’espansione a pressione costante. Se il pistone si sposta di un tratto ∆h il
lavoro compiuto dal gas è dato da L = F·∆h = P·A·∆h. Ma A·∆h è la variazione di volume ∆V,
cosicché il lavoro compiuto in una trasformazione a pressione costante è dato dal prodotto
della pressione per la variazione di volume: L = P·∆V. La trasformazione a pressione costante è
rappresentata nel piano di Clapeyron da un segmento orizzontale e il lavoro, dato dal prodotto tra la
pressione e la variazione di volume, è pari all’area compresa tra tale segmento e l’asse delle ascisse.
Questa osservazione ci permette di generalizzare la definizione di lavoro al caso di una pressione
non costante: in una qualsiasi trasformazione termodinamica il lavoro è dato dall’area
compresa tra la curva della pressione e l’asse dei volumi nel piano di Clapeyron.
Trasformazioni cicliche
Una trasformazione in cui lo stato iniziale e quello finale coincidono si chiama trasformazione
ciclica. Una trasformazione ciclica può essere vista come l’insieme di una espansione e di una
compressione.
2
Il lavoro è dato dalla differenza tra l’area sotto il tratto di curva
che rappresenta l’espansione e quella sotto il tratto di curva che
rappresenta la compressione, cioè l’area racchiusa dalla curva.
Il lavoro è positivo se il ciclo viene percorso in senso
antiorario, negativo altrimenti.
Verifiche di comprensione
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
Quali sono le grandezze che identificano lo stato
termodinamico di una data quantità di gas?
Quante grandezze è necessario conoscere per determinare lo stato di una data quantità di gas?
Come possiamo rappresentare geometricamente lo stato di una data quantità di gas?
Come si rappresenta una trasformazione termodinamica nel piano di Clapeyron?
Come si rappresenta una trasformazione a volume costante nel piano di Clapeyron?
Come si rappresenta una trasformazione a pressione costante nel piano di Clapeyron?
Come si rappresenta una trasformazione a temperatura costante nel piano di Clapeyron?
A che cosa è sempre associato il lavoro compiuto da un gas?
Come si determina il segno del lavoro compiuto da un gas?
Quanto vale il lavoro compiuto da un gas in una trasformazione isovolumica?
Quanto vale il lavoro compiuto da un gas in una trasformazione isobara?
Come si calcola il lavoro quando la trasformazione non è a pressione costante?
Come è definita una trasformazione ciclica?
Come si calcola il lavoro in una trasformazione ciclica?
Come si determina il segno del lavoro compiuto in una trasformazione ciclica?
Verifiche di conoscenza
1.
2.
3.
4.
5.
6.
Per determinare lo stato di una data quantità di gas:
a. è sufficiente conoscere la pressione e la temperatura
b. è necessario conoscere il volume, la pressione e la temperatura
c. è necessario conoscere la temperatura
d. è sufficiente conoscere la temperatura
Nel piano di Clapeyron la legge di Gay-Lussac è rappresentata da:
a. un segmento di retta obliquo
b. un segmento verticale
c. un segmento orizzontale
d. un arco di iperbole
Nel piano di Clapeyron la legge di Charles è rappresentata da:
a. un segmento di retta obliquo
b. un segmento verticale
c. un segmento orizzontale
d. un arco di iperbole
Nel piano di Clapeyron la legge di Boyle è rappresentata da:
a. un segmento di retta obliquo
b. un segmento verticale
c. un segmento orizzontale
d. un arco di iperbole
Se il lavoro compiuto da un gas durante una trasformazione è zero:
a. non è stato scambiato calore con il gas
b. la temperatura è rimasta costante
c. il volume è rimasto costante
d. il volume può essere cambiato
Il lavoro compiuto in una trasformazione a pressione costante:
a. è sempre positivo
b. è negativo se il gas viene compresso
c. è sempre nullo
d. è diverso da zero se anche il volume rimane costante
3
7.
8.
Consideriamo due trasformazioni: nella prima si raddoppia il volume di una data quantità di gas
mantenendo costante la pressione, la seconda mantenendo costante la temperatura;
a. il lavoro nella prima è sempre maggiore del lavoro nella seconda
b. il lavoro nella seconda è sempre maggiore del lavoro nella prima
c. il lavoro nelle due trasformazioni è uguale
d. il lavoro nella seconda è maggiore se la temperatura è sufficientemente elevata
Il lavoro necessario per raddoppiare il volume di un gas e poi riportarlo allo stesso volume e
temperatura iniziali:
a. è nullo
b. è positivo o nullo
c. non può essere nullo
d. è nullo solo se la trasformazione diretta e quella inversa coincidono
Problema svolto 1 – Confronto del lavoro compiuto su un gas nel passaggio da uno stato ad un
altro tramite due trasformazioni differenti
Una quantità di gas viene fatta passare da uno stato A caratterizzato da un
volume di 0,025 m3 e una pressione di 0,98·105 Pa a uno B in cui il volume è
doppio e la temperatura tripla. Calcola il lavoro compiuto se tale
trasformazione è composta da una isocora seguita da una isobara o da una
isobara seguita da una isocora.
Scriviamo i dati del problema
Volume iniziale = 0,025 m3; Volume finale = 0,050 m3;
Pressione iniziale = 0,98·105 Pa; Temperatura finale tripla di quella iniziale.
Incognite
Il lavoro nelle due trasformazioni
Analisi e soluzione
Poiché
B
A
PA ⋅ V A PB ⋅ VB
3
=
la pressione finale è PB = PA = 1,5 ⋅ 10 5 Pa . Il lavoro è dato nella prima
TA
TB
2
trasformazione da PA ⋅ (V B − V A ) = 2,5 ⋅ 10 3 J , mentre nella seconda da PB ⋅ (V B − V A ) = 3,7 ⋅ 10 3 J
Problemi
1.
2.
3.
4.
5.
Una mole di gas perfetto ha inizialmente una pressione di 1,25·105 Pa e una temperatura di 350
K. Se ne raddoppia il volume mantenendo costante la temperatura. Determina pressione, volume
e temperatura negli stati iniziale e finale e rappresenta la trasformazione nel piano di Clapeyron.
Due moli di gas perfetto occupano inizialmente un volume di 0,045 m3 a una temperatura di 350
K. Il gas viene poi fatto espandere a pressione costante fino a un volume di 0,078 m3. Di quanto
si deve successivamente variare la pressione per riportare il gas alla temperatura iniziale?
Per portare una mole di gas dallo stato iniziale A caratterizzato da un volume di 0,035 m3 e una
pressione di 1,2·105 Pa allo stato finale B in cui il volume è di 0,065 m3 e una pressione di
1,8·105 Pa si seguono due trasformazioni. La prima consiste in una espansione a pressione
costante fino a 0,050 m3 seguita da una isovolumica in cui la pressione raggiunge il valore finale
e da un’altra isobara fino al volume finale; la seconda consiste in una espansione a pressione
costante fino a 0,040 m3 seguita da una isovolumica in cui la pressione raggiunge il valore finale
e da un’altra isobara fino al volume finale. Calcola il lavoro compiuto nelle due trasformazioni
dopo averle rappresentate sul piano di Clapeyron.
Calcola il lavoro compiuto per aumentare il raggio di una bolla d’aria a 4,0 m di profondità
sott’acqua da 3,0 a 5,0 cm.
Lo stato A di una certa quantità di gas è caratterizzato da un volume di 0,027 m3 e una
pressione di 1,0 ·105 Pa, mentre lo stato B ha un volume di 0,036 m3 e una pressione di 1,6·105
Pa. Dopo aver opportunamente riportato i punti A e B sul piano di Clapeyron costruisci la
seguente trasformazione ciclica: fornendo opportunamente calore al gas si passa da A a B con
una trasformazione rappresentata da un segmento che unisce direttamente i due punti; si torna
poi in A mediante una isovolumica seguita da una isobara. Calcola il lavoro compiuto dal gas.
4
6.
Con riferimento al problema 3, calcola il lavoro compiuto dal gas nel ciclo formato dalla prima
trasformazione seguita dalla seconda percorsa in senso inverso. È positivo o negativo?