L’ossigeno è essenziale per la vita a causa del suo
ruolo nella produzione di ATP e la sua partecipazione
in processi di biosintesi e di detossicazione
Tale processo può danneggiare DNA, proteine e lipidi
con conseguenti mutazioni e modifiche strutturali che
favoriscono la carcinogenesi
Sono tanti i fattori intrinseci ed estrinseci che
contribuiscono alla formazione di specie reattive
dell'ossigeno (ROS)
L'aumento di ROS è legato all’invecchiamento ed alle
malattie connesse come cancro, aterosclerosi, diabete
e patologie degenerative come Parkinson e Alzheimer
Oxidative stress in prostate cancer: changing research concepts towards a novel paradigm for prevention and
therapeutics - Prostate Cancer Prostatic Dis. 2013 Sep;16(3):217-25. doi: 10.1038/pcan.2013.13 - Paschos et al.
H2
esiste come molecola
biatomica
Ymol = c1 Y1 c2 Y2
He
non esiste come
molecola biatomica
•La molecola di O2 ha due
elettroni spaiati ed è
paramagnetica
•L’ossigeno naturale si
trova in questa
configurazione
•Nelle reazioni redox può
quindi accettare solo un
solo elettrone per volta
Ossigeno tripletto
Ossigeno singoletto
Esiste anche un altro tipo di
molecola di O2 che
è diamagnetica ed
estremamente reattiva e
si trova nella
configurazione sopra
riportata
Nelle reazioni redox l’ossigeno può
accettare solo un solo elettrone per volta
O2 +
e
*O2
radicale superossido
O2*- + e- H2O2 perossido di idrogeno
H2O2 + e- OH- + *OH radicale idrossile
*OH
+
e
OH
Sistemi di difesa dai ROS
non enzimatici
• GSH
• vitamina C
enzimatici
• Catalasi: 2H₂O₂ => 2H₂O + O₂
• Perossidasi: ROOH + Xrid = ROH + XoxOH
• Superossido dismutasi:
2O₂-. + 2H⁺ = H₂O₂ + O₂
• vitamina E
• β-carotene
• Glutatione perossidasi:
2GSH + H₂O₂ = GSSG + 2H₂O
• Glutatione reduttasi:
2GSH + NADP+ = GSSH + NADPH + H+
CITOSOL
GLUCOSIO (6C)
glicolisi
due molecole di
acido piruvico (3C)
O2
respirazione
CO2 e H2O
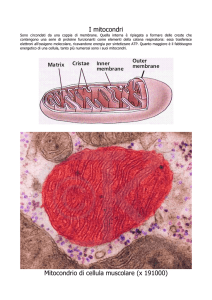
MITOCONDRIO
Membrana esterna
Membrana interna
Spazio intermembrana
Cresta
Matrice
Produzione di energia
Mantenimento dell’omeostasi cellulare
Protezione del resto della cellula dalle Specie Reattive dell’Ossigeno (ROS)
Necrosi e apoptosi importanti per sviluppo e patologie
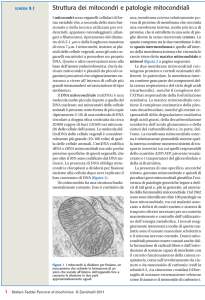
Nella matrice mitocondriale avviene il ciclo di Krebs che genera elettroni ad alta
energia nelle molecole di NADH+H+ (coenzima) e di FADH2 (gruppo prostetico)
Nelle creste mitocondriali si trovano le catene respiratorie, formate ciascuna da tre grandi
complessi enzimatici di membrana (I, III, IV), connessi dal lipide ubiquinone e dal citocromo
C. Il complesso II è un enzima del ciclo di Krebs, l’unico che non è solubile.
Nel funzionamento della catena
respiratoria, gli ioni H+ (protoni)
sono trasferiti nello spazio
intermembrana, accumulando
quindi energia come gradiente
di protoni
Forza proton motrice = DV + DpH
Il gradiente di protoni genera
un campo elettrico nella
membrana mitocondriale
interna
Il pH nello spazio
intermembrana è di oltre una
unità inferiore a quello nella
matrice
Il potenziale di membrana è
140 mV, con la parte positiva
nella faccia rivolta allo spazio
intermembrana
L’energia per la sintesi di ATP è
la forza proton motrice del
gradiente di protoni che aziona le
ATP sintasi (Pompe di tipo V,
reversibili)
La regolazione degli scambi citosol / mitocondrio è un’altra funzione importante che
è permessa dalla forza proton motrice generata dal gradiente di protoni
I mitocondri sono organuli responsabili della produzione di
energia cellulare sotto forma di calore e di ATP, ma sono
anche i principali responsabili dell’attivazione del programma
genetico di apoptosi mediato dal rilascio di numerose proteine
dello spazio intermembrana (citocromo c, Smac/ Diablo, …).
Il destino della cellula è determinato dalla presenza nelle
membrane mitocondriali di proteine della famiglia Bcl-2 (B-cell
lymphoma 2) o Bax. Molte cellule tumorali mostrano livelli
anormali di proteina Bcl-2 che si traducono in impossibilità di
attivare l’apoptosi.
Recenti evidenze indicano che diverse proteine pro-apoptotiche
localizzate nei mitocondri, così come le proteine delle
famiglie Bcl-2 e Bax, sono in grado di influenzare la funzione
bioenergetica dei mitocondri.
Central roles of apoptotic proteins in mitochondrial function - Oncogene. 2013 May 30;32(22):2703-11. doi:
10.1038/onc.2012.348 - Kilbride SM, Prehn JH.
In presenza di Bax si ha la formazione e
l’apertura di un poro
(MOMP) con rilascio
dei fattori
pro-apoptotici
(Citocromo c, Smac/Diablo, …) che inducono
l'apoptosi attraverso l'attivazione delle caspasi e la successiva
frammentazione del DNA nucelare. La presenza di Bcl2 impedisce invece
la formazione di MOMP. La perdita di citocromo c dallo spazio
intermembrana (i) impedisce il funzionamento della catena respiratoria con
crollo del Δψm, (ii) ma allo stesso tempo aumenta la produzione di ROS
a causa della fuga di elettroni dalla catena respiratoria. Lo stress ossidativo
causato dall’aumento dei ROS può contribuire alla morte delle cellule a
causa della liberazione di ioni Ca2 +, contribuendo all’apertura del poro.
Central roles of apoptotic proteins in mitochondrial function - Oncogene. 2013 May 30;32(22):2703-11. doi:
10.1038/onc.2012.348 - Kilbride SM, Prehn JH.
Comunicazione nucleo/mitocondrio: per costruire un
mitocondrio, il nucleo deve in qualche modo essere informato
della necessità di attivare geni mitocondriali nel genoma
nucleare,
quando
attivarli e
quali
attivare,
perché
specifici
tessuti
hanno
mitocondri
molto
differenti
nella
composizione in proteine.
Ageing: Beneficial miscommunication - Nature. 2013 May 23;497(7450):442-3. doi: 10.1038/497442a - Wolff S, Dillin A.
Sett 2014
Durante la divisione cellulare, è
fondamentale ripartire correttamente gli
organelli nelle due cellule figlie, usando
anche il citoscheletro.
A causa delle loro caratteristiche uniche, un
proprio genoma ed una modalità di
trasmissione nella linea germinale
femminile, la ripartizione dei mitocondri
richiede un processo particolare che si è
evoluto per regolare la segregazione
mitocondriale durante la divisione cellulare,
oogenesi, fecondazione e sviluppo
embrionale/fetale, per garantire l'integrità di
questi organelli e del loro DNA, compresa
la dinamica fusione-fissione, il trasporto
degli organelli, la mitofagia e la selezione
genetica dei genomi funzionali.
Difetti in questi processi possono portare a
patologie di cellule e tessuti.
Meccanismi cellulari coinvolti nella segregazione, trasporto e degradazione dei
mitocondri: (a) Controllo della morfologia mitocondriale per fusione e fissione.
(b) Dinamiche dei mitocondri durante il ciclo cellulare. La morfologia mitocondriale è
coordinata con il ciclo cellulare e garantisce una equa segregazione dei mitocondri
(c) I mitocondri si possono associare con filamenti del citoscheletro ed
essere trasportati da motori molecolari. Nelle cellule di mammifero i
mitocondri sono trasportati sui microtubili dai motori molecolari kinesina e
dineina. Milton agisce come adattatore per collegare il motore molecolare
alla GTPasi mitocondriale Rho (Miro) che si trova sulla superficie
mitocondriale. In presenza di elevate concentrazioni di ioni calcio (a destra),
la kinesina si stacca dal complesso Milton-Miro e si lega alla sintafilina
(SNPH) che inibisce l'attività di ATPasi della kinesina e porta
all'immobilizzazione dei mitocondri.
(d) Mitofagia nelle cellule di mammifero:
• i mitocondri disfunzionali (a destra) reclutano Parkin (una ubiquitina
ligasi E3), si ha quindi poliubiquitinazione di proteine della membrana
mitocondriale esterna e conseguente degradazione da proteasoma;
• nelle cellule eritroidi (a sinistra), la rimozione dei mitocondri richiede la proteina
NIX della membrana esterna NIP3 come X (NIX), che interagisce con il complesso
GABARAP-L1;
• nella mitofagia indotta da ipossia (al centro), la defosforilazione di FUNDC1
consente di reclutare LC3 per inglobare i mitocondri nell’autofagosoma.
Nella cellula, i mitocondri si localizzano vicini
ai siti dove c’è un elevato consumo di ATP
• I mitocondri crescono e si dividono per
produrre nuovi mitocondri.
• I mitocondri non funzionanti vengono digeriti
dai lisosomi.
•I Mitocondri sono strettamente imparentati con i procarioti, in particolare con i
batteri. Geni di Eubatteri e geni di Archea sono sempre presenti nel genoma degli
Eucarioti. Esistono sia Eucarioti che non hanno mitocondri (es. il protozoo Giardia)
che Eucarioti che usano batteri come mitocondri (es. l’ameba Pelomixa)
•Il genoma mitocondriale è circolare, è organizzato in operon e codifica per mRNA,
rRNA e tRNA. La maggior parte dei geni mitocondriali sono stati in qualche modo
trasferiti nel nucleo.
•La duplicazione del DNA mitocondriale è autonoma e la proliferazione dei
mitocondri non è in fase con la cellula.
DNA MITOCONDRIALE
• 5-10 molecole circolari/mitocondrio; presenza di ribosio e
dimensione molto variabile fino a milioni di nucleotidi;
•
•
•
presenza di 2 operon, H ed L, che codificano per 37 geni, tra cui
sono presenti eccezioni al codice genetico:(UGA stop -> Trp;
arg -> stop; AUA/AUU ile -> met)
mRNA incompleti (editing)
•
•
•
anomala duplicazione del DNA
trasmissione materna
tendenza alla ETEROPLASMIA
di uracile;
nell’uomo è 15596 bp
13 proteine
AGA/AGG
Il DNA mitocondriale
può essere riparato in
modo simile a quello
nucleare
Mag 2014
LC3, light chain 3; Ub, ubiquitin
Si riteneva il mitocondrio non disponesse di sistemi per riparare il suo mtDNA. È noto adesso
che il mitocondrio dispone di percorsi multipli per la riparazione del DNA che sono mediati
da enzimi simili a quelli che operano nel nucleo e, in tutti i casi identificati finora nei mammiferi,
sono codificati da geni nucleari.
Il fatto che i mitocondri siano i maggiori siti di produzione di ROS (specie reattive dell'ossigeno)
non sembra richiedere soluzioni uniche per la riparazione del mtDNA . Questo potrebbe essere
perché i mitocondri hanno sistemi completi in atto per neutralizzare i ROS, ed è solo
quando questi falliscono o sono assenti che il danno da ROS compromette la funzione
mitocondriale in modi che vanno ben al di là del mtDNA.
La DNA polimerasi mitocondriale, DNA polimerasi γ (Pol γ), è in grado di operare la
correzione delle bozze durante la sintesi di DNA.
Durante la sintesi del DNA, il filamento in ritardo è ibridato con un RNA di origine ancora
sconosciuta. Qualunque sia la sua origine, le molecole di RNA legate al DNA impediscono
l'inizio della trascrizione del DNA in corso di replicazione, riducendo il numero di collisioni tra i
complessi di trascrizione e replicazione.
La presenza di lunghi tratti di RNA in prossimità di DNA aumenta anche la possibilità che L’RNA
possa essere usato riparare eventuali danni al DNA.
Attualmente è noto che il macchinario di replicazione del mtDNA include la DNA polimerasi - γ
(Pol γ, composta da Pol γ1 e Pol γ2, l’elicasi Twinkle (nota anche come C2ORF10) e una
ssBP1 mitocondriale. Si ritiene che possa essere la stessa RNA polimerasi mitocondriale a
generare i due primer di RNA nei mitocondri.
Minimizing the damage: repair pathways keep mitochondrial DNA intact - Nat Rev Mol Cell Biol. 2012 Oct;13(10):659-71.
doi: 10.1038/nrm3439 - Kazak et al.
Tutti i mitocondri dello zigote vengono forniti
dalla cellula uovo: eredità materna e
trasmissione materna dell’eteroplasmia
Ipotesi del collo di bottiglia
n
1
Una restrizione o “collo di bottiglia” avviene precocemente nei primi stadi
di sviluppo embrionale: solo uno (o comunque pochi e sani) mitocondri
avranno la capacità di proliferare e colonizzeranno le cellule
dell’embrione. Il numero e la variabilità dei genomi mitocondriali presenti
si riduce quindi drasticamente e con essi il grado di eteroplasmia
Segregazione del DNA mitocondriale durante la trasmissione
materna e l'inizio dell’embriogenesi:
(a) selezione purificatrice di oociti con mutazioni al mtDNA
(b) genetic bottleneck (collo di bottiglia genetico) del DNA
mitocondriale, per riduzione copie o amplificazione mtDNA
(c) secondo bottleneck all’inizio dell’embriogenesi
7
Mag 2014