ENDOCRINOCHIRURGIA
Chirurgia della tiroide
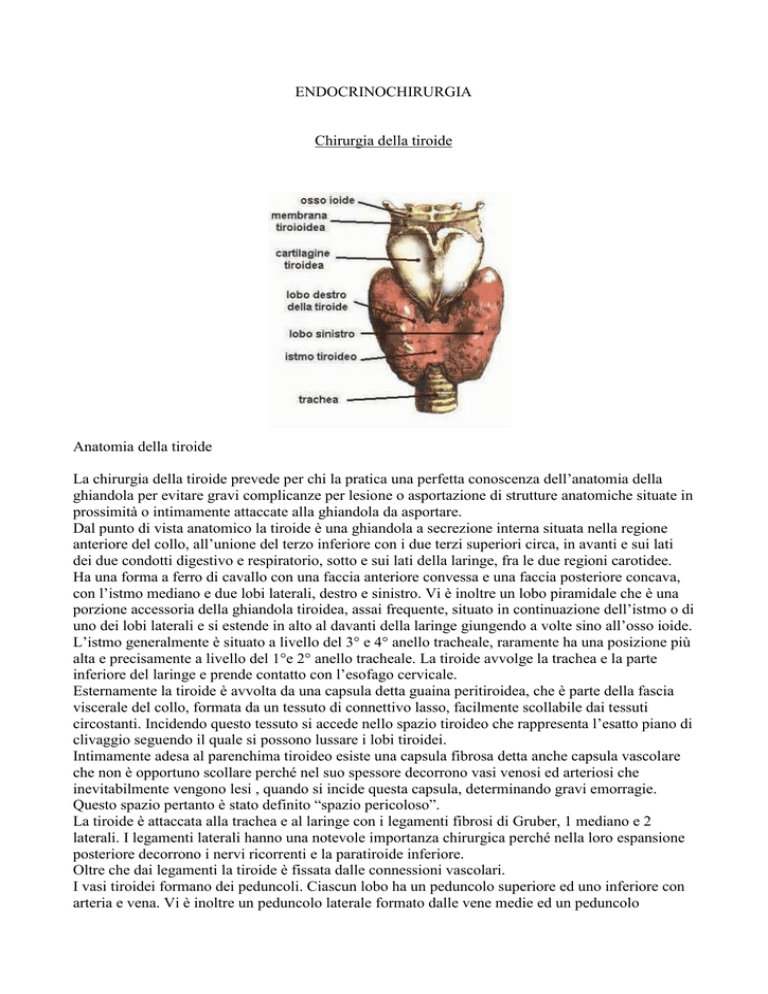
Anatomia della tiroide
La chirurgia della tiroide prevede per chi la pratica una perfetta conoscenza dell’anatomia della
ghiandola per evitare gravi complicanze per lesione o asportazione di strutture anatomiche situate in
prossimità o intimamente attaccate alla ghiandola da asportare.
Dal punto di vista anatomico la tiroide è una ghiandola a secrezione interna situata nella regione
anteriore del collo, all’unione del terzo inferiore con i due terzi superiori circa, in avanti e sui lati
dei due condotti digestivo e respiratorio, sotto e sui lati della laringe, fra le due regioni carotidee.
Ha una forma a ferro di cavallo con una faccia anteriore convessa e una faccia posteriore concava,
con l’istmo mediano e due lobi laterali, destro e sinistro. Vi è inoltre un lobo piramidale che è una
porzione accessoria della ghiandola tiroidea, assai frequente, situato in continuazione dell’istmo o di
uno dei lobi laterali e si estende in alto al davanti della laringe giungendo a volte sino all’osso ioide.
L’istmo generalmente è situato a livello del 3° e 4° anello tracheale, raramente ha una posizione più
alta e precisamente a livello del 1°e 2° anello tracheale. La tiroide avvolge la trachea e la parte
inferiore del laringe e prende contatto con l’esofago cervicale.
Esternamente la tiroide è avvolta da una capsula detta guaina peritiroidea, che è parte della fascia
viscerale del collo, formata da un tessuto di connettivo lasso, facilmente scollabile dai tessuti
circostanti. Incidendo questo tessuto si accede nello spazio tiroideo che rappresenta l’esatto piano di
clivaggio seguendo il quale si possono lussare i lobi tiroidei.
Intimamente adesa al parenchima tiroideo esiste una capsula fibrosa detta anche capsula vascolare
che non è opportuno scollare perché nel suo spessore decorrono vasi venosi ed arteriosi che
inevitabilmente vengono lesi , quando si incide questa capsula, determinando gravi emorragie.
Questo spazio pertanto è stato definito “spazio pericoloso”.
La tiroide è attaccata alla trachea e al laringe con i legamenti fibrosi di Gruber, 1 mediano e 2
laterali. I legamenti laterali hanno una notevole importanza chirurgica perché nella loro espansione
posteriore decorrono i nervi ricorrenti e la paratiroide inferiore.
Oltre che dai legamenti la tiroide è fissata dalle connessioni vascolari.
I vasi tiroidei formano dei peduncoli. Ciascun lobo ha un peduncolo superiore ed uno inferiore con
arteria e vena. Vi è inoltre un peduncolo laterale formato dalle vene medie ed un peduncolo
mediano sottoistmico impari, disposto a ventaglio sul margine della ghiandola, formato da una rete
di vene che dal margine inferiore dell’istmo e dei lobi si dirigono in basso nel tronco innominato di
sinistra (vene di Tillaux), e da una arteria ima (di Neubauer) che può essere assente e che comunque
solo eccezionalmente è di volume cospicuo.
Il peduncolo superiore è formato dall’arteria tiroidea superiore che nasce dalla carotide esterna e da
vene satelliti dell’arteria che sboccano nel tronco tireolinguo-facciale che si immette nella giugulare
interna. L’arteria tiroidea superiore da origine a tre rami uno esterno più piccolo che decorre lungo
il margine laterale, il ramo anteriore che si dirige sul margine superiore dell’istmo anastomizzandosi
con quello controlaterale, il ramo posteriore che si anastomizza con il ramo posteriore dell’arteria
tiroidea inferiore (ramo anastomotico di Halsted). Da questo ramo parte l’arteriola per la paratiroide
superiore. Dal tronco principale dell’arteria tiroidea superiore e dal suo ramo anteriore si staccano
rami che vascolarizzato il laringe, il muscolo cricofaringeo; dal ramo posteriore provengono rami
per la faringe. Il nervo laringeo superiore, motore del muscolo cricotiroideo che tende la corda
vocale omolaterale, decorre nell’84% dei casi fuori e posteriormente alla capsula chirurgica e non
contrae rapporti con i rami di divisione dell’arteria, ma nel 16% dei casi decorre in intimo contatto
con il tronco dell’arteria fino alle sue divisioni.
Il peduncolo inferiore è formato dalla arteria tiroidea inferiore che origina dall’arteria succlavia e
nel suo tratto terminale si divide in tre rami: inferiore, posteriore, interno. Il ramo inferiore è il più
piccolo, decorre verso la linea mediana sul bordo inferiore dell’istmo, anastomizzandosi con quello
dell’altro lato. Il ramo posteriore è il più grosso e si dirige in alto anastomizzandosi con il ramo
posteriore dell’arteria tiroidea superiore, vascolarizza in parte la paratiroide inferiore. Il ramo
interno si porta medialmente tra il margine postero-mediale della tiroide, la trachea e l’esofago, da il
ramo per la paratiroide inferiore, gira spesso dietro il nervo ricorrente e termina come arteria
laringea posteriore.
Il peduncolo laterale è costituito dalla vena media che si getta nella vena giugulare interna
Il peduncolo mediano è dato dalle vene di Tillaux e dalla arteria ima situate sul margine inferiore
dell’istmo.
Il nervo laringeo inferiore o ricorrente a sinistra circonda l’arco dell’aorta, risale verso la regione
cervicale nell’angolo fra esofago e trachea, incontra i rami dell’arteria tiroidea inferiore, passando
nella maggior parte dei casi tra i rami dell’arteria, oppure posteriormente al tronco principale,
eccezionalmente è anteriore ad esso a ai suoi rami. Dopo un breve tragitto penetra nel laringe
passando tra le fibre del muscolo costrittore inferiore a livello del corno inferiore della cartilagine
tiroidea.
A destra il ricorrente passa al disotto dell’arteria succlavia dirigendosi verso l’alto accostandosi alla
trachea solo prima di incontrare i rami di divisione dell’arteria tiroidea inferiore. Di qui sino al
laringe il decorso è analogo di quello di sinistra.
Le paratiroidi sono normalmente 4, 2 superiori, destra e sinistra e 2 inferiori pure destra e sinistra,
situate approssimativamente le superiori in un cerchio di 2,5 cm circa di diametro al di sopra del
punto di ingresso nella tiroide dei rami terminali dell’arteria tiroidea inferiore, sulla faccia
posteriore del lobo superiore, all’altezza della cartilagine cricoidea ed in prossimità dell’ingresso
del nervo laringeo inferiore nella cricoide. Le paratiroidi inferiori sono più incostanti. Hanno una
sede più laterale che posteriore in stretta connessione con l’arteria tiroidea inferiore e il nervo
ricorrente. Hanno forma discoidale o ellittica od ovoidale. Hanno una consistenza minore della
ghiandola tiroidea e colore più carico di quello della tiroide. Sono avvolte ciascuna da una capsula
fibrosa propria.
Linfatici La tiroide dal punto di vista del drenaggio linfatico drena la sua linfa in tutti i linfonodi del
collo.
Si distinguono i linfonodi delle catene giugulari che vengono classificati in superiori che sono
situati all’altezza del tronco venoso tireo-linguofacciale, medi che sono quelli situati a livello delle
vene tiroidee medie, latero-inferiori che sono presenti tra l’apice inferiore del lobo tiroideo e la
confluenza delle vene giugulare e succlavia . Altro linfonodo è quello denominato “delfico” situato
tra i muscoli cricofaringei al di sopra dell’istmo che a volte diviene palpabile ed è segno di tumore
tiroideo. Infine estono i linfonodi della catena ricorrenziale, situati lungo i ricorrenti tra la trachea e
l’esofago. Questi si continuano nel mediastino con la catena paratracheale.
Fisiopatologia della tiroide
La ghiandola tiroidea svolge un ruolo importante nel metabolismo dell’intero organismo essendo
preposta alla sintesi, immagazzinamento e secrezione degli ormoni tiroidei, necessari ed
indispensabili proprio al normale metabolismo e sono fondamentali nella stimolazione della crescita
del bambino. Gli ormoni tiroidei aumentano la risposta da parte dei tessuti alle catecolamine. La
sintesi degli ormoni consiste nella captazione dello iodio inorganico da parte della cellula tiroidea.
Questo viene assorbito nel tubo gastroenterico e trasportato nel sangue sotto forma di ioduro che
viene captato dalle ghiandole salivari e dalle cellule follicolari tiroidee mediante una specifica
proteina chiamata trasportatore dello ioduro. L’intrappolamento dello ioduro nelle cellule tiroidee
viene favorito dall’ormone tireotropo secreto dalla ipofisi e viene invece inibito da alcuni farmaci
come il perclorato od il tiocianato. Lo ioduro viene ossidato ad iodio da un enzima ossidante.
Questa ossidazione viene inibita dal tiouracile e dai derivati imidazolici. Lo iodio ossidato viene
utilizzato per la iodizzazione della tirosina a mono-iodotirosina e a di-iodotirosina.
I derivati sulfamidici inibiscono la ionizzazione della tiroxina. Nella tiroide è presente un enzima
deiodinasi che è capace di deiodizzare la mono e la diioditirosina ma non la tiroxina o la
triiodotironina. Lo iodio rimosso così dalle molecole di tiroxina è di nuovo libero nel sangue ,
pronto per una riutilizzazione da parte della tiroide. La iodizzazione della tirosina porta alla sintesi
della L-tiroxina (T4) e della tri-iodioL-tironina (T3). La tiroxina si forma per l’accoppiamento di 2
molecole di di-iodotirosina, la triiodio-tironina si forma per l’unione di una molecola di monoiodotirosina con una di di-iodotirosina. Il rapporto tra T4 e T3 nella tiroide umana è di 4 a 1.
Gli ormoni tiroidei vengono immagazzinati nella tiroide come una parte di una grande molecola di
peso molecolare di 650.000 detta tireoglobulina . Questa molecola è troppo grande per potere
attraversare la parete cellulare del follicolo tiroideo per cui esistono degli enzimi proteolitici che
vengono attivati dall’ormone tireotropo (TSH) secreto dall’ipofisi, che mettono in circolo gli
ormoni tiroidei. Questa azione è inibita dalla presenza di grandi quantità di iodio nel sangue. Oltre
al TSH esiste un altro ormone prodotto dall’ipotalamo detto TRH che agisce sulla tiroide in quanto
controlla il TSH. Gli ormoni tiroidei vengono trasportati dal sangue nei tessuti periferici ad opera di
proteine seriche che legano la tiroxina (globulina alfa 1 e alfa2 legante la tiroxina TBG, la T3
viaggia in notevole quantità nell’albumina). La tireoglobulina è presente nel sangue in seguito ad un
danno delle cellule tiroidee a causa di una infiammazione acuta o a tiroidite , carcinoma tiroideo o
dopo irradiazione della tiroide. Gli ormoni tiroidei a livello dei tessuti esercitano le loro azioni
metaboliche che sono fondamentalmente caloriche con aumento del metabolismo basale. Sia la T3
che la T4 vengono metabolizzate dal rene e dal fegato in acido piruvico ed acido acetico e in ioduro.
Gli ormoni tiroidei vengono concentrati e coniugati nel fegato con l’acido glicuronico, escreti con la
bile, idrolizzati nell’intestino tenue e riassorbiti.
La funzione e la crescita della cellula tiroidea dipendono dal TSH e dalla disponibilità dello iodio
Il TSH trasmette alla cellula tiroidea il segnale tramite il TSHr che è un recettore situato sulla
superficie cellulare. La trasmissione del segnale avviene mediante due proteine: la proteina Gs che
stimola la crescita e la funzione dei tireociti, la proteina Gq che stimola il processo di iodizzazione e
secrezione degli ormoni tiroidei.
Modalità di presentazione della patologia tiroidea
nodulo unico;
noduli multipli: es. gozzo multinodulare;
aumento diffuso di un lobo;
aumento diffuso di tutta la tiroide: es. M. di Basedow.
Approccio diagnostico/terapeutico
Anamnesi: familiarità, precedente esposizione a radiazioni, epoca di comparsa, modalità di
crescita, sintomi soggettivi, età, sesso;
E/O: nodulo solitario o aumento diffuso? Consistenza, mobilità, presenza di adenopatie satelliti.
Se si palpa un nodulo tiroideo:
1. Eseguire un’ecografia: è un’indagine morfologica che permette la valutazione di sede, numero,
dimensioni, forma, rapporto con i tessuti ed ecostruttura (solida o cistica) del nodulo. Con il
color doppler si distinguono noduli ipo o ipervascolarizzati: questi ultimi tipicamente sono o
nodi iperproducenti ormone (“nodi caldi”) oppure neoplasie;
2. Eseguire un agoaspirato: indagine che consiste nell’inserzione di un ago nel parenchima tiroideo
e nel prelievo di cellule per un successivo esame citologico. E’ un’indagine molto attendibile
(ottimo il VPP, buono il VPN). Il limite principale è, non essendo essa un’indagine istologica, di
non poter discriminare tra adenoma o carcinoma follicolare perché la differenza tra i due risiede
nell’esistenza di infiltrazione della capsula del nodulo o dei vasi;
3. Anche la scintigrafia tiroidea è un’indagine che può essere utile per distinguere tra nodi iper e
ipocaptanti (detti comunemente nodi caldi e freddi). Non sempre i nodi freddi sono neoplasie:
spesso anzi sono benigni. Tuttavia i nodi ipercaptanti non sono mai maligni.
Se si decide di operare la preparazione preoperatoria prevede:
valutazione ORL: studia i rapporti anatomici con i nervi laringei;
valutazione cardiologica: soprattutto se si riscontra ipertiroidismo è utile somministrare βbloccanti per ridurre l’ipertono simpatico indotto dagli ormoni tiroidei.
I farmaci più comunemente utilizzati nel trattamento preoperatorio sono:
iodio: a dosaggio crescente riduce la vascolarizzazione e conseguentemente la funzione tiroidea;
Tionamidi: riducono la funzione tiroidea bloccando l’organizzazione dello iodio captato dalle
cellule tiroidee;
β-bloccanti.
Interventi praticati:
Nodulo singolo benigno ipofunzionante o iperfunzionante (adenoma di Plumberg):
loboistmectomia. Non si asporta solo il singolo nodo perché la patologia recidiverebbe;
Gozzo multinodulare eutiroideo o tossico o gozzo tossico diffuso (m. di Basedow):
tiroidectomia totale.
Gozzo endotoracico
Rappresenta meno del 10% di tutti i gozzi. Possono essere cervico-mediastinici o mediastinici puri
(evenienza rara, causata da ectopia o a migrazione di un piccolo residuo operatorio).
Un gozzo endotoracico pone problemi di diagnosi differenziale che si risolvono con la TAC collomediastino. Va da sé che nel gozzo l’ecografia non basti.
Quandro clinico:
segni compressivi: della trachea, dell’esofago, di vasi venosi (giugulare o cava). I segni sono
rispettivamente dispnea, disfagia e stasi venosa con classico turgore giugulare;
turbe endocrine se il gozzo è tossico.
Un gozzo cervico-mediastinico tende a migrare per gravità soprattutto a destra perché c’è più spazio
mentre a sinistra c’è l’arco aortico. Quindi un gozzo di questo tipo si palesa per gravità soprattutto a
destra.
Trattamento: tiroidectomia totale.
Vie di approccio:
- cervicale: cervicotomia e asportazione gozzo dall’alto;
- sternotomia se la prima non è sufficiente. Si pratica in meno del 10% dei casi.
Tumori della tiroide
I tumori della tiroide rappresentano la più frequente patologia endocrino-chirurgica.
Possono essere:
benigni: adenoma:
maligni:
carcinoma papillare (80%)
carcinoma follicolare (15%)
carcinoma midollare (5-6%), origina dalle cellule C.
carcinoma indifferenziato (3-4%). E’ forse il tumore più aggressivo che esiste in natura.
Fattori prognostici:
istotipo;
sesso: nella donna la prognosi è migliore;
età: è stato stabilito un cut-off intorno ai 40 anni. Se il tumore appare prima la prognosi è
migliore;
estensione della lesione o stadiazione. Maggiore è lo stadio, peggiore è la diagnosi.
Il TNM per la tiroide comporta una piccola variante: cambia a seconda dell’età.
Sotto i 40 anni, esistono solo gli stadi I e II:
I: M0;
II: M1.
Sopra i 40 anni:
I: T1, N0, M0;
II: T2/3, N0, M0;
III: T4 e N0 oppure N1 con ogni T;
IV: M1
La sopravvivenza a dieci anni varia da circa 100% per il primo stadio a quasi lo 0% per lo stadio
IV. I carcinomi midollari non seguono questa stadiazione così come i carcinomi indifferenziati che
sono considerati tutti in stadio IV dal momento che crescono di settimana in settimana e sono
praticamente inoperabili perché infiltrano le strutture circostanti e comunque recidivano tantissimo.
Trattamento
Il trattamento è chirurgico e radioterapico.
Il tipo di tiroidectomia che deve essere fatta è un argomento molto dibattuto. In linea di principio la
tiroidectomia totale sarebbe indicata per tutte le neoplasie perché il tumore potrebbe essere
multifocale, potrebbe essersi diffuso e perché una rimozione totale del parenchima tiroideo permette
l’esecuzione di terapie aggiuntive. Tuttavia ciò obbliga il paziente ad assumere a vita ormoni
tiroidei. Per questo motivo alcune scuole per tumori a basso rischio (donne < 40 anni, stadio I)
praticano la loboistectomia. I risultati sono buoni ma in Italia si è deciso di non seguire tale via per
evitare al paziente lo stress del follow up e la comparsa di un eventuale altro nodulo.
La tiroidectomia può al bisogno essere allargata a strutture circostanti.
Linfonodi
I tumori della tiroide metastatizzano sia per via ematica che linfonodale. I linfonodi interessati sono
quelli del compartimento centrale (tra le due carotidi): sovra e sotto istmici, paratracheali,
mediastinici superiori e recurrenziali (seguono i nervi laringei ricorrenti). Anche i linfonodi
laterocervicali possono essere interessati.
La linfectomia di solito è conservativa, cioè ridotta al necessario.
Opoterapia post-operatoria
Se dopo l’intervento di tiroidectomia totale si somministra tiroxina a dosaggi tali da determinare
inibizione del TSH ipofisario si riesce a bloccare l’accrescimento di eventuali metastasi perché i
tumori conservano il recettore per il TSH.
Dosaggi sostitutivi: 100-125 mg/die. Dosaggi soppressivi: 150-200 mg/die.
Radioterapia
Se si asporta tutta la tiroide è possibile effettuare radio-iodoterapia. Le metastasi eventualmente
presenti captano lo iodio radioattivo rimandendone distrutte. Radioterapia esterna si effettua per
quei tumori che non captano lo iodio (ca. midollare o indifferenziato). Risulta molto deludente ma
spesso è l’unica chance.
Le varie tipologie di tumori tiroidei
Carcinoma papillare
E’ il più frequente. Colpisce soprattutto persone di sesso femminile (rapporto 3,5:1) di età compresa
tra i 25 e i 45 anni. A volte può essere bilaterale e diffonde prevalentemente per via linfatica prima
nei linfonodi, poi nei polmoni e tardivamente alle ossa.
Macroscopicamente si presenta come nodulo unico, privo di capsula e invasivo.
Microscopicamente si notano escrescienze papillari neoplastiche con asse fibro-vascolare.
La diagnosi citologica è facile perché il nucleo ha un aspetto a “vetro smerigliato”.
La prognosi dipende dalla stadiazione ma in generale è buona.
Carcinoma follicolare
Come il precendente origina dalle cellule dei follicoli. E’ più raro e compare di solito in età più
tarda. Colpisce maggiormente le donne ma con un rapporto inferiore al caso precedente (1,5:1).
Diffonde soprattutto per via ematica sempre nei polmoni e nelle ossa.
Aspetto macroscopico: nodulo unico che mostra invasione capsulare e vascolare.
Aspetto microscopico: follicoli piccoli capsulati e ben differenziati con cellule follicolari non
dissimili dalle normali, a cordoni o a strie pianeggianti.
Esso è un cancro perché è infiltrante, altrimenti è definito adenoma. Non è possibile distinguere
citologicamente tra i due casi.
La stadiazione è la stessa di quella che si effettua per i carcinomi papillari ma la sopravvivenza è
leggermente inferiore.
Carcinoma indifferenziato
E’ raro (> 1%) perché da quando si operano le tiroidi si impedisce ai piccoli focolai di cancro
anaplastico che possono originare a partire da cloni di neoplasie benigne di progredire.
La prognosi è assolutamente infausta (morte entro sei mesi).
Carcinoma midollare
Origina dalle cellule parafollicolari. Ne esistono due varianti:
sporadica: colpisce soggetti più anziani;
ereditaria: colpisce soggetti più giovani. E’ dovuta all’alterazione del proto-oncogene RET. E’
bilaterale.
Il carcinoma midollare può essere uno dei tumori che si sviluppano nei pazienti affetti da MEN:
MEN2A: carcinomi midollari (100% dei casi), feocromocitoma (20-60%) iperparatiroidismo
(10%);
MEN 2B: carcinoma midollare (100% dei casi, può essere presente già alla nascita con prognosi
peggiore che nel caso precendente), feocromocitoma, ganglioneuromi intestinali….
Siccome nel 100% delle mutazioni insorge il cancro si può fare profilassi. Nel caso di patologie
MEN è importante che la diagnosi precoce sia effettuata entro i 6-10 anni nel MEN2A,
possibilmente entro i 6 mesi (con tutte le difficoltà che ciò comporta) nel MEN2B.
Diagnosi di carcinoma midollare:
forme ereditarie: mutazione proto oncogene RET;
forme sporadiche: ipersecrezione di calcitonina fino a 50 volte il normale anche per piccoli
tumori. La diagnosi è facile ed ha specificità e sensibilità praticamente del 100%. E’ possibile
inoltre effettuare test di stimolo con somministrazione di Pentagastrina: se vi è una neoplasia la
secrezione di calcitonina aumenta in maniera tipica.
Il trattamento prevede tiroidectomia totale. La prognosi è intermedia: la sopravvivenza a 10 anni è
circa del 50%.
Terapia chirurgica
Nella patologia benigna della tiroide il tipo di atteggiamento chirurgico negli ultimi anni si è
modificato perché si è imposta una maggiore razionalizzazione dell’exeresi chirurgica. Per
considerazioni fisiopatologiche, oncologiche e chirurgiche sempre più nei vari centri che si
interessano di questa patologia, si praticano interventi di totale asportazione della ghiandola,
abbandonando gli interventi di enucleoresezione, lobectomia parziale o subtotale. Questo fatto ha
comportato una diminuzione delle percentuali dei reinterventi causati dalle recidive, facendo così
diminuire il rischio di danno ricorrenziale o paratiroideo con scoperta di tumori occulti. La
tiroidectomia totale è pertanto divenuta l’opzione chirurgica più praticata anche nel trattamento
delle patologie benigne quale il gozzo multinodulare, il morbo di Graves, le tiroiditi. Le motivazioni
dell’opzione per tale tecnica sono ben conosciute:
La gestione ormonale sostitutiva del tiroidectomizzato totale risulta più agevole rispetto a
quella del paziente con residuo tiroideo.
Il residuo tiroideo può andare incontro facilmente ad involuzione tiroiditica o a ripresa di
malattia, vanificando l’economia chirurgica, o a degenerazione neoplastica.
La totalizzazione chirurgica, dopo l’insuccesso di un provvedimento parziale bilaterale
presenta rischio di complicazioni ricorrenziali e paratiroidee maggiore di quello legato allo
stesso provvedimento in prima istanza.
Malattie Maligne di interesse chirurgico
Tumori della tiroide
Vengono classificati in base alla loro origine tessutale in:
Carcinoma differenziato papillare: è il più frequente (70% circa) di tutti i tumori della
tiroide. Interessa l’età giovanile al di sotto dei 40 anni. E’ meno aggressivo, da raramente
metastasi a distanza. Si presenta come un nodulo duro ben circoscritto con coinvolgimento
dei linfonodi regionali. Ha un grado molto basso di funzionalità , misurata dalla sua capacità
di concentrare lo iodio radioattivo.
Carcinoma differenziato follicolare : E’ un tumore più aggressivo del precedente, meno
frequente rappresentando il 12-15% di tutte le neoplasie tiroidee. Da metastasi spesso e
precocemente ai linfonodi regionali. In seguito può metastatizzare nei polmoni con
diffusione di tipo miliare e alle ossa. Questo tipo di tumore concentra lo iodio radioattivo.
Questa caratteristica consente una cura efficace delle metastasi dopo la rimozione del
tumore primitivo mediante la tiroidectomia totale.
Carcinoma midollare: E’ una neoplasia che deriva dalle cellule parafollicolari della tiroide
che producono calcitonina: Colpisce i soggetti al disopra dei 50 anni. Può associarsi ad altri
tumori dell’apparato endocrino. E’ caratterizzato dalla presenza di un nodulo fisso ma non
capsulato. Da metastasi ai linfonodi regionali e a distanza. La secrezione della calcitonina
favorisce il riconoscimento diagnostico con il suo dosaggio.
Tumore anaplastico o indifferenziato : E’ un tumore altamente maligno, rappresenta il 510% di tutti i tumori tiroidei. Interessa generalmente le persone anziane. E’ caratterizzato da
un ingrossamento rapido e doloroso della tiroide: Questo tumore non mostra segni di
funzionalità ormonale: E’ una neoplasia solida con cellule fusate e grosse cellule giganti. La
sua rapida crescita è locale con invasione delle strutture circostanti alla tiroide specie alla
trachea.
Terapia chirurgica
La chirurgia per le neoplasie della tiroide svolge un ruolo fondamentale. Come per le malattie
benigne, a maggior ragione per i tumori della tiroide, la tiroidectomia totale appare a tutt’oggi il
trattamento più appropriato. Questa metodica evita il temibile problema di recidive o malattia
residua, consente maneggevole opoterapia sostitutiva. Le complicanze maggiori di questa procedura
(ipoparatiroidismo e lesioni ricorrenziali) sono legate più alla tecnica che all’estensione dell’exeresi.
La buona conoscenza dell’anatomia della regione del collo permette di identificare e preservare le
paratiroidi e di identificare il ricorrente. La lesione del ricorrente può essere prevenuta solo con
l’identificazione e isolamento del nervo nel tratto in cui decorre a stretto contatto con il parenchima
tiroideo, di pari passo con le manovre di identificazione e conservazione delle paratiroidi. E’
indispensabile conservare l’integrità della guaina peritiroidea, tesa fra il fascio vasculo-nervoso e la
tiroide onde conservare l’irrorazione delle paratiroidi. Una corretta tecnica chirurgica evita le
complicanze maggiori di questa tipo di chirurgia. Gli atteggiamenti e i comportamenti tecnici
adeguati sono:
necessità di avere un campo completamente esangue
riconoscimento del ricorrente nei punti superiore e medio
identificazione del rapporto tra il nervo e uno dei rami terminali dell’arteria tiroidea
inferiore che costantemente lo accompagna in prossimità della sua penetrazione nel laringe
diffidare dal dare per scontato che il percorso del nervo ricorrente segua una linea retta.
Spesso descrive un’ansa preterminale che si sovrappone alla tiroide.
praticare legature arteriose solo sui rami di divisione delle arterie (ultralegature), in
prossimità del parenchima.
reimpiantare paratiroidi mal vascolarizzate.
In conclusione una corretta tecnica chirurgica evita le complicanze maggiori di questa tipo di
chirurgia. La tiroidectomia totale nel trattamento della patologia benigna e maligna della tiroide
evita i reinterventi per recidiva che sono gravati da una alta percentuale di complicanze maggiori, o
reinterventi per carcinomi occulti diagnosticati con l’esame istologico definitivo. Infine l’opoterapia
dopo tiroidectomia totale è maneggevole e consente situazioni ormonali pressoché fisiologiche.
Chirurgia delle paratiroidi
Le paratiroidi sono ghiandole situate nel collo, posteriormente alla tiroide. Generalmente in
numero di quattro (due superiori e due inferiori) sono costituite da due tipi di cellule: le
principali e le eosinofile (così definite perchè contenenti granuli citoplasmatici che si colorano
con l’eosina, un colorante acido).
Esse secernono il paratormone (PTH) ossia l’ormone che regola il metabolismo del calcio e
del fosforo, controllando, di concerto con la forma attiva della vitamina D
(1,25diidrossivitamina D3), l’equilibrio fosfo-calcico.
La funzione del PTH è di elevare la concentrazione plasmatica di calcio e di diminuire quella
del fosforo. La secrezione del PTH da parte delle paratiroidi è regolata direttamente dalla
concentrazione plasmatica di calcio: l’aumento della calcemia provoca una riduzione della
secrezione e deposizione di calcio nelle ossa; la diminuzione della calcemia, al contrario,
determina un incremento della sua secrezione e, di conseguenza, del riassorbimento di calcio
dalle ossa.
Il PTH esplica la sua azione principalmente su tre organi: osso, rene e intestino.
Nell’osso stimola il rilascio di calcio e di fosforo, nel tubulo renale stimola il riassorbimento
di calcio e inibisce quello del fosforo (azione fosfaturica). L’azione del PTH ha sull’intestino è
indiretta: l’ormone stimola direttamente il tubulo prossimale renale a produrre la forma attiva
della vitamina D, attivando l’enzima 1-α-idrossilasi. L’aumentata sintesi di
1,25diidrossicalciferolo a sua volta si traduce in un incremento dell’assorbimento intestinale
di calcio e del riassorbimento osseo; ne deriva un ulteriore incremento del carico di calcio
filtrato dal rene ed una minor ritenzione renale del fosforo.
In definitiva le azioni del PTH si traducono in un aumento della concentrazione sierica del
calcio e una diminuzione di quella del fosforo.
Le azioni integrate del PTH a livello tubulare ed osseo (azioni dirette) e intestinale (azione
indiretta, mediata dal 1,25diidrossicalciferolo) realizzano così una fine regolazione della
concentrazione sierica del calcio. D’altra parte, la secrezione del PTH è a sua volta
continuamente regolata dai livelli di calcio sierico, che rappresenta il più importante
regolatore fisiologico della sua secrezione. Come sopra indicato, l’incremento della
concentrazione del calcio sierico diminuisce la secrezione del PTH, mentre la sua
diminuizione ne incrementa la secrezione.
Paratiroidi e malattie correlate
Iperparatiroidismo
E’ una condizione caratterizzata da un’aumentata secrezione di paratormone da parte di una o
di tutte le paratiroidi.
Si definisce iperparatiroidismo primitivo la condizione in cui l’aumentata secrezione di
paratormone è dovuta ad un aumento e/o iperfunzione del tessuto paratiroideo, ed
iperparatiroidismo secondario, quella in cui una carenza di vitamina D (ad es. osteomalacia) o
l’insufficienza renale sono responsabili dell’incremento del PTH.
Nell’ipovitaminosi D il paratormone viene fisiologicamente secreto in eccesso per sopperire
alla carenza di calcio nell’organismo. Nell’insufficienza renale, invece, l’incremento del PTH
ha una patogenesi multifattoriale, legata alla diminuita sintesi di 1,25(OH)2vitamina D3 che
consegue alla ridotta massa renale e all’incremento del fosforo sierico (causato dalla
diminuzione della sua escrezione renale). La riduzione delle concentrazioni di calcio sierico
che consegue al diminuito assorbimento intestinale contribuisce all’incremento di secrezione
del PTH. Infine, anche gli aumentati livelli di fosforo incrementano direttamente la secrezione
del PTH.
Nell’insufficienza renale cronica quindi le paratiroidi vengono continuamente stimolate a
produrre PTH e questo può portare ad ipertrofia delle ghiandole e, talora, comparsa di
ipercalcemia, il che configura il quadro dell’iperparatiroidismo terziario.
Iperparatiroidismo primitivo
L’iperparatiroidismo primitivo è la più comune malattia delle paratiroidi, caratterizzata da una
secrezione dell’ormone PTH in eccesso rispetto alle richieste omeostatiche del calcio, con
conseguente ipercalcemia.
E’ causato più frequentemente (80-85%) da un adenoma singolo di una delle quattro
ghiandole paratiroidee, più spesso quelle inferiori. Nella maggioranza dei casi si tratta di
forme sporadiche. Nei restanti casi la malattia è sostenuta dall’iperplasia di tutti gli elementi
ghiandolari, come accade nelle neoplasie endocrine multiple (MEN I e MEN II), in cui si
associa il coinvolgimento di altre ghiandole endocrine quali pancreas, tiroide e surrene. Meno
del 2% dei casi è invece sostenuto da un carcinoma delle paratiroidi.
La diagnosi di iperparatiroidismo primitivo è diventata negli ultimi anni sempre più frequente,
grazie all’introduzione del dosaggio della calcemia nella routine emato-chimica ospedaliera.
Attualmente l’iperparatiroidismo primitivo viene riscontrato sempre più frequentemente in
soggetti asintomatici, che non presentano i segni clinici della malattia, in seguito al riscontro
casuale di ipercalcemia, ossia di valori di calcio superiori a 10,4 mg/dl. La presenza di valori
elevati di PTH sierico e di ipofosforemia completano il quadro biochimico. Sebbene il PTH
incrementi il riassorbimento tubulare di calcio, i pazienti con iperparatiroidismo sono spesso
ipercalciurici, ossia hanno un'elevata eliminazione urinaria di calcio. Questo apparente
paradosso è legato al fatto che l’ ipercalcemia determina un incremento del carico di calcio
filtrato dal rene e quindi della sua escrezione urinaria, nonostante il maggior riassorbimento
tubulare.
La forma sintomatica della malattia, la cui incidenza è oggi drasticamente calata, è
caratterizzata dalla classica sintomatologia scheletrica e renale. Il quadro clinico si manifesta
con osteoporosi, ossia una riduzione della densità minerale ossea, soprattutto nei siti
scheletrici in cui prevale il tessuto corticale, nonché aumentato rischio di fratture vertebrali,
nefrocalcinosi, ossia una calcificazione diffusa del parenchima renale, specie delle piramidi
(oggi meno frequente) e litiasi renale; quest’ultimo è il dato clinico più frequente nei pazienti
sintomatici, in cui l’eccessiva eliminazione urinaria di calcio rappresenta uno dei fattore
responsabili della formazione dei calcoli.
Altre manifestazioni cliniche correlate all’ipercalcemia, riscontrate in un terzo circa dei
pazienti, sono di ordine neuro-psicologico (intensa astenia, sonnolenza, incapacità a
concentrarsi, ansia, depressione), gastro-intestinale (ulcera peptica, dispepsia), cardiovascolare (ipertensione arteriosa) e neuro-muscolare (mialgie).
Il tessuto ghiandolare paratiroideo iperfunzionante viene localizzato mediante diverse
tecniche: ecografia del collo, metodica di primo livello; scintigrafia MIBI delle paratiroidi
(uso del doppio contrasto, Tecnezio 99 per il tessuto ghiandolare e sestamibi per quello
paratiroideo, con sottrazione di immagini); RMN del collo. Queste ultime due tecniche sono
utili soprattutto qualora le paratiroidi siano ectopiche o localizzate in regione mediastinica.
La terapia dell’IPP è essenzialmente chirurgica (paratiroidectomia classica o mini-invasiva) e
consiste nell’asportazione della ghiandola iperfunzionante. L’intervento è indicato in tutti i
pazienti che presentino una complicanza della malattia, come la calcolosi renale, ovvero segni
radiologici di severa compromissione scheletrica, quale osteoporosi con presenza o meno di
fratture, ovvero ipercalciuria, ossia un aumento della calciuria superiore a 400 mg/die. In tali
pazienti l’intervento chirurgico consente un recupero della densità minerale ossea e una
riduzione di oltre il 90% della frequenza della formazione di nuovi calcoli, rispetto ai pazienti
non operati. Più discussa è l’indicazione chirurgica nei pazienti con la forma lieve o
asintomatica della malattia, che è attualmente quella più comune.
Ipoparatiroidismo
Mentre una eccessiva funzione del tessuto paratiroideo causa iperparatiroidismo, la sua ridotta
funzione determina un quadro di deficit ormonale, noto come ipoparatiroidismo. La forma più
frequente è di certo l'ipoparatiroidismo secondario a chirurgia del collo (tiroidectomia e
paratiroidectomia), che può comportare l’ablazione o la devascolarizzazione delle ghiandole
paratiroidee. Di grande interesse clinico è anche il meno comune ipoparatiroidismo primitivo,
il cui riconoscimento è importante soprattutto nei primi anni di vita.
Attualmente si conoscono diverse sindromi ipoparatiroidee primitive:
da deficienza di secrezione di PTH: ipoparatiroidismo post-chirurgico; ipoparatiroidismo
idiopatico ( congenito e acquisito); da ipomagnesemia.
Da secrezione di PTH
biologicamente inattivo.
Da resistenza al PTH (pseudoipoparatiroidismi)
Ipoparatiroidismo primitivo
Nell' ipoparatiroidismo primitivo l'ipocalcemia e l'iperfosfatemia, in presenza di una normale
funzione renale, sono il risultato di un deficit della secrezione di PTH.
L'ipoparatiroidismo idiopatico isolato insorge in genere con carattere sporadico fra i 3 e i 12
anni, sebbene possa essere evidenziato anche in età adulta e siano state descritte in letteratura
anche forme familiari. Nell'ipoparatiroidismo familiare isolato l'età di insorgenza è fra 1 mese
e 30 anni e la diagnosi è generalmente posta in età infantile. Si tratta di una forma rara,
ereditata con carattere autosomico dominante, recessivo o legato al cromosoma X. In questi
pazienti è sempre presente ipercalciuria.
Esistono, inoltre, forme congenite, come la Sindrome di Di George, in cui l'assenza delle
paratiroidi si associa a quella del timo, con alterazione dell'immunità cellulo-mediata e
frequenti infezioni virali in età infantile. Questi pazienti hanno una facies tipica, con
alterazioni auricolari (abbassamento dell'inserzione dell'orecchio) e degli occhi (taglio verso il
basso), ipertelorismo e micrognatia. Molti casi sono sporadici, anche se vi sono forme
familiari.
Le forme familiari di ipoparatiroidismo possono presentarsi come parte di un disordine
multighiandolare complesso (come la sindrome poli-ghiandolare autoimmune) o in
associazione a difetti quali, sordità, nefropatia e linfedema. Questi ultimi quadri sindromici
sono esemplificati da patologie non ancora ben conosciute, come la Sindrome di Barket
(linfedema, alterazioni del nervo acustico, prolasso mitralico, brachidattilia e nefropatia) e la
Sindrome di Kenney Caffey (bassa statura, osteosclerosi, calcificazione dei nuclei della base e
difetti oftalmici).
La Sindrome polighiandolare autoimmune di tipo I (PGA I) è la più nota tra le forme di
ipoparatiroidismo legato a malattie autoimmuni. Può essere sporadica o familiare, trasmessa
con carattere autosomico recessivo. Classicamente si presenta con la triade rappresentata da
ipoparatiroidismo, insufficienza surrenalica e alterazioni muco-cutanee (candidiasi), sebbene
non sempre i soggetti esprimano il quadro clinico completo. Generalmente la diagnosi è
effettuata in età infantile anche se in alcuni casi la malattia si può manifestare dopo i 10 anni
di età. Generalmente le manifestazioni cliniche iniziano con le alterazioni muco-cutanee (in
genere verso i 5 anni), seguite da ipoparatiroidismo (verso i 9 anni) ed infine insufficienza
surrenalica (verso i 14 anni). Anticorpi anti-paratiroide, anti-tiroide e anti-surrene sono
frequentemente riscontrabili in tali soggetti.
Pseudoipoparatiroidismi
Alle sindromi ipocalcemiche si ascrivono anche i quadri di pseudoipoparatiroidismo, ossia
condizioni cliniche eterogenee caratterizzate da ipocalcemia e iperfosforemia (analogamente a
quanto si rileva nell'ipoparatiroidismo primitivo), nonostante siano presenti elevati livelli
circolanti di PTH.
Se ne conoscono due forme:
la Sindrome di Albright o pseudoipoparatiroidismo di tipo 1 che si configura clinicamente per
una resistenza ormonale multipla con ipotiroidismo, ipogonadismo, ritardo mentale e difetti
olfattivi. I pazienti presentano facies tonda, bassa statura, obesità, brachidattilia (brevità
metacarpale e metatarsale), ossificazioni sottocutanee eterotopiche (osteoma cutis) ed esostosi
(osteodistrofia di Albright).
Lo pseudoipoparatiroidismo di tipo 2 che insorge con un quadro di resistenza renale al PTH e
deficit di sintesi di 1,25 (OH)2D3 a livello renale.
La diagnosi è clinica e laboratoristica. Per la diagnosi differenziale fra le varie forme di
ipocalcemia è importante eseguire un'accurata anamnesi ed un accurato esame obiettivo del
paziente. Il quadro di ipoparatiroidismo è spesso associato ad una storia familiare per tale
patologia o alla presenza di disordini endocrini che non accompagnano tale quadro. Un test
molto importante nella diagnosi definitiva di pseudoipoparatiroidismo è quello di infusione
e.v. di PTH, la cui somministrazione determina una riduzione della fosfaturia anziché un suo
incremento.
Come si cura?
Di fronte ad un paziente con livelli di calcio ionizzato sotto la norma (inferiori a 1,12 mmol/l)
è necessario intervenire prontamente. Il trattamento delle forme gravi di ipocalcemia con crisi
ipocalcemiche (tetania grave, laringospasmo o convulsioni) viene effettuato con la
somministrazione di calcio gluconato per via endovenosa. Il trattamento cronico
dell'ipoparatiroidismo consiste invece nella somministrazione orale di calcio e di vitamina D.
In questi pazienti la concentrazione di calcio deve essere mantenuta fra 8 e 9 mg/dl. Tale
concentrazione è sufficiente per prevenire le manifestazioni ipocalcemiche (parestesie alle
mani, ai piedi e periorale), senza tuttavia indurre ipercalciuria e formazione di calcoli renali.
La forma di vitamina D generalmente utilizzata è il calcitriolo, forma attiva ma con breve
emivita.
Chirurgia del surrene
La chirurgia del surrene si rivolge a:
patologie iperfunzionanti: rappresentano la gran parte delle patologie surrenaliche che giungono
all’osservazione;
patologie non funzionanti (incidentalomi): questo tipo di patologia esiste solamente da quando
le tecniche di imaging hanno raggiunto un grado di accuratezza sufficiente.
Le sindromi cliniche che si associano ad iperfunzione sono:
corticale:
o sindrome o malattia di Cushing (ipercortisolismo);
o sindrome di Conn (iperaldosteronismo primitivo);
o sindrome adrenogenitale, rara (iperandrosteroidismo).
midollare: feocromocitoma.
Incidentalomi
Gli incidentalomi sono piccoli adenomi scoperti occasionalmente oppure perché provocano sintomi
da compressione o perché danno metastasi a distanza. Queste masse possono essere assolutamente
silenti dal punto di vista endocrino oppure secernere piccole quantità di ormoni e essere perciò
precursori di adenomi secernenti.
In presenza di incidentalomi surrenalici le indicazioni all’intervento chirurgico sono:
- presenza di disturbi compressivi legati alla massa;
- età del paziente inferiore ai 50 anni perché l’aspettativa di vita è superiore e c’è più tempo
perché queste masse possano evolvere verso una patologia maligna;
- dimensioni della massa: quando sono piccoli raramente sono carcinomi. I noduli > 4 cm vanno
sempre operati, per gli altri si consigliava il follow-up. In realtà oggi il criterio ha assunto
un’importanza secondaria dal momento che anche i noduli < 4 cm sono carcinomi in una
percentuale non trascurabile di casi;
- caratteristiche morfologiche: TAC e RM aiutano a capire se la massa è verosimilmente benigna
o maligna. Si tenga in considerazione che TAC e RM tendono a sottostimare di circa il 20% le
dimensioni della massa;
- scintigrafia: in presenza di carcinomi la scintigrafia evidenzia ipocaptazione;
- agoaspirato sotto guida TC: si esegue solo limitatamente ad alcune situazioni. Poiché la diagnosi
di carcinoma surrenalico si basa sull’invasione capsulare, analogamente a quanto detto per il
nodo follicolare tiroideo, non è possibile fare diagnosi citologica (a volte nemmeno sul pezzo
operatorio). Tuttavia quando vi sono notizie anamnestiche di tumore in altra sede si opta per
l’agoaspirato per capire se si tratta di una metastasi.
Una volta definito il quadro si può optare per:
surrenectomia:
o con apertura dell’addome: riservata ai carcinomi perché in tal caso è necessaria una visione
delle strutture circostanti;
o videolaparoscopica: 85-90% di tutte le patologie surrenaliche si operano con questa
metodica.
follow-up: controlli ogni 6-12 mesi.
Iperaldosteronismo primitivo
Le cause di iperaldosteronismo primitivo sono:
adenomi (75-80 %);
iperplasia mono o bilaterale (20-25 %);
carcinoma (circa 1%).
Essendo una patologia iperfunzionante caratterizzata da ipertensione e ipopotassemia che possono
creare problemi in anestesia generale è necessario preparare il paziente all’intervento trattandolo per
10-15 giorni con farmaci come i diuretici risparmiatori di potassio o i calcio antagonisti.
Il trattamento consiste nella surrenectomia totale monolaterale. Di fronte a iperplasia bilaterale nella
maggioranza dei casi si opta per un trattamento medico, solo eccezionalmente chirurgico.
Ipercortisolismo
L’ipercortisolismo può essere:
ACTH dipendente:
o patologia ipotalamo-ipofisaria;
o sindrome paraneoplastica (es. ca. del pancreas);
Si ricordi che l’ACTH viene prodotto insieme al MSH. Tuttavia esso provoca esso stesso
iperpigmentazione, anche se meno dell’MSH, quindi su questa base non si può distinguere tra
produzione ipofisaria o ectopica.
ACTH indipendente, in ordine di incidenza:
o iatrogeno;
o adenoma surrenalico;
o iperplasia bilaterale primitiva idiopatica;
o carcinoma surrenalico.
Nel caso di adenoma ipofisario nell’80% dei casi si tratta di microadenomi che non vengono rilevati
dalla TC. Per questo motivo si effettua sampling venoso del sangue refluo dall’ipofisi per capire
quale delle due metà sia responsabile della secrezione e la si asporta con un intervento di
neurochirurgia. A distanza di 8-10 anni il 40% dei pazienti recidiva: asportare l’altra metà
dell’ipofisi creerebbe un grave quadro di panipopituitarismo. Si preferisce allora asportare entrambi
i surreni.
Nel caso di adenoma surrenalico l’intervento di elezione è la surrenectomia totale monolaterale.
I pazienti con Cushing vanno preparati prima dell’intervento:
- riducendo l’increzione di cortisolo perché ciò influenza negativamente la guarigione delle ferite;
- correggendo la discoagulopatia: questi pazienti sono a rischio di trombosi ma allo stesso tempo
la loro coagulazione è più lenta del normale;
- correzione dell’eventuale ipertensione (se anche è presente non è mai grave come quella che si
associa a Conn).
Dopo l’operazione il paziente deve essere trattato con:
- terapia ormonale sostitutiva: se la surrenectomia è stata bilaterale la terapia dev’essere protratta
per tutta la vita. Anche in caso di surrenctomia monolaterale, tuttavia, poiché il surrene
controlaterale è stato soppresso per un lungo tempo è necessario somministrare ormone finchè
esso non sia in grado di riprendere la propria funzionalità;
- eparina: il decorso post-operatorio può complicarsi con una trombosi.
Feocromocitoma
Il feocromocitoma è il tumore della midollare del surrene. Tumori dello stesso istotipo possono
presentarsi anche al di fuori del surrene ed in questo caso si parla di paraganglioma.
Circa 1 feocromocitoma su 10 presenta una delle seguenti caratteristiche:
extrasurrenalico;
bilaterale;
maligno.
Il feocromocitoma si manifesta dal punto di vista clinico con ipertensione di vario tipo: può essere
stabile, stabile ma con rialzi sporadici oppure caratterizzata da crisi ipertensive con pressioni
normali tra una e l’altra. Le crisi sono spesso caratterizzate da pressioni molto alte in grado di
causare complicanze molto serie come l’emorragia cerebrale.
Il trattamento è chirurgico ma crea problemi: prima dell’operazione bisogna sottoporre i pazienti ad
un trattamento intensivo perché la manipolazione del tumore nel corso dell’intervento può causare
liberazione di catecolamine che può essere letale. Per la preparazione all’intervento si utilizzano α e
β bloccanti oppure un’associazione dei due. Quindi si esegue surrenectomia.
I feocromocitomi sono di dimensioni variabili, spesso molto grandi. Nella diagnosi preoperatoria
trovare una massa surrenalica alla TAC non è sufficiente perché il feocromocitoma può essere
multiplo: per questo si esegue scintigrafia con 131I-MIBG il quale è in grado di evidenziare
eventuali localizzazioni extra surrenaliche.
Corticocarcinoma o carcinoma adrenocorticale
Insieme al carcinoma indifferenziato della tiroide è uno dei tumori più aggressivi. Essi sono ben
differenziati e spesso secernono ormoni ma nonostante questo sono aggressivi e recidivano con
grande facilità (a 5 anni sopravvivenza solamente del 5%).
La sintomatologia clinica è spesso importante e quindi anche una riduzione della massa può essere
utile. In particolare nell’ambito del Cushing la presenza di irsutismo è un indizio di malignità.