Classe 3^ - Tecnologie mecc. di proc. e prod. - UdA n° 2: Materiali metallici: costituzione, trattamenti - La materia
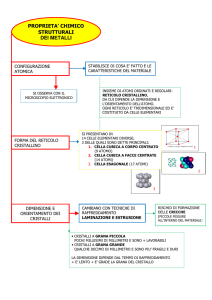
LA MATERIA: COSTITUZIONE, GENESI, PROPRIETÀ
Per Materia intendiamo tutto ciò che ci circonda, che ha una massa, che occupa uno spazio
e che può assumere una forma.
La materia non ha una struttura compatta come appare ai nostri occhi, ma una struttura
discontinua, cioè con spazi vuoti tra le varie particelle che la compongono.
Supponendo di frantumare in particelle sempre più piccole una porzione di materia (corpo),
la molecola è la più piccola quantità di materia che ancora possiede le proprietà caratteristiche
della sostanza considerata.
Supponiamo di dividere in particelle più piccole una
molecola. L’atomo è la più piccola unità di materia, indivisibile,
non avente più le proprietà chimiche e fisiche della materia di
origine.
L’atomo é formato da una parte centrale (nucleo), attorno
alla quale ruotano gli elettroni secondo orbite prestabilite a
ciascuna delle quali compete un certo livello di energia (gli
elettroni ruotano pure attorno al proprio asse).
Il nucleo è costituito da protoni e neutroni, gli elettroni sono
distribuiti attorno al nucleo dell’atomo secondo gusci orbitali
(livelli) di energia crescente verso l’esterno.
Gli elettroni hanno la tendenza a disporsi sugli
orbitali più stabili e cioè su quelli più interni, che
hanno minore energia (Stato fondamentale).
Completati i gusci interni, l’orbitale esterno può
rimanere incompleto.
Quando il guscio esterno è saturo, l’elemento
risulta inattivo ed inerte (es.: elio). Quando il guscio
esterno è incompleto, come nei non metalli, l’atomo
tende ad assorbire elettroni di altri atomi per
completare il suo guscio.
LO SCAMBIO DI ELETTRONI TRA ATOMI
ADIACENTI RENDE I METALLI BUONI
CONDUTTORI DI ELETTRICITA’ E DI
CALORE.
I Protoni sono particelle con carica elettrica positiva. I
Neutroni sono privi di carica elettrica. Gli Elettroni sono
particelle con carica elettrica negativa. Un atomo, in
condizioni normali, forma un insieme elettricamente
neutro: pertanto il numero di elettroni deve essere uguale
al numero di protoni. Le forze elettriche di attrazione tra
il nucleo e gli elettroni sono equilibrate dalle forze
centrifughe dovute alla rapida rotazione degli elettroni.
Gli elettroni di ciascun atomo sono attratti inoltre dai
nuclei degli atomi adiacenti ma sono respinti dagli elettroni degli altri atomi.
LA RESISTENZA MECCANICA E LA RIGIDITA’ DEI MATERIALI ALLO STATO
SOLIDO SONO DOVUTE A QUESTE FORZE INTERATOMICHE.
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
1
Classe 3^ - Tecnologie mecc. di proc. e prod. - UdA n° 2: Materiali metallici: costituzione, trattamenti - La materia
Gli elementi
Gli elementi sono sostanze costituite da atomi di uno stesso tipo (per esempio H2 , N2 , P4).
Gli elementi si dividono in due categorie: Metalli e Non metalli.
1) Metalli
I metalli hanno le seguenti caratteristiche:
- atomi che tendono preferenzialmente a perdere elettroni dello strato più “esterno” e quindi
si possono considerare “elettropositivi”; in genere si combinano con l’ossigeno formando
ossidi
- Buona conducibilità termica ed elettrica
- Molecola monoatomica
- Lucentezza caratteristica, detta metallica
- Buona o discreta duttilità e malleabilità
- Sono tutti solidi alla temperatura ambiente, tranne il mercurio che è liquido.
2) Non metalli
I non metalli non posseggono le suddette caratteristiche e non sono lavorabili.
Sono gassosi: Ossigeno, Azoto, Cloro …
Sono solidi: Zolfo, Carbonio, Silicio, Fosforo …
E’ liquido il Bromo.
Esistono elementi che presentano caratteristiche intermedie: tali elementi sono denominati
METALLOIDI (es.: Arsenco, Antimonio …).
Legami
La materia, come detto, è costituita da atomi legati più o meno stabilmente tra loro. Ogni
elemento tende a raggiungere la configurazione stabile, completando l’orbita esterna (es.: 8
elettroni sulla seconda orbita), attraverso lo scambio di elettroni. Tra i vari legami, ricordiamo
quello metallico.
LEGAME METALLICO
Si manifesta tra atomi appartenenti ad elementi metallici in grado di dare origine ad un
reticolo cristallino.
Il legame metallico non è localizzato e quindi gli strati di atomi possono scorrere gli uni
sugli altri permettendo perciò la lavorazione dei metalli.
La figura rappresenta un piano atomico di un reticolo
cristallino. Un elettrone che percorre l’orbita attorno al suo
nucleo, può abbandonare la sua sfera in corrispondenza
della zona di contatto con altre sfere.
Nel caso di figura, l’elettrone a può sciamare nella sfera
d’influenza del nucleo b. L’atomo A, per la perdita di una
carica elettrica negativa si trasforma in uno IONE
METALLICO POSITIVO.
Quando tanti elettroni a sciamano da un atomo all’altro,
si determina la formazione di IONI POSITIVI circondati da
una NUBE DI ELETTRONI con carica negativa.
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
2
Classe 3^ - Tecnologie mecc. di proc. e prod. - UdA n° 2: Materiali metallici: costituzione, trattamenti - La materia
E’
questa
NUVOLA
ELETTRONICA che tiene uniti
gli IONI (per la forza di
attrazione che si manifesta tra
cariche elettriche di segno
opposto), determinando così la
forza di coesione o legame
metallico.
STATO SOLIDO METALLICO
•
Metallo è ogni elemento che può assumere lo “Stato metallico”.
•
Stato metallico è quello stato caratterizzato dal possedere il
Legame metallico.
Un solido metallico è quindi un grande insieme di atomi (1 cm3
può contenere 1022 ÷ 1023 atomi) nel quale l’energia di legame è di
entità tale che ciascun atomo è vincolato a punti ben determinati in
grado di dare origine ad un RETICOLO CRISTALLINO. Intorno
a questi punti gli atomi vibrano con moto irregolare senza però
allontanarsi dalle posizioni di equilibrio e non possiedono un moto
traslazionale.
•
Reticolo è la gabbia tridimensionale di linee immaginarie che uniscono i centri degli atomi:
è costituito dal ripetersi periodico di una “cella elementare” nello spazio.
•
Cella elementare è il più piccolo solido ottenuto congiungendo i centri
degli atomi contigui.
Nella realtà gli atomi sono uno vicino all’altro e si toccano in un punto di
tangenza.
Reticoli cristallini
I metalli possono assumere diverse caratteristiche strutture cristalline. Ne ricordiamo tre:
- cubica a corpo centrata
- cubica a facce centrate
- esagonale compatta
Oltre a queste tipiche strutture, si hanno anche i sistemi tetragonale, rombico, monoclino,
triclino.
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
3
Classe 3^ - Tecnologie mecc. di proc. e prod. - UdA n° 2: Materiali metallici: costituzione, trattamenti - La materia
1) DISPOSIZIONE CUBICA A CORPO CENTRATA (C. C. C.)
E’ costituita da 9 atomi di cui 8 ai vertici del cubo ed 1 al centro di
esso. Essa è caratteristica dei metalli più duri, come il Ferro α, il tungsteno
(o Wolframio), il cromo, il molibdeno, il vanadio.
E’ la presenza dell’atomo al centro che, facendo da ostacolo allo
scorrimento dei piani atomici, rende i metalli più duri.
2) DISPOSIZIONE CUBICA A FACCE CENTRATE (C. F. C.)
E’ costituita da 14 atomi, di cui 8 ai vertici del cubo e 6 al centro di
ciascuna faccia di esso. Essa è caratteristica dei metalli più duttili e
malleabili, come il Ferro γ, l’alluminio, il nichel, il piombo, il rame, l’oro,
l’argento.
3) ESAGONALE COMPATTA (E. C.)
E’ costituita da 17 atomi, di cui 12 disposti in modo da individuare un
prisma esagonale, 2 nei centri delle facce inferiore e superiore e 3 al centro
dei tre prismi romboidali in cui può essere suddiviso il prisma esagonale.
Essa è caratteristica dei metalli più fragili, come lo zinco, il cobalto, il
magnesio.
Anche la grafite ha struttura esagonale.
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
4
Classe 3^ - Tecnologie mecc. di proc. e prod. - UdA n° 2: Materiali metallici: costituzione, trattamenti - La materia
Dimensioni del reticolo e costante reticolare
La dimensione della cella elementare (o reticolo) é detta “costante reticolare” ed il suo valore
varia a seconda del tipo di sistema.
Consideriamo, per comodità, il sistema cubico a facce centrate (CFC). In esso gli atomi sono a
contatto sulle diagonali delle facce.
Con riferimento al disegno a lato, si ha che:
l=
2
2
a +a =
l
a
2
2a = a 2
a
Ma, con riferimento al disegno del reticolo CFC, detta “l” la
diagonale della faccia superiore, é anche:
l=r+d+r=2r+d=2d
Possiamo quindi scrivere:
2d=a 2
da cui a =
2d
2
Per il ferro, che ha diametro dell’atomo d = 2,48 Å (dove 1 Å, angstrom; é pari a 10
ha:
-7
mm), si
2 = 3,507 Å
a = 2,48
Nel caso del sistema cubico a corpo centrato, gli atomi sono a contatto sulle diagonali del cubo.
Con riferimento al disegno a lato, si ha che:
l=
a 2 + b2
Per quanto dimostrato sopra, la diagonale della faccia inferiore é
b=a 2
Quindi si può scrivere:
l=
a 2 + (a 2 ) 2 =
a 2 + 2a 2 =
3a 2 = a
3
Ma, come prima, é anche:
l=r+d+r=2r+d=2d
Possiamo quindi scrivere:
2d=a
3
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
5
Classe 3^ - Tecnologie mecc. di proc. e prod. - UdA n° 2: Materiali metallici: costituzione, trattamenti - La materia
da cui a =
2d
3
Ricordando che, per il ferro, d = 2,48 Å, si ha:
a=
2 • 2,48
3
= 2,86 Å
Confrontando i due valori ottenuti si deduce che la costante reticolare, e quindi il lato, del
reticolo cubico a corpo centrato é minore di quella del reticolo cubico a facce centrato.
In sostanza, il reticolo C.F.C. é più grande del reticolo C.C.C.
TRASFORMAZIONI ALLO STATO SOLIDO: ALLOTROPIA
Alcuni elementi, come il Ferro,
variano la loro struttura cristallina a
seconda della temperatura alla quale si
trovano. Il fenomeno è detto
ALLOTROPIA.
Con riferimento alla figura a lato,
considerando le trasformazioni al
riscaldamento, si ha:
-
dalla temperatura ambiente fino a
768 °C il ferro ha reticolo
cristallino C.C.C., è detto ferro α ed
è magnetico;
-
da 768 °C fino a 910 °C il ferro ha
ancora reticolo cristallino C.C.C., è
detto ferro β o “α non magnetico”
perché non è più magnetico;
-
da 910 °C fino a 1394 °C il ferro ha
reticolo cristallino C.F.C., è detto
ferro γ e non è magnetico;
-
da 1394 °C fino a 1535 °C
(temperatura di fusione) il ferro
riprende il reticolo cristallino
C.C.C. ed è detto ferro δ.
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
6
Classe 3^ - Tecnologie mecc. di proc. e prod. - UdA n° 2: Materiali metallici: costituzione, trattamenti - La materia
GENESI DEI CRISTALLI
I cristalli possono provenire sia da trasformazioni liquido → solido, che da trasformazioni di
stato in fase solida. In entrambi i casi distinguiamo due momenti successivi: nucleazione e
accrescimento.
1) Nucleazione
E’ il momento in cui si producono nel sistema (es.: massa liquida) i nuclei o germi dei
cristalli.
Non si sa con esattezza come avviene il processo. Facciamo delle ipotesi ragionando in
termini energetici. Sappiamo che lo stato liquido è caratterizzato da una certa energia e che lo
stato solido ha una energia inferiore. Quindi il passaggio liquido – solido avviene con
diminuzione di energia. Tale passaggio, d’altra parte, non avviene direttamente, ma soltanto
dopo avere attraversato uno stato attivato. Diciamo allora che, quando la massa liquida
solidifica, non tutte le particelle danno origine ai nuclei, ma solo quelle che hanno energia
sufficiente per raggiungere lo stato attivato. Vi è infatti una forza che si oppone alla formazione
dei nuclei: la TENSIONE SUPERFICIALE, esercitata sul germe solido dal liquido.
2) Accrescimento
Costituisce lo sviluppo della fase solida, intorno ai nuclei preformati, a spese del liquido
circostante, formando cristalli che si uniscono gli uni agli altri fino alla completa
solidificazione.
Nella figura vi è la rappresentazione schematica della germinazione e della crescita dei
grani.
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
7
Classe 3^ - Tecnologie mecc. di proc. e prod. - UdA n° 2: Materiali metallici: costituzione, trattamenti - La materia
I cristalli, visti al microscopio, sono aggregati più o meno piccoli, generalmente senza
orientamento preferenziale. Essi vengono chiamati GRANI CRISTALLINI. Se non esistono
anisotropie nel raffreddamento della massa fusa, l’accrescimento procede regolarmente in tutte e
tre le direzioni e cesserà quando i bordi dei grani contigui vengono a contatto, formando i
“giunti”.
Nella realtà, i cristalli non possono svilupparsi regolarmente a causa della tensione
superficiale del liquido che li circonda, degli attriti interni e delle interferenze che avvengono
fra i cristalli stessi durante la fase di accrescimento. Si avrà quindi un aggregato cristallino
costituito da grani aventi dimensioni, forma ed orientamento diversi.
La velocità di raffreddamento influisce sulla dimensione dei cristalli:
- Velocità di raffreddamento lenta
- Velocità di raffreddamento veloce
pochi nuclei, pochi grani grandi
molti nuclei, molti grani piccoli
Strutture dendritiche
La forma e le dimensioni dei cristalli, come pure la direzione secondo cui
si sviluppano, dipendono essenzialmente, oltre che dalla velocità di
raffreddamento, dall’energia presente secondo i vari piani del reticolo
cristallino.
La crescita dei cristalli avviene più rapidamente in direzione
perpendicolare ai piani di massima energia.
In seguito alla formazione di parti solide, si libera una notevole quantità di
energia termica che si oppone al proseguimento della solidificazione in quella
direzione. Allora il cristallo tende a svilupparsi in un’altra direzione dove
l’energia è minore, quindi si arresta a causa dell’energia liberata e si accresce
in altra direzione di minore energia e così di seguito.
L’accostamento alla forma arborescente delle foglie di felce ha suggerito
la denominazione di DENDRITISMO al fenomeno e di DENDRITI ai
cristallini che conservano tale aspetto dopo la solidificazione.
Queste formazioni, talvolta visibili ad occhio nudo sulla superficie dei
metalli solidificati, hanno uno sviluppo più ampio quando il raffreddamento è
lento.
Col procedere della solidificazione, gli spazi tra le ramificazioni vengono
colmati da altre ramificazioni contigue per cui, in definitiva, si ha una massa
omogenea nella quale non si distingue più la dendrite originaria.
La figura a sinistra rappresenta la struttura dendritica di un acciaio inossidabile.
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
8
Classe 3^ - Tecnologie mecc. di proc. e prod. - UdA n° 2: Materiali metallici: costituzione, trattamenti - La materia
In seguito alla laminazione, tale struttura viene modificata con la formazione di fibre, che
conferiscono maggior resistenza ala materiale.
Dalla unione delle varie dendriti hanno origine i grani del cristallo.
I contorni dei grani: giunti
Durante la solidificazione le pareti dei cristalli
respingono via via nel liquido la maggior parte delle
IMPUREZZE presenti nel bagno di fusione: queste si
raccolgono sotto forma di sottile pellicola ai cosiddetti
CONTORNI DEI GRANO (o GIUNTI), ossia alla periferia
dei grani nel metallo solidificato.
Ai bordi dei grani iniziano i fenomeni di corrosione e di
fusione.
Dalle caratteristiche del giunto dipendono molte proprietà del materiale:
METALLI
- AD ELEVATA
RESISTENZA
- AD ELEVATA
PLASTICITA’
- AD ELEVATA
FRAGILITA’
RESISTENZA DEL
GIUNTO AL DISTACCO
Elevata
RESISTENZA DEI GRANI
ALLA DEFORMAZIONE
Elevata
Elevata
Bassa
Bassa
Elevata
Pertanto il comportamento dei metalli alle sollecitazioni dipende contemporaneamente dalle
proprietà del grano e dalle proprietà del giunto.
•
A TEMPERATURA ORDINARIA la coesione nei giunti è superiore a quella
che c’è all’interno dei grani, quindi, se c’è frattura, essa avviene attraverso i
grani (FRATTURA TRANSCRISTALLINA).
•
Alle ALTE TEMPERATURE diminuisce la coesione nei giunti e quindi è fra
di
essi
che
avviene
una
eventuale
frattura
(FRATTURA
INTERCRISTALLINA).
IMPERFEZIONI DEL RETICOLO CRISTALLINO
Nella realtà il reticolo cristallino presenta delle imperfezioni tipo:
• Difetti reticolari puntiformi (Vacanze)
• Difetti reticolari lineari (Dislocazioni)
• Presenza di atomi estranei
1) La VACANZA è un punto di discontinuità corrispondente a “posizioni atomiche vacanti”.
Il movimento di vacanze, cioè lo scambio di posizione tra un atomo ed un posto non
occupato è detto DIFFUSIONE.
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
9
Classe 3^ - Tecnologie mecc. di proc. e prod. - UdA n° 2: Materiali metallici: costituzione, trattamenti - La materia
La variazione delle proprietà meccaniche dei metalli nonché le rotture per fatica dei metalli
sollecitati si possono imputare alle vacanze.
2) Le
DISLOCAZIONI
sono
difetti
estesi
(combinazioni di vacanze) formatisi durante la
crescita dei cristalli, oppure in seguito a deformazione
plastica quando una parte del cristallo scivola su
quella adiacente.
A lato è rappresentata una “dislocazione a spigolo”.
Le dislocazioni rendono plastici i cristalli.
3) Gli ATOMI ESTRANEI alla composizione del metallo (dovuti ad IMPUREZZE
metalliche o non metalliche) possono essere di due tipi:
• INTERSTIZIALI, se si inseriscono nel reticolo base in posizioni non regolari, come
nelle vacanze o dislocazioni o negli interstizi del reticolo deformato.
• SOSTITUZIONALI, se sostituiscono atomi della matrice metallica in posizione normale
del reticolo.
E’ evidente che la presenza di atomi estranei disturba lo stato di equilibrio e crea
DISTORSIONI nei piani atomici, rendendo più difficoltosi lo scorrimento dei reticoli,
diminuendo di conseguenza la plasticità ed aumentando la durezza.
Gli atomi estranei, avendo una struttura elettronica ed un diametro diverso, agiscono come
centri di distorsione del reticolo.
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
10
Classe 3^ - Tecnologie mecc. di proc. e prod. - UdA n° 2: Materiali metallici: costituzione, trattamenti - La materia
Deformazioni del reticolo
Se un grano (o cristallo) di metallo potesse
essere sottoposto a sollecitazioni esterne, il suo
reticolo cristallino subirebbe una deformazione
causata dallo scorrimento dei blocchi dei piani
atomici.
Di conseguenza cambierebbe la forma esterna
del grano (che subirebbe un allungamento nella
direzione dello sforzo) ma la forma e le
dimensioni delle celle del reticolo cristallino
rimarrebbero inalterate.
Le proprietà meccaniche del grano (R, A …)
risultano diverse a seconda della direzione della
sollecitazione. Questo diverso comportamento alle
sollecitazioni nelle varie direzioni di denomina
ANISOTROPIA.
I metalli sono però policristallini, cioè costituiti da un numero
grandissimo di grani i cui piani atomici sono orientati in tutte le direzioni
possibili.
Essi sono allora ISOTROPI, cioè non variano le proprietà meccaniche
qualunque sia la direzione della sollecitazione applicata, in quanto lo
scorrimento dei piani in un grano risulta ostacolato dai piani del grano
adiacente, che sono orientati in direzioni diverse.
Con l’aumentare dello sforzo, anche altri grani iniziano lo slittamento
nella direzione della sollecitazione, fino a che il materiale non consentirà
altre deformazioni plastiche.
Se la sollecitazione aumenterà ulteriormente, fino a superare la forza di coesione, si avrà la
ROTTURA.
Le lavorazioni meccaniche, soprattutto se eseguite a freddo, provocano la frantumazione dei
cristalli e deformano il reticolo cristallino; per questo motivo il materiale acquista durezza e
fragilità e nascono tensioni interne.
Il fenomeno è conosciuto col nome di INCRUDIMENTO e può essere eliminato col
trattamento termico di RICOTTURA, che rigenera il grano, ricostituisce la struttura cristallina
originaria e fa scomparire le tensioni interne.
Tecnologie mecc. di proc. e prod. - Appunti dalle lezioni del prof. Di Cara Nicola - ITIS “Galilei” - Conegliano
11