SVILUPPO DI TECNICHE PER IL
CONFERIMENTO Di RESISTENZA A PATOGENI
IN VITE PER IL MIGLIORAMENTO DELLA
QUALITA’ DEL MATERIALE VIVAISTICO E LA
RIDUZIONE DELL’IMPATTO AMBIENTALE
DELLA COLTIVAZIONE
Università Politecnica delle Marche – Prof. Bruno Mezzetti
Università di Verona - Dott.ssa Pandolfini - Dott.ssa Polverari
Vitroplant Italia s.r.l. Società Agricola
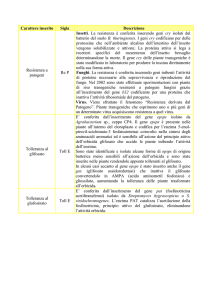
Miglioramento genetico con metodo biotecnologico
Le caratteristiche di una varietà possono essere migliorate con tecniche tradizionali di
miglioramento genetico integrati con le biotecnologie ora in particolare con l’uso dell’ingegneria
genetica
PROBLEMI PER L’INGEGNERIA GENETICA:
–
–
–
–
Possibile effetti su organismi no-target
Possibilità di sintesi di nuovi composti tossici o allergeni nelle piante transgeniche
Essudati radicali, detriti rilasciati sul suolo e in acqua
Possibili rischi di flusso genico
Legislazione vigente
Direttiva 18/2001/EC (abroga la direttiva 220/90 EC) disciplina l’emissione deliberata
nell’ambiente di OGM
si basa sul principio di precauzione
Regolamento N. 1829/2003 EC disciplina la presenza di OGM sui cibi e
sull’alimentazione
centralizzato nell’EFSA (European Food Safety Authority)
ruolo di esprime pareri scientifici o valutare il rischio stesso
Italia
Direttiva 18/2001 EC
Decreto n. 224 del 08/07/2003
Procedure da affrontare
Introduzione di norme sulla tracciabilità
per prodotti OGM
L’organismo preposto a tali controlli è Commissione Interministeriale, coordinata dal
Ministro dell’Ambiente e composta da 22 esperti
Decreto 224
Decreto n. 225 del 28/01/2005 (Ministro Agricoltura)
regolamentazione della coesistenza tra OGM ed il tradizionale sistema di coltivazione
13 Luglio 2010: Commissione ha ufficializzato la proposta di concedere agli stati membri la
libertà di autorizzare, restringere o proibire le colture biotech. sul loro territorio
Immediata applicazione: Modifica e sostituisce le
raccomandazioni in materia di coesistenza tra colture
convenzionali, biologiche ed OGM, lasciando al singolo stato
la facoltà di introdurre regole più restrittive per la loro
coesistenza.
Proposta legislativa: lascia libera
scelta ad ogni stato membro UE di
autorizzare la coltivazione di
OGM. NEGOZIATA con
Consiglio Europeo e Parlamento
Europeo
GM Research Trend in Europe 1991-2002
Total number of permits and notification approved per year
1991
1992
1993
1994
1995
1996
1997
1998
1999
2000
2001
Esempio di ingegnerizzazione su portinnesto
(Palauqui et al., 1997) tabacco
linea transgenica che manifesta una clorosi a causa
della soppressione dei geni Nia e Nii dovuta dall’induzione di un processo di silenziamento
genico post trascrizionale
Es. Palauqui et al., 1997 S: silenced
S: silenced
NS: Non - silenced
•
Trasmissione avviene a qualsiasi altezza dell’
innesto (10, 20, 30 cm)
Esempio di innesti su portinnesto GM
(Crete et al., 2001)
(tabacco) linee transgeniche mostravano una sostanziale diminuzione
della presenza della chitinasi (enzemi idrolitici che degradano la chitina), dovuta
all’inibizione dell’espressione del gene codificante per tale enzima.
-Portinnesto GM silenziato - 50 cm
- nesto non GM - 5 cm
-Portinnesto non GM - 50 cm
- nesto GM - 50 cm
- innesto a gemma (5 mm) da non
GM a GM ad altezza di 50 cm
Perché trasferire questa tecnologia in frutticoltura ?
L’utilizzo delle biotecnologie trascina con se un insieme di problematiche legate all’impatto
sull’ecosistema:
-
sviluppo di resistenza ai pesticidi e tolleranza egli erbicidi
-
effetti negativi sugli organismi non target (insetti impollinatori, predatori ed altri);
-
Possibilità che la pianta GM divenga infestante e/o invasiva;
-
Inquinamento genetico di cultivars della stessa specie;
-
Inquinamento genetico di piante selvatiche sessualmente compatibili.
Nel caso di modifiazione del portinnesto ci si può attendere una riduzione o eliminazione totale
dei possibili rischi che possono derivare dal trasferimento genetico verticale. Infatti la dispersione
del polline e/o dei semi può avvenire solo nel caso di ricacci alla base delle piante innestate che
possono andare a fiore se non eliminati precocemente. In caso contrario il polline ed i semi non
eriditerebbero il transgene.
Applicazione: Valutazione agronomica di vite transgenica
resistente al virus dell’arriciamento fogliare e possibili danni
ambientali
- Istituto responsabile della sperimentazione: Institute national de la recherche agronomique Centre de Recherche de Colmar. http://www.colmar.inra.fr
- Titolo Progetto: Valutazione dell’impatto ambientale della vite transgenica sulla diversità e la
dinamica delle popolazioni virali.
- Normativa di Riferimento: Dir. 2001/18/CE.
- Numero Notifica: B/FR/04/05/01.
- Autorità competente al rilascio: Ministere de l'Agriculture et de la Peche.
- Data di autorizzazione: 28-06-2005.
- Fine rilascio: 31-10-2009.
Informazioni tecniche
- Portinnesto: 41 B (Vitis vinifera x Vitis berlandieri).
- Metodo di trasformazione: Agrobacterium tumefaciens.
- Fenotipo: Resistenza a virus (Grapevine fanleaf virus – GFLV) e tolleranza antibiotici (gene
nptII).
Prova in campo su 1000 m2 di superficie su 1604 piante non transgeniche delle varietà Cabernet
Sauvignon (clone 15) e Chardonnay (clone 96) di cui 70 impiantate su portinnesti transgenici.
SCOPO:
- confermare gli studi preliminari relativi all’efficacia delle piante transgeniche verso l’infezione
del virus GFLV;
- valutare gli effetti del portinnesto transgenico sulla dinamica e la variabilità genetica delle
popolazioni virali;
- valutare la mobilità dei vettori virali;
- analizzare l’eventuale flusso genico dei trascritti transgenici dal portinnesto geneticamente
modificato all’innesto convenzionale.
Il sito di disseminazione comprende 5
zone distinte:
- una zona centrale (in rosso) contaminata
dai nematodi vettori del virus (terreno
infettato di riporto), comprendente 50
piante transgeniche (5 x 10 ripetizioni) e
46 non transgeniche di superficie pari a 40
m2;
- una zona di conservazione (in verde)
comprendente 20 piante transgeniche (5 x
4 ripetizioni) e 4 piante non transgeniche
di superficie pari a 50 m2;
- una zona di confinamento impiantata con
336 piante di vite non transgenica su una
superficie di 170 m2;
- una zona di sicurezza incolta di 225 m2;
- una zona di bordo costituita da 1148
piante non trasgeniche su una superficie
pari a 560 m2.
- Valutazione della stabilità dell’inserto: Sperimentazione (1994/99) in campo
inserto stabile
- Analisi morfologiche: I risultati provenienti da 5 anni di prove in campo (Notifica
B/FR/94.11.04) hanno evidenziato che non vi sono differenze morfologiche tra i portinnesti
transgenici e i corrispettivi isogenici, sia ad uno stadio giovanile che dopo 5 anni di studio.
- Tossicità ed allergenicità verso l’uomo e gli altri organismi viventi: Non sono finora stati
riportati effetti nocivi sull’uomo e sugli organismi non target attribuibili alla presenza del gene
CP e nptII. Inoltre, in seguito ad infezione virale, il gene CP può essere naturalmente presente
nella pianta.
- Disseminazione del transgene: non esistono evidenze che il fenomeno di ricombinazione possa
avvenire in piante di vite coltivate in pieno campo (notifiche n. B/FR/94.11.04 e B/FR/96.03.11,
sperimentazione condotto in Romania).
Non valutato: effetti sulla resistenza delle VGM verso il virus GFLV rispetto alle corrispettive
isogeniche, a causa della distruzione del campo sperimentale da attivisti.
Resistenza a virus in piante erbacee e arboree
La ricerca effettuata (Polverari et al.,2003) è stata finalizzata alla preparazione di un costrutto ad
hairpin (ihprolC-PP197 - intron-hairpin rolC PPV 197) in grado di silenziare l’espressione di un
frammento genico del Plum Pox Virus (Virus della Sharka delle Pomacee). L’espressione del
gene è regolata promotore rol C che esprime il costrutto a livello floematico.
promotore
sequenza senso
introne
sequenza antisenso
terminatore
derivato dal genoma PPV
rol A
derivato dal genoma PPV
rol C
nptII
rol C
regione dsRNA del costrutto hairpin
L’infezione del PPV si diffonde in una pianta tramite plasmodesmi da cellula a cellula e per le
distanze più lunghe per via floematica. Gli RNA di silenziamento prodotti da questo costrutto
conferiscono resistenza sistemica della malattia, senza impedire la locale infezione virale.
DefH9-IaaM Gene (Spena – UniVR)
LB
RB
P. savastanoi
EcoRI
EcoRI
BamHI
DefH9 Promoter
KpnI
IaaM coding
HindIII
EcoRI
Terminator
Antirrhinum majus
It confers expression
within the placenta and the
ovules and it has been used
to confer parthenocarpic
fruit development to
several plant species and
varieties
(Rotino et al., 1997)
From regeneration and selection
to the open field (2001)
DefH9–iaaM Table Grape (Genomic DNA digested with HindIII)
GM
Cont
Thompson
GM Cont
Silcora
GM
GM
Cont
Silcora
Schematic drawings of the constructs used for transformation of Silcora (right)
and Thompson Seedless (left) plants and probes indicated with grey boxes.
Only restriction sites relevant for Southern analysis are indicated.
DefH9–iaaM expression
in Table Grape
RT-PCR analysis
performed with single
strand cDNA synthesized
from mRNA extracted from
young flower initials of
Thompson Seedless and
Silcora control and
transgenic plants.
The amplification product
of 266 bp corresponds to
the 5' end of the spliced
DefH9-iaaM mRNA.
C GM C GM GM
Thompson Silcora
Flower initials transgenic for the DefH9-iaaM gene had an IAA content
higher than controls (data not reported).
The DefH9-iaaM auxin-synthesizing gene does not however inhibit
grape fruit ripening.
The experimental trial:
‘Thompson Seedless’ Control and GM line: 32 plants each
‘Silcora’ Control and GM lines (line A and line B): 16 plants each
Vines were spaced at 2.5 x 1.5 m,
trained with
the ‘double guyot’ system
DefH9-iaaM - Table grape
Effect on yield capacity (0ne plot production)
TH – Control
TH – GM
SI – Control
SI – GM
Sperimentazione in atto
Attualmente si sta tentando di trasformare geneticamente due varietà (Pinot e Corvina) ed un
portinnesto (1103 Paulsen) di vite con un costrutto ad hairpin al fine di valutare l’applicabilità
di questa strategia per introdurre resistenza a virus direttamente su varietà o indirettamente
mediante l’utilizzo del portinnesti GM.