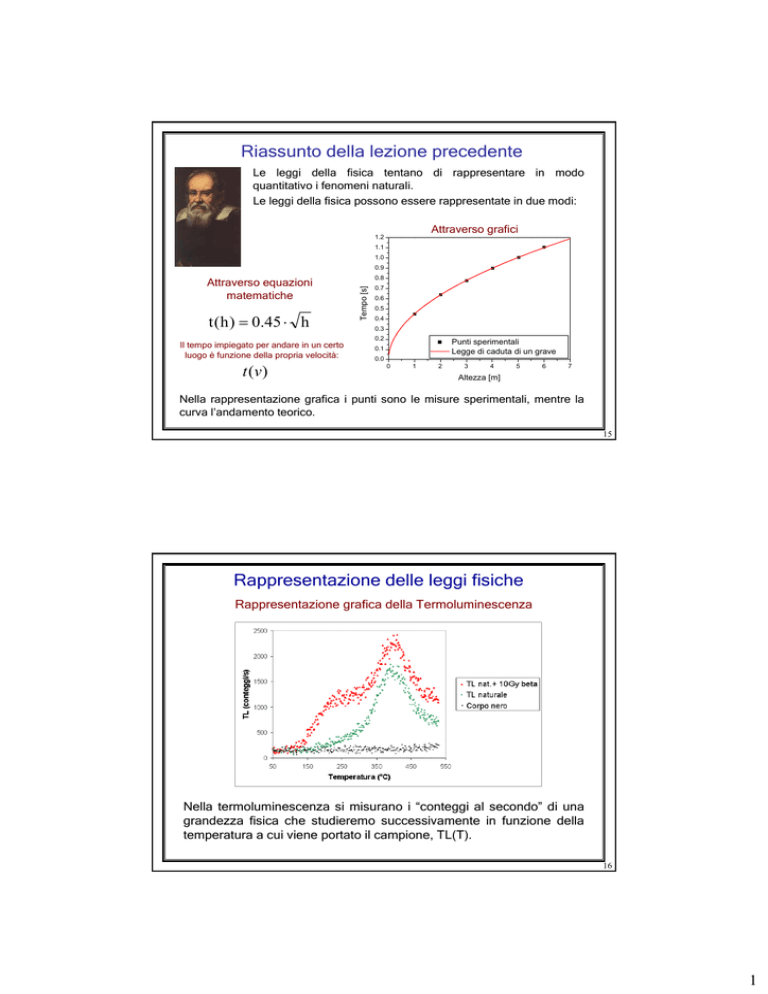
Riassunto della lezione precedente
Le leggi della fisica tentano di rappresentare in modo
quantitativo i fenomeni naturali.
Le leggi della fisica possono essere rappresentate in due modi:
Attraverso grafici
1.2
1.1
1.0
0.9
t ( h ) = 0.45 ⋅ h
Il tempo impiegato per andare in un certo
luogo è funzione della propria velocità:
t (v )
0.8
Tempo [s]
Attraverso equazioni
matematiche
0.7
0.6
0.5
0.4
0.3
0.2
Punti sperimentali
Legge di caduta di un grave
0.1
0.0
0
1
2
3
4
5
6
7
Altezza [m]
Nella rappresentazione grafica i punti sono le misure sperimentali, mentre la
curva l’andamento teorico.
15
Rappresentazione delle leggi fisiche
Rappresentazione grafica della Termoluminescenza
Nella termoluminescenza si misurano i “conteggi al secondo” di una
grandezza fisica che studieremo successivamente in funzione della
temperatura a cui viene portato il campione, TL(T).
16
1
(http://helios.unive.it/~termo/Autenticazione.html)
17
18
2
http://flint.mater.unimib.it
Ogni misura, per poter essere valida e fornire informazioni, deve essere
sempre accompagnata dall’errore sperimentale (incertezza sulla misura).
Età = 1206 ± 10 anni
Età = 1206 ± 465 anni
Torneremo successivamente sul metodo per ottenere l’incertezza sulla misura.
19
Il Sistema Internazionale di misura (SI)
Nel sistema SI le unità di base sono sette e precisamente:
Lunghezza:
METRO
Massa:
KILOGRAMMO [kg]
Tempo:
SECONDO
[s]
Temperatura termodinamica:
KELVIN
[K]
Intensità di corrente elettrica:
AMPERE
[A]
Quantità di sostanza:
MOLE
[mol]
mol]
Intensità luminosa:
CANDELA
[cd]
[m]
Zero assoluto
0 K = -273.15 °C
Numero di Avogadro
6.022 1023
Queste unità sono state scelte in modo tale ed in numero tale da poter rappresentare in modo non
ambiguo qualunque grandezza fisica che si voglia misurare. Il loro numero tuttavia rappresenta un
compromesso tra esigenza di semplicità, per cui il numero di unità fondamentali dovrebbe essere il
minore possibile, ed esigenze di chiarezza e di praticità, per cui forse sarebbe utile un numero
maggiore. La scelta è determinata principalmente da ragioni storiche e dal modello fisico matematico
con il quale si rappresentano i fenomeni naturali.
20
3
http://www.imgc.to.cnr.it/
Cubiti egiziani (equivalenti al nostro metro)
Museo egizio di Torino
21
Esempi
spazio
m
⇒
tempo
s
Velocità
≈ 39600
km
m
m
= 11000 = 1.1 ⋅10 4
h
s
s
≈
Velocità di fuga
Velocità di un centometrista
m
velocità
m
⇒ s = 2
tempo
s s
Accelerazione
Energia
Lavoro = Forza · Spostamento
Newton [N]
[Joule]
Metro [m]
Massa · Accelerazione
kilogrammo [kg]
Joule = N ⋅ m =
100m
m
km
= 10 = 36
10 s
s
h
kg ⋅ m
kg ⋅ m 2
m
=
s2
s2
[m s-2]
Velocità / tempo
1eV = 1.602 ⋅10 −19 Joule
elettronvolt
22
4
Energia
Ci sono diverse manifestazioni ”dell’entità” energia:
EC =
Energia cinetica (automobile che si sposta)
Energia termica (calore)
Energia chimica (reazioni chimiche)
Energia elettrica
Energia luminosa (lampadina)
1 2
mv
2
Con opportuni “trasduttori” è possibile convertire un tipo di energia in un altro
(stufa elettrica, lampadina, etc.). - l’energia totale si conserva -
23
Isaac Newton (1642-1727)
Inghilterra
1687 – pubblicazione dei Principia
James Prescott Joule (1818-1889)
Inghilterra
1850 – equivalenza tra calore e lavoro meccanico
KNELLER, Godfrey
1689
Ritratto di Sir Isaac Newton
Farleigh House, Husterbourbe Park, England
James Prescott JOULE
24
5
Multipli e Sottomultipli
Faremo ampio uso di numeri molto grandi e molto piccoli, per cui è doveroso
ricordare che:
Fattore di moltiplicazione
Nome
Simbolo
giga
G
1 000 000
= 106
mega
M
1 000
= 103
kilo
k
100
2
etto
h
10
= 101
deca
da
0.1
= 10-1
deci
d
0.01
-2
1 000 000 000
= 10
= 10
9
centi
c
0.001
= 10-3
milli
m
0.000 001
= 10-6
micro
µ
0.000 000 001
= 10-9
nano
N
0.000 000 000 001
= 10-12
pico
p
= 10
25
Esempi
Lunghezza [m]
Diametro della via lattea
Diametro del Sole
Distanza Terra - Luna
Diametro della Terra
Dimensione umana
10 21 m
Dimensione di una cellula
Dimensione di un virus
Dimensione di un atomo
10 −6 m = 1µm
10 −7 m = 100nm
Dimensione di un protone
10 −15 m = 0.001 pm
109 m = 1Gm
4 ⋅108 m = 400000 km
10 7 m = 10000 km
1.7 m
10 −10 m = 0.1nm
26
6
Esempi
0
Tempo [s]
1 miliardo
Oggi: prime lezioni di beni culturali
0 anni
Roberto Baggio sbaglia un rigore a USA94
Fotografato il primo pianeta extrasolare
Nasce il Pentium Intel
≈ 101 anni
Inizio della rivoluzione russa
Einstein formula la teoria della relatività
ristretta e dell’effetto fotoelettrico
Viene inventato il diodo
≈ 10 2 anni
Medioevo: Enrico II scende in Italia, primi
Normanni in sud Italia
≈ 10 3 anni
Inizia il neolitico
Lavorazione della ceramica, agricoltura e
addomesticazione degli animali.
≈ 10 4 anni
Paleolitico medio: uomo di Neandertal
≈ 10 5 anni
Paleolitico inferiore: Homo Erectus
Scoperta del fuoco
≈ 10 6 anni
Inizio del pliocene: scimmie antropomorfe
≈ 10 7 anni
Cretaceo: dominio dei dinosauri
≈ 108 anni
Proterozoico Algonkiano: cellule eucarioti
≈ 10 9 anni
Nascita della Terra
≈ 4.5 × 10 9 anni
2 miliardi
3 miliardi
4 miliardi
5 miliardi
27
Tecniche di analisi: impatto sull’oggetto
Le tecniche preferibili sono quelle non distruttive in quanto è possibile
ottenere informazioni dall’oggetto sotto studio senza apportarvi alcuna
alterazione. Un semplice esempio di tecnica non distruttiva è l’analisi
radiografica con raggi x che può permettere (come vedremo) di ottenere
informazioni sugli strati interni dell’opera senza neppure toccarla.
Le tecniche non distruttive forniscono molte informazioni sulle opere d’arte,
ma in molti casi sono limitate. Per ottenere informazioni più approfondite è
necessario prelevare un piccolo campione dal reperto ed analizzarlo
successivamente in laboratorio con tecnologie più sofisticate. Questo si
potrà fare quando l’asportazione di un campione non compromette
l’integrità globale dell’oggetto (un piccolo foro nel basamento di una statua
lignea, all’interno di un vaso o in un mattone oppure una piccola quantità di
stoffa da un tessuto etc.).
Se la tecnica d’analisi impiegata non comporta la distruzione del campione
prelevato si parla di tecniche paradistruttive, viceversa di tecniche
distruttive.
Esempio di tecnica
paradistruttiva
A volte, semplicemente con
l’ausilio di un trapano, si può
prelevare una piccola quantità di
campione (scartando la parte
superficiale più soggetta a
contaminazioni esterne).
Riepilogando, dal punto di vista dell’impatto sul bene artistico, le tecniche di analisi
possono essere suddivise nelle seguenti categorie:
Non distruttive: l’opera non subisce alcuna modificazione
Paradistruttive: si richiede il prelievo di un campione che non verrà distrutto
(riutilizzabile quindi per altre analisi)
Distruttive: si richiede il prelievo di un campione che verrà distrutto
28
7
Tecniche di datazione
Le tecniche di datazione sono quelle a cui la fisica
e la scienza dei materiali hanno dato un contributo
sostanziale.
Ritrovamento nei
ghiacci di un uomo
del neolitico
Datare un oggetto non è una cosa semplice,
specialmente se il suo ritrovamento avviene al di
fuori di un contesto conosciuto (ed anche in questo
caso possono esserci dubbi sulla sua attribuzione).
Si osserva che la corretta datazione di un reperto è
automaticamente anche una autenticazione o meno
dello stesso.
Museo archeologico dell’Alto Adige
(http://www.archaeologiemuseum.it/index_ice.html)
Le datazioni di un reperto possono essere di tipo:
Relativo: la datazione fornisce solo una comparazione di età tra oggetti (stesso stile,
stesso periodo) ed una eventuale sequenza cronologica senza però fornire una data
(es. templi Maya)
Assoluto: il risultato dell’analisi è una data assoluta (correlata della relativa incertezza)
relativa ad un particolare momento della “vita” dell’oggetto (es: anno della morte per il
carbonio 14 o dell’ultima cottura per la termoluminescenza)
In questa parte del corso ci occuperemo delle datazioni assolute
29
Tecniche di datazione relativa
Dall’archeologia
Metodi stratigrafici: tutti i reperti trovati in uno stesso strato
(non perturbato!) sono coevi. Gli strati alti sono più recenti
di quelli posti in basso. Lo strato di superficie è il presente,
andando verso il basso si incontrano strati sempre più
antichi. La numerazione degli strati avviene partendo dal
livello sterile in basso e andando verso la superficie.
Metodi stilistici e tipologici: i manufatti simili in stile o
tipologia sono in linea di principio coevi.
Cronologie relative da iscrizioni su manufatti: nomi di
sovrani su monete o su lapidi, ecc..
Dalla geologia
Sequenze stratigrafiche di sedimenti.
Sequenze stratigrafiche di fossili. Fossili di flora e fauna,
tipici dei cicli glaciali e interglaciali, che si alternano nei
vecchi suoli.
30
8
Tecniche di datazione relativa
Dalla biologia
Analisi del polline e dei semi: diversamente dalla cellulosa
vegetale che non si conserva, i tessuti del polline e dei
semi si conservano per migliaia di anni. L'analisi pollinica
dei semi (specie e quantità) dà informazioni sul clima di
un'area geografica in un certo momento storico.
Studio di fratture delle ossa, gruppi sanguigni, malattie
ereditarie, tumori, talassemia, carie dentarie, DNA, ecc.
Pollini di diverse piante
31
Tecniche di datazione assoluta
Radiocarbonio (14C)
Tecniche
basate sulla
radioattività
Altri isotopi (40K, 36Cl, 238U, 232Th, 87Rb)
Termoluminescenza
ESR (Electron Spin Resonance)
Tracce di fissione nucleare
Dendrocronologia
Altre
Tecniche
Astronomiche
Archeomagnetismo
Racemizzazione (amminoacidi)
Idratazione delle ossidiane
32
9
Medioevo
Neolitico
Uomo di
Neandertal
Homo
Erectus
Ogni tecnica di datazione è in
grado di ricoprire solo un arco
limitato di tempo (BP = Before
Present).
Il materiale databile differisce a
seconda della tecnica. Non esiste
una tecnica in grado di datare
qualunque tipo di oggetto.
Radiocarbonio
Materiale organico
Termoluminescenza
Vasi, laterizi…
Nel diagramma sono riportate
le estensioni temporali teoriche
di applicabilità delle tecniche di
datazione assoluta.
(in verdino sono indicate quelle
legate in qualche modo alla
radioattività).
33
Metodo del RADIOCARBONIO o 14C
Tecnica distruttiva
Per poter comprendere tale tecnica
introdurremo i seguenti argomenti di fisica
Caratteristiche delle particelle elementari: elettroni, protoni, neutroni
Struttura atomica alla Bohr
Elementi chimici (cenni) e loro isotopi
Radioattività
Legge del decadimento radioattivo
34
10
Struttura dell’atomo
Particelle principali costituenti l’atomo.
Unità
elettrostatiche
Elettroni
1Ampere =
Simbolo: eMassa = 0.00091 10-27 kg
Carica Elettrica = -1.6 10-19 Coulomb
1Coulomb
1s
-1
1elettrone ⇒ −1.6 ⋅10 −19 Coulomb
1.6 ⋅10 −19
1.6 ⋅10 −19
0.625 ⋅1019 elettroni ⇒ −1Coulomb
Protoni
Neutroni
Simbolo: p+
Massa = 1.67262 10-27 kg
Carica Elettrica = 1.6 10-19 Coulomb
+1
Simbolo: n
Massa = 1.67493 10-27 kg
Carica Elettrica = 0 Coulomb
0
35
Cariche elettriche
Le particelle cariche sono soggette alla forza coulombiana. Tale forza è
repulsiva tra cariche dello stesso segno, attrattiva per cariche di segno
opposto. I neutroni non hanno carica elettrica e quindi non sono soggetti
a questa forza.
La forza di repulsione (o attrazione) tra particelle cariche, detta forza
coulombiana è molto più forte delle forza gravitazionale.
Protoni
Elettroni
36
11
Struttura dell’atomo
Per i nostri scopi (fenomeni di interesse) è sufficiente il modello alla Bohr dell’atomo
(1913). Sarebbe inutile utilizzare un modello più sofisticato di quanto necessario. Il
modello di Bohr può essere riassunto nei seguenti punti:
Atomo di Bohr.
La quasi totalità della massa dell’atomo (protoni e neutroni) è racchiusa
in una piccola regione detta nucleo.
Le dimensioni del nucleo sono circa di 10-15 m.
Z = numero atomico
(numero dei protoni nel nucleo)
A = numero di massa
(numero dei protoni più quello dei neutroni nel nucleo)
Non è detto che il numero di neutroni sia uguale a quello dei protoni
Il nucleo ha una carica elettrica positiva pari a +Z in
unità elettrostatiche
37
Struttura dell’atomo
C
Protoni
C
Neutroni
Elettroni
6 p+, 6 n
Atomo di carbonio 12
(Z =6; A = 12)
Atomo di carbonio 12
6 p+, 6 n, 6 e -
Gli elettroni “orbitano” intorno al nucleo, attratti dalla forza coulombiana,
su una serie di orbite circolari nello stesso modo in cui i pianeti orbitano
intorno al Sole.
Le orbite sono dette stazionarie (senza perdita di energia).
Le orbite sono quantizzate (non tutte le distanze dal nucleo sono permesse)
rn = n 2
a0
Z
Essendo:
Z = numero atomico,
n = numero intero partendo da 1
a0 = 0.0529 10-9 m = 0.0529 nm (costante)
38
12
Struttura dell’atomo
Atomo di Bohr.
Ad esempio, nel caso dell’atomo di idrogeno formato da 1 solo protone (Z=1) si ottiene:
rn = n 2
n=1
n=2
n=3
a0
Z
Z = numero atomico,
n = numero intero partendo da 1
a0 = 0.0529 10-9 m = 0.0529 nm (costante)
y [nm]
a0
= a0 = 0.0529nm
1
a
r2 = 22 0 = 4a0 = 0.2166nm
1
2 a0
r3 = 3
= 9a0 = 0.4761nm
1
r1 = 12
0.5
0.4
0.3
0.2
0.1
n=3
n=2
n=1
In condizioni “normali” gli atomi sono elettricamente neutri (la somma delle
cariche elettriche vale 0).
Il numero di protoni eguaglia il numero di elettroni.
39
Niels Henrik David Bohr (1885-1962)
Danimarca
1913 – Modello atomico di Bohr
Charles Augustin de Coulomb (1736-1806)
Francia
Bohr da giovane, da anziano e durante una discussione con Einstein
40
13
Numero atomico
Peso atomico
Gli elementi chimici si distinguono per il numero di protoni
presenti nel nucleo (Z). Ad esempio, l’atomo con 6 protoni è detto
carbonio ed ha un comportamento diverso dall’atomo con 7
protoni (detto azoto).
Nell’atomo neutro il numero di elettroni è pari a quello dei protoni.
Nello stesso elemento chimico (stesso Z) il numero di neutroni
può essere diverso.
41
42
14
GLI ISOTOPI
Numero di
Massa (A)
Protoni
14
6
Neutroni
Numero
Atomico (Z)
Elettroni
Atomo di idrogeno
1
1
1
Atomo di deuterio
2
1
H
p+,
1
e-
1
p+,
C
Simbolo chimico
dell’elemento
Atomo di trizio (instabile)
3
1
H
1 n, 1
1
e-
p+,
H
2 n, 1 e43
Atomo di carbonio
GLI ISOTOPI
(Numero di atomi di C) = 1.176 ⋅10 ⋅ (Numero di atomi di C)
14
−12
A14 C = 1.176 ⋅10
−12
12
⋅ A12 C
Esempio:
Per mezzo di processi chimici viene isolato 1 kg di carbonio dai resti di un
albero appena abbattuto. Quanti grammi di 13C e di 14C ci saranno?
12
6
C
6 p+, 6 n, 6 e99 % in natura
13
6
14
6
C
C
6 p+, 7 n, 6 e1 % in natura
6 p+, 8 n, 6 eTracce
Peso12 C ≈
PesoC
1000 g
⋅ 99 =
⋅ 99 = 990 g
100
100
Peso 13 C ≈
PesoC
1000 g
⋅1 =
⋅1 = 10 g
100
100
Peso14 C ≈ 1.176 ⋅10 −12 ⋅ Peso12 C = 1.176 ⋅10 −12 ⋅ 990 g = 1.164 ⋅10 −9 g
(
)
A14 C = Moli di 14C ⋅ N A ≈
1.164 ⋅10 −9
6.022 ⋅10 23 = 5 ⋅1013 atomi
14
(1.176 atomi di 14C su 1012 di 12C)
Il carbonio 14 (14C) è instabile
44
15
GLI ISOTOPI
Il numero di neutroni in un nucleo atomico
aumenta notevolmente con l’aumentare del
numero atomico Z (numero di protoni)
Numero di neutroni
All’interno del nucleo i nucleoni (protoni e
neutroni) esercitano intense forze attrattive sui
loro vicini. Questo tipo di forza,
chiamata
interazione nucleare forte, è più intensa della
forza Coulombiana di repulsione tra i protoni.
La forza forte tra due particelle simili (neutroneneutrone o protone-protone) è all’incirca uguale
che tra due particelle diverse (neutrone-protone),
tuttavia il legame tra protoni è indebolito
fortemente dalla repulsione coulombiana.
Una caratteristica della forza nucleare è che, per i
nuclei leggeri, si raggiunge la massima stabilità
se il numero di protoni è all’incirca uguale al
numero di neutroni.
Per nuclei più pesanti, la repulsione elettrica tra
protoni fa sì che si abbia maggiore stabilità se ci
sono più neutroni.
Numero atomico (numero di protoni)
Tipler, Invito alla fisica, vol. 3, Zanichelli
45
Principali tipi di decadimento radioattivo
Decadimento β.
Il decadimento β si verifica nei nuclei che hanno troppi o troppo pochi neutroni per la stabilità. Nel
decadimento β, la massa atomica (A) resta invariata mentre aumenta in numero atomico (Z) di 1 unità
(decadimento β -) o diminuisce di 1 (decadimento β +).
L’esempio più semplice è quello del decadimento di un neutrone libero, in cui:
n → e− + p +
T1 = 10.8 min
2
(dove T1/2, come vedremo, è il tempo di dimezzamento ovvero il tempo dopo il quale il numero di
“oggetti” di partenza, in questo caso neutroni, si è ridotto della metà a causa del decadimento). Per
questo decadimento si usa indicare l’elettrone generato con il simbolo β - per distinguerlo dagli elettroni
e- orbitanti intorno al nucleo. Infatti l’elettrone generato viene “sparato” via con una velocità che può
essere anche molto elevata. Per cui:
n → β − + p+
Si osserva che questo decadimento permise la scoperta del neutrino. Per
evitare la violazione del principio di conservazione dell’energia, Pauli 14
suppose (1930) la presenza di una particella a cui dette il nome di neutrino.
6
Solo nel 1957 il neutrino fu osservato sperimentalmente. Il decadimento
corretto è quindi:
6
−
+
n → β + p +ν
Il caso del decadimento del 14C ricade nella categoria dei decadimenti β -.
14
6
C →147 N + β − + ν
+
C →147 N + β −
p
6 e8n
7p
6 e7n
1e-
46
16
Riepilogo
In natura ogni essere vivente è formato in parte di carbonio ed una piccola quantità di questo è
radioattivo (14C), circa 1 atomo su 1012 ci carbonio non radioattivo (12C), .
Ad esempio, in 1 kg di carbonio ci sono circa 1.2·10-9 g di 14C che
corrispondono a circa 5·1013 atomi.
Quando un essere vivente muore smette di assimilare carbonio dall’ambiente (cibo, respirazione etc.).
Il 14C inizia a decadere in azoto (con processi di decadimento β-) per cui la quantità di 14C nell’organismo
si riduce nel tempo.
Misurando la quantità di 14C presente in un organismo morto tempo addietro e conoscendo la
quantità di 14C in esso presente alla morte, è possibile risalire alla data in cui è avvenuto il trapasso?
Si, se si conosce la legge fisica che lega il numero di atomi di 14C rimasti
al tempo passato dal momento della morte
Questa legge si chiama legge del decadimento radioattivo
47
17











