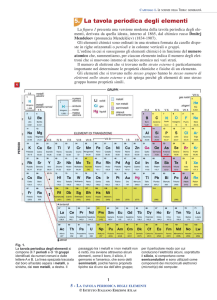
Il sistema periodico
Tra il 1869 e il 1871 uno scienziato russo di nome D. Mendeleev in
seguito ad un lavoro scientifico sistematico raggiunse un risultato
sorprendente: gli elementi disposti secondo i pesi atomici crescenti
mostrano proprietà chimiche e fisiche che si ripetono a intervalli regolari
cioè mostrano proprietà PERIODICHE
Il sistema periodico
Cominciò con l’idrogeno e aggiunse di seguito gli elementi via via più pesanti
H
1
Li
7
Be
9
B
11
C
12
N
14
O
16
F
19
Avrebbe dovuto proseguire con il sodio, ma poiché il sodio ha proprietà simili a quelle del litio lo collocò sotto il
litio cominciando così una nuova riga che concluse con il cloro che ha le stesse proprietà del fluoro
H
Li
Be
B
C
N
O
F
Na
23
Mg
24
Al
27
Si
28
P
31
S
32
Cl
35
In questo modo ogni elemento della seconda riga ha le stesse proprietà del corrispondente elemento della
prima riga
Il sistema periodico
Mendeleev seguendo sempre la regola dei pesi atomici crescenti e incolonnando elementi con proprietà simili
costruì la prima tavola periodica degli elementi
H
Li
Be
B
C
N
O
F
Na
Mg
Al
Si
P
S
Cl
K
Ca
?
?
As
Se
Br
Rb
Sr
In
Sn
Sb
Te
I
Sistemando gli elementi seguendo le regole viste nella diapositiva precedente, lasciò delle caselle vuote
prevedendo la collocazione in quelle caselle di elementi non ancora noti.
Mendeleev era talmente convinto della validità del suo lavoro che scrisse
«OGNI LEGGE NATURALE ACQUISTA PARTICOLARE SIGNIFICATO SCIENTIFICO QUANDO DA ESSA
E’ POSSIBILE RICAVARE CONSEGUENZE PRATICHE, CIOE’ CONSEGUENZE LOGICHE CHE
SPIEGANO CIO’ CHE ANCORA NON E’ STATO SPIEGATO E INDICANO FENOMENI PRIMA DI ALLORA
IGNOTI, E SOPRATTUTTO QUANDO ESSA DA’ LA POSSIBILITA’ DI AVANZARE PREVISIONI
CONTROLLABILI CON L’ESPERIENZA»
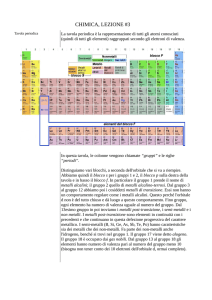
Il sistema periodico
Nella attuale tavola periodica gli elementi sono ordinati secondo il loro numero atomico crescente: ogni
casella è individuata da un numero che corrisponde al numero atomico Z dell’elemento che occupa tale
casella
Il sistema periodico
c’è una relazione tra la forma della tavola periodica e la struttura elettronica degli atomi
Blocco s
Blocco p
Blocco d
Blocco f
Lo schema a fianco mette in
evidenza che la tavola
periodica può essere
suddivisa in quattro blocchi: a
sinistra vi è un blocco con due
colonne di elementi, a destra
un blocco con sei colonne, al
centro uno con dieci colonne e
sotto la tavola vi è un blocco
di quattordici colonne. I
numeri, 2, 6, 10 e 14,
corrispondono esattamente al
numero di elettroni necessari
per completare
rispettivamente i sottogusci
s, p, d e f.
Il sistema periodico
Ogni colonna si chiama gruppo
Ogni gruppo è caratterizzato da un numero
Gli elementi dei due gruppi del blocco s (1, 2) hanno gli elettroni più esterni nel sottoguscio s, gli elementi dei
sei gruppi del blocco p (13, 14, 15, 16, 17, 18) hanno gli elettroni esterni in sottogusci p, gli elementi dei dieci
gruppi del blocco d (3, 4, 5, 6, 7, 8, 9, 10, 11, 12) hanno gli elettroni esterni in sottogusci d, gli elementi dei
gruppi del blocco f hanno gli elettroni esterni in sottogusci f.
Ogni riga orizzontale si chiama periodo
I periodi sono sette e sono numerati
Gli elementi che appartengono ad uno stesso periodo hanno gli elettroni esterni nel guscio energetico avente
un valore di n uguale al numero del periodo di appartenenza, ciò sta a significare che tutti i gusci energetici
inferiori sono completi.
Una corretta lettura della tavola periodica consente di ricavare la struttura elettronica di qualsiasi atomo.
Es: scrivere la configurazione elettronica del Silicio
Il silicio appartiene al periodo 3 (atomi che hanno gli elettroni esterni nel terzo guscio energetico) e al gruppo
14 (atomi che hanno 2 elettroni esterni in sottogusci p) 1s22s22p63s23p2
Questa è la configurazione del neon, l’elemento che chiude il secondo periodo
Quindi si può scrivere la configurazione nel seguente modo
[Ne] 3s23p2
Si può scrivere il simbolo dell’elemento che chiude il periodo precedente e scrivere quindi la configurazione
elettronica esterna
Il sistema periodico
Tutti gli elementi fino all’uranio Z = 92 sono presenti in natura per lo più sotto forma di composti, gli
elementi dal nettunio Z = 93 in poi sono artificiali ossia sono stati preparati in laboratorio tramite
reazioni nucleari
La linea di demarcazione divide i metalli dai non metalli: gli
elementi a sinistra sono metalli, gli elementi a destra non
metalli e gli elementi vicini alla linea semimetalli
Il sistema periodico
I metalli hanno colori diversi, a temperatura ambiente sono solidi tranne il mercurio che è
liquido, sono lucenti, conducono il calore, conducono la corrente elettrica, sono duttili (possono
essere ridotti in fili sottili) e sono malleabili ( possono essere ridotti in lamine sottili)
I non metalli a temperatura ambiente si trovano in stati fisici diversi: cinque sono solidi, uno è
liquido e gli altri sono gassosi, non possiedono le proprietà tipiche dei metalli.
I semimetalli hanno proprietà intermedie tra quelle dei metalli e dei non metalli; proprio perché
hanno una conducibilità elettrica intermedia, alcuni semimetalli sono usati come semiconduttori
nel campo delle tecnologie elettroniche
Il sistema periodico
Alcuni gruppi della tavola periodica prendono dei nomi particolari:
Il gruppo 1
è il gruppo dei metalli alcalini.
tale nome deriva dal fatto che reagiscono facilmente con l’acqua formando
degli idrossidi che hanno proprietà basiche o alcaline.
la reazione può essere così schematizzata:
Na + H2O → NaOH + H2
la reattività di questi metalli aumenta dall’alto verso il basso
Il sistema periodico
il gruppo 2
è il gruppo dei metalli alcalino terrosi.
tranne il berillio anche questi metalli reagiscono con l’acqua per formare gli
idrossidi es: Mg + 2H2O → Mg(OH)2 + H2
la reattività con l’acqua aumenta dall’alto verso il basso.
si trovano in natura sotto forma di composti diffusi nella crosta terrestre
Il sistema periodico
Il gruppo 17
è il gruppo degli alogeni la particella più piccola che li rappresenta è biatomica
Il gruppo 18
è il gruppo dei gas nobili o inerti, il termine inerte deriva dalla loro incapacità di
formare composti
Il sistema periodico
I gruppi dal 3 al 13 formano la famiglia dei metalli di transizione
Hanno tutte le caratteristiche dei metalli anche se la loro reattività
con l’acqua e con l’ossigeno è minore di quella dei metalli alcalini e
alcalino terrosi. Alcuni di questi elementi come il titanio, il vanadio e il
manganese trovano impiego nella preparazione di acciai speciali,
altri come il palladio e il platino il rodio sono importanti perché
vengono usati nell’industria come catalizzatori
Questi 14 elementi che vanno dal Z =58 a Z = 71, pur
facendo parte dei metalli di transizione, costituiscono la famiglia dei lantanidi, sono teneri duttili malleabili e hanno proprietà
ottiche e magnetiche molto interessanti
I 14 elementi, facenti parte dei metalli di transizione
che costituiscono la famiglia degli attinidi sono
radioattivi., gli elementi con numero atomico Z > 92 sono detti transuranici e sono prodotti artificialmente per cui hanno vita breve
Il sistema periodico
le proprietà degli elementi
dipendono dalla configurazione elettronica esterna
variano gradualmente all’interno di un periodo ( nel passare da un elemento all’altro il numero
atomico aumenta di una unità e quindi le proprietà cambiano gradualmente)
Sono le stesse all’interno di un gruppo. (gli elementi di uno stesso gruppo hanno uguale
configurazione elettronica esterna e quindi stesse proprietà)
Sono proprietà periodiche
il raggio atomico
l’energia di ionizzazione
l’affinità elettronica
l’elettronegatività
Il sistema periodico
Gli atomi di uno stesso gruppo sono più grandi procedendo dall’alto verso il basso; gli atomi di un dato
periodo diventano più piccoli procedendo da sinistra a destra. Per poter comprendere i motivi di
questo andamento, dobbiamo considerare due fattori: il guscio energetico a cui appartengono gli
elettroni esterni e la forza di attrazione che la carica nucleare efficace esercita sugli elettroni di esterni
Procedendo dall’alto verso il basso in un gruppo, la carica
nucleare efficace sentita dagli elettroni esterni rimane pressoché
costante mentre gli elettroni esterni si trovano in gusci energetici
sempre più lontani dal nucleo Procedendo da sinistra a destra
lungo un periodo, gli elettroni esterni si trovano sempre nello
stesso guscio energetico mentre la carica nucleare efficace aumenta di una unità e quindi gli elettroni
esterni si avvicinano al nucleo
Il sistema periodico
L’energia di ionizzazione è l’energia necessaria per rimuovere un elettrone da un atomo isolato.
A + energia → A+ + e- (A simbolo dell’atomo, A+ ione positivo o catione)
L’energia di prima ionizzazione (l’energia necessaria per togliere un solo elettrone dall’atomo e
precisamente un elettrone che si trova nel sottoguscio più esterno) aumenta lungo un periodo e
diminuisce lungo un gruppo
l’energia di prima ionizzazione aumenta lungo un
periodo in quanto gli elettroni esterni si trovano
sempre nello stesso guscio energetico però risentono
di una forza nucleare sempre più alta (il numero
atomico e quindi il numero di cariche positive presenti
nel nucleo aumenta progressivamente.
l’energia di prima ionizzazione diminuisce lungo un
gruppo in quanto gli elettroni esterni si trovano in
gusci energetici sempre più lontani dal nucleo
Il sistema periodico
L’affinità elettronica
L’elettronegatività
Quando un atomo acquista un elettrone libera energia che si chiama
affinità elettronica A + e−
A− + energia (affinità elettronica)
A rappresenta il simbolo di un elemento A− è il suo ione negativo o
anione
L’elettronegatività di un elemento misura la sua tendenza ad
attrarre gli elettroni più esterni di un altro elemento
diventando così anione mentre l’elemento che cede
l’elettrone diventa catione
L’affinità elettronica e l’elettronegatività aumentano lungo un periodo e diminuiscono lungo un gruppo.
.
Il sistema periodico
Anche le proprietà chimiche degli elementi variano in modo graduale e periodico. Nella tabella seguente sono riportate le formule
dei composti con l’ossigeno e con l’idrogeno degli elementi del 3° periodo, a esclusione ovviamente del gas nobile
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
0,5
1
1,5
2
2,5
3
3,5
NaH
MgH2
AlH3
SiH4
PH2
H2S
HCl
1
2
3
4
3
2
1
Sotto a ogni formula è riportato il valore del rapporto tra il numero di atomi di ossigeno o di idrogeno e il numero di
atomi dell’altro elemento.
Quando gli elementi di un periodo si combinano con l’ossigeno e con l’idrogeno, si formano composti le cui formule
cambiano seguendo una precisa regolarità.
◼ Nelle formule dei composti con l’ossigeno il rapporto tra il numero di atomi di ossigeno e il numero di atomi dell’altro
elemento aumenta in modo regolare: questo indica che lungo il periodo aumenta il numero di atomi di ossigeno che si
combina con un atomo dell’altro elemento.
◼ Nelle formule dei composti con l’idrogeno il rapporto il numero di atomi di idrogeno e il numero di atomi dell’altro
elemento aumenta e poi diminuisce in modo regolare.
Questo andamento regolare si riscontra anche negli altri periodi.
Se consideriamo gli elementi di ogni gruppo, si ha che essi formano composti con l’ossigeno e con l’idrogeno
caratterizzati da una formula analoga
Nella tabella sono riportate le formule dei composti con l’ossigeno e con l’idrogeno degli elementi del gruppo 14 e del
gruppo 15. Le formule analoghe dei composti confermano che gli elementi dello stesso gruppo hanno comportamento
chimico simile.
SiO
Gruppo 14
CO2
Gruppo 15
N2O5
2
GeO2
SnO2
PbO2
CH4
SiH4
GeH4
SnH4
PbH4
P2O5
As2O5
Sb2O5
Bi2O5
NH3
PH3
AsH3
SbH3
BilH3