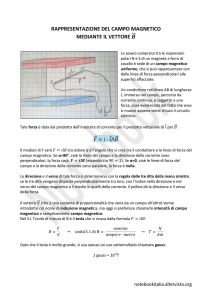
UNIVERSITA’ DEGLI STUDI DI TRIESTE
Dipartimento di Ingegneria e Architettura
CORSO DI LAUREA MAGISTRALE IN INGEGNERIA CLINICA
TESI DI LAUREA
IN
COMPLEMENTI DI STRUMENTAZIONE BIOMEDICA
OTTIMIZZAZIONE DELLA QUALITA’ DI IMMAGINI MRI
AD ALTA RISOLUZIONE PER LO STUDIO DELLA
MALATTIA DI ALZHEIMER
Laureanda
Relatore
Valentina Mancarella
Prof.ssa Renata Longo
Correlatore
Dott. Francesco Brun
Anno accademico 2012/2013
2
“Una volta Marina mi disse che ricordiamo
solo quello che non è mai accaduto.”
Da “Marina” di Carlos Ruiz Zafòn
3
4
INDICE
1.
INTRODUZIONE .....................................................................................................................9
2.
L’ALZHEIMER E I SUOI STUDI ......................................................................................... 12
2.1 La malattia di Alzheimer ......................................................................................................... 12
2.2 L’analisi Longitudinale ........................................................................................................... 16
2.3 Workflow automatico “MIND” ............................................................................................... 19
2.3.1 Il Denoising...................................................................................................................... 19
2.3.2 La Co-registrazione .......................................................................................................... 21
2.3.3 La Normalizzazione .......................................................................................................... 22
2.3.4 L’estrazione delle “scatole” ippocampali ......................................................................... 24
3.
INTENSITY INHOMOGENEITY ......................................................................................... 26
3.1 La Risonanza Magnetica Nucleare ........................................................................................... 26
3.2 Intensity Inhomogeneity .......................................................................................................... 27
3.2.1 Le Sorgenti e i Modelli di IIH ........................................................................................... 28
3.3 La classificazione dei Metodi di Correzione ............................................................................ 32
3.3.1 I metodi Prospettici .......................................................................................................... 32
3.3.2 I metodi Retrospettivi........................................................................................................ 33
3.4 Misure Preliminari su Oggetto test........................................................................................... 36
4.
MATERIALI E METODI ...................................................................................................... 45
4.1 Il campione di studio ............................................................................................................... 45
4.1.1 Il protocollo MP-RAGE .................................................................................................... 46
4.1.2 Il nuovo protocollo ad Alta Risoluzione ............................................................................ 48
5
4.2 I Software di Correzione.......................................................................................................... 49
4.2.1 SPM5 ............................................................................................................................... 50
4.2.2 BRAINSUITE ................................................................................................................... 52
4.3 Il Sistema di Confronto ........................................................................................................... 54
4.4 I Riferimenti Assoluti nell’immagine ....................................................................................... 56
4.5 La Calibrazione con Riferimenti Assoluti ................................................................................ 61
5.
RISULTATI ............................................................................................................................ 64
5.1 Le Correzioni di Intensity Inhomogeneity ................................................................................ 64
5.2 La Correzione SPM5 su MP-RAGE MRI ................................................................................ 68
5.3 La Correzione SPM5 su HR MRI ............................................................................................ 70
5.4 Confronto tra MP-RAGE e HR MRI ....................................................................................... 72
5.5 La Normalizzazione con Nuovo Oggetto di Calibrazione ......................................................... 73
6.
DISCUSSIONE E CONCLUSIONI........................................................................................ 81
APPENDICE ................................................................................................................................... 85
A.1 La Risonanza Magnetica Nucleare .......................................................................................... 85
A.1.1 Preludio all’Imaging di Risonanza Magnetica .................................................................. 85
A.1.2 La generazione del segnale RM ........................................................................................ 89
A.1.3 La localizzazione del segnale RM ..................................................................................... 93
A.1.4 La formazione dell’immagine MRI ................................................................................... 99
A.2 Procedure di Installazione e Accettazione di apparecchiature di RM ..................................... 102
A.2.1 Le Procedure d’installazione .......................................................................................... 102
A.2.2 Le Procedure d’accettazione .......................................................................................... 109
A.3 Lo standard DICOM ............................................................................................................. 113
6
BIBLIOGRAFIA E SITOGRAFIA .............................................................................................. 117
RINGRAZIAMENTI .................................................................................................................... 125
7
8
1. INTRODUZIONE
Negli ultimi anni, le tecniche di imaging del sistema nervoso centrale e del cervello in
particolare, hanno assunto un ruolo sempre più decisivo in ambito clinico, come strumenti in
grado di permettere la visualizzazione in vivo delle strutture neuro-anatomiche e di rilevarne
cambiamenti morfologici o funzionali, permettendo così la diagnosi e la prognosi di malattie
cerebrali. Una delle tecniche di neuroimaging di maggior rilevanza, in questo contesto, è
l’imaging di Risonanza Magnetica (RM) Nucleare. Una sfida importante nel campo della
medicina attuale è la diagnosi precoce della Malattia di Alzheimer. Le immagini di RM (o
MRI – Magnetic Resonance Imaging) possono evidenziare l’atrofia dei tessuti cerebrali,
causata dalla malattia stessa, e la letteratura scientifica evidenzia che nei malati di Alzheimer,
l’atrofia ha in genere una diffusione nel cervello non uniforme ed interessa in primis le
strutture anatomiche dei lobi temporali e dell’ippocampo; ed è per tale motivo che
l’ippocampo è ritenuto un promettente biomarker per la valutazione dell’Alzheimer. Una linea
di sviluppo di metodi di diagnosi precoce si basa quindi sulle immagini di RM, ed ha portato
alla nascita di ampie collaborazioni internazionali per la raccolta di tali immagini insieme a
dati clinici e biochimici, da rendere disponibili ai gruppi di ricerca.
Per studiare l’evoluzione della malattia, si segue l’analisi longitudinale, ovvero l’osservazione
della patologia nel tempo, basata sul confronto di immagini di RM dello stesso paziente
acquisite in tempi diversi, a distanza di 6 mesi l’una dall’altra per esempio, per valutarne i
cambiamenti morfologici causati dall’atrofia cerebrale. L’intento è quello di verificare se tale
atrofia anticipa il presentarsi dei sintomi della malattia di Alzheimer. Poiché le terapie attuali
hanno solo la capacità di rallentare l’evoluzione della malattia, la diagnosi precoce è l’unico
strumento per garantire la qualità della vita del paziente.
In quest’ottica di analisi
longitudinale, è stata sviluppata una procedura automatica di elaborazione delle immagini
MRI, in grado di estrarre le informazioni anatomiche della sola regione ippocampale del
cervello così che le “scatole”, o “box”, ippocampali estratte dalle immagini ripetute, possano
essere analizzate per valutare l’evoluzione della degenerazione neuronale. Questa pipeline
automatica è stata implementata dal progetto MIND (Medical Imaging for Neurodegenerative
Diseases) dell’INFN (Istituto Nazionale di Fisica Nucleare) sezione di Genova e permette di
estrarre da un’immagine volumetrica del cervello intero la sola area anatomica relativa
9
all’ippocampo per poi svolgere analisi statistiche sul suo grado di atrofia e sulla velocità della
stessa.
Dagli studi condotti sui grandi database di immagini si dimostra che le immagini RM dello
stesso soggetto sano (ossia senza alcuna patologia cerebrale) acquisite in momenti diversi,
anche a poca distanza l’una dall’altra, risultano non essere perfettamente sovrapponibili. Per
poter allora utilizzare con successo le procedure automatiche appena descritte, in ambito
clinico, come strumenti di supporto alla diagnosi radiologica, occorre ridurre queste
variabilità. In termini di analisi longitudinale, è necessario che dal confronto di immagini
ripetute nel tempo dello stesso paziente le differenze riscontrate siano imputabili ad effettive
variazioni della morfologia delle strutture cerebrali e non alle incertezze sulle misure o agli
artefatti che degradano le immagini stesse.
Per affrontare tale problematica, l’INFN, sezione di Trieste e di Genova, e l’Università degli
studi di Trieste hanno recentemente sviluppato una nuova sequenza di acquisizione di
immagini RM ad Alta Risoluzione (High Resolution, HR) per ottenere immagini ad alto
contrasto e ad alta risoluzione spaziale (0.60 x 0.60 x 0.59 mm3), centrate sulle regioni
ippocampali e paraippocampali del cervello. Aumentare la risoluzione spaziale significa
incrementare il numero di pixel dal contenuto omogeneo permettendo così di apprezzare
meglio i dettagli anatomici e ottenere maggiori informazioni morfologiche.
Lo scopo del presente lavoro di tesi è l’ottimizzazione della qualità delle immagini HR
acquisite con questo nuovo protocollo. Per raggiungere tale obiettivo si sono seguite due
strade: la prima rivolta a correggere la disomogeneità di segnale che altera l’immagine di RM,
definita Intensity Inhomogeneity (IIH), applicando metodi proposti dalla letteratura ed
implementati da software di correzione. La seconda strada punta alla definizione di una nuova
procedura di normalizzazione dei toni di grigio dell’immagine, applicabile alle HR, che si
basi su riferimenti assoluti presenti nell’immagine stessa con la realizzazione di un apposito
oggetto di calibrazione.
Pertanto in questo lavoro di tesi, il secondo capitolo è dedicato alla presentazione della
malattia di Alzheimer e del progetto MIND dell’INFN. In particolare verrà presentata la
tecnica di analisi delle immagini sviluppata per la valutazione dell’ippocampo e della sua
degenerazione. Di questa procedura verranno analizzati alcuni punti critici, oggetto di questo
10
lavoro di tesi: la correzione per gli artefatti da disomogeneità del segnale e la calibrazione di
toni di grigio per permettere confronti quantitativi tra le immagini.
Il capitolo successivo è dedicato alla correzione delle immagini per l’artefatto della Intensity
Inhomogeneity. Sarà quindi introdotto il problema della stima e della correzione della IIH,
saranno descritti i metodi di correzione proposti in letteratura e sarà presentato uno studio
preliminare su immagini di oggetti test acquisiti per questa tesi.
Il capitolo 4 è dedicato alla presentazione del sistema RM utilizzato in questo lavoro di tesi,
delle sequenze di acquisizione, del gruppo di volontari studiato e dei SW di correzione
utilizzati. Viene inoltre presentato un nuovo fantoccio di calibrazione sviluppato per la
correzione dei toni di grigio.
Nel capitolo 5 sono presentati i risultati relativi al pre-processing di correzione della IIH e al
suo contributo alla correlazione tra le scatole dell’ippocampo ripetute sui volontari sani. E
inoltre vengono presentati i primi risultati ottenuti con il nuovo metodo di calibrazione basato
su riferimenti assoluti presenti nell’immagine grazie al nuovo fantoccio sviluppato. Questa
metodica viene proposta come un valido metodo alternativo al criterio di normalizzazione
attualmente utilizzato dalla pipeline automatica MIND, basato sulla definizione di toni di
grigio di un cervello standard di riferimento, che quindi non tiene conto della variabilità
interindividuale.
Il capitolo conclusivo riassume e discute i risultati ottenuti ed indica l’evoluzione della ricerca
che sembra pronta alla fase di studio clinico.
In Appendice, a completamento della presentazione della strumentazione per imaging di RM,
si riporta un estratto della relazione di tirocinio universitario svolto dalla laureanda,
riguardante le procedure d’installazione e accettazione di apparecchiature per imaging di
Risonanza Magnetica Nucleare.
11
2. L’ALZHEIMER E I SUOI STUDI
2.1 La malattia di Alzheimer
La malattia di Alzheimer (Alzheimer’s Disease AD), detta anche morbo di Alzheimer [1], è la
forma di demenza degenerativa invalidante più comune, con esordio prevalentemente senile.
La sua ampia e crescente diffusione nella popolazione, la non efficacia delle terapie
disponibili e l’elevate risorse necessarie per la sua gestione (sociali, emotive ed economiche
che gravano in gran parte sui familiari dei malati), la rendono una delle patologie a più grave
impatto sociale del Mondo [2][3]; in Italia ne soffrono circa 492.000 persone e 26,6 milioni
nel Mondo, secondo lo studio della Johns Hopkins Bloomberg “School of Public Health” di
Baltimora (USA). Tali dati sono destinati a crescere nei prossimi anni a causa
dell’innalzamento dell’età media della popolazione. Viene anche definita demenza di
Alzheimer essendo un deterioramento cognitivo cronico progressivo e tra tutte le demenze è
la più comune con 80-85% di tutti i casi totali.
La patologia è stata decritta per la prima volta nel 1906, dallo psichiatra e neurologo tedesco
Aloysius Alzheimer (Marktbreit 1864 – Breslavia 1915), a seguito del caso di una sua
paziente, la signora Auguste Deter, di 51 anni. Nel corso della visita, le mostrò diversi oggetti
e poco dopo le domandò cosa le era stato mostrato, Lei però non poteva ricordare.
Inizialmente registrò il suo comportamento come “disordine di amnesia”, ma in seguito la
signora Deter fu la prima paziente alla quale venne diagnosticata la malattia di Alzheimer.
Anche se il decorso clinico della malattia è in parte specifico per ogni individuo, la patologia
causa diversi sintomi comuni alla maggior parte dei pazienti. I primi sintomi osservabili sono
spesso erroneamente considerate problematiche legate all’età, o manifestazioni di stress.
Quando s’ipotizza presenza di Alzheimer, la diagnosi viene confermata tramite specifici test
cognitivi e comportamentali, seguiti da indagini cliniche su immagini cerebrali. Normalmente
le fasi dell’evoluzione della malattia di Alzheimer sono tre. La prima fase è caratterizzata da
un calo degli interessi e della memoria di lieve entità, che significa l’incapacità di acquisire
nuovi ricordi e la difficoltà nel ricordare eventi osservati recentemente (ricordare cosa si è
mangiato a pranzo, cosa si è fatto durante il giorno, ricordare l’immediato futuro, come andare
a un appuntamento). Nella seconda fase il calo delle capacità cognitive è più evidente e si
12
manifestano deficit dell’attenzione, della capacità critica e di giudizio; la perdita della
memoria arriva a colpire anche la memoria retrograda (riguardanti fatti della vita passata). Al
termine di questa fase si presentano problemi nell’orientamento, nello scrivere e nel leggere,
nel comprendere e pronunciare parole. La terza fase è quella in cui si hanno gravi disturbi
della memoria a breve e a lungo termine, totale incapacità di riconoscere volti, difficoltà a
compiere movimenti, a mangiare e a deglutire. Nelle fasi intermedie possono manifestarsi
problematiche comportamentali (vagabondaggio, coazione a ripetere movimenti o azioni,
reazioni comportamentali incoerenti) o psichiatriche (confusione, ansia, depressione, deliri e
allucinazioni).
Con l’invecchiamento naturale, il cervello va incontro a modifiche anatomo-funzionali non
molto diverse da quelle che si determinano alla presenza della malattia di Alzheimer.
Fisiologicamente si ha una perdita graduale della sostanza cerebrale con conseguente
riduzione del peso e del volume del cervello, tuttavia in presenza della malattia, questa perdita
è molto più marcata (figura 2.1).
Figura 2.1: Confronto tra il cervello di un soggetto sano (a sinistra) e di un soggetto
malato di Alzheimer (a destra), di pari età.
La letteratura medica [5] mette in evidenza che nei malati di AD, l’atrofia ha in genere una
diffusione nel cervello non uniforme ed interessa le strutture anatomiche dei lobi temporali e
in particolare l’ippocampo. L’ippocampo (destro e sinistro) è una struttura fondamentale nei
meccanismi di memoria, ed è quella che risente più precocemente degli effetti della malattia
di Alzheimer (figura 2.2). Un cervello umano è costituito da circa cento miliardi di neuroni
13
comunicanti attraverso il sistema di connessione, chiamato sinapsi (regione in cui un
terminale assonale incontra la sua cellula bersaglio) [8], attraverso il quale si propagano i
segnali nervosi. Studi medici in ambito di AD sostengono che la causa del deterioramento
delle cellule nervose sia un frammento proteico chiamato beta-amolide, responsabile della
formazione di depositi amiloidi che gradualmente si accumulano e vanno ad interferire con
l’attività delle cellule cerebrali causandone il deterioramento e successivamente la morte. In
particolare vengono danneggiate le sinapsi celebrali, con una notevole perdita delle funzioni
collegate ai processi cognitivi e alla memoria.
Il fattore di rischio maggiore per lo sviluppo della patologia è l’età. Nella maggior parte dei
casi, la prima manifestazione dei sintomi caratterizzanti l’AD avviene in età superiore a 65
anni, ma è lecito ipotizzare che l’inizio vero e proprio avvenga ad età inferiore ma in modo
silente, senza manifestazione di sintomi.
La diagnosi dell’AD si basa, inizialmente, sulla valutazione di sintomi neurologici e
comportamentali legati a disturbi sulla memoria, del linguaggio e della percezione spaziale.
Ad oggi gli esami neuropsicologici sono l’unico criterio clinico riconosciuto per la diagnosi
della patologia. Tale esame consiste nel sottoporre il paziente ad una serie di test con lo scopo
di verificarne le capacità cognitive. Per quanto la neuropsicologia abbia una lunga tradizione e
sia migliorata nei metodi e nell’analisi dei dati, essa richiede un’interazione diretta medico
paziente, che molto spesso è difficile rendere standard tra i diversi casi clinici. Per stabilire dei
criteri diagnostici più oggettivi ed uniformi si ricorre spesso all’utilizzo di esami neurologici,
tipicamente Tomografia ad Emissione di Protoni (PET, Positron Emission Tomography) e
Risonanza Magnetica (RM). Attraverso lo studio d’immagini di RM è possibile individuare la
malattia anche negli stadi iniziali e distinguere forme lievi da forme più gravi della stessa,
valutando il livello di atrofia cerebrale (figura 2.3).
Attualmente non esiste una cura per la malattia di Alzheimer; gli unici interventi medici
palliativi eseguibili hanno lo scopo di rallentare il più possibile l’avanzare della malattia e di
ridurre gli effetti dei sintomi, garantendo il più possibile al paziente uno stile di vita autonomo
e dignitoso.
14
Figura 2.2: Lobo temporale e ippocampo.
Figura 2.3: Confronto tra l’atrofia dovuta al naturale invecchiamento (sinistra)
e quella patologica (destra).
15
2.2 L’analisi Longitudinale
Negli ultimi anni le tecniche avanzate d’indagini morfologiche hanno permesso lo sviluppo di
nuovi metodi diagnostici e chirurgici. In particolare, le immagini digitali hanno dato la
possibilità di ottenere informazioni sia quantitative, come volumi, aree e distanze, sia la
realizzazione di una rete multimediale di condivisione delle immagini. L’imaging di
Risonanza Magnetica (RM) Nucleare è parte integrante del processo di valutazione clinica dei
pazienti con sospetta malattia di Alzheimer (Alzheimer’s Disease, AD). La letteratura medica
considera l’atrofia di alcune strutture del lobo temporale come un valido marcatore
diagnostico in fase di lieve alterazione cognitiva e l’imaging di RM è in grado di evidenziare
le caratteristiche tipiche della patologia.
La ricerca di nuovi biomarker dell’AD, ha lo scopo di permettere una diagnosi quanto più
precoce possibile, quando la patologia è ancora asintomatica [7] e quindi segnare l’inizio di
un eventuale trattamento. In questo contesto, trova un ruolo fondamentale l’Analisi
Longitudinale delle immagini RM dell’encefalo di soggetti a rischio di AD. Quest’analisi
consiste nell’osservazione nel tempo dell’evoluzione della degenerazione dei tessuti cerebrali,
valutando l’atrofia su immagini di RM.
Nella pratica clinica i pazienti vengono classificati in tre gruppi: Sani (detti anche controlli),
Mild Cognitive Impairment (MCI) e soggetti affetti da demenza (AD). Chi appartiene al
gruppo MCI manifesta un deficit cognitivo lieve e rappresenta uno stato intermedio tra una
situazione di normali capacità cognitive e di demenza; tuttavia l’appartenenza a questo gruppo
non implica lo svilupparsi della demenza. Al gruppo AD appartengono tutti i soggetti affetti
da malattia di Alzheimer con severi deficit cognitivi e funzionali. La figura 2.4 mette in
evidenza come alcuni test di memoria e di linguaggio siano sensibili in modo diverso nei
differenti stati della malattia e quindi la loro utilità per la diagnosi cambia a seconda dello
stato di avanzamento della patologia. I test di memoria sono utili per la diagnosi nella fase
MCI, perché i risultati variano sensibilmente con l’avanzare della malattia, ma sono meno
utili nel monitorarne l’avanzamento nella fase di demenza. I risultati dei test di comprensione
verbale iniziano a cambiare più tardi nel corso della malattia, durante la fase MCI mostrano
una lieve o nessuna compromissione (4), quindi non possono essere usati in fase di diagnosi.
Questi test diventano più sensibili in fase di demenza, quando risentono di un rapido
cambiamento con l’avanzare della malattia (5).
16
Figura 2.4: Andamento temporale dell’efficacia dei test neuropsicologici nei vari
stadi della malattia di Alzheimer.
Uno degli obiettivi dell’analisi longitudinale per l’AD è ricercare nuovi marcatori biologici
che siano in grado di discriminare i soggetti sani dai malati, già nella fase asintomatica della
malattia. La figura 2.5, ottenuta tramite studi longitudinali e valutazioni statistiche, evidenzia
le curve di sensibilità attese per alcuni indici morfologici. Si può osservare come alcuni di
questi indicatori siano sensibili al progredire della patologia già anni prima della comparsa dei
primi sintomi [23]. Queste considerazioni indicano che sia possibile trovare un metodo,
basato sui dati clinici e sulle neuro immagini, in grado di fornire delle informazioni relative
alla malattia di Alzheimer in tempi antecedenti alla comparsa dei sintomi.
17
Figura 2.5 :Ipotesi della capacità discriminante dei marcatori morfologici e funzionali
nei vari stadi della malattia di Alzheimer.
18
2.3 Workflow automatico “MIND”
Per studiare l’evoluzione della malattia, si segue l’Analisi Longitudinale, ovvero
l’osservazione della patologia nel tempo, e basata sul confronto di immagini di RM dello
stesso paziente acquisite in tempi diversi, a distanza di 6 mesi l’una dall’altra per esempio, per
valutarne i cambiamenti morfologici causati dall’atrofia cerebrale. In quest’ottica di analisi
longitudinale è stata sviluppata una procedura automatica di elaborazione delle immagini di
RM, in grado di estrarre le informazioni anatomiche della sola regione ippocampale del
cervello, così che le “scatole”, o “box”, ippocampali estratte dalle immagini ripetute possano
essere confrontate per valutare l’evoluzione della degenerazione neuronale. Questa pipeline
automatica è stata implementata dal progetto MIND (Medical Imaging for Neurodegenerative
Diseases) dell’INFN (Istituto Nazionale di Fisica Nucleare) sezione di Genova, e permette di
estrarre da un’immagine a cervello intero la sola area anatomica relativa all’ippocampo.
Durante il processo le immagini subiscono diversi trattamenti (definiti pre-processing) per
raggiungere un buon grado di omogeneità e rendere possibile il confronto tra le stesse. Il
trattamento di pre-processing conta tre operazioni fondamentali:
1. Denoising
2. Co-registrazione
3. Normalizzazione
Successivamente, le immagini sono “pronte” per l’estrazione della box ippocampale.
2.3.1 Il Denoising
La riduzione del rumore introdotto in fase di acquisizione, permette di migliorare il rapporto
segnale rumore e uniformare la qualità delle immagini provenienti anche da apparecchiature
diverse. Per ridurre il rumore si applica un filtro piramidale agente nello spazio delle
frequenze tramite una trasformata Wavelet particolare [24] invariante per rotazioni e
traslazioni. Per eseguire il denoising (figura 2.6) si sceglie un valore di soglia sotto al quale
gli artefatti dell’immagine si assumano attribuibili al rumore. Tale soglia viene individuata
tramite lo Structural Similiraty Index (SSI) [25], che misura la similarità delle strutture,
19
dell’intensità e del contrasto tra l’immagine prima e dopo l’applicazione del filtro. Per ogni
direzione dello spazio, e per ogni slice, si applica il filtro. Le tre immagini filtrate sono poi
fuse in un’immagine “media” per migliorare il rapporto segnale-rumore. Per stabilire la soglia
di rumore, l’idea è di preservare le strutture dell’immagine, perciò si utilizza il SSI tra
l’immagine grezza e quella filtrata, calcolando la derivata prima, la derivata seconda e il
punto di flesso della funzione SSI e il valore della soglia quindi è definito come il punto
medio tra lo zero della derivata prima e il punto di flesso. Il risultato di questo processo è
mostrato in figura 2.7.
Figura 2.6: Il processo di Denoising.
Figura 2.7: esempio del risultato del processo di denoising su un’immagine sagittale
dell’ippocampo destro: immagine originale (a sinistra) e corretta dal rumore (a destra).
20
2.3.2 La Co-registrazione
Una volta che le immagini sono state pulite da artefatti dovuti al rumore, devono essere
necessariamente allineate per poter rendere automatica l’individuazione e l’estrazione delle
varie strutture. Il processo di co-registrazione è una mappatura di un’immagine “mobile”
rispetto un’altra “fissa” di riferimento (o template). La necessità di questa fase è che si
vogliono confrontare tra loro i singoli voxel di più immagini di RM per paziente, perciò questi
devono essere più allineati possibile. Il procedimento ricerca una trasformazione spaziale che
esegue la mappatura dei punti di ogni immagine sugli omologhi dell’immagine di riferimento
che nel caso in esame è il volume ICBM152, definito dal Montreal Neurological Institute
(MNI) (figura 2.8). Oltre alla trasformazione (per esempio rigida, affine, deformabile), il
processo definisce una metrica (per esempio somma dei quadrati delle differenze delle
intensità, cross-correlazione) e un processo di ottimizzazione. Nel contesto di lavoro la
trasformazione è a 12 parametri che definiscono i gradi di libertà, di cui 3 corrispondono alla
traslazione, 3 alla rotazione, 3 all’applicazione di una dilatazione su ogni asse e 3
all’applicazione di trasformazioni trasversali (figura 2.9).
Figura 2.8: Il template ICBM152.
21
Translation
(3 parameters)
Rotation
(3 parameters)
Shearing
(3 parameters)
Scaling
(3 parameters)
* Shearing slides one edgeFigura
of an image along the X or Y axis, creating a parallelogram
2.9: La Co-registrazione.
2.3.3 La Normalizzazione
La procedura di normalizzazione ha lo scopo di uniformare i valori dei livelli di grigio delle
immagini, in modo tale che in ogni immagine vengano associati ai tessuti come materia
bianca, grigia o liquido cerebrale, gli stessi valori di grigio. Per fare questo, la procedura
automatica considera una regione del cervello come riferimento, per esempio il corpo calloso,
facilmente riconoscibile e contenete tutti i tre tipi di tessuto appena elencati. La regione scelta
nell’immagine di riferimento, il template ICBM152 (figura 2.8), conta 50x120x50 = 300.000
voxel ed è orientata lungo l’asse del corpo calloso dell’encefalo (figura 2.10). All’interno di
questa regione d’interesse, per ciascuno dei tre tessuti viene riportato il valore medio ricavato
dagli istogrammi delle intensità dell’immagine. Questa regione ora viene registrata
sull’immagine di cui vogliamo estrarre la regione dell’ippocampo, attraverso una
trasformazione analogamente al processo descritto in 2.3.2. Ora da ogni regione definita
sull’immagine acquisita, si identificano i tre tessuti GM, WM, e CFS e se ne calcolano i valori
medi, che vengono poi abbinati ai corrispondenti livelli medi della regione di riferimento,
attraverso una spline cubica che passa tra 0, 1 e i tre punti definiti dal template, normalizzati
tra 0 e 1.
22
Figura 2.10: rappresentazione della regione utilizzata per la normalizzazione dei livelli di grigio
(scatola rossa).
Le intensità dei livelli di grigio sono portati a valori comprese tra 0 e 1 attraverso la seguente
trasformazione:
new Iij =
dove Imax e Imin rappresentano rispettivamente i valori massimi e minimi delle intensità di
grigio. Questa normalizzazione dei livelli di grigio non lineare confronta le intensità medie dei
tre tessuti della regione d’interesse tra l’immagine da normalizzare e il riferimento, ed
interpola a tutti gli altri punti (figura 2.11).
Figura 2.11: esempio di normalizzazione dei livelli di grigio sull’immagine.
Si specifica che per le immagini acquisite mediante il nuovo protocollo ad alta risoluzione
(HR), non è possibile applicare il metodo di normalizzazione appena descritto, poiché infatti
il corpo calloso non è completamente visibile. Pertanto per le HR questa fase del processing
23
viene saltata ed è stato definito un criterio per la normalizzazione dei livelli di grigio, per
avere un’immagine con tali livelli compresi tra [0,1]. E’ stato utilizzato un metodo in cui
l’immagine normalizzata g’ è ottenuta mediate la seguente formula:
g’ = g(x,y) / 4096 – μg + 0.5
in cui, g(x,y) rappresenta il pixel alla posizione (x,y) dell’immagine in input g; 4096 è il
risultato di 212 con 12 bit usati per la quantizzazione dei livelli di grigio nel sistema di RM e
μg è il valore medio dei livelli di grigio nell’immagine in input, dopo la normalizzazione. Si
somma un fattore 0.5 affinché il risultato della normalizzazione non sia centrata sullo 0.
2.3.4 L’estrazione delle “scatole” ippocampali
L’evidenza clinica stabilisce che la malattia di Alzheimer colpisca dapprima in maniera più
marcata le zone e le strutture del lobo temporale, rispetto alle altre strutture del cervello. E lo
scopo ultimo della seguente procedura automatica è la valutazione del livello di atrofia delle
stesse, causata dalla malattia.
La procedura dell’estrazione di un biomarker per la diagnosi della malattia di Alzheimer è
completamente automatica e comincia con le procedure pre-processing, descritte ai paragrafi
2.3.1, 2.3.2 e 2.3.3. Le immagini acquisite vengono inviate al gruppo in collaborazione MIND
dell’INFN di Genova, per l’estrazione delle “scatole” dell’ippocampo, che identificano un
volume di cervello a forma di parallelepipedo (box) con dimensioni dell’ordine di alcuni cm
per lato; in particolare vengono estratte le scatole relative all’ippocampo destro (40x75x30
mm3) e all’ippocampo sinistro (40x75x30 mm3). Una volta che i template (scatole di
riferimento) sono definiti per un dato VOI, viene applicata una registrazione rigida per
mapparli sulle immagini in studio. In figura 2.12 è riportato un esempio di VOI estratto.
24
Figura 2.12: volume dell’ippocampo sinistro da immagine acquisita con protocollo
MP-RAGE (a sinistra) e da immagine acquisita con il nuovo protocollo ad Alta
Risoluzione (a destra).
25
3. INTENSITY INHOMOGENEITY
3.1 La Risonanza Magnetica Nucleare
La Risonanza Magnetica (RM) Nucleare rappresenta lo studio delle proprietà magnetiche del
nucleo dell’atomo; sia i protoni che i neutroni esibiscono proprietà magnetiche legate al loro
spin (momento angolare) e alla loro distribuzione di carica. In particolare tutto l’imaging di
RM si basa sul segnale del nucleo di Idrogeno (H+), costituito da un unico protone. I primi
studi di RM risalgono agli anni 40, come strumento d’indagine per ricerche in ambito chimico
e biochimico; negli anni 70, è stato scoperto che i gradienti di campo magnetico possono
permettere la localizzazione del segnale RM e la generazione d’immagini il cui contrasto e’
determinato dalle proprietà magnetiche del protone, fornendo importanti informazioni
cliniche. Dal 1980 si è verificata la grande diffusione di tale apparecchiatura in ambito
clinico. Infatti l’alto contrasto, la differenziazione dei tessuti molli e la sicurezza per il
paziente (dato dal fatto che non utilizza radiazioni ionizzanti) hanno fatto si che la RM
diventasse per molti esami la tecnica di indagine preferenziale, a dispetto della CT (Computed
Tomography). Tuttavia ci sono alcuni svantaggi da considerare, che includono l’elevato costo
dell’apparecchiatura, i lunghi tempi per l’acquisizione di un immagine, artefatti significativi e
problemi legati alla claustrofobia dei pazienti sottoposti all’indagine.
Approfondimenti sulla fisica della Risonanza Magnetica Nucleare e sulla formazione delle
immagini MRI sono riportati in Appendice 1, la descrizione tecnica del tomografo RM e le
procedure di installazione ed accettazione sono riportate in Appendice 2.
26
3.2 Intensity Inhomogeneity
L’imaging di Risonanza Magnetica (RM) misura la risposta dei nuclei d’idrogeno immersi in
un campo magnetico, i quali, a seguito di un impulso di eccitazione a Radiofrequenza (RF),
vengono perturbati dalla loro condizione di equilibrio. L’immagine è ottenuta misurando e
processando il segnale emesso dai nuclei d’idrogeno nel loro ritorno all’equilibrio.
Un’immagine è normalmente affetta da artefatti che ne alterano la qualità. La stessa immagine
invece “non corrotta”, mostrerebbe il segnale dipendente solamente dalle caratteristiche del
tessuto (densità protonica, T1 e T2) e dai parametri di acquisizione dell’immagine stessa (TE
e TR).
Nell’attuale sviluppo di tools diagnostici, un problema comune è la correzione della Intensity
Inhomogeneity (IIH) o Bias Field, che altera l’intensità di segnale delle immagini di risonanza
magnetica. La IIH comporta una variazione dell’intensità del segnale proveniente dallo stesso
tessuto non imputabile ad effettive differenze anatomiche o morfologiche. Ciò può essere
causato dalla strumentazione, dalla non uniformità dell’impulso di eccitazione a
radiofrequenza (che genera la disomogeneità dovuta a campo magnetico B1), dalla
disomogeneità del campo magnetico principale, o anche dal posizionamento e dai movimenti
del paziente [9] all’interno del gantry. Inoltre questo fenomeno è particolarmente severo nelle
immagini MRI acquisiste con bobine di superficie. Questo fenomeno viene definito in
letteratura anche come Bias Field, rappresentato come un segnale a bassa frequenza e fa sì che
l’intensità del segnale proveniente dallo stesso tessuto vari in base alla sua posizione
nell’immagine (figura 3.1) [10]. In figura 3.1A è mostrata un’immagine di RM con artefatti di
questo tipo, in cui si vede come l’intensità varia significativamente tra i pixel dello stesso
tessuto e tra i pixel di tessuti diversi. Se si effettua una mappatura di IIH (figura 3.1B), è
possibile correggere IIH attraverso diversi strumenti proposti in letteratura e la qualità
dell’immagine aumenta (figura 3.1C).
In generale, la presenza di IIH può ridurre in modo significativo l’accuratezza delle procedure
di segmentazione e registrazione e di misure quantitative. Nasce pertanto la necessità di
definire uno o più step di pre-processing per correggere il segnale dal bias field. La letteratura
[9], [10] e [30] definisce e considera la IIH come una variazione smooth dell’intensità
all’interno di una regione omogenea. Inoltre viene considerato come un campo additivo o
moltiplicativo e indipendente dal rumore.
27
A
B
C
Figura 3.1: Disomogeneità dell’intensità del segnale in un’ immagine di cervello di RM.
Nel contesto del presente lavoro di tesi, si intende stimare e rimuovere dalle immagini
acquisite su volontari sani, la disomogeneità IIH, prima di effettuare la procedura automatica
di estrazione delle scatole ippocampali, per valutare se tale step di pre-processing risulti
efficace ai fini di ottenere una correlazione migliore tra le immagini dell’ippocampo baseline
e repeat.
3.2.1 Le Sorgenti e i Modelli di IIH
L’estrazione automatica d’informazioni cliniche dai moderni sistemi di imaging, richiede
passaggi definiti pre-processing grazie ai quali i diversi artefatti dell’immagine, che
degradano l’immagine stessa, vengono rimossi. La disomogeneità in immagini di RM, IIH, si
manifesta come una variazione dell’intensità del segnale. A causa di questo fenomeno,
l’intensità del segnale proveniente dallo stesso tessuto varia a seconda della sua posizione
all’interno dell’immagine. Questo è il motivo per cui sono stati proposti nel passato e tutt’ora
metodi di correzione della IIH. Le prime pubblicazioni risalgono al 1986; da allora si studiano
le sue sorgenti, divisibili in due gruppi:
Le sorgenti del primo gruppo sono legate alle proprietà della strumentazione e dei
dispositivi di Risonanza Magnetica utilizzati, ed includono: la disomogeneità del
campo magnetico principale B0, la larghezza di banda nel filtraggio dei dati, le eddy
current derivanti dal sistema di gradienti e la disomogeneità del sistema di
trasmissione e ricezione delle radiofrequenze (campo magnetico B1). Questi tipi di
28
IIH possono essere corretti attraverso tecniche di shimming particolari sequenze di
acquisizione, utilizzo di diverse bobine o calibrando il sistema con opportuni fantocci
[18].
Le sorgenti di disomogeneità del secondo gruppo invece sono relative alle
caratteristiche dell’oggetto acquisito, per esempio: la forma, la posizione e
l’orientazione all’interno del magnete e la specifica permeabilità magnetica e le
proprietà dielettriche. Questi tipi di sorgenti sono più difficili da trattare. Inoltre si e’
mostrato [9] che questi aspetti sono molto più marcati negli scanner a campi magnetici
più elevati, a causa dell’aumento della frequenza necessaria per stimolare i nuclei di
idrogeno sotto l’azione di un campo magnetico più elevato [33].
Un modello della disomogeneità di IIH, proposto da Zhou [9], considera x come l’intensità
del segnale misurato e x’ come l’intensità vera:
x = αx’ + ξ
(1)
dove α rappresenta l’effetto introdotto da IIH e ξ il rumore. In figura 3.2 e’ mostrata la stessa
immagine MRI dove: a, e’ l’immagine originale, b l’immagine con gli artefatti da IIH, c
l’immagine con il rumore e d la stessa con entrambi gli effetti di IIH e rumore.
Nei modelli più semplici, la IIH si assume sia una funzione moltiplicativa o additiva, ovvero
si moltiplica o si somma all’intensità dell’immagine vera. Sono stati proposti in letteratura
diversi modelli per la formazione dell’immagine RM, che considerano le combinazioni di IIH,
b(x) e del rumore n(x). I tipi di rumore sono generalmente due: il rumore biologico, derivante
dalla disomogeneità interna dei tessuti, e il rumore che deriva dalle imperfezioni dei
dispositivi di acquisizione. Il modello più comune di formazione dell’immagine assume che il
rumore abbia una distribuzione gaussiana, che derivi dallo scanner e che pertanto sia
indipendente da b(x) [19, 26].
29
Figura 3.2: immagine originale (A), immagine affetta da Bias Field (B), immagine affetta da
rumore (C) e immagine affetta sia da Bias Field che da rumore (D).
L’immagine v(x) è ottenuta come:
v(x) = u(x)b(x) + n(x)
(2)
dove u(x) è l’immagine “libera” dalla IIH, analogamente alla (1).
In altri modelli [27], in cui si considera il solo rumore biologico, in formula:
v(x) = (u(x) + n(x))b(x)
30
(3)
Un altro modello per la formazione dell’immagine MRI si basa su intensità logaritmiche,
dove l’effetto moltiplicativo di IIH nella (2) diventa additivo [34]:
log v(x) = log u(x) + log b(x) + n(x)
(4)
Anche nella (4) il rumore n(x) è considerato come una Gaussiana, il che è matematicamente
conveniente, ma in disaccordo con il modello (2) che assume che il rumore sia gaussiano nel
dominio non logaritmico.
31
3.3 La classificazione dei Metodi di Correzione
Negli ultimi vent’anni sono stati proposti diversi metodi di correzione della Intensity
Inhomogeneity, IIH, in base al modello di descrizione della stessa. Likar et al. propongono in
[20] una classificazione dei metodi di correzione più comuni, suddividendoli in metodi
prospettici e retrospettivi. I primi mirano a migliorare il processo di acquisizione
dell’immagine, mentre i secondi si concentrano esclusivamente sulle informazioni ottenibili
dalle immagini una volta acquisite. Si classificano ulteriormente i metodi prospettici in:
metodi basati su fantocci, su bobine e su particolari sequenze. I metodi retrospettivi invece si
distinguono tra quelli basati sulla segmentazione, su istogramma delle intensità e sul
filtraggio. Si descrivono qui di seguito tali metodi.
3.3.1 I metodi Prospettici
Questi metodi trattano le disomogeneità come errori sistematici dei processi di acquisizione
dell’immagine MRI e possono essere minimizzati acquisendo immagini di fantocci uniformi,
acquisendo immagini utilizzando bobine diverse o particolari sequenze di acquisizione.
I.
Correzione basata su Fantocci:
Una stima della disomogeneità IIH può essere ottenuta acquisendo un’immagine di un
fantoccio uniforme con proprietà fisiche note [21] e applicando su queste operazioni di
scaling e di smoothing. Solitamente si utilizzano fantocci pieni di acqua o soluzioni
acquose di solfato di rame. Questo tipo di approccio comunque non corregge dalla
disomogeneità introdotta dal paziente, il che rappresenta un grave inconveniente di
questo approccio.
II.
Correzione basata su Bobine (multicoil):
Le bobine più usate per le acquisizioni sono quelle di superficie e quelle di volume (la
body coil). Le bobine di superficie hanno in genere un buon rapporto segnale-rumore
(SNR) ma introducono gravi disomogeneità, mentre si verifica il contrario con quelle
32
di volume: poca IIH ma basso SNR. Il metodo in questione combina le immagini
acquisite con bobine di superficie e con la body coil. La stima di IIH è ottenuta
dividendo l’immagine acquisita con la bobina di superficie con l’immagine da body
coil e successivamente applicando uno smooth l’immagine ottenuta. Il problema di
questo metodo sono i lunghi tempi di acquisizione. Inoltre, la IIH introdotta dalla body
coil permane sull’immagine da bobina di superficie corretta.
III.
Correzione basata su Sequenze spaziali:
Per alcune sequenze di eccitazione, si può stimare la distribuzione spaziale dell’angolo
di flip ed usarla per calcolare la IIH. Il metodo richiede di acquisire due immagini,
dove la seconda con angolo di flip doppio rispetto alla prima [22].
3.3.2 I metodi Retrospettivi
I metodi retrospettivi si basano principalmente sulle informazioni delle immagini acquisite
dove le informazioni anatomiche e le informazioni su IIH, si combinano [10]. A differenza
dei metodi prospettici, i retrospettivi possono anche eliminare sia la disomogeneità introdotta
dalla strumentazione, sia quella introdotta dal paziente. Si descrivono qui di seguito i più
comuni metodi di correzione retrospettivi.
I.
Correzione basata sulla Segmentazione:
La correzione del Bias Field è spesso un’operazione pre-processing necessaria per
permettere una segmentazione migliore. La correzione di IIH e la segmentazione
possono essere viste come due procedure strettamente legate tra loro. Nei metodi di
correzione basati sulla segmentazione, queste due procedure sono pertanto fuse
insieme. Uno dei metodi esistenti più comuni, è chiamato: ML, MAP Based. Questo
tipo di metodo viene implementato dal software di correzione per Bias Field, SPM5,
usato nel presente lavoro di tesi. ML e MAP rappresentano rispettivamente: il
Maximum-Likelihood (massima verosimiglianza) e il Maximum a posteriori
Probability (massimo della probabilità a posteriori). Questi possono essere usati per
stimare la distribuzione dell’intensità. Si utilizza inoltre un modello gaussiano, i cui
33
parametri possono essere stimati con la Expectation-Maximization (EM), algoritmo
per la segmentazione e la simultanea correzione di IIH. Poiche’ il modello gaussiano è
un’approssimazione della densità di probabilità di un singolo tessuto, si possono usare
più gaussiane per più tessuti, per esempio: 3 per la materia bianca e 2 per la grigia.
Nell’algoritmo si iterano due grandezze interdipendenti: la stima di MAP
dall’immagine segmentata fornisce la stima della disomogeneità e la stima di ML
dall’IIH fornisce un risultato per la segmentazione di MAP.
II.
Correzione basata su Istogrammi:
I metodi di correzione basati sugli Istogrammi (Histogram Based Model, HBM)
operano direttamente sugli istogrammi delle intensità dell’immagine e non richiedono
conoscenze a priori sulla distribuzione della probabilità dell’intensità di struttura.
Questi metodi sono completamente automatici e molto generali, per cui possono
essere utilizzati su diverse immagini sia con o senza patologie. Sebbene diversi metodi
basati sulla segmentazione utilizzino istogrammi dell’intensità dell’immagine, la
distinzione tra questi e i HBM è che questi ultimi non forniscono come risultato una
segmentazione. D. W. Shattuck et al. [26] propongono un metodo a Histogram
Matching per cui si divide l’immagine in piccoli sub volumi in cui la disomogeneità
dell’intensità (IIH) si suppone sia relativamente costante. La IIH locale viene stimata
attraverso il metodo dei minimi quadrati dell’istogramma relativo al sub volume. Il
metodo applicato è una Gaussiana con 7 parametri, ricavati dall’istogramma
dell’immagine globale. Queste stime locali sono state interpolate con una superficie Bspline per produrre il campo di disomogeneità finale. Il vantaggio di questo metodo è
che non necessita di informazioni a priori, rendendolo completamente automatico e
generale. Tuttavia lo svantaggio è che si assume che i sub volumi abbiano una
disomogeneità costante [30]. D. W. Shattuck [26] propose un software di elaborazione
di neuro immagini, che implementa questo tipo di metodo. Questo SW,
BRAINSUITE, e’ stato utilizzato nel presente lavoro di tesi.
34
III.
Correzione basata su Filtraggio:
Tale metodo assume che IIH sia un artefatto a bassa frequenza e che possa essere
separato dalle alte frequenze del segnale, relative alle informazioni anatomiche del
paziente attraverso un filtraggio passa basso. Quest’assunzione è valida solamente se
le strutture anatomiche acquisite siano relativamente piccole e che pertanto non
contengano basse frequenze che possano essere confuse con IIH. I due principali
metodi di filtraggio proposti sono:
1
Homomorphic Filtering: questo è usato sulle intensità dell’immagine logtransformed. All’immagine in input log u(x) è sottratto la sua immagine
filtrata (con un filtro passa basso):
log v(x) = log u(x) – LPF(log u(x)) + Cn
Cn è una costante di normalizzazione per mantenere il valore medio (o
massimo) dell’intensità dell’immagine corretta. E l’immagine corretta v(x)
si ottiene con l’esponenziale.
2
Homomorphic Unsharp Masking: è il metodo più semplice da usare. La
correzione b(x) è ottenuta attraverso un filtraggio passa basso
dell’immagine in input u(x), divisa per la costante Cn. L’immagine corretta
v(x) sarà la divisione (o sottrazione in logaritmi) di u(x) per b(x):
v(x) = u(x)/b(x)= u(x)Cn / LPF(u(x))
35
3.4 Misure Preliminari su Oggetto test
In questo paragrafo viene presentata a titolo esplicativo e introduttivo l’analisi della IIH da
immagini ottenute dall’oggetto test TO5 (figura 3.3), facente parte di un kit di oggetti test più
ampio noto come EUROSPIN (si approfondisce in Appendice 2). La descrizione dettagliata
della sequenza di acquisizione delle immagini e dei SW di analisi è oggetto del capitolo
successivo.
Il sistema di test Eurospin è il risultato di una collaborazione internazionale della Comunità
Europea sulla “Caratterizzazione tissutale mediante Risonanza Magnetica” (attiva dal 1983). I
fantocci del kit, tutti da 200 mm di diametro, sono costruiti con plexiglass e vetro e per questo
sono molto fragili. Sono riempiti da una soluzione leggermente acida di Solfato di Rame
(Conduttanza 1000 µS/cm +/- 50 µS/cm) e l’acidità è necessaria per evitare le precipitazioni
degli ioni Cu come idrossile che porterebbero ad un aumento del valore del T1.
Figura 3.3: Oggetto test TO5 EUROSPIN per gli scanner di Risonanza Magnetica Nucleare.
L’oggetto test utilizzato, il TO5, viene generalmente impiegato per misurare il rapporto
contrasto/rumore e l’accuratezza e precisione dei tempi di rilassamento T1 e T2, e viene
fornito con un set di 18 provette a gel inseribili nel supporto stesso. Il TO5 presenta pertanto
12 cavità da 20 mm di diametro e 80 mm di profondità , realizzate per contenere le provette
(figura 3.4).
36
Per lo studio della disomogeneità IIH (o Bias Field), sono state effettuate 4 acquisizioni dello
stesso fantoccio disponendo le 12 provette in 4 configurazioni diverse, per valutare come
cambino i valori di livello di grigio dello stesso gel nelle diverse posizioni all’interno del
campo magnetico. Se le immagini non fossero alterate dagli effetti del Bias Field, ad ogni gel
corrisponderebbe lo stesso livello di grigio indipendentemente dalla sua posizione all’interno
dell’immagine. Sono state scelte le 12 provette con tempi di rilassamento T1 e T2
nell’intervallo di valori dell’encefalo. Si specifica che le immagini sono state acquisite con lo
stesso tomografo di Risonanza Magnetica usato per l’acquisizione dei volontari, il Philips da
1.5 Tesla, installato presso l’ospedale Cattinara dell’Azienda ospedaliero-universitaria
“Ospedali Riuniti” di Trieste.
Figura 3.4: TO5 in vista sagittale (sinistra) e assiale (destra).
Per l’analisi della disomogeneità si sono misurati per ogni gel, in ogni immagine, il valore
medio e la deviazione standard del livello di grigio corrispondente. Per mostrare questo
risultato si sono create le “mappe dei colori” in cui per ogni gel (identificato sempre da un
colore) è stato misurato valore di grigio medio nelle diverse configurazioni:1, 2, 3 e 4 (figura
3.5).
Successivamente si è applicata la stessa procedura sulle immagini trattare con i software di
correzione e si sono valutate le differenze.
37
Figura 3.5: Mappa dei colori (valori medi) dei gel nelle immagini grezze nelle configurazioni 1, 2, 3 e 4.
Analizzando i valori riportati in figura 3.5 è evidente che l’effetto della disomogeneità è
presente nelle immagini, dato che lo stesso gel, a seconda della sua posizione nell’immagine
assume un valore diverso. In particolare si nota un maggior effetto della disomogeneità ai
bordi dell’oggetto test (nelle posizioni più esterne del fantoccio), per esempio il gel
identificato dal colore Giallo ha valori che variano tra i 553 ± 7 a 590 ± 9. E anche il gel color
Marrone Chiaro passa da 195 ± 5 a 213 ± 7 e il Verde Smeraldo da 357 ± 9 a 375 ± 6. Effetti
meno evidenti sono presenti nelle quattro posizioni centrali delle immagini. Il Verde Chiaro
per esempio nelle posizioni centrali misura 222 ± 3, 224 ± 5 e 227 ± 5. L’Azzurro tra 369 ± 4
e 375± 5.
Nell’ottica della correzione del Bias Field, si sono applicate alle immagini acquisite i software
di correzione che implementano i metodi basati sulla segmentazione e sull’istogramma, SPM5
[32] e BRAINSUITE [26] rispettivamente.
Un esempio “visivo” del risultato dell’applicazione del SW SPM5 alle immagini dell’oggetto
test è mostrato in figura 3.6: dove la figura A mostra l’immagine del TO5 “originale”, la B
quella “corretta da IIH”, la C mostra una differenza tra A e B, e la figura D mostra la mappa
38
delle disomogeneità percentuale tra le due: (A-B)/A. La mappa della disomogeneità mostra un
andamento simile tra le diverse immagini acquisite, specifico del tomografo utilizzato e del
tipo di oggetto test.
A
B
C
D
Figura 3.6: A: immagine grezza (dimensione voxel 0.94x0.94x1.00 mm3); B: immagine corretta da Bias
Field con SPM5; C: differenza tra A e B; D: mappa della disomogeneità percentuale ((A-B)/A).
Differenze percentuali entro il 5%.
Si sono quindi valutati dopo la correzione, i valori medi e deviazione standard dei livelli di
grigio dei gel nelle 4 diverse posizioni nelle immagini. Per mostrare questo risultato si sono
create le “mappe dei colori” dalle immagini corrette con SPM5, in cui per ogni gel
(identificato sempre dallo stesso colore) è stato misurato il valore di grigio medio nelle
diverse configurazioni 1, 2, 3 e 4 (figura 3.7).
39
Figura 3.7: Mappa dei colori (valor medio) dei gel nelle immagini corrette da IIH con SPM5 nelle
configurazioni 1, 2, 3 e 4.
Si riportano in tabella 3.8 i valori medi e le deviazioni standard, per il confronto dei livelli di
grigio dei gel nelle diverse posizioni prima e dopo il trattamento delle immagini con SPM5 in
cui: in NERO sono riportati i valori per le immagini originali; in VERDE gli stessi relativi ai
gel delle immagini corrette con SPM5.
Analizzando i valori riportati in figura 3.5, 3.7 e in tabella 3.8, gli stessi gel dopo la
correzione di SPM5 mostrano valori più simili tra loro, in particolare l’effetto della correzione
è molto più evidente nelle posizioni ai bordi dell’oggetto test: per esempio il Giallo misura
547 ± 6, 549 ± 7 e 544 ± 5. Per il Marrone Chiaro si passa a valori che fluttuano tra 198 ± 3 e
205 ± 3 contro 195 ± 5 e 213 ± 7 dell’immagine non corretta. Al centro dell’immagine la
correzione è meno significativa, per cui i valori medi dei gel sono simili ai valori non corretti
come per il Verde e l’Azzurro di cui però si evidenzia una diminuzione della deviazione
standard.
40
IMMAGINE1
IMMAGINE2
IMMAGINE3
IMMAGINE4
560 ± 6
557 ± 7
553 ± 7
590 ± 9
552 ± 6
547 ± 6
549 ± 7
544 ± 5
369 ± 4
365 ± 5
375 ± 5
359 ± 5
368 ± 5
366 ± 4
372 ± 4
373 ± 5
256 ± 3
253 ± 3
259 ± 3
255 ± 4
260 ± 3
270 ± 3
261 ± 4
264 ± 5
222 ± 3
224 ± 4
230 ± 4
227 ± 5
222 ± 2
224 ± 4
225 ± 3
230 ± 5
432 ± 8
449 ± 9
434 ± 7
439 ± 6
453 ± 8
457 ± 9
456 ± 6
447 ± 6
VERDE
453 ± 6
465 ± 14
453 ± 6
468 ± 7
CHIARO
434 ± 5
467 ± 13
462 ± 7
456 ± 6
VERDE
357 ± 9
363 ± 4
375 ± 6
359 ± 6
SMERALDO
367 ± 6
364 ± 4
373 ± 7
365 ± 5
VIOLA
307 ± 4
291 ± 5
313 ± 6
305 ± 4
291 ± 2
297 ± 5
305 ± 5
305 ± 4
269± 6
290 ± 6
284 ± 5
284 ± 5
292 ± 5
278 ± 3
294 ± 6
292 ± 4
207 ± 6
198 ± 5
208 ± 6
211 ± 5
205 ± 5
203 ± 5
206 ± 4
210 ± 4
MARRONE
198 ± 4
195 ± 5
213 ± 7
207 ± 3
CHIARO
205 ± 3
198 ± 3
203 ± 3
202 ± 3
GRIGIO
172 ± 3
179 ± 6
180 ± 3
181 ± 4
177 ± 2
166 ± 2
182 ± 4
178 ± 3
GIALLO
AZZURRO
ROSSO
VERDE
ARANCIONE
MARRONE
BLU
Tabella 3.8: media e deviazione standard del gel nelle 4 configurazioni: in NERO i valori grezzi, in
VERDE i valori dopo la correzione di SPM5.
Analogamente si è lavorato con il software di correzione da IIH, BRAINSUITE. In figura 3.9
si mettono a confronto le immagini originali (A) e quella corretta dal SW (B), la figura C
41
rappresenta la differenza tra A e B, e nella D si mostra la disomogeneità percentuale tra le
due: (A-B)/A.
B
A
D
C
Figura 3.9: A: immagine grezza (dimensione voxel 0.94x0.94x1.00 mm3); B: immagine corretta da
Bias Field con SPM5; C: differenza tra A e B; D: mappa della disomogeneità percentuale ((A-B)/A).
Differenze percentuali entro il 5%.
Si è successivamente creata la “mappa dei colori” anche per le immagini corrette con
BRAINSUITE (figura 3.10), dove si sono utilizzati per gli stessi gel, gli stessi colori usati
nelle precedenti.
Si riportano in tabella 3.11, valor medio e deviazione standard dei gel nelle 4 configurazioni
per un confronto: in NERO i valor per le immagini originali; in BLU gli stessi relativi alle
immagini corrette con BRAINSUITE.
42
Figura 3.10: Mappa dei colori (valor medio) dei gel nelle immagini corrette da IIH con BRAINSUITE
nelle configurazioni 1, 2, 3 e 4.
Analizzando i valori riportati in figura 3.5, 3.10 e in tabella 3.11, restano le considerazioni
fatte in precedenza ossia che gli effetti della disomogeneità si manifestano maggiormente ai
bordi dell’immagine. Dopo la correzione applicata con BRAINSUITE, gli effetti della
correzione sono distribuiti più uniformemente sia ai bordi che al centro dell’immagine. Per
esempio il gel identificato dal colore Giallo ha valori che fluttuano tra i 561 ± 7 e i 579 ± 10
contro i 553 ± 7 a 590 ± 9 prima della correzione. Per esempio anche il gel color Marrone
Chiaro passa da 213 ± 7 a 205 ± 4. Al centro dell’immagine i valori corretti sono molto più
simili tra loro rispetto a prima della correzione, per esempio il Verde Chiaro mantiene nelle
quattro configurazioni 220 ± 4 e i 235 ± 5 e l’Azzurro con valori attorno a 368 con una
diminuzione della deviazione standard rispetto ai valori non corretti.
Nei capitoli seguenti gli stessi algoritmi verranno applicati alle immagini cliniche analizzate
con le procedure sviluppate dalla collaborazione MIND.
43
IMMAGINE1
IMMAGINE2
IMMAGINE3
IMMAGINE4
560 ± 6
557 ± 7
553 ± 7
590 ± 9
568 ± 6
561 ± 7
561 ± 7
579 ± 10
369 ± 4
365 ± 5
375 ± 5
359 ± 5
368 ± 3
364 ± 4
368 ± 4
639 ± 3
256 ± 3
253 ± 3
259 ± 3
255 ± 4
258 ± 3
259 ± 3
262 ± 5
257 ± 6
222 ± 3
224 ± 4
230 ± 4
227 ± 5
224 ± 3
220 ± 4
235 ± 5
220 ± 4
432 ± 8
449 ± 9
434 ± 7
439 ± 6
438 ± 5
452 ± 7
441 ± 5
434 ± 5
VERDE
453 ± 6
465 ± 14
453 ± 6
468± 7
CHIARO
466 ± 10
462 ± 9
450 ± 6
467 ± 7
VERDE
357 ± 9
363± 4
375 ± 6
359 ± 6
SMERALDO
358 ± 4
357 ± 4
378 ± 6
364 ± 6
VIOLA
307± 4
291 ± 5
313 ± 6
305 ± 4
299 ± 4
298 ± 5
306 ± 5
303 ± 4
269 ± 6
290 ± 6
284 ± 5
284 ± 5
292 ± 5
298 ± 6
289 ± 6
288 ± 5
207± 6
198 ± 5
208 ± 6
211± 5
205 ± 3
196 ± 4
201 ± 4
207 ± 4
MARRONE
198 ± 4
195 ± 5
213 ± 7
207 ± 3
CHIARO
203 ± 3
198 ± 3
205 ± 4
206 ± 3
GRIGIO
172 ± 3
179± 6
180 ± 3
181 ± 4
175 ± 2
180 ± 4
177 ± 4
177 ± 3
GIALLO
AZZURRO
ROSSO
VERDE
ARANCIONE
MARRONE
BLU
Tabella 3.11: media e deviazione standard del gel nelle 4 configurazioni: in NERO i valori grezzi, in
BLU i valori dopo la correzione di BRAINSUITE.
44
4. MATERIALI E METODI
4.1 Il campione di studio
Il presente lavoro di tesi è stato svolto su immagini di RM, acquisite attraverso un nuovo
protocollo ad Alta Risoluzione su un totale di 6 volontari (4 femmine e 2 maschi), dall’età
compresa tra i 19 e i 29 anni. Nessuno dei volontari presenta o ha presentato patologie al
Sistema Nervoso Centrale. Per ognuno di questi sono state acquisite 4 immagini:
2
utilizzando il protocollo MP-RAGE dell’ADNI sull’intero cervello e 2 applicando il nuovo
protocollo ad Alta Risoluzione (High Resolution, HR), definito da Quartulli et al. [30].
Volendo seguire la rapidità di evoluzione della malattia di Alzheimer attraverso l’analisi
longitudinale, è necessario avere a disposizione immagini dello stesso paziente acquisite a
distanza temporale l’una dall’altra, per poterne valutare le variazioni neurodegenerative;
perciò delle 2 immagini MP-RAGE, una è definita baseline e l’altra repeat (in quanto
acquisita in un momento diverso), analogamente per l’HR. Nel presente lavoro si è voluto
studiare se immagini acquisite con maggior risoluzione spaziale, risultano più riproducibili di
quelle a bassa risoluzione nella regione dell’ippocampo; il quale è una struttura di piccole
dimensioni in cui gli effetti di volume parziale possono essere importanti. Per le acquisizioni,
è stato usato il tomografo PHILIPS-Achieva da 1.5 Tesla (figura 4.1) installato presso
l’Ospedale Cattinara dell’Azienda ospedaliero-universitari Ospedali Riuniti di Trieste con la
bobina testa-collo SENSE da 16 canali solo ricevente (figura 4.1).
Figura 4.1: Tomografo PHILIPS Achieva, 1.5 Tesla (a sinistra) e Bobina SENSE (a destra).
45
Le caratteristiche che differenziano un’immagine RM dall’altra sono legate all’intensità dei
toni di grigio, che possono assumere valori diversi sulla stessa macchina o su macchine
differenti anche sul medesimo soggetto, al differente posizionamento del paziente e infine al
rumore. Pertanto nasce la necessità di trattare le immagini acquisite in modo da minimizzare
questi aspetti introdotti in fase di acquisizione preservandone l’informazione per la successiva
Analisi Longitudinale.
4.1.1 Il protocollo MP-RAGE
La sequenza MP-RAGE (Magnetization Prepared - RApid Gradient Echo) è una delle
sequenze più utilizzate in imaging di RM e soprattutto per le acquisizioni strutturali
dell’encefalo T1 pesate (figura 4.5). La sequenza è stata definita dall’ADNI (Alzheimer’
Disease Neuroimaging Initiative, http://www.adni-info.org/), progetto per la ricerca, la
prevenzione e il trattamento della malattia di Alzheimer; composto da istituzioni di ricerca si
pubbliche che private, da aziende farmaceutiche, università e gruppi no-profit. L’obiettivo
principale dell’ADNI è valutare come immagini MRI, PET, marker biologici e studi clinici e
psicologici, possano essere combinati per valutare la progressione allo stadio MCI (Mild
Cognitive Impairment) e all’Alzheimer precoce.
La MP (Magnetization Preparation) rappresenta un impulso di radiofrequenza (RF)
solitamente di 180° o 90° di preparazione, che viene applicato prima della sequenza vera e
propria. La sequenza MP-RAGE è composta da un impulso di preparazione di 180°, seguito
da una sequenza FAST GRE, dopo un tempo pari a TI (tempo d’inversione). Dopo l’impulso
di 180°, la magnetizzazione longitudinale, inizia il suo recupero secondo il rilassamento T1,
con la possibilità di differenziare maggiormente i segnali con diverso T1 rispetto ad un flip di
90°, così che nell’immagine risulterà un maggior contrasto tra i relativi tessuti. Le sequenze di
impulsi acquisite sono intervallate da un tempo pari a TR per evitare effetti di saturazione. Il
processo in figura 4.2 è ripetuto tante volte quanti sono i segmenti di volume, facendo variare
l’intensità del gradiente di codifica di fase (figura 4.3).
46
Figura 4.2: Schema della sequenza MP-RAGE.
Figura 4.3: Volume acquisito con una sequenza MP-RAGE.
La Gradient Recalled Echo (GRE) è una sequenza che utilizza un gradiente di campo
magnetico per generare l’Echo. L’impulso di eccitazione della fetta di tessuto applicato è
minore di 90° (tipicamente tra 10° e 90°) e subito dopo gli spin perdono coerenza di fase.
Invece di applicare un impulso di 180°, l’eco viene generato applicando una coppia di
gradienti di codifica di frequenza dalla polarità opposta (figura 4.4).
Figura 4.4: Schema della sequenza GRE.
47
Figura 4.5: Immagini sagittali baseline (a sinistra) e repeat (a destra) acquisite attraverso il protocollo
MP-RAGE su cervello intero (dimensioni dei voxel : 0.94 x 0.94 x 1.20 mm3).
4.1.2 Il nuovo protocollo ad Alta Risoluzione
Il nuovo protocollo di acquisizione ad Alta Risoluzione e’ stato definito da Quartulli et al.
[30] e si basa su una sequenza MP-RAGE, con tempi di acquisizione di circa 14 minuti e una
maggior risoluzione spaziale rispetto alla sequenza proposta dall’ADNI ed un rapporto
segnale rumore accettabile. Il nuovo protocollo ad alta risoluzione fornisce immagini T1
pesate centrate su una regione ristretta del cervello, in particolare il FOV è di 10x20x4 cm3,
con voxel di dimensioni 0.60x0.60x0.59 mm3 (figura 4.6).
Figura 4.6: Immagini baseline (a sinistra) e repeat (a destra) acquisite utilizzando il nuovo protocollo ad
Alta Risoluzione (dimensione del voxel: 0.6 x 0.6 x 0.59 mm3).
48
4.2 I Software di Correzione
Nel presente lavoro di tesi sono stati applicati alcuni metodi di correzione per la
disomogeneità dell’intensità nelle immagini MRI proposti in letteratura. Si sono in particolare
usati software che si basano sui principali metodi di correzione quali: segmentazione e
istogramma (discussi al capitolo 3). Tali correzioni sono state applicate alle immagini MRI
acquisiste tramite protocollo MP-RAGE (dell’ADNI) e il nuovo protocollo HR (dell’INFN,
sezione di Genova e Trieste, dell’Università di Trieste e degli Ospedali Riuniti di Trieste) sia
sulle immagini baseline che repeat. Lo scopo è quello di ottenere immagini più omogenee tra
loro, per poter effettuare un confronto tra le stesse. Una volta che le immagini sono state
“corrette” dalla disomogeneità, saranno processate e sottoposte al metodo di estrazione delle
“scatole” ippocampali definito dal gruppo in collaborazione MIND di Genova
(approfondimento al paragrafo 2.3). Ottenute le scatole dell’ippocampo, si confronteranno tra
loro la baseline e la repeat dello stesso paziente, valutando quanto siano sovrapponibili tra
loro le due immagini. Dato che i soggetti in esame sono tutti giovani e sani, si suppone che
non ci siano state tra la prima e seconda acquisizione delle differenze morfologie cerebrali,
perciò le differenze tra le due siano solo attribuibili ai fenomeni già citati. Con la correzione
di IIH, si andrà a verificare se le box estratte siano più simili tra loro rispetto a quando non si
sia effettuata una correzione.
I SW di correzione utilizzati per tale scopo sono: SPM5 [32] e BRAINSUITE [26], dove
rispettivamente applicano metodi di correzione basati sulla segmentazione e sull’istogramma.
Una Pipeline rappresenta una serie di analisi effettuate su un’immagine, dove l’output da uno
step diventa l’input per lo step successivo. Le pipeline citate permettono: la correzione
dell’uniformità, la segmentazione, la classificazione della materia grigia, bianca e tessuto
cerebrospinale, la registrazione, le trasformazioni nello spazio, la visualizzazione delle
immagine, ecc. In particolare la correzione dell’uniformità, nota anche come correzione bias
field, è fondamentale oltre che per lo studio in esame anche per determinare quelle variazioni
dell’immagine (non visibile ad occhio nudo) che causano dei problemi alle procedure di
segmentazione.
Segue una descrizione dei software usati per la correzione del Bias Field: SPM5 e
BRAINSUITE.
49
4.2.1 SPM5
SPM (Statistical Parametric Mapping), traducibile in italiano come
Mappatura Statistica Parametrica, è un software per l’analisi di dati di
Risonanza Magnetica, PET, EEC e MEC, distribuito per la prima
volta nel 1991 dal Wellcome Department of Imaging Neuroscience di
Londra [32]. La nascita di SPM è data dall’esigenza di promuovere
schemi comuni e collaborazioni fra i diversi laboratori di neuroimaging. In questo lavoro di
tesi è stata usata la versione SPM5, la versione più consigliata e collaudata, consistente in
funzioni, comandi, file dati e sottoprogrammi esterni in C per MATLAB. SPM5 consente di
effettuare la correzione di IIH definita nell’opzione Bias Corrected, per produrre una versione
corretta dell’immagine in input. Le immagini MRI sono corrotte da smoothig, da artefatti che
variano spazialmente e che sebbene non siano un problema per visualizzazione
dell’immagine, possono essere un problema per i processi automatici di segmentazione.
Attraverso il metodo di correzione di IIH basato sulla segmentazione, SPM produce una
versione dell’immagine con una maggiore uniformità dei valori d’intensità all’interno dei
diversi tessuti.
All’avvio di MATLAB da Command Window è possibile lanciare SPM5 e appariranno sullo
schermo tre nuove finestre (figura 4.7), relative al menù di SPM, allo stato di avanzamento
delle funzioni avviate e finestra per la visualizzazione dei risultati.
Prima di procedere al caricamento delle immagini su SMP5, queste sono state convertite dal
formato DICOM, al formato .NII (Nifti) attraverso il programma gratuito di conversione
MRIConvert.
Per avviare la correzione, fare click su [SEGMENT] dal menù di SMP e dalla finestra di
visualizzazione si andranno a definire: il percorso della cartella da dove sarà presa l’immagine
in input da correggere (l’immagine in output è la stessa cartella dell’input) in [DATA] (figura
4.8) e impostare il solo comando [BIAS CORRECTED] (figura 4.9). A questo punto con
[RUN], si avvia una procedura automatica di correzione, al termine della quale, l’immagine
“corretta” da IIH viene salvata automaticamente nella cartella dell’input, nel formato mX.img
(dove X è il nome del file).
50
Figura 4.7: Interfaccia grafica SPM5.
Figura 4.8: Finestra per il
caricamento dell’immagine..
Figura 4.9: Selezione del comando
Bias Corrected.
51
4.2.2 BRAINSUITE
Nel presente lavoro di tesi e’ stato utilizzato il SW BRAINSUITE (versione 13a) sviluppato
da D.W. Shattuck [26], University of Southern California. BRAINSUITE è costituito da una
collezione di tools sviluppati appositamente per l’elaborazione di neuroimmagini ed
implementa una metodica per effettuare l’estrazione della superficie corticale con una serie di
interfacce di dialogo che guidano l’utilizzatore (figura 4.10).
Per correggere la disomogeneità d’intensità presente nell’immagine, il risultato di variazioni
del campo magnetico, della strumentazione, del posizionamento del paziente e del rumore, si
applica la procedura automatica Bias Field Corrector (BFC). Questa, stima un campo di
correzione per il volume di tessuto in esame basandosi su una serie di stime locali delle
variazioni del guadagno dei tessuti, utilizzando il metodo Histogram Matching.
BRAINSUITE lavora su immagini in formato Nifti, quindi le DICOM acquisite vengono
prima convertite in .NII attraverso un SW gratuito di conversione MRIConvert.
Figura 4.10: Esempio di interfaccia grafica di BRAINSUITE.
Inizialmente BFC individua un valore globale per il valore di grigio medio della materia
bianca, grigia e liquido cerebro spinale, e il rumore presente nell’immagine. Dopo di che,
52
rimuove tutti gli altri tessuti. Questi valori medi vengono poi usati su un modello di misura su
volumi parziali (sub-volumi); adattando il modello all’istogramma dei sub-volumi
dell’immagine, si può stimare il guadagno nel singolo sub-volume rispetto all’intensità
dell’intera immagine. Questi valori individuano poi una B-spline 3D che stima la non
uniformità. Dividendo l’immagine originale per questa spline, si corregge la non uniformità.
BFC è stata concepita per applicare la correzione del bias field su immagini segmentate, per
cui sulle immagini a cervello intero acquisite sui volontari con il protocollo MP-RAGE è stato
possibile applicare il metodo Brain Surface Extractor (BSE), che segmenta, rimuovendo il
tessuto non cerebrale dall’immagine. Attraverso i comandi [CORTEX] -> [CORTICAL
SURFACE EXTRAXTION] è possibile selezionare il tipo di operazione da eseguire, in
questo caso BSE e BFC in cui l’output della pipeline, l’immagine corretta, viene
automaticamente salvata come X.bfc.nii (dove X è il nome dell’immagine). Il risultato della
procedura e’ visibile in figura 4.11.
Figura 4.11: Esempio del risultato delle procedure BSE e BFC.
53
4.3 Il Sistema di Confronto
Le scatole ippocampali estratte con la pipeline MIND dalle immagini baseline e repeat per
ogni volontario, acquisiste sia con il protocollo ADNI MP-RAGE, che con il nuovo ad alta
risoluzione (HR) sono state confrontate per determinare come cambino tra la prima e la
seconda acquisizione. Gli indici utilizzati per il confronto sono: PSNR, MSE, MAXERR and
NCC.
Peak Signal-to-Noise Ratio (PSNR) valuta la qualità di un’immagine ed è definito
come il rapporto tra la massima potenza del segnale e la massima potenza del rumore
che corrompe l’immagine. Più è alto il PSNR maggiore è la correlazione tra le
immagini.
Errore quadratico medio - Mean Squared Error (MSE) rappresenta la norma al
quadrato della differenza tra la prima immagine e la seconda, diviso per il numero di
elementi, ed indica la discrepanza quadratica media fra i valori dei dati osservati ed i
valori dei dati stimati. Un MSE pari a 0 indica che la prima e la seconda immagine
sono perfettamente coincidenti.
Maximum Error (MAXERR) è la massima deviazione quadratica della prima
immagine rispetto alla seconda. Più è alto MAXERR maggiore sarà la differenza tra
la baseline e la repeat.
Ratio of Squared Norms (L2RAT) è il rapporto tra la norma al quadrato della seconda
immagine (repeat) rispetto alla prima (baseline). Più è vicino ad 1, maggiore sarà la
correlazione tra le immagini.
Normalized Cross Correlation (NCC) è un altro indice di misura per la somiglianza
tra le immagini in cui ritorna un valore vicino ad 1 quando la prima e la seconda
immagine presentano cambiamenti minimi.
È qui di seguito riportato lo script di Matlab usato per il confronto degli indici.
addpath('./_NIFTI_20130306/');
%% Parameters according to path names:
54
DIAG = 'IM_HIRES';
% Type 'IM_HIRES' or 'IM_MPRAGE' (case sensitive)
SIDE = 'left'; % Type 'left' or 'right' (case sensitive)
%% Body
% Read folders:
prefix_base
= [ DIAG '/baseline/' SIDE '/'];
prefix_rpt6
= [ DIAG '/repeat/' SIDE '/'];
files_base
= dir ( [prefix_base '*.nii' ] );
files_rpt6
= dir ( [prefix_rpt6 '*.nii' ] );
% Prepare header for the xls file:
v = {'Patient ID', 'PSNR', 'MSE', 'MAXERR', 'L2RAT', 'NCC'};
str = [num2str(1,'A%d') ':' num2str(1,'F%d')];
xlswrite('Results.xls',v,[ DIAG '_' SIDE],str);
% For each subject:
for i=1:length(files_base)
% Get baseline image:
nii
= load_untouch_nii( [ prefix_base files_base(i).name ] );
im_base
= double(nii.img);
% Get repeat6 image:
nii
= load_untouch_nii( [ prefix_rpt6 files_rpt6(i).name ] );
im_rpt6
= double(nii.img);
% Statistics:
[PSNR,MSE,MAXERR, L2RAT] = measerr(im_base,im_rpt6);
NCC = xcorr(im_base(:),im_rpt6(:),0,'coeff');
% Write to Excel:
v = {files_base(i).name, PSNR, MSE, MAXERR, L2RAT, NCC};
str = [num2str(i+1,'A%d') ':' num2str(i+1,'F%d')];
xlswrite('Results.xls',v,[DIAG '_' SIDE],str);
end
55
4.4 I Riferimenti Assoluti nell’immagine
Nelle ultime acquisizioni su volontari, sono stati utilizzati oggetti, come cuscini e palloncini,
riempiti di mezzi di contrasto in diluizioni diverse, per definire nelle immagini dei riferimenti
assoluti per la normalizzazione dei toni di grigio. E’ stato utilizzato un palloncino pieno di
acqua per avere il riferimento assoluto del nero, uno di gadolinio diluito con acqua distillata
per il grigio e uno di solfato di rame per il riferimento del bianco (posizionati sulla fronte dei
volontari, figura 4.12). Tra il cuscino e la testa dei volontari è stato necessario interporre un
elemento separatore (foglio di plastica da imballaggio) per non corrompere la procedura di coregistrazione effettuata dalla pipeline automatica MIND (figura 4.13).
Figura 4.12: Immagini acquisite utilizzando il protocollo MP-RAGE, con il cuscino dietro
la nuca e i palloncini in fronte.
Figura 4.13: Immagine acquisita utilizzando il protocollo MP-RAGE, con cuscino e
separatore dietro la nuca (a sinistra) e immagine acquisita utilizzando il protocollo HR con
cuscino (a destra).
56
Tuttavia, dalle analisi condotte, è emerso che questi riferimenti assoluti (cuscini e palloncini),
risultano molto disomogenei tra loro sia nelle acquisizioni con protocollo MP-RAGE che con
il nuovo protocollo HR e anche all’interno della stessa immagine. Durante il lavoro di tesi, si
è quindi ideato e sperimentato un nuovo metodo per la normalizzazione di livelli di grigio,
con altri riferimenti assoluti, realizzando un nuovo oggetto (o campione) di calibrazione.
Tale oggetto (figura 4.14) consiste in un elemento in plexiglass di 9 x 8 x 1 cm3, all’interno
del quale sono state create 6 cavità per l’inserimento di diluizioni diverse di mezzo di
contrasto, per avere 6 riferimenti assoluti sull’immagine. Le dimensioni dell’oggetto sono
state stabilite in base alla necessità di riuscire ad inserirlo all’interno del campo di vista delle
immagini ad Alta Risoluzione (10 x 20 cm2).
Figura 4.14: Il Nuovo Oggetto di Calibrazione.
E’ noto che i mezzi di contrasto (abbreviati m.d.c) sono sostanze in grado di modificare il
modo in cui una regione analizzata appare in un’immagine. Nello specifico, alterano il
contrasto della struttura anatomica in esame rispetto a ciò che la circonda, in modo da rendere
visibili i dettagli che altrimenti risulterebbero non apprezzabili. Ogni tecnica di imaging ha i
proprio mezzi di contrasto, i quali hanno caratteristiche diverse a seconda del metodo di
formazione dell’immagine. Infatti, a differenza dei mezzi di contrasto utilizzati in CT, dove
l’azione del m.d.c. è rivolta ad attenuare i raggi X che attraversano l’organo bersaglio, in RM
57
i mezzi di contrasto influenzano i tempi di rilassamento T1 e T2. Il mezzo di contrasto più
utilizzato in RM è il Gadolinio, per le caratteristiche paramagnetiche del suo ione Gd3+. Viene
utilizzato in soluzione e complessato da legami ciclici poliamminopolicarbossilici, che
servono ad evitare la tossicità dello ione libero per l’organismo umano [34]. I mezzi di
contrasto a base di Gadolinio aumentano il segnale nelle sequenze T1 pesate, dato che
riducono il tempo di rilassamento T1.
Per la preparazione delle diluizioni, si è utilizzato il Gd-DOTA 0.5 mmol/mL. Nell’uso sui
pazienti, la dose di m.d.c. iniettato per endovenosa è proporzionale al suo peso corporeo e in
genere il dosaggio è tra 0.1 – 0.3 mmol/Kg del peso del paziente, che equivalgono a 0.2 – 0.6
mL/Kg [35]. Si sono inserite nelle cavità concentrazioni variabili di mezzo di contrasto al
gadolinio considerando che la dose massima di m.d.c. generalmente iniettata è di 0.6 mL/Kg e
che la quantita’ di sangue presente nel corpo umano è di circa 5.5 L (per un uomo di 80 Kg),
si stima allora che 0.6 mL di gadolinio sono presenti in 70 mL di sangue. Si e’ impostata la
seguente equazione:
(1)
Dove CGd rappresenta la concentrazione di Gadolinio che si desiderata ottenere, 70 sono mL
0.5 mL rappresenta la quantita’ minima di Gadolinio che si e’ in grado di
di sangue,
selezionare con la siringa usata durante la preparazione e Vol rappresenta il volume di acqua
demineralizzata necessaria per diluire i 0.5 mL di Gd-DOTA per avere una concentrazione
pari a CGd.
Nel primo prototipo, si sono diluite concentrazioni diverse di Gadolinio in 5 delle 6 cavita’
presenti sul fantoccio, come mostrato in tabella 4.A.
Soluzione CGd [mL]
2
3
4
5
6
0.1
0.2
0.4
0.6
0.8
Vol [mL]
350
175
88
58
44
Tabella 4.A: Diluizioni del mezzo di contrasto al Gadolinio, nel primo prototipo.
58
Nella cavità (o posizione) 1 dell’oggetto di calibrazione sono stati iniettati 2 mL di soluzione
di Solfato di Rame (Conduttanza 1000 µS/cm +/- 50 µS/cm) (tabella riassuntiva 4.B).
Soluzione Sostanza
mL
1 Solfato di Rame
2
Gadolinio
3
Gadolinio
4
Gadolinio
5
Gadolinio
6
Gadolinio
2
0.1
0.2
0.4
0.6
0.8
Tabella 4.B: Le soluzioni nel Primo Prototipo dell’oggetto
di calibrazione.
Preparato il campione, si sono acquisite le immagini con sequenza MP-RAGE e con la nuova
sequenza ad alta risoluzione HR (le stesse utilizzate per le acquisizioni sui volontari). Date le
piccole dimensioni dell’oggetto di calibrazione, lo si è acquisito insieme ad altri phantom (di
dimensioni maggiori) per avere più segnale nella bobina e per valutare come e se cambino i
valori dei toni di grigio delle soluzioni utilizzando un oggetto test o l’altro come confronto. Si
sono utilizzati il fantoccio TO5 dell’EUROSPIN (figura 4.15 e 4.16), l’ADNI phantom [45]
(figura 4.17) e una SFERA ripiena di materiale omogeneo (acqua demineralizzata e solfato di
rame) (figura 4.18).
Figura 4.15: MP-RAGE dell’oggetto test
TO5 e del Nuovo oggetto di calibrazione
(sulla destra).
Figura 4.16: HR dell’oggetto test TO5
e del Nuovo oggetto di calibrazione
(in basso).
59
Figura 4.17: HR dell’oggetto test ADNI
PHANTOM e del Nuovo oggetto di
calibrazione (in basso).
Figura 4.18: HR dell’oggetto test SFERA
e del Nuovo oggetto di calibrazione (in
basso).
60
4.5 La Calibrazione con Riferimenti Assoluti
La procedura di normalizzazione ha lo scopo di uniformare i valori dei livelli di grigio delle
immagini, in modo tale che in ogni immagine vengano associati agli stessi tessuti gli stessi
valori di grigio. Attualmente, la procedura automatica di estrazione delle scatole ippocampali,
definita dal progetto MIND (descritta al paragrafo 2.3), effettua una normalizzazione dei toni
di grigio che si basa sulla segmentazione del corpo calloso, non applicabile alle immagini
acquisiste con il protocollo ad Alta Risoluzione, in quanto tale regione del cervello non è
visibile nel campo di vista delle HR. Secondo la procedura della pipeline, individuata sulle
immagini total brain la regione del corpo calloso, si identificano i tre tessuti: materia grigia
(GM), materia bianca (WM), e liquido cerebrospinale (CFS) e se ne calcolano i valori medi,
che vengono poi abbinati ai corrispondenti livelli medi degli stessi tessuti di un template di
riferimento (il ICBM152) attraverso una spline cubica che passa tra 0, 1 e i tre punti definiti
dal template (normalizzati tra 0 e 1).
Questo tipo di normalizzazione, ragionevole ma arbitraria, presenta delle criticità, date dal
fatto che i toni di grigio della GM, WM e CFS dell’immagine acquisita sono forzati ai toni di
grigio dei corrispondenti tessuti dell’immagine di riferimento, perdendo così contenuto
informativo non rispettando la variabilità interindividuale. Inoltre come detto, tale procedura è
applicabile alle sole immagini acquisite con protocollo MP-RAGE. Nasce pertanto la
necessità di definire un nuovo metodo di normalizzazione che superi queste criticità.
Una volta che l’oggetto di calibrazione (descritto al paragrafo 4.4) è stato riempito di
diluizioni diverse di mezzo di contrasto, ne sono state acquisite immagini RM, con le stesse
sequenze e con lo stesso tomografo utilizzato per le acquisizioni sui volontari. E’ stato creato
uno script in ambiente MATLAB che crea una spline cubica passante tra 0 e 3 punti di
riferimento definiti dall’oggetto test nell’immagine. In particolare, si sono analizzate le
immagini HR dell’oggetto test acquisito con TO5, ADNI phantom, e SFERA e si è deciso di
prendere quest’ultima come riferimento, in quanto lungo le fette dell’immagine i toni di grigio
per la stessa soluzione mostrano un andamento più costante. Si sono poi interpolati i punti
della spline in modo tale che i toni di grigio delle soluzioni contenute nelle diverse cavità
nelle altre immagini vengano portati ai toni di grigio delle soluzioni corrispondenti a quelli
misurati nell’immagine con la SFERA. In particolare, in base ai profili delle immagini, si
61
sono presi come riferimento i toni di grigio delle soluzioni 1, 2 e 4. Un esempio del risultato
di questa spline e’ mostrato nella figura 4.19.
2000
1800
1600
1400
1200
1000
800
600
400
200
0
0
500
1000
1500
2000
Figura 4.19: Spline cubica: in ascissa, i valori delle soluzioni 1, 2 e 4 che si
desidera riportare ai valori del riferimento (in ordinata).
Lo script MATLAB creato per la procedura di normalizzazione è riportato qui di seguito:
addpath('./NIFTI_20130306/');
clear all
close all
X=[0,1017, 1309, 1435]; %% valori soluzioni 1, 2 e 4 dell’immagine
Y=[0,1191, 1587, 1865]; %% valori soluzioni 1, 2 e 4 dell’immagine SFERA
(il riferimento)
xx=linspace(0, 2000);
curva=spline(X,Y,xx); % spline (cubica di default): essa calcola la
trasformazione cubica che porta i valori di X ad essere coincidenti con
quelli in Y
plot(X, Y, 'o', xx, curva, '-');
grid on
b=load_untouch_nii('dir_in');
62
B=double(b.img);
hbox=interp1(xx,curva,B(:),'linear'); % stessa trasformazione a B(:)
b.img=reshape(hbox,size(B)); % da vettore torno 3D
save_untouch_nii(b,’dir_out’);
63
5. RISULTATI
5.1 Le Correzioni di Intensity Inhomogeneity
Alle immagini RM acquisite sui volontari sono stati applicati i software di correzione della
disomogeneità IIH, SPM5 e BRAINSUITE. I risultati della correzione effettuata da SPM5
sulle immagini MP-RAGE sono mostrati in figura 5.1, dove: A è l’immagine originale, B
l’immagine corretta con SPM e C rappresenta la disomogeneità percentuale tra le due: (AB)/A. Altri risultati sono riportati in figura 5.2, dove si mostrano le disomogeneità percentuali
di immagini di volontari diversi.
A
B
C
Figura 5.1: A: Immagine MP-RAGE grezza ; B: immagine A corretta da SPM5; C: Mappa della
disomogeneità percentuale tra l’immagine A e B: (A-B)/A La differenza percentuale tra le immagini grezza
e corretta è tra 5-10%.
64
Figura 5.2: Mappe delle disomogeneità percentuali di IIH simili tra immagini di volontari diversi.
I risultati della correzione effettuata da SPM5 sulle immagini ad Alta Risoluzione (HR) sono
mostrati in figura 5.3, dove: A è l’immagine originale, B l’immagine corretta con SPM5 e C
rappresenta la disomogeneità percentuale tra le due: (A-B)/A.
A
B
C
Figura 5.3: A: Immagine HR grezza ; B: immagine A corretta da SPM5; C: Mappa della disomogeneità
percentuale tra l’immagine A e B: (A-B)/A La differenza percentuale tra le immagini grezza e corretta è tra
5-10%.
65
Il SW di correzione BRAINSUITE sulle immagini MP-RAGE produce i risultati mostrati in
figura 5.4, dove: A è l’immagine originale, B l’immagine corretta con BRAINSUITE e C
rappresenta la disomogeneità percentuale tra le due: (A-B)/A.
A
B
C
Figura 5.4: A: Immagine MP-RAGE grezza ; B: immagine A corretta da BRAINSUITE; C: Mappa della
disomogeneità percentuale tra l’immagine A e B: (A-B)/A La differenza percentuale tra le immagini grezza e
corretta è tra 5-10%.
La correzione di BRAINSUITE sulle immagini ad alta risoluzione è mostrata in figura 5.5,
dove: A è l’immagine HR originale, B l’immagine corretta con BRAINSUITE e C
rappresenta la disomogeneità percentuale tra le due: (A-B)/A.
A
B
66
C
Figura 5.5: A: Immagine HR grezza ; B: immagine A corretta da BRAINSUITE; C: Mappa della
disomogeneità percentuale tra l’immagine A e B: (A-B)/A La differenza percentuale tra le immagini
grezza e corretta è tra 5-10%.
L’applicazione di BRAINSUITE sulle immagini acquisite, sia con protocollo MP-RAGE che
HR, ha prodotto una serie di problematiche che rendono il SW incompatibile con la procedura
automatica MIND. Il programma provoca deformazioni, legate alle dimensioni dei voxel
dell’immagine in input, e applica rotazioni della matrice dell’immagine che rendono
impraticabili le procedure di co-registrazione della pipeline. Pertanto si procede alla
valutazione delle scatole ippocampali estratte dalle sole immagini trattate con SPM5, che è
risultata compatibile con la procedura automatica.
67
5.2 La Correzione SPM5 su MP-RAGE MRI
Si calcolano gli indici di confronto introdotti al paragrafo 4.3 per analizzare quantitativamente
la riproducibilità delle scatole ippocampali estratte dalle immagini di RM (o MRI – Magnetic
Resonance Imaging) MP-RAGE, con e senza correzione attraverso SPM5. Nelle figure 5.6 e
5.7 sono riportate le box “corrette” baseline e repeat, destre e sinistre rispettivamente. Dal
momento che i volontari hanno un età compresa tra i 19 e i 29 anni, e non hanno o hanno
avuto patologie al Sistema Nervoso Centrale, si suppone che non ci siano differenze
anatomiche tra le acquisizioni ripetute nel breve arco di tempo di una settimana o poco più.
Figura 5.6: Box MP-RAGE dell’ippocampo destro: baseline (a sinistra) e repeat (a destra).
Figura 5.7: Box MP-RAGE dell’ippocampo sinistro: baseline (a sinistra) e repeat (a destra).
68
Si mettono a confronto i valori dei parametri della correlazione (PSNR, MSE, MAXERR,
L2RAT e NCC) ricavati dalle immagini corrette con SPM5 con gli stessi relativi alle
immagini non corrette (o immagini grezze) (Tabella 5.A).
PSNR*
C
NC
MSE
C
MAXERR*
L2RAT*
C
C
NC
NC
NC
NCC
C
NC
AR
74.22 74.15 0.0025 0.0025 0.3520 0.407 0.955 0.954 0.998 0.997
BR
69.69 69.74 0.0070 0.0069 0.9039 0.797 0.954 0.991 0.993 0.992
CR
72.12 73.49 0.0040 0.0029 0.5500 0.429 0.974 1.065 0.996 0.997
DR
67.54 76.45 0.0115 0.0015 0.6470 0.427 0.836 0.994 0.991 0.998
ER
68.79 74.93 0.0086 0.0021 0.8894 0.400 0.925 1.064 0.992 0.998
FR
75.37 76.22 0.0019 0.0016 0.4321 0.414 1.004 0.976 0.998 0.998
AL
74.73 74.67 0.0022 0.0022 0.2822 0.321 0.962 0.321 0.998 0.998
BL
70.91 68.93 0.0053 0.0083 0.7000 0.722 0.942 0.722 0.995 0.992
CL
72.43 73.32 0.0037 0.0030 0.5277 0.456 0.992 0.456 0.996 0.998
DL
69.89 77.65 0.0067 0.0011 0.6624 0.297 0.864 0.297 0.995 0.999
EL
67.65 77.12 0.0112 0.0013 0.6683 0.348 1.152 0.348 0.990 0.999
FL
75.98 76.87 0.0016 0.0013 0.3759 0.328 1.026 0.328 0.998 0.999
MEDIA 71.61 74.46 0.0055 0.0029
0.583 0.446 0.966 1.018 0.995 0.997
Tabella 5.A: confronto tra PSNR, MSE, MAXERR, L2RAT e NCC delle box MP-RAGE dell’ippocampo destro
(R) e sinistro (L), delle immagini Corrette (C) e Non Corrette (NC) , per ogni volontario(lettera da A a F).
I parametri di riproducibilità sono migliori per le immagini MP-RAGE non corrette dalle
disomogeneità attraverso il software SPM5. Infatti il PSNR medio per le immagini non
corrette è 74.46 per e per le corrette è 71.61; il MAXERR è più alto per le immagini corrette
0.583 in media rispetto alle non corrette 0.446 e L2RAT è maggiore per le immagini non
corrette, con t-test significativo (p<0.02).
69
5.3 La Correzione SPM5 su HR MRI
Calcolo gli indici di confronto introdotti al paragrafo 4.3 tra le scatole estratte dalle immagini
HR con e senza correzione attraverso SPM5. Nelle figure 5.8 e 5.9 sono mostrate le box
“corrette” baseline e repeat, destre e sinistre rispettivamente. Dal momento che i volontari
hanno un età compresa tra i 19 e i 29 anni, e non hanno o hanno avuto patologie al Sistema
Nervoso Centrale, si suppone che non ci siano differenze anatomiche tra le acquisizioni
ripetute nel breve arco di tempo di una settimana o poco più.
Figura 5.8: Box HR dell’ippocampo destro: baseline (a sinistra) e repeat (a destra).
Figura 5.9: Box HR dell’ippocampo sinistro: baseline (a sinistra) e repeat (a destra).
70
Si mettono a confronto i valori dei parametri della correlazione (PSNR, MSE, MAXERR,
L2RAT e NCC) ricavati dalle immagini corrette con SPM5 con gli stessi relativi alle
immagini non corrette (Tabella 5.B)
PSNR
C
NC
MSE
C
MAXERR*
NC
C
NC
L2RAT
C
NC
NCC
C
NC
AR
71.82 67.82 0.0042
0.0108 0.376 0.241 0.995
2.34 0.992 0.994
BR
71.78 72.96 0.0043
0.0033 0.459 0.365 1.003 0.752 0.992 0.981
CR
74.47 76.77 0.0023
0.0014 0.376 0.145 0.996 0.743 0.995 0.994
DR
73.53 71.54 0.0028
0.0046 0.380 0.236 0.990 0.575 0.994 0.993
ER
73.69 79.63 0.0027
0.0007 0.388 0.136 0.995 0.843 0.995 0.991
FR
68.62 80.28 0.0089
0.0006 0.396 0.094 0.989 0.882 0.983 0.993
AL
71.15 67.65 0.0049
0.0112
0.396 0.244 0.984
2.35
0.990 0.995
BL
71.15 73.73 0.0048
0.0028
0.397 0.253 0.990 0.790
0.990 0.984
CL
73.83 76.93 0.0026
0.0013
0.398 0.135 0.993 0.738
0.995 0.995
DL
72.18 71.73 0.0039
0.0044
0.390 0.229 0.988 0.571
0.992 0.986
EL
73.46 78.95 0.0029
0.0008
0.396 0.283 0.995 0.831
0.994 0.993
FL
73.33 80.01 0.0030
0.0006
0.376 0.216 1.009 0.876
0.994 0.993
MEDIA
72.41 74.83 0.0040
0.0035 0.394 0.215 0.993 1.025 0.992 0.994
Tabella 5.B: confronto tra PSNR, MSE, MAXERR, L2RAT e NCC delle box HR dell’ippocampo destro (R)
e sinistro (L), delle immagini Corrette (C) e Non Corrette (NC) , per ogni volontario(lettera da A a F).
Dalla tabella 5.B, i parametri di riproducibilità sono migliori per le immagini HR non corrette
dalle disomogeneità; infatti il PSNR medio per le immagini non corrette è 74.83 mentre per le
corrette con SPM5 72.41; il MAXERR è più alto per le immagini corrette con 0.394 rispetto
alle non corrette pari a 0.215, con t-test significativo (p<0.02).
71
5.4 Confronto tra MP-RAGE e HR MRI
Noto che sulle immagini acquisiste con il nuovo protocollo ad Alta Risoluzione la procedura
automatica MIND non effettua le operazioni pre-processing di denoising e normalizzazione,
si confronta la riproducibilità delle immagini MP-RAGE rispetto alle immagini HR con e
senza la correzione dal Bias Field, tabella 5.C.
PSNR
C
NC
MSE
C
MAXERR*
NC
C
NC
L2RAT
C
NC
NCC
C
NC
MPRAGE 71.61 74.46 0.0055 0.0029 0.583 0.446 0.966 1.018 0.995 0.997
HR
72.41 74.83 0.0040 0.0035 0.394 0.215 0.993 1.025 0.992 0.994
Tabella 5.C: confronto tra PSNR, MSE, MAXERR, L2RAT e NCC delle box MP-RAGE e HR delle
immagini Corrette (C) e Non Corrette (NC).
Dati i valori in tabella 5.C, si conferma la miglior riproducibilità delle immagini acquisiste
con il nuovo protocollo ad Alta Risoluzione rispetto a quelle acquisite con protocollo ADNI
MP-RAGE, indipendentemente da correzioni o meno del Bias Field. Per le immagini trattate
con SPM5, Il MAXERR vale 0.394 per le HR e 0.583 per le MP-RAGE e per le immagini
non corrette il MAXERR vale 0.215 per le HR mentre misura 0.446 per le MP-RAGE, con ttest significativo (p < 0.02).
72
5.5 La Normalizzazione con Nuovo Oggetto di Calibrazione
Le immagini del nuovo oggetto di calibrazione acquisite con il protocollo ad Alta Risoluzione
e con il protocollo dell’ADNI, MP-RAGE, sono state analizzate per valutare come variano i
toni di grigio delle stesse soluzioni di gadolinio, di solfato di rame e di acqua distillata tra le
immagini.
Si sono analizzati i toni di grigio delle 6 soluzioni nelle immagini acquisite con i fantocci TO5
(figura 5.10), SFERA (figura 5.11) e ADNI phantom (figura 5.13), e si è constatato che la
stessa soluzione di mezzo di contrasto mostra valori variabili tra le immagini e tra le diverse
fette della stessa immagine.
Figura 5.10: (a sinistra) HR dell’oggetto test TO5 e del Nuovo oggetto di calibrazione (in basso) con
relativo profile plot (a destra).
Figura 5.11: (a sinistra) HR dell’oggetto test SFERA e del Nuovo oggetto di calibrazione (in basso) con
relativo profile plot (a destra).
73
Figura 5.12: (a sinistra) HR dell’oggetto test ADNI e del Nuovo oggetto di calibrazione (in basso) e
relativo profile plot (a destra).
Le immagini 5.10, 5.11 e 5.12 mostrano che con le diluizioni del primo prototipo (definite al
paragrafo 4.4), le cavità 4, 5, 6 (da sinistra) dell’oggetto di calibrazione non mostrano
differenze apprezzabili, dove il gadolinio appare iperintenso, pertanto si è effettuato un
secondo riempimento dell’oggetto di calibrazione in cui si sono modificati i contenuti delle
cavità 5 e 6. Nella 5a cavità del secondo prototipo è stata inserita una soluzione di gadolinio
al 0.07 mL e nella 6a 2 mL di acqua distillata (tabella 5.D). Successivamente si sono acquisite
con gli stessi protocolli le immagini del secondo prototipo dell’oggetto di calibrazione
utilizzando come oggetto test di riferimento una bottiglia omogenea contenente una soluzione
di Solfato di Rame (figure 5.13 e 5.14).
Soluzione Sostanza
mL
1 Solfato di Rame
2
2
Gadolinio 0.1
3
Gadolinio 0.2
4
Gadolinio 0.4
5
Gadolinio 0.07
6 Acqua Distillata
2
Tabella 5.D: Le soluzioni nel Secondo Prototipo dell’oggetto di
calibrazione.
74
Figura 5.14: MP-RAGE dell’oggetto test
BOTTIGLIA e del Nuovo oggetto di
calibrazione (sulla destra).
Figura 5.13: HR dell’oggetto test
BOTTIGLIA e del Nuovo oggetto di
calibrazione (in basso) .
Le tabelle 5.E e 5.F riportano i valori di media e deviazione standard dei toni di grigio delle
soluzioni contenute nell’oggetto di calibrazione nelle immagini HR ed MP-RAGE:
TO5 (HR)
Soluzione
1
2
3
4
5
6
MEDIA
1258
1643
1831
1810
1779
1700
SFERA (HR)
DS
34
61
66
71
72
73
MEDIA
1191
1587
1828
1865
1820
1768
ADNI (HR)
DS
40
52
82
77
76
73
MEDIA
1017
1309
1457
1435
1399
1336
BOTTIGLIA (HR)
DS
31
40
58
59
56
62
MEDIA
1131
1504
1677
1646
1402
157
DS
42
61
85
75
57
27
Tabella 5.E: Confronto della media e deviazione standard delle soluzioni contenute nelle 6
cavità dell’oggetto di calibrazione tra le immagini ad alta risoluzione.
75
TO5 (MPRAGE)
Soluzione
1
2
3
4
5
6
MEDIA
1669
2183
2477
2618
2504
2507
BOTTIGLIA(MPRAGE)
DS
120
181
178
195
175
180
MEDIA
DS
1276
1741
2069
2091
1663
221
81
157
213
174
155
14
Tabella 5.F: Confronto della media e deviazione standard delle soluzioni contenute nelle 6
cavità dell’oggetto di calibrazione tra le immagini MP-RAGE.
Dalle analisi condotte, la SFERA ha una maggior uniformità dei toni di grigio, perciò si
decide di usare i valori delle cavità dell’immagine con la sfera come riferimento per la
normalizzazione dei toni di grigio per le altre immagini.
La funzione di calibrazione non lineare creata permette di portare i valori dei toni di grigio
delle immagini (TO5, BOTTIGLIA e ADNI phantom) con i corrispondenti nell’immagine di
riferimento della SFERA. Lo script definisce una spline cubica che associa ai valori di 3
soluzioni prese come riferimento: la 1, la 2 e la 4 dell’immagine da normalizzare, ai valori dei
corrispondenti nell’immagine target di riferimento. Si sono scelte le soluzioni contenute nelle
cavità 1, 2 e 4 in base ai profili.
Il risultato delle calibrazioni è mostrato nei grafici: 5.15 e 5.16 per il TO5 HR e MP-RAGE,
5.17 per l’ADNI phantom HR, 5.18 e 5.19 per la BOTTIGLIA HR e MP-RAGE.
2000
1800
1600
1400
1200
1000
800
600
400
200
0
0
500
1000
1500
2000
Figura 5.15: Curva di calibrazione tra i valori dell’immagine TO5 HR (in ascissa) e i
valori dell’immagine delle SFERA (in ordinata).
76
2000
1800
1600
1400
1200
1000
800
600
400
200
0
0
500
1000
1500
2000
2500
3000
Figura 5.16: Curva di calibrazione tra i valori dell’immagine TO5 MP-RAGE (in ascissa) e i
valori dell’immagine delle SFERA (in ordinata).
2000
1800
1600
1400
1200
1000
800
600
400
200
0
0
500
1000
1500
Figura 5.17: Curva di calibrazione tra i valori dell’immagine ADNI phantom HR (in ascissa) e i
valori dell’immagine delle SFERA (in ordinata).
2000
1800
1600
1400
1200
1000
800
600
400
200
0
0
500
1000
1500
2000
Figura 5.18: Curva di calibrazione tra i valori dell’immagine BOTTIGLIA HR (in ascissa) e i
valori dell’immagine delle SFERA (in ordinata).
77
2000
1800
1600
1400
1200
1000
800
600
400
200
0
0
500
1000
1500
2000
2500
Figura 5.19: Curva di calibrazione tra i valori dell’immagine BOTTIGLIA MP-RAGE (in ascissa) e
i valori dell’immagine delle SFERA (in ordinata).
Si mettono a confronto le medie e le deviazioni standard dei toni di grigio delle 6 soluzioni,
prima e dopo la calibrazione rispetto al riferimento della SFERA tra le immagini ad HR,
tabella 5.G e tra le MP-RAGE, tabella 5.H:
Soluzione SFERA(HR)
TO5(HR)
ADNI(HR)
BOTTIGLIA(HR)
Riferimento
Prima
Dopo
Prima
Dopo
Prima
Dopo
1
1191±40
1258±34
1195±26
1017±31
1191±23
1131±42
1188±23
2
1587±52
1643±61
1573±88
1309±40
1585±70
1504±61
1585±71
3
1828±82
1831±66 1892±100
1457±58 1933±124 1677±85
1916±125
4
1865±77
1810±71 1851±109
1435±59 1889±135 1646±75
1857±150
5
1820±76
1779±72
1824±90
1399±56 1802±127 1402±57
145±359
6
1768±73
1700±73
1683±90
1336±62 1679±125
157±27
379±56
Tabella 5.G: Confronto di media e deviazione standard delle soluzioni contenute nelle 6 cavità
dell’oggetto di calibrazione tra le immagini HR rispetto al riferimento della SFERA, prima e dopo
la calibrazione.
78
Soluzione SFERA(HR)
TO5(MPRAGE)
BOTTIGLIA(MPRAGE)
Riferimento
Prima
Dopo
Prima
Dopo
1
1191±40
1669±120
1200±89
1276±81
1191±20
2
1587±52
2183±181 1558±127
1741±157
1586±24
3
1828±82
2477±178 1837±108
2069±213
1845±28
4
1865±77
2618±196 1865±109
2091±174
1865±34
5
1820±76
2504±175 1871±166
1663±155
1521±25
6
1768±73
2507±180 1791±130
221±14
213±20
Tabella 5.H: Confronto di media e deviazione standard delle soluzioni contenute nelle 6 cavità
dell’oggetto di calibrazione nelle immagini MP-RAGE rispetto al riferimento della SFERA.,
prima e dopo la calibrazione.
Le Tabelle 5.G, 5.H e le figure 5.20 e 5.21 mostrano i risultati della calibrazione, per cui i toni
di grigio delle stesse soluzioni contenute nel nuovo oggetto di calibrazione risultano più simili
nelle diverse immagini ai valori di riferimento.
IMMAGINI NON CALIBRATE
2000
1800
1600
1400
1200
TO5
1000
SFERA
800
ADNI
600
BOTTIGLIA
400
200
0
1
2
3
4
5
6
Figura 5.20: Confronto delle medie dei toni di grigio delle 6 soluzioni tra le immagini ad alta
risoluzione TO5, SFERA, ADNI e BOTTIGLIA prima della Calibrazione.
79
IMMAGINI CALIBRATE
2000
1800
1600
1400
TO5
1200
SFERA
1000
ADNI
800
BOTTIGLIA
600
400
200
1
2
3
4
5
6
Figura 5.21: Confronto delle medie dei toni di grigio delle 6 soluzioni tra le immagini ad alta
risoluzione TO5, SFERA, ADNI e BOTTIGLIA dopo la Calibrazione.
80
6. DISCUSSIONE E CONCLUSIONI
Il presente lavoro di tesi è rivolto a migliorare la qualità di immagini di Risonanza Magnetica
Nucleare per lo studio della malattia di Alzheimer, con l’obiettivo di rendere utile ai fini
diagnostici l’analisi longitudinale delle immagini RM ad Alta Risoluzione (High Resolution,
HR). A questo scopo si sono seguite due strade: la prima rivolta a correggere la
disomogeneità dell’intensità di segnale che altera l’immagine di RM, definita Intensity
Inhomogeneity (IIH) o Bias Field, applicando metodi proposti dalla letteratura ed
implementati da software di correzione; la seconda alla definizione di una nuova procedura di
normalizzazione dei toni di grigio dell'immagine che si basi su riferimenti assoluti presenti
nell’immagine stessa con la realizzazione di un nuovo oggetto di calibrazione.
Lo studio della IIH su oggetti test ha dimostrato che nelle sequenze utilizzate in questo lavoro,
le alterazioni di segnale possono essere fino al 10% ed interessano principalmente le regioni
periferiche dell’immagine. Questa quantità, per quanto piccola, può mascherare piccole
variazioni di segnale utili alla diagnosi precoce e quindi si è proceduto allo studio dei metodi
di correzione sulle immagini acquisite sui volontari.
Il lavoro si è basato su un data set in cui per ogni volontario sono presenti: una coppia di
immagini acquisite secondo il protocollo MP-RAGE dell’ADNI e una coppia di immagini
acquisite mediante il nuovo protocollo ad Alta Risoluzione (High Resolution HR), definito
dall’INFN (sezione di Genova e di Trieste), dall’Università di Trieste e dalla collaborazione
con l’Ospedale Cattinara di Trieste. Ogni volontario è stato chiamato per due sessioni di
acquisizioni, ad una settimana o più di distanza l’una dall’altra: la prima immagine viene
identificata con baseline e la seconda con repeat. E’ stata studiata la riproducibilità delle
immagini e se questa poteva essere aumentata introducendo le correzioni della disomogeneità
IIH.
Alle immagini acquisite sono stati applicati due dei metodi di correzione del Bias Field più
comuni proposti in letteratura, basati sulla segmentazione e sugli istogrammi, ed implementati
rispettivamente dai software SPM5 e BRAINSUITE. Le immagini acquisite e corrette per
ogni volontario sono state inviate all’INFN di Genova per l’avvio della procedura automatica
di estrazione delle scatole ippocampali (MIND). Ogni box mostra la porzione di encefalo
81
relativa alla sola area ippocampale, che è considerata un promettente biomarker per lo studio
dell’Alzheimer. Tuttavia si è appurato che solo il SW SPM5 risulta essere compatibile con la
pipeline MIND. Per ogni volontario si hanno 16 scatole (8 per le immagini grezze e 8 per le
immagini corrette da SPM5): le coppie baseline (destra e sinistra) e le coppie repeat (destra e
sinistra) sia per MP-RAGE che per HR. Si è implementato un sistema di confronto oggettivo,
per valutare la correlazione tra le immagini ripetute con la definizioni degli indici: PSNR,
MSE, MAXERR, L2RAT e NCC.
I risultati mostrano la miglior riproducibilità delle immagini acquisite con il protocollo ad
Alta Risoluzione rispetto alle immagini MP-RAGE, in quanto i parametri della correlazione
sono più alti per le immagini HR con t-test significativo. Tuttavia l’applicazione della
correzione mediante SPM5 sul nostro campione non migliora la riproducibilità tra baseline e
repeat rispetto alle immagini non corrette da IIH, anzi si osserva un leggero peggioramento.
Ritengo che questo sia dovuto al fatto che le disomogeneità osservate incidono principalmente
nelle regioni periferiche dell’immagine e sono caratterizzate da una bassa frequenza spaziale,
ed è quindi ragionevole che pesino poco nei volumi ippocampali che sono di piccole
dimensioni (4 x 7.5 x 3 cm3) e piuttosto centrali. Il leggero peggioramento dei parametri
utilizzati per valutare la riproducibilità delle immagini è un effetto indesiderato delle
procedure di correzione.
Le immagini acquisite con il nuovo protocollo ad Alta Risoluzione non possono essere
analizzate con il processo di pre-processing che caratterizza la pipeline di MIND. Infatti la
normalizzazione dei toni di grigio di MIND si basa sulla segmentazione della regione del
corpo calloso che non è visibile nelle immagini HR a ridotto campo di vista e centrate sulle
porzioni ippocampali e paraippocampali del cervello. Si è sviluppato un nuovo metodo di
normalizzazione che utilizza riferimenti assoluti presenti nell’immagine stessa. Si è creato un
nuovo oggetto di calibrazione, un elemento in plexiglass (9 x 8 x 1 cm3) con 6 cavità riempite
da diluizioni differenti di gadolinio, solfato di rame e acqua distillata definendo così 6
riferimenti assoluti nell’immagine.
I risultati della calibrazione sono soddisfacenti in quanto la normalizzazione si dimostra una
procedura efficace e robusta e in questo modo le immagini HR sono normalizzate con un
criterio oggettivo.
82
Uno sviluppo futuro sarà studiare la correzione di IIH dalle immagini in vivo ed in presenza
del nuovo oggetto di calibrazione, che verrà posizionato sotto la nuca del volontario. A tale
scopo si propone la realizzazione di un secondo prototipo di oggetto di calibrazione dalle
caratteristiche più ergonomiche. Inoltre si potrà procedere alla programmazione di un
protocollo clinico di studio longitudinale su pazienti, coinvolgendo una o più sedi.
83
84
APPENDICE
A.1 La Risonanza Magnetica Nucleare
La Risonanza Magnetica (RM) nucleare rappresenta lo studio delle proprietà magnetiche del
nucleo dell’atomo; sia i protoni che i neutroni esibiscono proprietà magnetiche legate al loro
spin (momento angolare) e alla loro distribuzione di carica. In particolare tutto l’imaging di
RM si basa sul segnale del nucleo di Idrogeno (H+), costituito da un unico protone. I primi
studi di RM risalgono agli anni 40, come strumento d’indagine per ricerche in ambito chimico
e biochimico; negli anni 70, è stato scoperto che i gradienti di campo magnetico possono
permettere la localizzazione del segnale RM e la generazione d’immagini il cui contrasto e’
determinato dalle proprietà magnetiche del protone, fornendo importanti informazioni
cliniche. Dal 1980 si è verificata la grande diffusione di tale apparecchiatura in ambito
clinico. Infatti l’alto contrasto e differenziazione dei tessuti molli e la sicurezza per il paziente
(dato dal fatto che non utilizza radiazioni ionizzanti) hanno fatto si che la RM diventasse per
molti esami la tecnica di indagine preferenziale, a dispetto della CT (Computed Tomography).
Tuttavia ci sono alcuni svantaggi da considerare, che includono l’elevato costo
dell’apparecchiatura, i lunghi tempi per l’acquisizione di un immagine, artefatti significativi e
problemi legati alla claustrofobia dei pazienti sottoposti all’indagine.
A.1.1 Preludio all’Imaging di Risonanza Magnetica
Il nucleo di un atomo è composto da protoni e da neutroni con le caratteristiche riportate in
figura (A.1.1), il loro spin e la loro distribuzione di carica ne influenzano le proprietà
magnetiche. Lo spin è assimilabile al momento angolare di un sistema macroscopico rotante e
si può affermare che sia una grandezza “intrinseca” che prescinde da un modello del sistema e
che ha le proprietà formali di un momento angolare. In particolare lo spin del protone (dalla
carica positiva, opposta all’elettrone) produce un dipolo magnetico; nonostante il neutrone sia
85
elettricamente privo di carica, le disomogeneità di carica a livello subnucleare produce un
campo magnetico di direzione opposta e delle stessa intensità dei quello generato dal protone.
Il vettore momento magnetico (μ), descrive le caratteristiche del campo magnetico di una
carica elettrica che ruota su stessa, ovvero dotata di spin (S). La relazione che lega il momento
magnetico allo spin è:
μ = γ*S
(1)
dove γ rappresenta una costante di proporzionalità nota come rapporto giromagnetico,
caratteristico di ogni tipo di nucleo. Si specifica che in un nucleo con un numero pari di
protoni e neutroni, gli spin sono accoppiati e il momento magnetico è essenzialmente zero.
Invece i nuclei aventi numero dispari di protoni o di neutroni o entrambe, hanno S diverso da
zero e perciò questi nuclei sono dotati di momento angolare μ diverso da zero.
Tabella A.1.1 :Caratteristiche dei Neutroni e Protoni.
Il principale elemento usato per l’imaging di RM è l’idrogeno, costituito da un solo protone
(H+) e da spin pari a 1/2. Di seguito nucleo d’idrogeno e protone saranno usati come sinonimi.
Il protone può essere considerato come un piccolo magnete costituito dal polo nord e sud
(figura A.1.2) e in assenza di un campo magnetico esterno (il campo magnetico terrestre ha
intensità troppo bassa per creare effetti significativi a temperatura ambiente), l’isotropia dello
spazio fa si che non sussistano motivi perché il nucleo preferisca un’orientazione rispetto ad
un’altra. (figura A.1.3A). Ma sotto l’influenza di un campo magnetico esterno, B0, gli spin si
distribuiranno in due possibili configurazioni o livelli energetici (secondo la meccanica
quantistica): paralleli (livello energetico inferiore) o antiparalleli a B 0 (livello energetico
86
superiore) (figura A.1.3B). Si è dimostrato che prevalgono in numero gli spin con direzione
parallela al campo magnetico esterno.
Secondo la meccanica classica, i protoni dotati di μ e sotto l’influenza di B 0, sono soggetti ad
un momento torcente, che ne causa un moto di precessione attorno alla direzione di B0 (moto
di una trottola) (figura A.1.4). La frequenza angolare della trottola (numero di
rotazioni/secondo) è proporzionale all’intensità di B0 ed è descritta dall’equazione di Larmor:
ω0 = γ * B0
(2)
data la dipendenza di ω0 da γ , allora la frequenza di Larmor dipenderà dal nucleo studiato
(tabella A.1.5) .
μ
Figura A.1.2: (a sinistra) rappresentazione classica del protone come dipolo magnetico,
(a destra) rappresentazione del momento magnetico dello stesso protone.
Figura A.1.3: A: senza un campo magnetico esterno, i protoni si dispongono in maniera
casuale nello spazio (μ complessivo pari a zero). B: sotto l’influenza di B0, i protoni assumono
i due orientamenti possibili (parallelo o antiparallelo).
87
Figura A.1.4: moto di precessione di un protone con frequenza proporzionale al campo
magnetico esterno B0.
Intensità B0
1
H
31
P
0.15 T
6.39 MHz
2.58 MHz
0.5 T
21.29 MHz
8.6 MHz
1.5 T
63.87 MHz
25.8 MHz
3.0 T
127.74 MHz
51.6 MHz
Tabella A.1.5 : frequenza di precessione f = ( γ/2π ) B0.
Si introduce a questo punto il concetto di vettore magnetizzazione M, come il vettore
risultante dei momenti magnetici dei nuclei contenuti in un elemento di volume (voxel):
M = ∑i μi
(3)
M risulterà essere un vettore con direzione parallela al campo magnetico B 0, in quanto nel
voxel in esame, come detto precedentemente, si ha una prevalenza di spin in posizione
parallela al campo e precedera’ con un moto di precessione pari alla frequenza di Larmor.
Considerando un sistema di riferimento x,y,z, con z orientata nella direzione di B 0, il vettore
magnetizzazione è descritto, secondo la meccanica classica, come un vettore a due
componenti: Mz e Mxy (figura A.1.6). La prima è chiamata magnetizzazione longitudinale ed è
parallela al campo magnetico applicato. All’equilibrio Mz è massima e pari a M0, l’ampiezza
di M, determinata dalla differenza nel numero di spin in posizione up o down rispetto il
campo magnetico. Mxy è la magnetizzazione trasversale, perpendicolare al campo magnetico
88
applicato e all’equilibrio è pari a zero, poiché le componenti trasversali dei singoli protoni
hanno orientamento causale e nella sommatoria vettoriale la risultante sarà pari a zero. Per
poter fare imaging è necessario a questo punto stimolare il sistema attraverso l’irraggiamento
con radiofrequenze (RF).
Figura A.1.6: il vettore magnetizzazione e le due componenti, longitudinale e trasversale,
in un sistema di riferimento x,y,z, con z coincidente con la direzione di applicazione di B0.
A.1.2 La generazione del segnale RM
L’Applicazione di un impulso a RF sincronizzato con la frequenza di precessione dei protoni,
provoca l’eccitazione degli stessi: ossia si realizzano le condizioni per il fenomeno della
risonanza (scambio efficiente di energia tra due sistemi). Per la meccanica classica, questo si
manifesta come una torsione del vettore magnetizzazione M dalla condizione di equilibrio;
per la meccanica quantistica lo stesso fenomeno è descritto come un salto energetico degli
spin dallo stato non eccitato allo stato eccitato, quindi da UP a DOWN. Il ritorno
all’equilibrio da questa condizione di eccitazione, rappresenta il segnale di risonanza
magnetica, che avrà un’ampiezza proporzionale al numero di protoni eccitati e un rate che
dipenderà dalle caratteristiche del tessuto da cui proviene il segnale stesso.
L’impulso di eccitazione corrisponde all’energia che separa il livello energetico dei protoni
nello stato non eccitato (posizione parallela al campo) a quello dello stato eccitato (posizione
antiparallela al campo). Solo quando è applicata la giusta energia si ottiene l’eccitazione degli
89
spin, in particolare la frequenza di questo impulso di eccitazione corrisponde proprio alla
frequenza di precessione dei protoni. Si precisa che essendo la frequenza di Larmor, ω0 , del
nucleo di idrogeno, dell’ordine dei MHz, allora l’energia di eccitazione rientra nella porzione
dello spettro elettromagnetico corrispondente alle radio frequenze.
Si analizza il modello della meccanica classica per la descrizione del fenomeno. Si consideri
un sistema di riferimento fisso, come in figura A.1.6, con z coincidente con la direzione di
applicazione di B0. L’irraggiamento con RF si realizza con una bobina alimentata da corrente
alternata alla frequenza ω0 (orientata per esempio lungo y) , generando così un campo
magnetico oscillante B1. B1 provocherà una torsione di M e nel sistema di riferimento, si
vedrà M ruotare in un moto a spirale (seguendo il profilo di una sfera) alla frequenza di ω1
con ω1 pari a γ * B1 (dall’equazione (2)). L’impulso di eccitazione provoca così la formazione
di un angolo tra M e B0, definito angolo di flip, θ:
θ = ω1 * t = γ * B1 * t
(4)
dove t è il tempo di applicazione di B1.
Un impulso RF di 90°, per esempio, provoca il ribaltamento di M sul piano xy; perciò genera
la massima magnetizzazione trasversale Mxy. Una bobina posta in modalità ricevente
raccoglierà il segnale generato dal rilassamento; in quanto durante il ritorno all’equilibrio, M
determinerà un fenomeno magnetico che indurrà una corrente alternata sulla bobina alla
frequenza di Larmor. In un sistema di riferimento fisso, il vettore magnetizzazione mantiene
costante il suo modulo durante il ritorno all’equilibrio. Il segnale generato in un’antenna dopo
un impulso di 90° è noto come free induction decay (FID) (figura A.1.7) ed ha l’andamento di
una sinusoide smorzata esponenzialmente con un tempo caratteristico di T2*.
90
Figura A.1.7: il rilassamento di Mxy induce un segnale nella bobina, il FID, alla frequenza
di Larmor e secondo T2* dovuto alla perdita di coerenza di fase.
Più precisamente si parla di Rilassamento Longitudinale e Trasversale, aventi meccanismi e
tempi differenti. Il primo rappresenta il ripristino di M z (da zero, dopo un impulso di 90°)
secondo un tempo pari a T1. Questo rilassamento dipende dalla dissipazione di energia tra
spin e reticolo causata da urti e moti vibrazionali (figura A.1.8). L’equazione di Bloch
descrive il recupero della magnetizzazione longitudinale come:
Mz (t) = M0 (1 – e-t/T1)
(5)
Il rilassamento trasversale rappresenta la perdita di M xy (che dopo θ=90° è massima e pari a
M0) a causa dello sfasamento della precessione degli spin per interazione spin-spin (con una
relazione esponenziale la cui costante di tempo pari a T2). L’equazione di Bloch per la perdita
della magnetizzazione trasversale e’ definita come:
Mxy (t) = M0 e-t/T2
(6)
Oltre a disomogeneità atomiche tra gli spin vicini, che fluttuano con i moti casuali delle
molecole, anche la disomogeneità del campo magnetico principale causa questa perdita di
91
coerenza di fase e per tanto il tempo di rilassamento trasversale effettivo che si misura è pari a
T2*; il quale è dato dal tempo T2 (disomogeneità del materiale) e dalla disomogeneità del
campo magnetico nel volume di tessuto considerato, secondo la relazione:
1/T2* = 1/T2 + γ∆B0
(7)
Dove ∆B0 rappresenta la disomogeneità di B0, (figura A.1.9A e B).
Dato che T1 e T2 sono caratteristici dei tessuti, sono stati tabulati (tabella A.1.10).
Figura A.1.8: dopo un impulso di 90°, Mz diventa 0 sul piano xy. Dopo un tempo pari a
T1, si è ripristinato il 63% della magnetizzazione longitudinale.
92
Figura A.1.9: A: perdita di Mxy causata da interazioni spin-spin nel tessuto. Dopo T2 è decaduto il
37% della magnetizzazione trasversale. B: T2 è legato alle proprietà intrinseche della materia; T2* è
legato sia alle disomogeneità intrinseche che del campo magnetico principale. T2 è sempre più lungo
di T2*.
Tabella A.1.10: tempi di rilassamento T1 e T2 per alcuni tessuti
A.1.3 La localizzazione del segnale RM
Con l’utilizzo di un campo statico d’induzione magnetica esterno B 0 e di uno specifico
impulso di eccitazione, i protoni presenti all’interno di un materiale, vengono eccitati e
successivamente producono un segnale con ampiezza proporzionale al tempo di rilassamento
93
e alla densità protonica, durante il rilassamento. La localizzazione del segnale è fondamentale
per l’imaging di risonanza magnetica e richiede l’utilizzo di gradienti di campo magnetico.
Questi si ottengono dalla sovrapposizione dei campi magnetici generati dalle bobine di
gradiente, spire conduttrici che producono variazioni lineari del campo magnetico principale.
All’interno del corpo dell’apparecchiatura, sono posizionati i tre set di gradient coil lungo x, y
e z (figura A.1.11). E si definiscono Gx, Gy e Gz, i gradienti di B0 lungo x, y e z,
rispettivamente.
Figura A.1.11: Set di bobine di gradiente lungo x,y e z.
La presenza di un gradiente lineare fa si che cambi la frequenza di precessione dei protoni in
funzione della loro posizione. In particolare, per la geometria del sistema di gradienti, al
centro del FOV (field of view), il gradiente è nullo e quindi non si hanno modifiche sulla
frequenza di precessione. Pertanto si risale alla posizione del protone all’interno del sistema
grazie alla sua frequenza e alla sua fase (figura A.1.12).
94
Figura A.1.12: distribuzione del gradiente e della frequenza di Larmor all’interno del FOV.
Se per esempio accendiamo un gradiente lungo x:
B(x) = B0 + xGx
(6)
Dove B(x) rappresenta il campo magnetico nella posizione x e B 0 è il campo magnetico
principale. Allora l’intensità del campo in due punti x1 e x2 sarà:
B(x1) = B0 + x1Gx
(7)
B(x2) = B0 + x2Gx
Perciò la frequenza di precessione nelle posizioni x1 e x2 sarà:
ω1 = γ B(x1)
ω2 = γ B(x2)
95
(8)
dove pertanto ω1 ≠ ω2. Il segnale raccolto dalla bobina sarà così costituito da due componenti
a frequenze diverse che si determinano con la trasformata di Fourier; note le frequenze si
possono determinare le posizioni di x1 e x2, quindi localizzare la provenienza del segnale
RM. Per localizzare un protone all’interno di un volume tridimensionale sono necessari tutti e
tre i gradienti: il gradiente di selezione della fetta (Gz), quello di codifica di frequenza (Gx) e
quello di codifica di fase (Gy).
Il Gradiente di Selezione della fetta (Gz)
La bobina generatrice dell’impulso RF non ha la capacita’ di indirizzare l’energia
nello spazio considerato. Percio’ e’ il gradiente di selezione della fetta che
definisce/seleziona la fetta di tessuto che deve essere perturbata dall’impulso RF che
viene applicato contemporaneamente all’impulso RF. Per esempio il gradiente puo’
essere applicato lungo l’asse del corpo (direzione cranio-caudale) e la frequenza di
precessione dei protoni varia a seconda della loro posizione all’interno del gradiente.
L’impulso di eccitazione sara’ cosi’ applicato all’intero volume, ma solo gli spin
aventi la stessa frequenza di precessione della RF, assorbiranno l’energia, a causa del
fenomeno di risonanza (figura A.1.13).
Lo spessore della fetta e’ determinato da due parametri: la larghezza di banda
dell’impulso RF e dall’intensita’ del gradiente all’interno del FOV. Per un dato valore
di Gz, piu’ e’ stretta la banda dell’impulso, piu’ stretta sara’ la fetta di tessuto (figura
A.1.14A). Invece stabilita la banda di RF, maggiore e’ la forza del gradiente, piu’
ampio sara’ il range di frequenze nel FOV e quindi lo spessore delle fette diminuisce
(figura A.1.14B).
Figura A.1.13: il gradiente di selezione della fetta modifica la frequenza di precessione dei
protoni.
96
A
B
Figura A.1.14: A: dato un gradiente, lo spessore della fetta e’ determinato dalla larghezza
di banda RF; B: fissata la banda RF, l’intensita’ del gradiente determina lo spessore della
fetta.
Il Gradiente di Codifica di Frequenza (Gx)
Il gradiente di codifica di frequenza, noto anche come gradiente di lettura, e’ applicato
in direzione perpendicolare al gradiente di Selezione della fetta, lungo l’asse x,
durante la formazione del segnale proveniente dagli spin eccitati da Gz. Pertanto si
varia linearmente la frequenza di emissione dei protoni.
Il Gradiente di Codifica di Fase (Gy)
La posizione degli spin nella terza dimensione dello spazio e’ determinata dal
gradiente di codifica di fase, applicato perpendicolarmente tra il gradiente di selezione
della fetta e di lettura. La fase rappresenta una variazione nel punto di partenza di una
sinusoide, e puo’ essere introdotta dall’applicazione di un gradiente. Dopo la selezione
della fetta di tessuto, tutti gli spin sono in coerenza di fase; durante l’applicazione di
Gy, si determina una variazione lineare della frequenza di precessione degli spin
eccitati. Spegnendo il gradiente, gli spin continuano a precedere con la frequenza di
Larmor ma non sono piu’ in fase. Per ogni TR (tempo di ripetizione), uno specifico
Gy introduce uno specifico cambiamento di fase all’interno del FOV (figura A.1.15).
97
Figura A.1.15: il gradiente di codifica di fase per ogni TR produce una variazione della frequenza
di precessione dei protoni e in seguito, i protoni tornano a precedere alla frequenza di Larmor ma
non piu’ in fase.
Per illustrare l’applicazione dei gradienti, si riporta qui di seguito un esempio di sequenza
SPI-ECHO (figura A.1.16). La figura A.1.16 mostra l’applicazione del gradiente di selezione
della fetta in contemporanea agli impulsi di eccitazione di 90 e 180; il gradiente di codifica di
frequenza viene acceso durante la formazione dell’echo (dopo un tempo pari a TE). La
sequenza e’ ripetuta all’aumentare del gradiente di codifica di fase per definire la terza
dimensione dell’immagine.
98
Figura A.1.16: schema di un sequenza spin-echo, in cui si mostrano i tempi di applicazione dei
diversi gradienti in un intervallo pari a TR. Ogni TR e’ caratterizzato da un diverso valore di Gy.
A.1.4 La formazione dell’immagine MRI
Il segnale di RM viene acquisito nello spazio K, matrice come files di dati acquisiti nel corso
della scansione ma che all’apparenza non ricostruiscono l’immagine anatomica selezionata.
Ogni immagine ha il proprio set di dati che costituisce lo spazio k. Lungo le righe della
matrice sono disposti i valori di kx che corrispondono ai tempi (integrali) di misura in cui è
applicato il gradiente di lettura; e lungo le colonne quelli di k y che rappresentano ogni passo
della codifica di fase. La matrice è divisa in 4 quadranti, con l’origine posto al centro e
rappresentante la frequenza pari a 0. Esempio di riempimento dello spazio K, in figura
A.1.17:
1) Un impulso di eccitazione RF viene applicato contemporaneamente al gradiente di
selezione della fetta (Gz). L’energia assorbita dal tessuto dipende dall’ampiezza e
dalla durata dell’impulso stesso. Ad un impulso di 90°, la magnetizzazione
longitudinale si annulla e risulta massima la magnetizzazione trasversale;
99
2) Un gradiente di codifica di fase è applicato per un generare una differenza di fase tra
gli spin lungo la stessa direzione di Gy; in questo modo si “seleziona” una riga dello
spazio k;
3) Un impulso di 180° produce l’eco al tempo TE, simultaneamente al Gz;
4) Durante la formazione dell’eco, il gradiente di codifica di frequenza, applicato
ortogonalmente a Gy e Gz, modifica le frequenza di precessione degli spin lungo il
gradiente stesso;
5) Allo stesso momento l’ADC acquisisce il segnale nel dominio del tempo, la frequenza
di campionamento e’ determinata dalla banda di eccitazione. I dati digitali vengono
convertiti in frequenze discrete riempiendo così una riga dello spazio k;
6) Il processo si ripete fino al riempimento dell’intera matrice;
7) La trasformata inversa 2D di Fourier, permette di decodificare le informazioni nel
dominio delle frequenze per ottenere le caratteristiche spaziali e del contrasto del
tessuto nell’immagine;
8) L’immagine finale rappresenta le caratteristiche di T1, T2 e densità protonica del
tessuto utilizzando scale di grigio. Ogni pixel rappresenta un voxel e lo spessore è
determinato dal gradiente di selezione della fetta e dalla banda dell’impulso RF.
La posizione di un dato nello spazio-k e’ determinata dagli effetti dei gradienti e degli impulsi
di eccitazione. La parte centrale dello spazio-k e’ relativo alle basse frequenze, contribuisce al
contrasto dell’immagine e contiene le informazioni sulle forme grossolane; mentre l’area al
bordo dello matrice corrisponde alle alte frequenze, responsabili della risoluzione spaziale
dell’immagine, dei dettagli e delle strutture più fini.
100
Figura A.1.17: acquisizione dei dati RM e riempimento dello spazioK.
101
A.2 Procedure di Installazione e Accettazione di apparecchiature di RM
A.2.1 Le Procedure d’installazione
Riprendo in questa appendice parte della
relazione di tirocinio formativo universitario
che ho svolto presso il Servizio di Ingegneria
Clinica dell’Azienda Ospedaliero-universitaria
“Ospedali Riuniti” di Trieste (AOUTS), in
quanto il lavoro di tesi riguarda la correzione
di immagini MRI le cui alterazioni
hanno
origine nell’hardware qui di seguito presentato
e discusso. Presso il Nuovo Polo tecnologico dell’Ospedale Maggiore di Trieste è stato
recentemente installato un tomografo a Risonanza Magnetica (RM) 1.5 Tesla, il
MAGNETOM Aera System della Siemens (figura a lato), di cui ho potuto seguire le
procedure d’installazione ed accettazione durante il mio tirocinio formativo. Si tratta di
un’apparecchiatura a magnete superconduttore. Le procedure d’installazione hanno richiesto
complessivamente 4 giorni.
Il tomografo a RM è un apparecchio utilizzato nell’ambito della diagnostica per immagini, i
cui componenti principali possono essere suddivisi in tre categorie [35]:
1
I componenti che hanno il compito di produrre l’eccitazione dei nuclei in esame e
sono: il Magnete, l’alimentazione del magnete, i sistemi di controllo dell’omogeneità
del campo magnetico (shimming), le bobine di gradiente, il generatore di
radiofrequenze (RF) e l’amplificatore di potenza degli impulsi RF;
2
Le parti destinate al rilevamento, all’elaborazione del segnale RM e alla formazione
dell’immagine finale, e sono la bobina per rilevare il segnale RM, il preamplificatore,
il ricevitore, il campionatore e convertitore A/D, il calcolatore e il sistema di
presentazione dell’immagine a video;
3
Il calcolatore di controllo di tutte le componenti del tomografo.
L’elemento fondamentale del tomografo è il Magnete che ha il compito di produrre un campo
magnetico statico all’interno del quale sarà posto il paziente. I parametri che caratterizzano il
102
campo magnetico prodotto sono l’intensità, l’omogeneità e la stabilità nel tempo [35].
L’intensità del campo magnetico si misura in Tesla (1 Tesla = 10.000 Gauss) ed ha valori
differenti a seconda del campo d’applicazione: per l’imaging sono sufficienti intensità di 0,15
e 0,5 T. Attualmente i sistemi clinici utilizzano magneti da 1,5 a 2 T; in ambito di ricerca si
arriva fino a 7 T. Il massimo raggiunto fin’ora è un 9 Tesla. L’omogeneità del campo si
misura in parti per milione (ppm). Questi rappresentano la variazione del campo magnetico
lungo una direzione divisa per il valore del campo stesso. Una bassa omogeneità fa diminuire
la quantità di protoni del volume esaminato che saranno eccitati dall’impulso RF e il risultato
sarà un’immagine di scarsa qualità. La stabilità dell’intensità ed omogeneità deve essere
mantenuta nel tempo e si misura in parti per milione per ora (ppm/h).
Vista in sezione di un sistema a magnete superconduttore.
103
Fantocci utilizzati per la valutazione dell’omogeneità di campo magnetico.
Sfere dal diametro di 25 e 50 cm.
Il Refill dell’elio
La superconduttività è una caratteristica di alcuni materiali, come leghe di niobio-titanio, che
esibiscono resistenza nulla al passaggio di corrente elettrica quando mantenuti a temperature
estremamente basse. Pertanto realizzando una bobina con una materiale superconduttivo e
“immergendola” in un fluido criogenico (elio liquido), mantenuto alla temperatura di circa 269°C, si ottiene la permanente circolazione di corrente senza la necessità di una continua
alimentazione, con l’instaurazione di un campo statico d’induzione magnetica [26]. La fase
che precede lo start up del magnete, ossia l’accensione del campo magnetico, è il refill
dell’elio. Si tratta di un refill, vale a dire “ricarica”, dal momento che l’apparecchiatura esce
dalla fabbrica con circa un 10-30% di elio già presente all’interno del sistema del criogeno.
L’elio liquido (LHe) possiede il più basso punto di ebollizione tra tutti gli elementi (4,2
Kelvin ovvero -269°C) ed è quindi il liquido più freddo sulla Terra [36]. L’elio gas è presente
nell’atmosfera solo in tracce (0,0005%), il che rende l’estrazione dall’aria molto dispendiosa e
antieconomica. Per questo viene ricavato esclusivamente da giacimenti di gas naturali e
attualmente i principali si trovano in USA, Russia, Algeria, Qatar e in Polonia. Secondo la
Cornell University di Ithaca, visti gli attuali tassi di consumo di elio e la scarsa disponibilità
di questo elemento sulla Terra, c’è il rischio che le riserve di elio finiscano entro il 2040 [37].
L’operazione di refill dell’elio viene effettuata da personale tecnico specializzato. L’elio pur
non essendo tossico, se inalato in concentrazioni elevate, può portare all’asfissia; inoltre se
viene a contatto con altri corpi può portare a gravi ustioni da freddo. Per evitare perdite
104
dovute all’evaporazione, l’elio liquido viene trasportato fino al sito RM in recipienti speciali
isolati e sottovuoto, i dewar. Sono stati portati tre dewar, ciascuno da 250 litri di capacità. Si è
utilizzato elio gassoso (puro 5.5 a 2 bar) per veicolare l’elio liquido all’interno
dell’apparecchiatura. Qui deve essere ovviamente mantenuta la bassa temperatura dell’elio,
pertanto l’avvolgimento e il bagno d’elio sono contenuti in una struttura ermetica raffreddata
ad acqua. Dopo il refill, procedura durata circa 3 ore, si è proceduto all’installazione della
consolle dei comandi per dare avvio alla fase di accensione del magnete.
Lo start up del magnete
Una volta posizionata la segnaletica di avvertimento della presenza di campo magnetico ad
alta intensità sulle porte di accesso alla zona di rispetto (0,1 mT < B < 0,5 mT) e alla zona
controllata (B ≥ 0,5 mT), si è effettuato lo start up del magnete. L’accensione è avvenuta
attraverso il collegamento dell’avvolgimento ad un generatore ausiliario (figura A.2.1),
fornito della ditta produttrice stessa, opportunamente agganciato attraverso la gabbia di
Faraday.
Figura A.2.1: Generatore ausiliario per lo start up del magnete.
Lo start up e l’innalzamento del campo magnetico avvengono gradualmente. Da console si è
impostata l’intensità massima della corrente che si vuole circoli sulla bobina e gradualmente il
105
generatore ausiliario fornisce tale corrente, fino a raggiungere i 500 Ampere desiderati.
Quindi dalla console si visualizza a monitor solo la corrente che circola nella bobina e non
l’intensità del campo magnetico che si genera. Prima di scollegare il generatore, si sono
effettuati altri due start up ed è in genere durante il primo innalzamento del campo che è più
probabile che si verifichi un quech spontaneo. Nel caso seguito questo fortunatamente non è
accaduto. Si deve distinguere tra quench spontaneo e pilotato. Il primo può manifestarsi a
seguito di un grande shock meccanico della strumentazione o a seguito di una brusca
riduzione del livello di elio liquido a causa di un accidentale ed eccessivo surriscaldamento. Il
quench pilotato, quindi comandato dall’operatore con la premuta del pulsante di spegnimento
del magnete (figura A.2.2), viene anche chiamato soft-quench, in quanto il riscaldamento
dell’elio liquido avviene in maniera uniforme e controllata, e ciò tendenzialmente non
provoca danni all’apparecchiatura. Lo spegnimento del magnete avviene in 20 secondi,
tuttavia con una perdita in denaro di più di 20.000 €. È opportuno che l’avvio del magnete si
effettui se in sala consolle, è attivo il dispositivo di visualizzazione del tenore di ossigeno, del
livello d’umidità e della temperatura presenti in sala magnete (figura A.2.3). Al momento
dell’accensione questi misuravano rispettivamente: 20.9%, 38% (calata fino a 20% nei giorni
successivi) e 22°C. Un’umidità troppo bassa (ossia meno di 40-60%) comporta due
problematiche. La prima legata ad un problema di sicurezza del paziente, la seconda ad un
problema di qualità dell’immagine. Come infatti prevedono le linee guida per la sicurezza del
paziente, il livello di umidità deve essere intorno al 40-60% [38], per far sì che siano garantite
le condizioni per un adeguato smaltimento del calore da parte dei tessuti del paziente
sottoposto all’indagine RM. Inoltre, un’umidità bassa può portare alla formazione di cariche
elettrostatiche (spike) all’interno dell’apparecchiatura, che vanno a produrre artefatti
sull’immagine acquisita. Per individuare la presenza di questi spike, un dispositivo dedicato
(figura A.2.4) aspira l’aria da determinati punti critici dell’apparecchiatura e la analizza
cercando la presenza di queste particelle cariche.
106
Figura A.2.2: Pulsante di
emergenza per il quench
(spegnimento del magnete).
Figura A.2.3: Dispositivo per la visualizzazione
di: (da sinistra) tenore di ossigeno (in %), livello
di umidità (in %) e temperatura (in °C).
Figura A.2.4: Dispositivo per la rilevazione di spike.
Lo shimming del magnete
La presenza di imperfezioni negli avvolgimenti e il non ideale posizionamento delle bobine al
momento dell’assemblaggio, determinano asimmetrie nel sistema con conseguente
generazione di variazioni del campo indesiderate [35]. Anche la presenza di un paziente
comporta variazioni di campo magnetico [39]. Per rendere il campo magnetico più uniforme
possibile, si effettua lo shimming, operazione di compensazione delle disomogeneità di
campo. Lo shimming può essere passivo o attivo. Lo shimming passivo consiste in una
procedura per cui si inseriscono all’interno dell’apparecchiatura opportune quantità di ferro,
secondo una mappatura prodotta via software. Il Siemens MedService Software, installato in
107
console, effettua una mappatura dell’omogeneità del campo magnetico presente in sala e
guida il tecnico alla correzione delle disomogeneità individuate. Il tecnico apre il gantry e in
base alle indicazioni del SW, posiziona le placche metalliche su lunghi “vassoi” che
costeggiano la bobina di campo magnetico. I pezzi di ferro, essendo magnetici, alterano il
campo. Lo shimming attivo si effettua con le shim coils (bobine non supeconduttive), per cui
ogni volta che si introduce un paziente all’interno del gantry, il sistema RM fa una mappatura
del campo magnetico e farà scorrere correnti di opportune intensità attraverso le bobine di
shim per rendere il campo più uniforme possibile.
I Quality Assurance
Durante l’installazione sono stati effettuati dei controlli di qualità, Quality Assurance, a
livello di sicurezza dell’impianto e di funzionamento dell’intero sistema e delle singole
bobine Radiofrequenza (RF). Per la sicurezza dell’impianto si sono esaminati per esempio:
visivamente lo stato del tubo del quench, pressione dell’acqua, presenza dei manuali per gli
utilizzatori, dei pulsanti di arresto di emergenza, della segnaletica di avvertimento per
l’accesso alla zona controllata e di rispetto, il sistema di chiamata d’emergenza del paziente, e
lo stato dei gradient supervision. Quest’ultimo consiste in un sistema presente all’interno della
strumentazione, in grado di aspirare l’aria della strumentazione e di convogliarla ad una
camera di analisi, per individuare la presenza di particelle di fumo. Per i controlli di qualità
sul funzionamento del sistema e bobine RF si sono utilizzati opportuni fantocci (o
phantom) messi a disposizione della ditta produttrice stessa. I phantom comunemente
utilizzati sono composti da soluzioni di acqua, NaCl e NiSO 4. A livello di sistema si è valutata
l’omogeneità di campo magnetico, l’RF Noise check, la compensazione delle eddy current, la
stabilità, lo shim check e lo spike check. In particolare RF Noise check è un controllo in cui si
è valutato il rumore fuori dal magnete, ponendo la bobina testa/collo in ricezione fuori dal
gantry. Il rumore potrebbe provenire dalla luci della sala, dal sensore per l’ossigeno, dal
termoigrometro ecc. La stessa cosa è stata fatta con l’iniettore di mezzo di contrasto
all’interno della sala, per valutare se la sua presenza originasse rumore. L’iniettore di mezzo
di contrasto è controllato dalla sala consolle e collegato facendo passare i cavi attraverso le
guide d’onda.
108
Le bobine a radiofrequenza richieste e fornite dalla ditta sono: 4Ch BI Breast head Nor, due
Body 18, Flex large 4, Flex small 4, Head Neck 20, Loop 4 cm, Peripheral Angio 36 feet,
Peripheral Angio 36 head, Spine 32, TxRx Knee 15 QED [40] [41]. Le bobine a
radiofrequenza sono potenzialmente in grado sia di trasmettere sia di ricevere i segnali RF,
ma nei tomografi di ultima generazione il compito di trasmettere il segnale RF di eccitazione
per i nuclei di idrogeno, è affidato ad una bobina posta fissa all’interno del gantry [35].
Questa bobina è detta Body Coil (bobina del corpo). Tutte le bobine precedentemente indicate
sono solo riceventi, ad eccezione della bobina per il ginocchio (TxRx Knee) che è anche
trasmittente. Da capitolato sono state richieste bobine di tipo phased array. Queste sono
costituite da più bobine poste in parallelo fra loro. Ogni singola bobina riceve
indipendentemente i segnali RF provenienti dal proprio settore di pertinenza. Le informazioni
sono successivamente elaborate e sommate alle altre in modo tale da ottenete un’unica
immagine globale.
A.2.2 Le Procedure d’accettazione
Le procedure d’accettazione e collaudo comprendono la verifica della congruità,
dell’adeguatezza e della qualità della fornitura rispetto a quanto richiesto in fase di gara.
L’accettazione è una procedura facente parte del collaudo e che consiste in un insieme di
verifiche e controlli, effettuate dai tecnici Siemens sotto la supervisione dell’Esperto
Responsabile del sito RM. Fanno parte dell’accettazione i Quality Assurance, secondo i
protocolli Siemens ed Eurospin, i controlli sul buon funzionamento dei sistemi di emergenza e
la mappatura del campo magnetico. All’esito positivo dell’accettazione, virtualmente
l’apparecchiatura potrebbe già essere utilizzata sui pazienti. Durante il mio tirocinio ho
assistito alle fasi di accettazione dell’apparecchiatura, mentre il collaudo sarà eseguito da un
incaricato dell’Ingegneria Clinica e della Fisica Sanitaria dell’AOUTS, alla presenza dei
tecnici della ditta fornitrice, e verterà sulle prove di sicurezza elettrica del sito RM. Tutto
quanto è necessario per effettuare le prove di collaudo (strumenti di misura, mano d’opera,
etc.) dovrà avvenire a cura, a spese e responsabilità della stessa. Come concordato in fase di
gara, la fatturazione è vincolata all’esito positivo delle prove di accettazione e collaudo.
109
I Controlli qualità
I controlli di qualità consentono di assumere che le prestazioni strumentali di un dato apparato
diano risultati riproducibili ed accurati, nonché di rendere possibile il confronto dei risultati da
apparecchiature diverse [42]. La complessa problematica di messa a punto e validazione a
livello internazionale di procedure standard per il controllo di qualità, sono stati la definizione
di metodologie, la costruzione di oggetti campione e l’identificazione di appropriate sostanze
di riferimento per la calibrazione degli apparati. Il Verbale d’ispezione RM emanato
dall’INAIL e istituito con decreto ISPESL del 6 Aprile 2009, identifica come controlli
periodici di qualità e di sicurezza RM: i parametri funzionali del tomografo, il SAR, il sensore
ossigeno e la gabbia di Faraday. Per effettuare controlli sui parametri funzionali si sono
definiti negli anni diversi protocolli, tra cui quello EUROSPIN, NEMA (National electrical
manufactuer association) e AAPM (American association of physicist in Medicine). I
parametri principali di imaging (definiti come quei parametri che caratterizzano la qualità
dell’immagine e direttamente determinabili dall’immagine ottenuta) sono: uniformità del
campo magnetico, rapporto segnale/rumore e distorsione geometrica [42][44]. L’uniformità
del segnale nell’immagine si riferisce alla capacità dell’apparecchiatura di produrre la stessa
risposta in segnale (valore di pixel) sull’intero piano dell’immagine ottenuta da un oggettocampione avente caratteristiche RM uniformi. I fattori che possono contribuire a produrre
disomogeneità del segnale sono la disomogeneità del campo magnetico principale, le
caratteristiche geometriche della bobina e la non uniformità del campo a radiofrequenza, la
non linearità dei gradienti, un’inadeguata calibrazione degli impulsi dei gradienti, un’errata
correzione delle correnti parassite, un erroneo posizionamento dell’oggetto, un’irregolarità
nella risposta del ricevitore o nei procedimenti di elaborazione dei segnali. Il rapporto
segnale/rumore (SNR) rappresenta il rapporto tra la media dei valori di pixel nella regione di
interesse e la loro deviazione standard. La distorsione geometrica è la deviazione tra le
distanze misurate in un’immagine e le corrispondenti dimensioni all’interno dell’oggetto. In
un’immagine di RM la distorsione geometrica può essere causata da disomogeneità del campo
magnetico principale, difetti nei gradienti o imperfezioni nel campionamento del segnale.
I principali parametri non imaging che caratterizzano le prestazioni dell’impianto e che
rappresentano, da un punto di vista fisico, le condizioni iniziali del processo di formazione
dell’immagine sono: la frequenza di risonanza, la stabilità del campo magnetico, l’omogeneità
110
del campo, l’intensità e la linearità dei gradienti di campo magnetico, le correnti parassite e
l’accuratezza del flip angle [44].
Il protocollo “EUROSPIN”
I fantocci utilizzati (figura a lato) sono elementi in
plexiglass con all’interno una soluzione acquosa di
solfato di rame (CuSO4) in grado di simulare la
conducibilità
elettrica
dei
tessuti
umani.
Ogni
fantoccio viene utilizzato per il controllo di specifici
parametri e presenta caratteristiche geometriche
differenti. Oltre a SNR, distorsione e uniformità, descritti al paragrafo precedente, il
protocollo Eurospin permette di determinare i seguenti parametri [44][43][42]:
La risoluzione caratterizza la capacità di un sistema di imaging di mostrare due oggetti
distinti, quando non c’è notevole contributo di rumore. In condizioni di buon
funzionamento del sistema, la risoluzione è semplicemente limitata dalla dimensione
del pixel; tuttavia, molti fattori possono provocare una perdita di risoluzione per
esempio: il FOV, il SNR, la frequenza di campionamento, lo spessore dello strato e i
filtri di ricostruzione.
Lo spessore dello strato è definito come la larghezza a metà altezza del profilo dello
strato, a sua volta definito come la variazione di contributo al segnale di imaging,
lungo la direzione ortogonale al piano. In altri termini questo parametro indica la
variazione nell’efficacia di eccitazione selettiva degli spin contenuti nello strato. Tale
parametro è rappresentato dalla larghezza espressa in mm del profilo misurato come
“full width half maximum” (FWHM). I fattori che lo influenzano sono: disomogeneità
dei gradienti di campo, non uniformità del campo RF, rapporto TR/T1, forma degli
impulsi e degli echi.
La distanza dello strato, o separazione tra gli starti, è la distanza tra i punti medi della
larghezza a metà altezza di due profili adiacenti.
Per posizione dello strato si intende la localizzazione assoluta del punto medio della
“FWHM” del profilo dello strato.
111
Le immagini fantasma (ghost) sono rappresentazioni indesiderate dell’oggetto in
studio. Il livello di ghost (espresso in percentuale) è definito come la massima
intensità di un artefatto nell’immagine rispetto all’intensità dell’immagine originale. I
ghost possono essere causati da malfunzionamenti dei gradienti, da agenti esterni
come vibrazioni meccaniche e movimenti di grosse masse metalliche nelle vicinanze
del sistema RM che provocano una instabilità del campo magnetico.
La valutazione dei parametri T1 e T2 viene effettuata tramite un fantoccio avente
composizione nota che per un dato valore di campo magnetico presenta tempi T1 e T2
noti a priori.
112
A.3 Lo standard DICOM
Lo standard DICOM (Digital Imaging and Comunication in Medicine) definisce i criteri per
la comunicazione, la visualizzazione, l’archiviazione e la stampa d’informazioni di tipo
biomedico, quali immagini radiologiche. La sua diffusione si rivela estremamente vantaggiosa
perche’ consente di avere una solida base di interscambio di informazioni tra apparecchi di
produttori diversi, server e PC diversi. E’ uno standard pubblico, cioe’ accessibile a tutti, e si
basa su un modello definito “Service Object Pair” (SOP). Secondo la definizione ISO/OSI, il
DICOM ricopre le specifiche relative allo Application Domain di un processo distribuito.
Ovvero come un modello client/server, in presenza di almeno due applicazioni che
condividono informazioni, queste devono accordarsi sui ruoli: Service Class User (SCU) e’ il
client (o utente) e Service Class Provider (SCP) il server (o fornitore). L’elemento
fondamentale di scambio tra i due e’ la Service Object Pair class (SOP) che definisce le azioni
della SCU e della SCP. Ovvero: SCU e’ il SW di un’apparecchiatura che vuole archiviare
un’immagine appena creata e SCP e’ il server del PACS del reparto di Radiologia in ascolto
su un port TCP/IP.
Il file DICOM contiene una gran quantita’ di informazioni, di cui la pura immagine e’ solo
una parte. E la struttura del documento e’ solo una parte di cio’ che si intende per
comunicazione conforme allo standard DICOM. L’informazione scambiata (IOD, information
Object Definition) piu’ frequentemente usata e’ quella composita, dove viene strutturata
raggruppando i dati relativi ad un singolo oggetto reale (paziente, immagine, macchinario…)
in Information Object Modules (IOM). Ogni IOM e’ a sua volta descritto da “Attributi”
univoci, tra cui: nome, Tag (in esadecimale), descrizione semantica, VR (Value
Representation) e VM (Value Multiplicity). La SOP e’ costituita per gli IOD: C-STORE,
utilizzata per inviare le immagini al PACS per esempio, C-FIND, C-MOVE, serve per
ordinare il trasferimento di un oggetto, C-GET, C-CANCEL e C-ECHO.
Lo IOD (Information Object Definition) e’ costituito da un certo numero di attributi
raggruppati in IOM (Information Object Modules). Il mondo reale e’ schematizzato nel
“DICOM Model of the Real World”: un’entita’ del modo reale come un’immagine, un
paziente viene definita come un oggetto; ogni oggetto contiene attributi, per esempio
l’oggetto paziente conterra’ gli attributi dati anagrafici, data di ricovero… Definti gli oggetti e
gli attributi, DICOM definisce quali operazioni possono essere eseguite e su quali oggetti.
113
Quando c’e’ un’immagine, questa e’ semplicemente contenuta in uno degli attributi, per la
precisione nel tag (7FE0, 0010), di nome “Pixel Data”. Percio’ tutti gli altri attributi possono
essere visti come un complesso “header” che precede l’immagine vera e propria, fornendo
una vasta serie d’informazioni realtive al contesto medico dell’immagine. Tutte le
informazioni memorizzate nell’header vengono catalogate in gruppi di elementi, detti ache
Tag DICOM.
Alcuni degli attributi sono relativi al piano dell’immagine:
Image Position (Patient) [0020, 0032] specifica le coordinate x,y,z (in mm)
dell’angolo superiore sinistro dell’immagine, il centro del primo pixel (o voxel)
trasmesso.
Image Orientation (Patient) [0020,0037] specifica la direzione coseno della prima riga
e prima colonna rispetto al paziente. Contiene due vettori con 3 cifre decimali. Il
primo vettore ha valori (1,0,0) ed ‘ la prima riga dell’immagine; il secondo (0,0,-1) e’
l’orientamento della prima colonna (figura A.3.1).
Figura A.3.1
Patient Position [0018, 5100] descrive la posizione del paziente rispetto alla
strumentazione (per esempio HFP, HSF, HFDR…).
Patient orientation [0020, 0020] e’ dato da due valori che definiscono la direzione
dell’asse delle riga e colonna: A anterior, P posterior, R right, L left, H head F foot.
114
115
116
BIBLIOGRAFIA E SITOGRAFIA
1. Berchtold NC, Cotman CW. “Evolution in the Conceptualization of Dementia and
Alzheimer's Disease: Greco-Roman Period to the 1960s”. Neurobiol. Aging. 1998
2. Zhu CW, Sano M. Economic considerations in the management of Alzheimer's
disease. Clin Interv Aging 1 (2): 143–54. PMCID: PMC2695165(2006).
3. Liesi E. Hebert, Paul A. Scherr, Judith J. McCann, Laurel A. Beckett, Denis A.
Evans Is the Risk of Developing Alzheimer's Disease Greater for Women than for
Men? Am. J. Epidemiol. 153(2): 132-136 (2001).
4. Liana G Apostolova, Lisa Mosconi, Paul M Thompson, Amity E Green, Kristy S
Hwang, Anthony Ramirez, Rachel Mistur, Wai H Tsui, and Mony J de Leon.
Subregional hippocampal atrophy predicts Alzheimer's dementia in the cognitively
normal. Neurobiology of aging, 31(7):1077-88,July 2010.
5. Diego Fortunato, “Sviluppo di modelli per la regressione di serie temporale di dati
biologici con applicazione allo studio di immagini di risonanza magnetica nucleare”,
tesi di laure specialistica in fisica, Università degli studi di Genova.
6. A Caroli, G B Frisoni. The dynamics of Alzheimer's disease biomarkers in the
Alzheimer's Disease Neuroimaging Initiative cohort. Neurobiology of aging,
31(8):1263-74, August 2010.
7. D.U. Silverthon FISIOLOGIA, Ambrosiana, III edizione, 2007
117
8. Z. Hou, “A review on MR image intensity inhomogeneity correction”, Biomedical
Imaging Lab., Singapore Biomaging Consortium, Singapore, 2006.
9. U. Vovk, F. Pernus, B. Likar, “A review of methods for correction of Intensity
inhomogeneity in MRI”, IEEE Transaction on Medical Imaging, 26 (3), 2007.
10. R. C. Gonzalez, R. E. Woods, Digital Image Processing, Addison-Wesley,
Singapore, 1993.
11. J. Luo, Y. Zhu, P. Clarysse, I. Magnin, “Correction of bias field in MR images using
singularity function analysis” IEEE Transactions onMedical Imaging, 24 (8):1067–
1085, 2005.
12. F. Lin, Y. Chen, J. W. Belliveau, L. L. Wald, “A waveletbased approximation of
surface coil sensitivity profiles for correction of image intensity inhomogeneity and
parallel imaging reconstruction” Human BrainMapping, 19(2): 96–111,2003.
13. B. M. Dawant, A. P. Zijdenbos, R. A. Margolin, “Correction of intensity variations
in MR images for computer-aided tissue classification, IEEE Transactions on Medical
Imaging, 12 (4): 770–781, 1993.
14. J. F. Mangin, “Entropy minimization for automatic correction of intensity
nonuniformity,” in Proceedings of IEEE Workshop on Mathematical Methods in
Biomedical Image Analysis :62–169, Hilton Head Island, SC, USA, 2000.
15. J. G. Sled, A. P. Zijdenbos, and A. C. Evans, “Nonparametric method for automatic
correction of intensity onuniformity in MRI data,” IEEE Transactions on Medical
Imaging, 17(1): 87–97, 1998.
16. http://www.bic.mni.mcgill.ca/software/N3
118
17. Z.-P. Liang and P. C. Lauterbur, Principles of Magnetic Resonance Imaging: A
Signal Processing Perspective. Piscataway, NJ: IEEE Press, 1999.
18. D. L. Pham and J. L. Prince, “Adaptive fuzzy segmentation of magnetic resonance
images,” IEEE Trans. Med. Imag., 18(9):737–752, 1999.
19. B. Likar, M. A. Viergever, and F. Pernuˇs, “Retrospective correction of MR
intensity inhomogeneity by information minimization,” IEEE Trans. Med. Imag.,
20(12): 1398–1410, 2001.
20. B. Belaroussi, J. Milles, S. Carme, Y. M. Zhu, and H. Benoit-Cattin, “Intensity
non-uniformity correction in MRI: Existing methods and their validation,” Med.
Image Anal., 10: 234–246, 2006.
21. H. Mihara, N. Iriguchi, and S. Ueno, “A method of RF inhomogeneity correction in
MR imaging,” Magma, 7: 115–120, 1998.
22. A Caroli and G B Frisoni. The dynamics of Alzheimer's disease biomarkers in the
Alzheimer's Disease Neuroimaging Initiative cohort. Neurobiology of aging,
31(8):1263-74, August 2010.
23. V.Strela, M.Wainwright, J.Portilla, E.Simoncelli. Imaging denoising using scale
mixtures of gaussians in the wavelet domain, Image Process, 2003.
24. A.Chincarini, P.Bosco, P.Calvini, G.Gemme, M.Esposito, C.Olivieri, L.Rei,
S.Squarcia, .Rodriguez, R.Bellotti, P.Cerello, I.De Mitri, A.Retico, F.Nobili and
The Alzheimer's Disease Neuroimaging Initiative. Local MRI analysis approach in
the diagnosis of early and prodromal Alzheimers disease, NeuroImage, 2011.
119
25. D. W. Shattuck, S. R. Sandor-Leahy, K. A. Schaper, D. A. Rottenberg, and R. M.
Leahy, “Magnetic resonance image tissue classification using a partial volume
model,” Neuroimage, 13:856–876, 2001.
26. J. Ashburner and K. J. Friston, “Unified segmentation,” Neuroimage, 26: 839–851,
2005.
27. Vivian S. Lee, “Cardiovascular MRI: physical principles ti practical protocols”,
Lippncott Williams & Wilkins, 2006.
28. D.W. Shattuck, R.M. Leahy, “Automated Graph-Based Analysis and Correction of
Cortical Volume Topology”, IEEE Transactions on Medical Imaging, 20: 1167-1177,
2001.
29. M.A. Balafar, “Review of the intensity inhomogeneity correction methods for brain
MRI images”, Department of computer, Faculty of Engineering, University of Tabriz,
Tabriz, Iran.
30. R. Quartulli, F. Brun, A. Chincarini, L. Rei, M. Ukmar, R. Longo, “High-Resolution MRI
images of the hippocampal region for early diagnosis of Alzheimer’s diseas”, AIFM, Torino
2013.
31. http://www.fil.ion.ucl.ac.uk/spm/
32. Z.P. Liang, P.C. Lauterburg, “Principles of Magnetic Resonanca Imaging: a signal
processing perspective.” Piscataway, NJ: IEEE Press, 1999.
33. R. Guillemaud and M. Brady, “Estimating the bias field of MRimages,” IEEE
Trans. Med Imag., 16(3): 238–251, 1997.
120
34. http://it.wikipedia.org/wiki/Mezzo_di_contrasto#Imaging_a_risonanza_magnetic
a
35. Francesco Paolo Sellitti, Apparecchiature e tecnologie di risonanza magnetica per
immagini, Federazione Nazionale Collegi Tecnici Sanitari di Radiologia Medica
(F.N.C.T.S.R.M).
36. www.messeritalia.it/Prodotti/Gas_puri_e_speciali/Elio.pdf
37. http://www.corriere.it/scienze/10_agosto_27/elio-rischio_0018d6b8-b20b-11dfa044-00144f02aabe.shtml
38. F. Campanella, M. Mattozzi, Realizzazione alla regola dell’arte degli impianti di
ventilazione nelle sale di risonanza magnetica. Indicazioni operative, esperienze,
criticità, INAIL, 2012.
39. Patrick W. Stroman, Essentials of functional MRI, CRC Press, 2011
40. https://www.healthcare.siemens.com/magnetic-resonance-imaging/options-andupgrades/coils
41. http://www.medical.siemens.com/siemens/en_GLOBAL/gg_mr_FBAs/files/apps/
MAGNETOM_world/MR_Manuals/syngo_mMR_B18P/USA_English/OM_Coils
_B18P/Coils/Advanced/Content/SubRegister5.htm
42. Gianluca Coscia, I controlli di qualità – Corso pratico su qualità e sicurezza in
risonanza magnetica, S.C. Fisica Sanitaria, E.O. Ospedali Galliera di Genova
43. Stefano Paluan, Mitigazione delle onde EM generate da un tomografo RM e
valutazione dell’efficienza di schermature per radiofrequenza, Tesi di laurea
magistrale, Università degli studi di Padova
121
44. Felice Vitulo, Il controllo di qualità in Risonanza Magnetica, Corso di formazione per
tecnici sanitari di radiologia medica, Casa di cura Villa Salus (Messina).
45. J.L. Gunter, M.A. Bernstein, B.J. Borowski, C.P. Ward, P. Britson, J. Felmlee, N.
Schuff, M. Weiner and C.R. Jack, “Measurement of MRI scanner performance with
the ADNI phantom”, Medical Physics, 36(6): 2193-2205 ,2009.
122
123
124
RINGRAZIAMENTI
Ringrazio la Professoressa Renata Longo per avermi dato la possibilità di svolgere il presente
lavoro di tesi, per la gentilezza e la disponibilità.
Ringrazio per l’aiuto il Dottor Francesco Brun, Francesco Sensi e Luca Rei.
Ringrazio inoltre la Dott.ssa Maria Rosa Fonasier, la Dott.ssa Maja Ukmar, il Dott. Fabio
Quargnali, Sebastian Schlussarek e Stefano Virgilio.
125