AIAS – ASSOCIAZIONE ITALIANA PER L’ANALISI DELLE SOLLECITAZIONI
45° CONVEGNO NAZIONALE, 7-10 SETTEMBRE 2016 – UNIVERSITÀ DEGLI STUDI DI TRIESTE
AIAS 2016 - 652
IL BONE STRUCTURE INDEX: UNO STUDIO SULLA QUALITÀ DELLA STRUTTURA
TRABECOLARE
F. Cosmia, A. Nicolosib
a
Università degli Studi di Trieste - Dipartimento di Ingegneria e Architettura,
Via A. Valerio 10, 34127 Trieste, e-mail: [email protected]
b
M2Test, e-mail: [email protected]
Sommario
L'osteoporosi è una malattia silente ma molto comune e in rapida crescita visto l’allungarsi della vita,
caratterizzata da una diminuzione della resistenza ossea, che porta ad un progressivo aumento del rischio
di frattura. Attualmente, la diagnosi viene fatta sulla base della densità minerale ossea, che però nel 4050% dei casi non è in grado di prevedere le fratture, e dei fattori di rischio clinici, ma non viene valutata
la solidità strutturale della disposizione trabecolare. Il Bone Structure Index (BSI) nasce per dare
un’indicazione clinica sulla qualità, cioè sulla capacità portante, della struttura trabecolare ed è in grado
di aiutare a identificare i soggetti a rischio, integrando gli strumenti attualmente in uso a costi
estremamente contenuti. In questo lavoro, ci proponiamo di identificare la distribuzione del BSI in una
popolazione di oltre 300 volontari di sesso femminile e di discutere i fattori di rischio di frattura fragile
riconosciuti dalla comunità scientifica
Abstract
Osteoporosis is a silent disease, characterized by a decrease of bone strength, which leads to a
progressive increase in fracture risk. It is very common and rapidly growing given the increasing life
span. Currently, diagnosis is made on the basis of bone mineral density, which seems to be a poor
fracture predictor in about 40-50% of cases, and of the clinical risk factors, but the structural safety of
the trabecular structure is not evaluated. The Bone Structure Index (BSI) was created to give an
indication of the clinical evaluation of the trabecular structure quality, that is its load-bearing capability.
The BSI is able to help in the identification of those at risk, by complementing the instruments currently
in use at an extremely low cost. In this work, we aim to identify the distribution of BSI in a population
of over 300 female volunteers and to discuss the fracture risk factors recognized by the scientific
community.
Parole chiave: Osteoporosi, Bone Structure Index, Metodo delle Celle, Analisi strutturale, Qualità
dell’osso.
1. INTRODUZIONE
Il tessuto osseo è estremamente complesso e le sue caratteristiche morfo-funzionali dipendono dalle
continue modificazioni fisiologiche o patologiche che subisce nel corso della vita dell’individuo.
L'osteoporosi è una malattia silente ma molto comune al giorno d’oggi e in rapida crescita visto il
progressivo allungamento della vita. È caratterizzata da una diminuzione della resistenza ossea con
progressivo aumento del rischio di frattura: l’osteoporosi provoca più di 8,9 milioni di fratture ogni anno
in tutto il mondo e più di un terzo delle fratture osteoporotiche si verificano in Europa.
Le proprietà meccaniche dell’osso sono strettamente influenzate dalla sua componente spongiosa e, sulla
macro-scala, dipendono sia dalla composizione sia dalla complessa micro-architettura delle trabecole.
Nella letteratura scientifica viene comunemente accettato che entrambi questi fattori, contenuto minerale
45° CONVEGNO NAZIONALE – TRIESTE, 7-10 SETTEMBRE 2016
e organizzazione strutturale delle trabecole, contribuiscano a determinare la resistenza complessiva del
tessuto osseo [1-11].
Attualmente, gli accertamenti clinici non valutano la solidità strutturale, cioè la qualità, della
disposizione trabecolare e la diagnosi viene fatta sulla base della densità minerale ossea o di appositi
algoritmi per il calcolo del rischio di frattura (p.es. a 10 anni) quali il FRAX®, sviluppato dall’OMS
integrando i fattori di rischio clinici ed il valore della densità minerale ossea (BMD – Bone Mineral
Density) misurata a livello del collo femorale [12].
La risposta meccanica della struttura ossea al carico applicato può essere valutata a partire da
ricostruzioni 3D del tessuto esaminato, per esempio ottenute a partire da scansioni micro-CT. Queste
applicazioni sono però al momento ancora lontane da un utilizzo nella pratica clinica, mentre offrono
grandi potenzialità in ambiti di ricerca, ad esempio per valutare gli effetti sulla struttura ossea in
condizioni di permanenza in microgravità [13-15].
Il BSI – Bone Structure Index, è un indice della qualità della struttura ossea che nasce appunto
dall’esigenza di superare le limitazioni legate all’impiego di modelli 3D e viene calcolato a partire dalla
simulazione dell’applicazione di carichi su quella che può essere considerata una biopsia virtuale
dell’architettura ossea del paziente, ottenuta da immagini radiografiche. Il BSI nasce quindi per dare
un’indicazione clinica sulla qualità, cioè sulla capacità portante, della struttura trabecolare, in grado di
identificare i soggetti a rischio, integrando gli strumenti attualmente in uso: le alterazioni della struttura
ossea, p. es. dovute all’osteoporosi, possono essere rilevate e quantificate mediante il BSI, completando
il quadro clinico derivato dalla densitometria con un esame di basso costo.
Figura 1. Acquisizione della radiografia e selezione della zona trabecolare per l’analisi.
Il modello numerico è ricavato a partire da un’immagine radiografica tradizionale (Fig.1). Sul modello
viene simulata l’applicazione di carichi attraverso l’applicazione del Metodo delle Celle in campo
elastico [16-18].
Il risultato dell’elaborazione viene sintetizzato in un indice strutturale indicativo della capacità della
struttura ossea di reggere i carichi (BSI – Bone Structure Index), che combina la risposta elastica della
struttura ricostruita e la somma normalizzata dei toni di grigio, indicativa della mineralizzazione nella
regione in esame. La tecnica, che prevede la semplificazione della struttura trabecolare da 3D a 2D,
viene applicata in distretti anatomici opportuni, quali ad esempio l’epifisi prossimale delle dita della
mano, in cui, nonostante la forma irregolare dell’osso, è possibile identificare il pattern della struttura
trabecolare che si sviluppa per piani con una discreta regolarità. In questo modo è possibile rilevare e
quantificare le alterazioni patologiche della struttura ossea trabecolare in pochi secondi [19].
Una prima validazione clinica ha evidenziato come questa tecnica possa migliorare la diagnosi e aiutare
il medico nell’ identificazione del rischio effettivo di frattura osteoporotica [20].
Un successivo studio eseguito su 66 soggetti ha confermato che la tecnica è in grado di discriminare i
soggetti sani da quelli a rischio [21].
Il test è stato utilizzato per valutare in termini quantitativi il decorso in un caso di sindrome
algoneurodistrofica della mano (CRPS – Complex Pain regional Syndrome type II) complicato da
osteoporosi [22]. Recentemente, grazie ad uno studio che ha coinvolto più di 300 volontari, è stato
45° CONVEGNO NAZIONALE – TRIESTE, 7-10 SETTEMBRE 2016
possibile acquisire le informazioni sulla distribuzione del BSI all’interno della popolazione ed elaborare
i parametri statistici di riferimento per il medico in fase di diagnosi [23].
Dal punto di vista procedurale, le immagini radiografiche delle epifisi prossimali di indice, medio e
anulare della mano non dominante vengono elaborate e convertite in un modello numerico su cui viene
simulata l’applicazione di carichi di compressione, come sinteticamente descritto qui di seguito.
1.
Viene selezionata la regione trabecolare di interesse per l’analisi (ROI – Region Of Interest) e
sull’immagine della ROI vengono definite una griglia di nodi e la connettività delle celle, costituite da
triangoli a 3 nodi.
2.
In ciascuna cella viene valutata la media dei toni di grigio in alcuni punti e questo valore viene
utilizzato per assegnare le proprietà elastiche della cella con una procedura di scala tra 0 MPa (nessuna
caratteristica meccanica) e 1000 MPa, valore arbitrariamente assunto per la fase trabecolare. Ulteriori
ipotesi sono il comportamento elastico-lineare e il valore del modulo di Poisson =0.3 di ciascuna cella.
3.
Viene quindi simulata la compressione a spostamento impresso lungo gli assi della ROI,
utilizzando i modelli micro-meccanici basati sul Metodo delle Celle e sviluppati per la determinazione
delle proprietà meccaniche apparenti di materiali porosi [24-28]. Il risultato delle simulazioni è il
modulo elastico apparente E* nelle due direzioni della struttura ricavata a partire dall’immagine
radiografica piana della regione di interesse.
4.
Nella ROI viene inoltre definito un parametro indicativo del livello locale di mineralizzazione
della fase ossea, somma normalizzata dei toni di grigio nella zona esaminata, CF – Content Factor, [1923].
5.
L’indice strutturale BSI viene introdotto per sintetizzare il risultato delle simulazioni,
evidenziando il contributo dell’organizzazione spaziale delle trabecole alla capacità della struttura ossea
di reggere i carichi, a prescindere dal livello locale di mineralizzazione:
BSI a1 b1E * b2CF
(1)
con a1 fattore di normalizzazione calcolato dai parametri di acquisizione radiografici (fissati dal
protocollo di acquisizione), e b1 e b2 costanti positive.
I risultati dell’elaborazione dell’immagine e del modello numerico sono disponibili in meno di un
minuto su un normale personal computer.
I primi studi sul BSI [20-22] sono stati eseguiti utilizzando un mammografo. Questo approccio era
limitato da diverse criticità:
•
difficoltà a reperire strutture in cui eseguire l’acquisizione dei dati
•
necessità di normalizzazione dei dati al variare dell’apparecchiatura utilizzata
•
facilità di errore dell’operatore nell’impostazione dei parametri
•
studi su numero limitato di soggetti.
La recente diffusione anche sul mercato italiano degli apparecchi di radiologia portatile “palmare”, nati
per applicazioni dentali ed in grado di fornire immagini di ottima qualità, ha portato a esaminare la
possibilità di un loro impiego per questa applicazione [29], con definizione di un protocollo di
acquisizione, superamento delle precedenti limitazioni ed evidenza di ulteriori vantaggi quali:
•
costo contenuto
•
facilità e rapidità d’uso
•
peso estremamente contenuto
•
non sono richiesti ambienti particolari
•
apparecchio già certificato ed in commercio
•
condivisibilità fra operatori.
Nell’applicazione clinica, la modalità di erogazione dell’analisi della qualità ossea mediante il BSI
prevede un’architettura client-server con remotizzazione del calcolo su cloud, che consente di
disaccoppiare il software di acquisizione delle immagini radiografiche (su client) da quello che esegue
effettivamente l’elaborazione, come schematicamente illustrato in Fig.2.
45° CONVEGNO NAZIONALE – TRIESTE, 7-10 SETTEMBRE 2016
Figura 2. Applicazione clinica: schema di erogazione dell’analisi della qualità ossea mediante BSI.
In questo lavoro, ci proponiamo di identificare la distribuzione del BSI in una popolazione di oltre 300
volontari di sesso femminile e di discutere le relazioni tra qualità strutturale, densità minerale ossea ed
alcuni fattori di rischio di frattura riconosciuti dalla comunità scientifica.
3. MATERIALI E METODI
3.1. Disegno sperimentale
Lo studio è stato articolato in 3 fasi.
Fase1. La prima fase del progetto si è svolta durante le giornate di Trieste NEXT – Salone Europeo
della Ricerca Scientifica svoltosi il 25-26-27 Settembre 2015 in Piazza Unità, Trieste, presso lo
spazio n.9 “Le strutture ossee. Ingegneria meccanica per la diagnosi di osteoporosi”, a cura della
prof.ssa Francesca Cosmi. Nei tre giorni della manifestazione sono stati raccolti più di 400 nomi
con relativi recapiti di volontari interessati ad eseguire l’analisi per la valutazione della qualità
ossea.
Fase 2. Successivamente il CRG – Centro Radiologico Giuliano, Piazza San Giovanni 6, Trieste, ha
messo a disposizione tre giornate per lo svolgimento delle radiografie. I volontari sono stati
richiamati e sono state fissate le date per la misurazione. Sono state raccolte le radiografie e
contestualmente ai volontari è stato somministrato un questionario anamnestico.
Fase 3. Oltre alla raccolta dei dati riguardanti età, sesso, peso, altezza, fratture precedenti, presenza di
genitore con frattura dell'anca, fumatore abituale, uso di glucocorticoidi, presenza di artrite
reumatoide, presenza di osteoporosi secondaria, uso di alcol (3 o più unità / giorno), valore del
T-score densitometrico a livello del collo del femore (BMD T-score), sulle radiografie acquisite
è stato calcolato il valore del BSI di ciascun volontario.
Il Comitato Etico di Ateneo dell’Università degli Studi di Trieste ha espresso parere favorevole agli
aspetti etici e scientifici del progetto (verbale n. 66 dell’11.11.2015).
Al termine del progetto il CRG ha consegnato ai volontari i referti in maniera anonima e gratuita.
3.2. Metodi
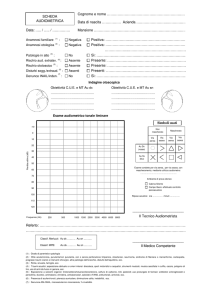
Ai volontari che si sono presentati per l’esame è stato chiesto di compilare, oltre al modulo di consenso
informato, un semplice questionario (Fig. 3) nel quale indicare i fattori di rischio già citati, riconosciuti
dalla comunità scientifica ed utilizzati nell’algoritmo FRAX®.
In questo lavoro sono stati considerati i dati relativi ad età, peso, altezza e, quando disponibile, il risultato
dell’esame densitometrico, attuale gold-standard per la diagnosi di osteoporosi, espresso come T-score
densitometrico a livello del collo del femore (BMD T-score). Si ricorda che il valore di T-score esprime
il numero di deviazioni standard al di sotto della BMD media dei giovani adulti di razza caucasica dello
stesso sesso.
Utilizzando le radiografie acquisite durante le tre giornate presso lo studio radiologico Giuliano, è stato
inoltre possibile valutare il BSI di tutti i volontari che si sono presentati per l’analisi.
45° CONVEGNO NAZIONALE – TRIESTE, 7-10 SETTEMBRE 2016
Figura 3. Il questionario anamnestico presentato ai volontari.
4. RISULTATI
4.1. Caratteristiche generali della popolazione
Nelle giornate della manifestazione Trieste NEXT 473 volontari di sesso femminile hanno lasciato un
recapito, unico criterio di inclusione: età ≥ 20 anni. Di queste, 351 si sono effettivamente presentate
nelle giornate indicate per eseguire il test ed hanno compilato il questionario. Tutte le donne che hanno
compilato il questionario sono di razza caucasica.
Per ciascuna volontaria che si è presentata sono state raccolte le radiografie raffiguranti l'epifisi
prossimale delle prime falangi nelle tre dita centrali della mano non dominante con il sistema a raggi X
portatile Nomad2Pro ™ (parametri di acquisizione: KVP 60, esposizione 0.17s).
Le radiografie con osso trabecolare non sufficientemente raffigurato, fratture nelle regioni di misura,
materiale estraneo o posizionamento inaccettabile state successivamente escluse manualmente.
Al termine della procedura, il campione della popolazione idoneo allo studio è risultato composto da
336 soggetti di sesso femminile con un range di età compreso nella fascia 20 – 95 anni. L’età delle donne
esaminate è di 61±12 anni (media±deviazione standard). La maggioranza della popolazione si
distribuisce nella fascia d’età tra i 46-65 anni (56%).
I soggetti femminili delle quali si ha il valore del T-score densitometrico all’altezza del collo femorale,
BMD_T-score, rappresentano il sottogruppo sul quale sono state ricercate ulteriori relazioni.
Il sottogruppo è composto da 65 donne con un range di età compreso tra 40-85 anni. L’età delle donne
del sottogruppo è di 65±10 anni (media±deviazione standard). La maggioranza si distribuisce nella
fascia d’età tra i 46-65 anni (43%).
Le distribuzioni per fascia d’età della popolazione e del sottogruppo sono riportate in Fig.4.
45° CONVEGNO NAZIONALE – TRIESTE, 7-10 SETTEMBRE 2016
Figura 4: Distribuzione per fascia d’età della popolazione (a sinistra) e del sottogruppo (a destra).
4.2. Caratteristiche antropometriche della popolazione
Il picco di massa ossea si raggiunge tra i 20 e i 30 anni e superati i 65 anni aumenta il rischio di frattura
[30], evento cui corrisponde un incremento del tasso di mortalità.
I principali fattori di rischio non modificabili per l'osteoporosi sono il sesso femminile, la menopausa
precoce e l'invecchiamento. Tra i fattori di rischio modificabili ci sono l'inadeguato apporto di calcio e
vitamina D nella dieta e la scarsa attività fisica. Il rischio di frattura, oltre che da una bassa densità massa
minerale ossea e a modifiche della micro-architettura trabecolare [31, 32], dipende anche da altri
elementi tra cui la presenza di una terapia cortisonica cronica (aumento significativo dopo 3 mesi di
assunzione e riduzione dopo sospensione), l’immobilizzazione protratta e l’abuso di alcolici e fumo e
un basso peso corporeo [33, 34].
L’Indice di Massa Corporea o Body Mass Index (BMI, kg/m2), calcolato secondo la formula
𝐵𝑀𝐼 =
𝑃𝑒𝑠𝑜 (𝐾𝑔)
𝐴𝑙𝑡𝑒𝑧𝑧𝑎2 (𝑚2 )
costituisce un indice indiretto di adiposità [35].
Per quanto riguarda la relazione tra BMI e rischio di osteoporosi si è visto che la terapia dietetica
ipocalorica, se da un lato migliora gli indici di rischio cardiovascolare dall’ altra diminuisce la densità
minerale ossea totale, delle braccia e delle gambe, nelle donne sia in pre- sia in post-menopausa [36].
Nelle donne sane, non obese, in pre- e peri-menopausa, anche un modesto calo corporeo di 3-4 Kg
induce una perdita ossea doppia al femore rispetto alle donne con peso stabile, con una perdita ossea
proporzionale alla perdita di peso, solo parzialmente compensata dall’attività fisica. I motivi di questa
perdita ossea anche per piccole diminuzioni di peso sono oscure, secondo alcuni autori [37] possibili
spiegazioni sono:
1) diminuito stress meccanico che causa un’alterazione del rimodellamento osseo
2) adattamento fisiologico al minor carico di lavoro, che appare poco credibile anche in funzione della
modesta diminuzione, 3.2 Kg in media
3) diminuzione della massa grassa con parallela diminuzione dei precursori degli androgeni
4) diminuito apporto di calcio dovuto alla dieta.
La figura 5 mostra la distribuzione in categorie ponderali della popolazione e del sottogruppo, calcolate
dai dati di peso e altezza riportati anamnesticamente.
Dal grafico si può notare come la maggior parte della popolazione presa in esame abbia un indice di
massa corporea rappresentativo di un rischio moderato di andare incontro a fratture e che solo una
frazione inferiore al 30% rientra nella categoria di basso rischio.
Il campione del sottogruppo appare rappresentativo della popolazione generale studiata per quanto
riguarda la distribuzione dell’indice di massa corporea IMC.
45° CONVEGNO NAZIONALE – TRIESTE, 7-10 SETTEMBRE 2016
Figura 5: Distribuzione dell’indice di massa corporea IMC nella popolazione (a sinistra) e nel
sottogruppo (a destra).
4.3. Caratteristiche di densità ossea della popolazione del sottogruppo
L’assorbimetria a raggi X a doppia energia – DEXA o DXA, è allo stato attuale la metodica di
riferimento per la misura della densità ossea (BMD – Bone Mineral Density) e la diagnosi di
osteoporosi. I risultati del test DEXA sono espressi in forma di T-score, che esprime il numero
di deviazioni standard al di sotto della BMD media dei giovani adulti caucasica dello stesso
sesso. Un T-score sopra -1 è considerato normale, uno tra -1 e -2.5 è classificato come
osteopenia (massa ossea bassa) e un punteggio T-score inferiore a -2,5 indica l'osteoporosi,
come riassunto in Tab.1.
Tabella 1. Linee guida per l’interpretazione del BMD_T-score
SALUTE OSSEA
BMD
T-score ≥ -1
-2.5 ≤ T-score < -1
T-score < -2.5
T-score < -2.5 con frattura
Normale
Osteopenia
Osteoporosi
Osteoporosi severa
La figura 6 mostra la distribuzione in categorie diagnostiche valutate dai dati densitometrici riportati
anamnesicamente dalle volontarie che hanno riportato tale dato nel questionario.
Figura 6. Distribuzione del valore di T-score densitometrico (BMD_T-score) nella popolazione del
sottogruppo.
4.4. Caratteristiche di qualità della struttura ossea della popolazione
L’interpretazione del risultato dell’analisi della struttura ossea può basarsi sul calcolo del BSI_T-score
e quindi sul confronto tra il risultato BSI del paziente e quello medio di soggetti adulti sani dello stesso
sesso e di giovane età (20-45 anni) e /o sul calcolo del BSI_Z-score e quindi sul confronto tra il risultato
BSI del paziente e quello medio di soggetti di pari età e sesso, in entrambi i casi espressi in numero di
deviazioni standard. Sono state quindi calcolate le medie per fascia di età e la deviazione standard dei
BSI della popolazione e ottenute le rispettive curve di livello, come indicato ad esempio in Fig.7.
45° CONVEGNO NAZIONALE – TRIESTE, 7-10 SETTEMBRE 2016
Figura 7. Distribuzione di BSI_T-score e BSI_Z-score ed esempio di risultato dell’analisi.
Ai fini della valutazione clinica della qualità dell’osso possono essere seguite le linee guida usuali:
• BSI T-score = 0
indica che il soggetto ha una qualità ossea pari quella media della
popolazione giovane dello stesso sesso;
• BSI_T-score ≥-1
indica una qualità ossea normale;
• - 2.5 < BSI_T-score < -1 indica una prima riduzione di qualità dell'osso, che deve essere valutata
da uno specialista, il quale può eventualmente suggerire nuovi test e/o
trattamenti (deficit di livello 1);
• BSI_T-score < -2.5
indica una riduzione importante della qualità ossea e la necessità di
cure mediche appropriate (deficit di livello 2).
Una volta intrapreso un trattamento, il medico può valutarne l'efficacia sottoponendo il paziente a
valutazioni periodiche del BSI, che può essere ripetuto anche a distanza di pochi mesi.
La figura 8 mostra la distribuzione in categorie diagnostiche calcolate dai dati del BSI dalle volontarie
che hanno partecipato allo studio.
Figura 8. Distribuzione del valore della qualità strutturale, BSI_T-score, nella popolazione (a sinistra) e
nel sottogruppo (a destra).
In fig.9 vengono confrontati i valori di BSI_T-score e di BMD_T-score, che appaiono indipendenti tra
loro (R² = 0.0631).
2.0
BSI_T-score
1.0
-4
0.0
-1.0
-2
-2.0
0
2
-3.0
-4.0
BMD_Tscore
Figura 9. Distribuzione del valore della qualità strutturale, BSI_T-score nel sottogruppo.
45° CONVEGNO NAZIONALE – TRIESTE, 7-10 SETTEMBRE 2016
È da notare la validità clinica di questo tipo di grafico, che permette di individuare la situazione del
paziente a seconda del quadrante occupato: valori normali di densità e qualità ossea, valori bassi di
entrambe, o valori normali di solo uno o l’altro dei fattori che più influenzano la resistenza, cui possono
corrispondere prognosi ed interventi terapeutici diversi a seconda del tipo di deficit riscontrato.
5. CONCLUSIONI
In questo lavoro sono state esaminate le distribuzioni in una popolazione di oltre 300 volontari di sesso
femminile del Bone Structure Index (BSI), indice della qualità, cioè della capacità portante, della
struttura trabecolare e sono stati presi in esame i principali fattori di rischio di frattura fragile riconosciuti
dalla comunità scientifica.
Alcuni dei vantaggi derivanti dall’introduzione del BSI come complemento all’indagine densitometrica
possono essere così riassunti:
•
migliorare il follow-up del paziente, verificando l’efficacia delle terapie con maggiore
frequenza, data la riduzione dell’esposizione alle radiazioni per l’esecuzione dell’esame, che può essere
ripetuto anche a distanza di pochi mesi;
•
aumentare la soddisfazione del paziente in quanto l’analisi è comoda e veloce da effettuare,
inoltre con visite ravvicinate il paziente si sente seguito al meglio ed è motivato a proseguire l’eventuale
terapia fino al controllo successivo;
•
valutare adeguatamente una parte di popolazione che altrimenti verrebbe considerata a basso
rischio sulla base del solo referto MOC.
RINGRAZIAMENTI
Si ringraziano il Centro Radiologico Giuliano e il dott. Zappa per l’insostituibile contributo alla raccolta
dei dati discussi in questo lavoro e KaVo Italia per aver reso possibili le acquisizioni radiografiche.
BIBLIOGRAFIA
[1] Kleerekoper M. et al., 1985. The role of three dimensional trabecular microstructure in the
pathogenesis of vertebral compression fractures. Calcif Tissue Int. 37(Suppl):S594–S597
[2] Consensus Development Conference, 1993. Diagnosis, prophylaxis and treatment of osteoporosis.
AM J Med. 94, 646-650
[3] Barou O et al., 2002. High-resolution three-dimensional micro-computed tomography detects bone
loss and changes in trabecular architecture early: comparison with DEXA and bone
histomorphometry in a rat model of disuse osteoporosis. Invest Radiol. 37: 40-46
[4] Ruppel M.E et al., 2008. The effect of the microscopic and nanoscale structure on bone fragility.
Osteoporos. Int. 19: 1251-1265
[5] X. Sherry Liu et al., 2009. Contributions of trabecular rods of various orientations in determining
the elastic properties of human vertebral trabecular bone. Bone. 45(2), 158–163
[6] Yeni Y.N. et al., 2009. Human cancellous bone from T12–L1 vertebrae has unique microstructural
and trabecular shear stress properties. Bone. 44(1), 130–136
[7] Haiat G et al., 2009. Relationship between ultrasonic parameters and apparent trabecular bone
elastic modulus: A numerical approach. J Biomech. 42(13), 2033-9
[8] World Health Organization Scientific Group. Assessment of osteoporosis at the primary healthcare level. Technical Report. Available at http://www.who.int/chp/topics/Osteoporosis.pdf (2008)
[9] Pasco J.A. et al. The population burden of fractures originates in women with osteopenia, not
osteoporosis. Osteoporos. Int. 17(9): 1404-1409 (2006)
[10] Siris E.S. et al. Bone mineral density thresholds for pharmacological intervention to prevent
fractures. Arch Intern Med. 164: 1108 – 1112 (2004)
[11] Sornay-Rendu E. et al. Identification of osteopenic women at high risk of fracture: the OFELY
study. J Bone Miner Res. 20(10): 1813-1819 (2005)
[12] https://www.shef.ac.uk/FRAX/
45° CONVEGNO NAZIONALE – TRIESTE, 7-10 SETTEMBRE 2016
[13] Cosmi F. and Dreossi D., 2007. Numerical and experimental structural analysis of trabecular
architectures. Meccanica. 42(1), 85-93.
[14] Cosmi, F. et al., 2015. A mesoscale study of the degradation of bone structural properties in
modeled microgravity conditions. JMBBM: Journal of the Mechanical Behavior of Biomedical
Materials, 44, 61-70
[15] Cosmi, F. et al., 2009. Structural analysis of rat bone explants kept in vitro in simulated
microgravity conditions. JMBBM: Journal of the Mechanical Behavior of Biomedical Materials
2(2), 164-172
[16] Tonti E., 2001. A Direct Discrete Formulation of Field Laws: The Cell Method. CMES: Computer
Modeling in Engineering & Sciences. 2(2), 237-258
[17] Cosmi, F., 2001. Numerical Solution of Plane Elasticity Problems with the Cell Method. CMES:
Computer Modeling in Engineering & Sciences, 2(3), 365-372
[18] Tonti, E., Zarantonello, F., 2009. Algebraic Formulation of Elastostatics: the Cell Method. CMES:
Computer Modeling in Engineering & Sciences. 39(3), 201-236
[19] Cosmi, F., 2015. Numerical evaluation of trabecular bone alterations: a Cell Method application.
MCB: Molecular & Cellular Biomechanics, 12(2). 87-105
[20] Cosmi F., Dreossi D., 2007. The Application of the Cell Method in a Clinical Assessment of Bone
Fracture Risk. Acta of Bioengineering and Biomechanics. 9(2), 35-39
[21] Cosmi F et al., 2011. A structural method for the clinical evaluation of fracture risk in osteoporosis,
Fourth International Conference on Mechanics of Biomaterials & Tissues, Waikoloa Beach
Marriott Resort, Hawai’i, USA, 11-15.12.2011
[22] Cosmi F., Mazzoleni, G., 2014. Evaluation of the structural quality of bone in a case of progressive
osteoporosis complicating a CRPS syndrome of the upper limb. J. Mech. Behav. Biomed. Mater.
29, 517-528
[23] Cosmi F et al., 2015. The Bone Structure Index: a study on bone quality, Sixth International
Conference on Mechanics of Biomaterials & Tissues, Waikoloa Beach Marriott Resort, Hawai’i,
USA, 6-10.12.2015
[24] Cosmi F., 2003. Numerical Modeling of Porous Materials Mechnical Behaviour with the Cell
Method, Proc. of Second M.I.T. Conference on Computational Fluid and Solid Mechanics,
Massachusetts Institute of Technology, Cambridge, MA, U.S.A. , June 17 – 20
[25] Cosmi F., 2004. Two-dimension estimate of effective properties of solid with random voids,
Theoretical and Applied Fracture Mechanics, , 42, 183-186
[26] Cosmi F., 2011 A Cell Method model for sintered alloys. CMES: Computer Modeling in
Engineering & Sciences, 74(3&4) , 269-282
[27] Cosmi F. 2011 Local anisotropy and elastic properties in a short glass fibre reinforced polymer
composite. Strain.47, 215–221
[28] Cosmi F. 2011. A micro-mechanical model of the elastic properties of a short fibre reinforced
polyammide. Procedia Engineering. 10, 2135-2140
[29] Cosmi, F., Tomanik M. 2016. Preliminary design of an x-ray imaging system for the bone structure
index evaluation. Materials Today: Proceedings. 3, 947 – 952.
[30] X. Jiang et al. 2013. Age as a Predictor of Osteoporotic Fracture Compared With Current RiskPrediction Models, Obstetrics & Gynecology, 122(5), 1040-1046.
[31] Kleerekoper M. et al., 1985. The role of three dimensional trabecular microstructure in the
pathogenesis of vertebral compression fractures. Calcif Tissue Int. 37(Suppl):S594–S597
[32] Consensus Development Conference, 1993. Diagnosis, prophylaxis and treatment of osteoporosis.
AM J Med. 94, 646-65.
[33] Jones G et al. 1994. Symptomatic fracture incidence in elderly men and women: The Dubbo
osteoporosis epidemiology study (DOES). Osteoporosis Int. 4(5), 277-282.
[34] Kanis JA1 et al. 2008. FRAX and the assessment of fracture probability in men and women from
the UK. Osteoporosis Int. 19(4)385-397.
[35] Istat, Aspetti della vita quotidiana nel 2008 - Capitolo Sovrappeso e obesità 28/03/2014.
[36] Jensen LB, Quaade F, Sorensen OH. 1994. Bone loss accompanying voluntary weight loss in obese
humans. J Bone Miner Res 9, 459-463.
[37] Salamone LM, et al. 1999. Effect of a lifestyle intervention on bone mineral density in
premenopausal women: a randomised trial. Am J Clin Nutr Vol 70, N 1,97-103.