Nome, Cognome e classe
Serie VIII: da consegnare la prima lezione della settimana del 17 novembre
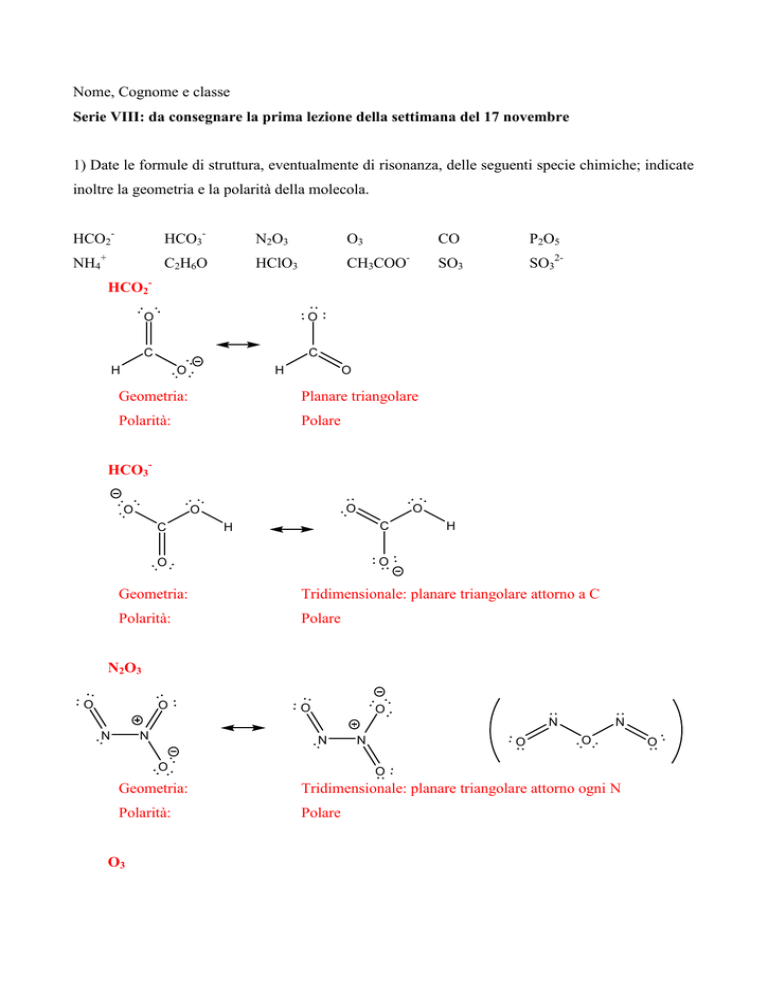
1) Date le formule di struttura, eventualmente di risonanza, delle seguenti specie chimiche; indicate
inoltre la geometria e la polarità della molecola.
HCO2-
HCO3-
N2O3
O3
CO
P2O5
NH4+
C2H6O
HClO3
CH3COO-
SO3
SO32-
HCO2O
O
C
C
H
O
H
O
Geometria:
Planare triangolare
Polarità:
Polare
HCO3O
O
O
C
O
C
H
H
O
O
Geometria:
Tridimensionale: planare triangolare attorno a C
Polarità:
Polare
N2O3
O
O
O
O
N
N
N
N
O
N
O
N
O
O
Geometria:
Tridimensionale: planare triangolare attorno ogni N
Polarità:
Polare
O3
O
O
O
O
O
O
O
Geometria:
Piegata (<120°)
Polarità:
Polare
CO
C
O
C
O
Geometria:
Lineare
Polarità:
Polare
P2O5
O
O
P
P
O
O
P
P
o
O
O
O
Geometria:
O
O
O
Tridimensionale : Planare triangolare attorno P (120°) e
piegata attorno ad O (<109°)
Polarità:
NH4
(Polare)
+
H
H
N
H
H
Geometria:
Tetraedrica
Polarità:
Polare
C2H6O
O H
Etanolo
Geometria:
O
oppure
Dimetil etere (sono isomeri strutturali)
Tridimensionale: tetraedrica attorno C, piegata attorno O
(<109°)
Polarità:
Polare
HClO3
O
O
Cl
H
O
Geometria:
Tridimensionale: piramidale trigonale attorno a Cl
Polarità:
Polare
CH3COOO
H
C
H
C
O
H
H
Geometria:
tetraedrica attorno C, planare triangolare attorno C, piegata
attorno O
Polarità:
Polare
SO3
O
O
O
O
S
S
O
O
Geometria:
Planare triangolare
Polarità:
Non polare
O
O
S
O
O
O
S
O
S
O
O
Geometria:
Piramide trigonale (<109°)
Polarità:
Polare
O
2) Assegna il corretto nome IUPAC alle seguenti strutture:
2,2-dimetilbutano
3-metilpentano
2,2-dimetilpropano
2,3,5-trimetilesano
b) Disegna i seguenti composti:
c) 3-etil-2-metileptano; d) 3-esene; e) butan-2-olo; f) 2-metilpropan-2-olo;
c)
CH3
CH3
H3C
CH3
d)
H3C
H3C
CH3
CH3 isomero Z
isomero E
e)
OH
H3C
CH3
f)
H3C
H3C
OH
CH3
3) Rappresenta in modo schematico i seguenti idrocarburi:
;
;
;
;
;
4) Scrivi l’equazione di dissociazione acquosa dei seguenti sali: Ca(NO3)2, MgF2, NaCH3COO,
Ba(MnO4)2, Na3PO4
Ca(NO3)2
MgF2
NaCH3COO
Ba(MnO4)2
Na3PO4
Ca2+ + 2 NO3 –
Mg2+ + 2 FNa+ + CH3COOBa2+ + 2 MnO4 –
3 Na+ + PO43-
5) Prova a prevedere quali prodotti solidi si formeranno mescolando le seguenti coppie di soluzioni
acquose saline.
b) Bilancia le reazioni indicando anche quali ioni idrati rimarranno disciolti nella soluzione.
… AgNO3 (aq) + … NaCl (aq) → AgCl (s) + Na+ (aq) + NO3- (aq)
… BaCl2 (aq) + … Na2SO4 (aq) → BaSO4 (s) + 2 Na+ (aq) + 2 Cl- (aq)
3 … CaCl2 (aq) + 2 … Na3PO4 (aq) → Ca3(PO4)2 (s) + 6 Na+ (aq) + 6 Cl- (aq)
6) Quali tra i seguenti composti hanno legami covalenti e quali ionici: CO2, TiCl4, CCl4, CaCl2,
NaCl, HF, H2O, CS2, CHCl3, MgBr2.
Covalenti: CO2, CCl4, HF, H2O, CS2, CHCl3, TiCl4 (differenza di elettronegatività circa 1.6): è un
metallo di transizione, a volte si comportano diversamente
Ionici: CaCl2, NaCl, MgBr2
7) In un motore a scoppio, oltre alla normale combustione della benzina, avviene anche la seguente
reazione:
… N2 (g) + … O2 (g)→ 2 … NO (g)
Calcola la pressione finale nella camera di combustione (ipotizzando che quello indicato sia l’unico
processo che avviene) se 2 mol di N2 reagiscono con 5 mol di O2, ammettendo che la camera abbia
volume pari a 2 L e che la misura venga effettuata ad una temperatura di 300 °C.
La pressione finale è data dalla somma delle pressioni parziali di tutti i gas presenti nella camera di
combustione alla fine della reazione.
p TOT = p NO + p O2 = n NO ∙ R ∙ T / V + nO2 ∙ R ∙ T / V = (nNO + nO2) R ∙ T / V
n TOT = (n NO + n O2) = 4 mol + 3 mol = 7 mol (gas)
p = n TOT ∙ R ∙ T / V = [7 mol ∙ 0.0821 atm L K-1 mol-1 ∙ (300+273) K] / 2 L = 164.6 atm
Formalmente sarebbe più corretto calcolare la pressione parziale di ogni gas e poi sommarle per
ottenere quella totale.
8) Una bottiglia porta la scritta: Solfato di sodio 2.0 M.
a) Quali sono gli ioni presenti in questa soluzione? Scrivi la reazione di dissociazione ionica
Na+ e SO42Equilibrio di dissociazione ionica:
Na2SO4 (s) → 2 Na+ + SO42b) Qual è la concentrazione di questi ioni? Dai rapporti stechiometrici:
[Na+] = 4 M, [SO42-] = 2.0 M
c) Come devo procedere praticamente per preparare 250 cm3 di soluzione 0.5 M di solfato di sodio
utilizzando questa soluzione?
Calcolo la quantità chimica di soluto della soluzione finale:
n Na2SO4 = c soluzione Na2SO4 ∙ V soluzione Na2SO4 = 0.5 mol/L ∙ 0.25 L = 0.125 mol
n iniziali = n finali
V iniziale = n iniziale / c iniziale = 0.125 mol / 2.0 mol/L = 0.0625 L = 62.5 mL
Prelevo 62.5 mL dalla bottiglia di soluzione concentrata e porto a volume in un matraccio da 250
mL










