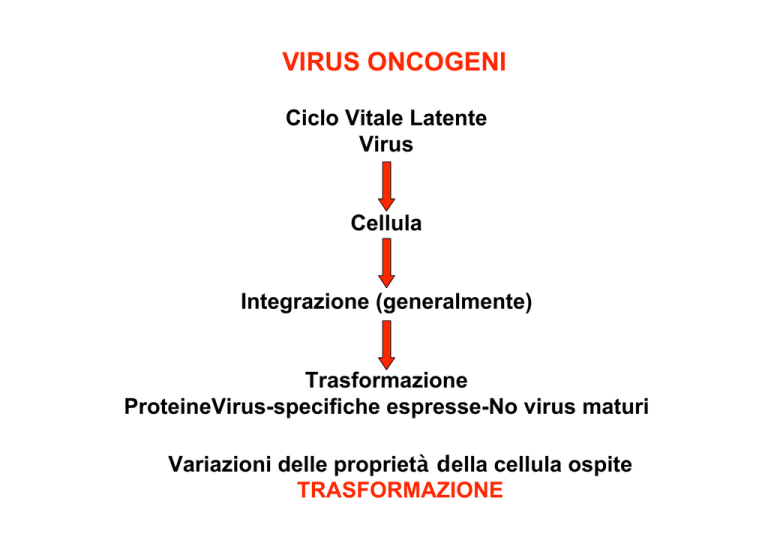
VIRUS ONCOGENI
Ciclo Vitale Latente
Virus
Cellula
Integrazione (generalmente)
Trasformazione
ProteineVirus-specifiche espresse-No virus maturi
Variazioni delle proprietà della cellula ospite
TRASFORMAZIONE
MECCANISMI DI TRASFORMAZIONE
DEI VIRUS ONCOGENI
- L’interazione di una singola particella virale con la cellula
bersaglio è sufficiente per indurre trasformazione
- Persistenza di tutto o parte del genoma virale in forma non
infettiva > integrato al DNA cellulare o in forma episomale
(EBV)
- Espressione di un numero limitato di geni virali (1 max 2)
per mantenere il fenotipo trasformato
VIRUS ONCOGENI E TUMORI ASSOCIATI
GRUPPI DI VIRUS
TUMORE ASSOCIATO
Virus Oncogeni a RNA
Retrovirus: HTLV-1
Tumori ematopietici: vari tipi di
carcinomi e sarcomi
ATL
Virus Oncogeni a DNA
1. Hepadnavirus: Epatite B
Carcinoma epatocellulare
2. Papovavirus (Papilloma,
Polioma, SV40)
Vari tumori solidi, papillomi e
carcinomi
3. Adenovirus
Vari tumori solidi
4. Herpesvirus: Epstein Barr
Linfomi, sarcomi e carcinomi
5. Poxvirus
Fibromi
VIRUS ONCOGENI A DNA
- Nelle cellule permissive il virus si replica e produce
nuove particelle che lisano la cellula (nessuna
trasformazione) > effetto citopatico con morte della
cellula ospite
- Nelle cellule non permissive che mancano di fattori
essenziali per la replicazione virale non si ha replicazione
virale né produzione di virioni > possibile trasformazione
PROTEINE TRASFORMANTI DEI VIRUS A DNA
Virus
Proteina
Localizzazione
Funzione
Polioma del topo
Antigene T grande
Antigene T medio
Antigene T piccolo
Nucl. Trasc. Repl. DNA
Memb. Trasd. Segn.
Citop. Nucl. ignota
SV40
Antigene T grande
Antigene T piccolo
Nucl. Memb. Citop.
Trasc. Repl. DNA
Citop. Nucl. Ignota
Adenovirus
E1A
E1B
Nucl. Trasc. Repl. DNA
Nucl. Memb. ignota
Papillomavirus
E5
E6
E7
Memb. Trasd. Segn.
Nucl. Trasc. Repl. DNA
Nucl. Trasc. Repl. DNA
POLIOMAVIRUS
(SV40)
Geni precoci: Antigene T grande e
T piccolo
Geni tardivi: proteine strutturali del
capside, VP1, VP2 e VP3
Il virus SV40 trasforma:
- Cellule di topi neonati mentre nei
topi giovani si replica naturalmente
(ciclo litico)
- Cellule di criceto
- Cellule mesoteliali umane (tumori
cerebrali e mesotelioma maligno)
- Normale ciclo litico nei fibroblasti di
scimmia (no trasformazione)
Antigene T grande di SV40
responsabile della
trasformazione
Mechanisms of T Ag-mediated transformation
1. T Ag SV40 induces
telomerase activity
2. T Ag binds and the
inhibits p53 and RB.
3. T Ag inhibits the activity of
protein phosphatase PP2A
4. T Ag upregulates the
expression of several
receptors suc as NOTCH1, MET oncogene and
IGF1
HUMAN PAPILLOMA VIRUS
(HPV)
- HPV è un virus a DNA appartenente alla famiglia dei
Papovaviridae con un tropismo spiccato per le cellule
epiteliali cutanee e delle mucose
- Induce lesioni iperproliferative degli epiteli cutanei e
delle mucose.
- Sono stati identificati più di 60 genotipi dei quali circa
30 infettano specificatamente l’epitelio genitale.
- “HPV low-risk” sono associati con lesioni epidermoidali
benigne e raramente sono presenti in lesioni
neoplastiche
- “HPV high-risk” HPV16 e 18 sono associati con lo
sviluppo di lesioni maligne preinvasive e tumorali > 12%
carcinomi cervice uterina
MECHANISM OF HPV INFECTION
- Gli HPV infettano le cellule basali epiteliali di zone colpite
da altre lesioni, o in epiteli di transizione (cervice uterina)
- Il ciclo di replicazione virale è legato al processo di
differenziazione dei cheratinociti
- I geni precoci sono espressi negli strati basali
- I geni tardivi sono espressi negli strati epiteliali superiori
LESIONI INDOTTE DAI DIVERSI TIPI DI HPV
Nelle verruche benigne e nelle lesioni pre-neoplastiche il
genoma dell’HPV rimane allo stato episomiale (non
integrato), mentre nei carcinomi esso è generalmente
integrato nel genoma della cellula ospite.
Questo indica che l’integrazione del DNA virale è
importante per la trasformazione maligna.
TRASMISSIONE DI HPV MUCOSALI
- Contatto sessuale: 95% delle persone infette
acquisiscono il virus per questa via
- Trasmissione verticale da madre infetta al neonato:
meno frequente. Difficile da rilevare a causa del periodo di
latenza (settimane-mesi) tra esposizione e manifestazione
clinica.
- Trasmissione orizzontale: rara.
• Doppia molecola di
HPV GENOME
• Genome of HPV 6800 and 8000 base pairs divided into eight open reading frames
— E6, E7, E1, E2, E4, E5, and L2 and L1 — coding for ‘early’ (E) or ‘late’ (L)
functions.
• The viral genome is frequently integrated into host-cell DNA. The ring molecule is
opened within the E2 open reading frame and part of E2 and adjacent E4, E5 and
part of L2 are regularly deleted after integration.
• Viral transcripts E6 and E7 responsible of transformation
FASI DELLA TRASFORMAZIONE
LSIL: Lesione squamosa
di basso grado
HSIL: Lesione squamosa
di alto grado
E7 ACTIVITY
- E7 interacts with Rb LXCXE motif that is present in its
amino-terminus. RB inactivate E2F by binding and
recruiting histone deacetylases (HDACs) > block of G1–S
phase transition.
- The binding of E7 to RB disrupts RB–E2F complexes
and favors Rb degradation > constitutive expression of
E2F-responsive genes, such as cyclin A and cyclin E >
premature S phase entry and DNA synthesis.
- E7 also affects the expression of S phase genes by
directly interacting with E2F factors and with HDACs.
- E7 interacts with and inhibits the CDK2 inhibitors p21
and p27 and activate the CDC25 phosphatase > high and
constitutive activity of CDK2 and S phase
SUMMARY
P53 LEVELS AND ACTIVITY INCREASE
E6 ACTIVITY
- E6 binds to p53 and block transcription by interfering
with its DNA-binding activity
- E6 recruits a cellular E3 ubiquitin ligase (E6AP) to the
trimeric complex with p53 and leads to the ubiquitylation
and proteasomal degradation of p53.
- E6 blocks the activity of p300/CBP acetyltransferase
essential for the stability of p53 and its transcritpional activity
- E6 binds and blocks FADD, Casp-8, Bax and Bak
- E6 activates TERT
SUMMARY
COOPERATION BETWEEN E6 AND E7
IL VIRUS DI EPSTEIN BARR
- Virus con envelope (proteine
gp350 e gp42) e nucleocapside
icosaedrico (2 proteine di 125 e
160 kDa) contenente DNA lineare
a doppia elica
- Genoma di 172 kb con più di 80
geni trascritti
- Nell’infezione non-produttiva dei
linfociti B sono trascritti solo 10
geni (fase di latenza): 6 proteine
nucleari (EBNA 1, EBNA2, 3A,
3B, 3C ed EBNA-LP) e 3 proteine
di membrana (LMP1, 2A e 2B)
EBV INFECTION
- Le glicoproteine gp350 dell’envelope di EBV
interagisce con il CD21 (o CR2, recettore per il
frammento C3d del complemento) e la gp42 con MHCII
- CD21 forma insieme a CD81 e CD19 il co-recettore
importante per la segnalazione da BCR e l’attivazione
dei linfociti B
- L’infezione primaria coinvolge le
cellule epiteliali stratificate
(recettore omologo a CD21 di
200 kDa) della mucosa
orofaringea dove il virus si replica
- Infezione secondaria linfociti B
(naive o memoria) nei tessuti
linfoidi dove il virus rimane
latente in forma episomiale
(Latenza III)
- Infezione persistente causata
dalla latenza virale nei reservoir
dei linfociti B memoria (latenza
che può durare tutta la vita)
- Persistenza del virus in forma
latente avviene nella zona orofaringea
TIPI DI INFEZIONE DA EBV
Tipo di latenza
Geni espressi
Tessuto o cellula
Latenza I
EBNA1
EBER (piccoli RNA
nucleari poliadenilati)
Biopsie di linfoma di
Burkitt o linee di
linfoma B nei primi
passaggi in vitro
Latenza II
EBNA, LMP1, LMP2,
EBER
Carcinoma
nasofaringeo
Linfoma di Hodgkin
Latenza III
EBNA1-6, LMP1,
LMP2, EBER
Linee cellulari
linfoblastoidi, linee di
linfoma di Burkitt in
coltura
IL LINFOMA DI BURKITT
- Descritta per la prima volta da Denis Burkitt nel 1958 in bambini
uganesi
- Linfoma scarsamente differenziato appartenente al tipo di linfomi
maligni ad alto grado, a piccole cellule
- Prevalente nell’Africa equatoriale e nella Nuova Guinea dove è
presente in forma endemica anche la malaria
- Nelle regioni occidentali è presente in forma sporadica
- Risposta positiva alla terapia: AZT e idrossiurea
Linfoma di Burkitt
traslocazione 8:14
Rottura del cromosoma 14 q32
myc
LINFOMA DI BURKITT
ENDEMICO
LMP1
LMP1 resembles CD40, member of the TNFR superfamily that provides
signals for growth and differentiation of B cells
LMP2A
LMP2A can drive the proliferation and survival of B cells in the absence
of signalling through the B-cell receptor (BCR).
EBV e carcinoma nasofaringeo: Cina e
sudest asiatico
LOH: loss of heterozygosity
VIRUS DELL’EPATITE B
(HBV)
- Virus appartenente alla famiglia degli Hepadnavirus con
genoma a DNA
- Provoca danni acuti e cronici agli epatociti e induce processi
flogistici a carico del fegato
- Particella di 42 nm con DNA circolare di 32 kb in un
nucleocapside (core) con involucro glicoproteico
- Involucro lipidico presenta l’antigene di
superficie (HbsAg=Ag Australia)
immunogenico (Ab neutralizzanti)
- Il core possiede l’HbcAg e l’antigene in
forma criptica HbeAg e contiene il DNA
virale, una DNA polimerasi RNAdipendente ed una tirosin-chinasi che
fosforila il polipeptide maggiore del core
- Il siero dei pazienti contiene sia virioni
(109/ml) sia forme particolate (1013/ml)
che rappresentano forme incomplete del
virus
- Periodo lungo di incubazione dal contagio (4 settimane) > pazienti
asintomatici fino a 180 giorni
- Risoluzione o cronicizzazione dovuta alla persistenza di HBV nel sangue
- Rischio di carcinoma epatocellulare nei portatori cronici
- Gli epatociti infettati contengono sia DNA libero, sia DNA integrato sia
una combinazione dei due
- DNA integrato nei pazienti cronici e carcinoma epatocellulare
HBV E CARCINOMA EPATOCELLULARE
-
Presenza di DNA di HBV integrato è un fattore patogenetico per lo
sviluppo del tumore (90% di pazienti)
-
Meccanismo dell’integrazione ed il suo effetto sull’espressione di
geni pro-tumorali sconosciuto - poca correlazione con attivazione di
oncogeni
-
Anomalie cromosomiche nel sito di integrazione:
1. Integrazione di HBV in sequenze codificanti l’acido retinoico e la
ciclina A > anomalie nella crescita cellulare
2. Integrazione a livello del gene per p53 (cr 17q) con perdita di un
allele
-
Lungo periodo di latenza > accumulo di più eventi mutageni per lo
sviluppo del tumore
-
L’infezione cronica con infiammazione e iperplasia rigenerativa
sono fattori importanti per lo sviluppo del tumore
HTLV-1: GIAPPONE, AFRICA, SUD AMERICA E CARAIBI
HTLV-1 E LEUCEMIA T DELL’ADULTO
(ATL)
Linfociti T CD4+, T helper (solo 1 studio sui Treg)
TAX E NF-κB
TAX AND DNA REPAIR SYSTEMS
TAX activities
VACCINAZIONE PREVENTIVA
Prevenzione della trasformazione neoplastica mediante
vaccini
Batteri
Helycobacter
Pilori
Cancro Stomaco
Linfoma
Virus
HPV
Epatite-B
HIV
Herpes virus 8
EBV
HTLV-1
C. Cervice
C. Epatico
Sarcoma Kaposi
Linfoma nonHodgkin’s
Sarcoma Kaposi
Linfoma B
Leucemia T (ALL)
Schistosomi
C. Vescica
Parassiti



![Lezione 15 Virus [modalità compatibilità]](http://s1.studylibit.com/store/data/000771737_1-84b1cca561c5813066d1b76125338a98-300x300.png)








