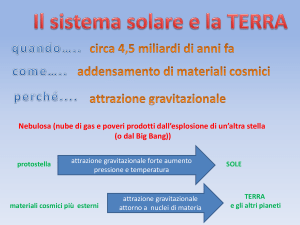
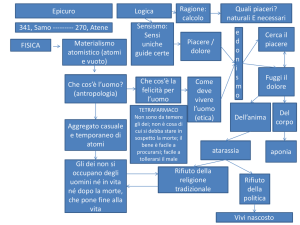
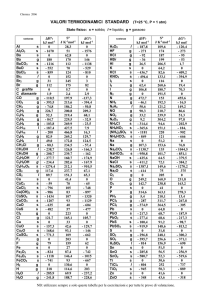
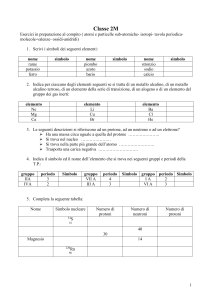
CAPITOLO 0
IL LESSICO DELLA CHIMICA
0.1 (a) Chimica. (b) Chimica. (c) Fisica. (d) Fisica. (e) Chimica.
0.3 La terra è una miscela eterogenea di minerali e materia organica. L’aria è una miscela omogenea costituita,
approssimativamente dai seguenti gas: azoto (78%), ossigeno (21%), argon (1%). Il fuoco è una miscela
eterogenea di gas caldi. L’acqua (H2O) è un composto.
0.5 (a) Mentre la palla sale, l'energia cinetica viene convertita in energia potenziale gravitazionale. Quando la palla
cade, l’energia potenziale gravitazionale è trasformata nuovamente in energia cinetica.
(b) L'energia chimica potenziale delle batterie viene convertita in energia luminosa.
(c) L'energia chimica potenziale del carburante impiegato nel motore dello ski lift è trasferito nella vostra energia
potenziale gravitazionale. Durante la discesa, la vostra energia potenziale gravitazionale viene convertita in
energia cinetica.
(d) L'energia chimica potenziale del fiammifero viene convertita in energia luminosa e calore.
0.7
1,02 × 10-16 J; 3,50 × 105 m s-1.
0.9
(a)
(b)
L’esperimento di Rutherford è descritto in dettaglio nel Paragrafo 0.2 del testo. Dall’entità delle
deflessioni, Rutherford stimò il numero di protoni (sulla base delle interazioni elettrostatiche) nel
nucleo.
Per il nucleo: d = 3,25 × 1014 g cm-3; per lo spazio occupato dagli elettroni: 3,72 × 10-4 g cm-3; sì.
0.11
Il rapporto tra l’atomo di F e l’idrogeno (o il deuterio) è di 1:1 in entrambi i composti. Poichè, però, il
deuterio è due volte più pesante (massivo), la stessa quantità di fluoro reagisce con il doppio della massa di deuterio.
Tutto ciò vìola la legge delle proporzioni definite. Tuttavia, quando la legge delle proporzioni definite fu formulata,
gli scienziati non conoscevano l'esistenza di isotopi.
0.13
54.
0.15
Isotopo
3
2
No. Protoni
No. Neutroni
0.17
(a)
23
11
Na
(b)
64
28
Ni
4
2
He
2
1
24
12
He
2
2
Mg
12
12
25
12
48
22
Mg
79
35
Ti
12
13
22
26
Br
35
44
195
78
Pt
78
117
2+
0.19
Zn .
0.21
Ione
No. protoni
No. elettroni
0.23
C2H5NO2.
+
Na
11
10
2+
Ca
20
18
3+
Al
13
10
2+
Fe
26
24
−
I
53
54
−
F
9
10
2−
S
16
18
2−
O
8
10
3−
N
7
10
Brian B. Laird, Chimica Generale – Copyright © 2010 The McGraw-Hill Companies S.r.l., Publishing Group Italia
2
CAPITOLO 0 - IL LESSICO DELLA CHIMICA
0.25
(a) CN; (b) P2O5; (c) NaSO2; (d) N2O5; (e) BH3; (f) CH2; (g) C3H6O4
0.27
(a) ipoclorito di potassio; (b) carbonato d’argento; (c) acido nitroso; (d) permanganato di potassio; (e) clorato
di cesio; (f) ossido di ferro (II) ; (g) ossido di ferro (III) ; (h) cloruro di titanio (IV); (i) idruro di sodio; (j) nitruro di
litio; (k) ossido di sodio; (l) perossido di sodio.
0.29
(a)
(f)
(k)
RbNO2
KH2PO4
Cu2CO3
(b)
(g)
K2S
IF7
0.31
(a)
(b)
(c)
(d)
(e)
(f)
(g)
(h)
(i)
(j)
(k)
CuCN.
Sr(ClO2)2.
HBrO4(aq).
HI(aq).
Na2(NH4)PO4.
PbCO3.
SnF2.
P4S10.
HgO.
Hg2I2.
SeF6.
0.33
(a)
2N2O5 → 2N2O4 + O2
(c)
(h)
(d)
(i)
Mg3(PO4)2
AgClO4
(e)
(j)
CaHPO4
BCl3
(f)
Be2C + 4H2O → 2Be(OH)2 + CH4
(g)
2C2H5OH + 12O2 → 4CO2 + 6H2O
(h)
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
(d) 2HCl + CaCO3 → CaCl2 + H2O + CO2
(i)
4C3H5N3O9 → 6N2 + 12CO2 + 10H2O + O2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
(j)
2Ca3(PO4)2 + 6SiO2 + 10C → 6CaSiO3 + P4 + 10CO
(b) P4O10 + 6H2O → 4H3PO4
(c)
(e)
0.35
NaHS
(NH4)2SO4
6
2NaHCO3 → Na2CO3 + H2O + CO2
7
Li = 7,5 %; Li = 92,5 %.
0.37
3,07 × 1024.
0.39
(a)
3,331 x 10-22 g
(b)
3,351 x 10-23 g
(c)
1,244 x 10-22 g
(d)
9,746 x 10-23 g
0.41
2,98 × 1022.
0.43
6,69 × 10 .
0.45
3,37 × 1026 atomi di N; 1,69 x 1026 atomi di C; 1,69 x 1026 atomi di O; 6,74 x 1026 atomi di H.
21
CHAPTER 0: THE LANGUAGE OF CHEMISTRY
0.47
Sn = 78,77 %; O = 21,23 %.
0.49
C5H8O4NNa.
0.51
(a) C = 80,56 %; H = 7,51 %; O = 11,93 %.
(b)
3
21
2,11 × 10 .
0.53
39,3 g S.
0.55
0,300 mol H2O.
0.57
2,58 × 10 kg NH3
0.59
HCl; 23,4 g Cl2.
0.61
(a)
(b)
0.63
18,0 g O2.
0.65
Cl2O7.
0.67
(b).
0.69
(a)
(b)
(c)
(d)
4
7,05 g O2.
92,9 %.
Nei composti ionici I prefissi non vanno utilizzati. Il nome corretto è cloruro di bario.
Il ferro ha carica +3 in questo composto. Il nome corretto è ossido di ferro (III).
NO −2 è lo ione nitrito. Il nome corretto è nitrito di cesio.
Il magnesio è un metallo alcalino-terroso che ha quindi sempre carica +2 nei composti ionici. Il nome
corretto è bicarbonato di magnesio.
0.71
Il radio è un elemento radioattivo con un tempo di dimezzamento di 1600 anni. Quindi, tutto il radio presente
quando la terra si è formata ha iniziato allora il suo decadimento e quindi ci si aspetta di non trovare nessun deposito
di solfato di radio. Il radio è un prodotto del decadimento radioattivo dell'uranio, per cui i composti del radio si
trovano nei minerali di uranio.
0.73
18.
0.75
2,4 × 1023.
0.77
35,0 g.
0.79
65,4 u, Zn.
0.81
→ 6CO2 + 6H2O
L’equazione bilanciata è: C6H12O6 + 6O2 ⎯⎯
15
1,7 × 10 g CO2 all’anno.
0.83
1,6 × 104 g mol-1.
4
CAPITOLO 0 - IL LESSICO DELLA CHIMICA
0.85
38,76 % Ca; 19,97 % P; 41,27 % O.
0.87
(a)
0.89
Ci può essere solo un atomo di cloro per molecola, dal momento che due atomi di cloro hanno una massa
35
totale superiore a 70 u. Dal momento che l'isotopo Cl è più abbondante, si sottraggono 35 u dalla massa
corrispondente al picco più intenso.
50 u − 35 u = 15 u
15 u è uguale alla massa di un 12C e tre 1H. Per spiegare i due picchi, abbiamo:
12 1 35
massa molecolare C H3 Cl = 12 u + 3(1 u) + 35 u = 50 u
12 1 37
massa molecolare C H3 Cl = 12 u + 3(1 u) + 37 u = 52 u
35
37
Cl è tre volte più abbondante di Cl per cui, il picco a 50 u sarà tre volte più intenso rispetto al picco a 52
u.
0.91
1:3,5.
0.93
PtCl2; PtCl4.
0.95
Mg3N2. Nitruro di magnesio.
0.97
(a) 0,47 € kg-1. (b) 0,631 kg K2O.
0.99
2.
0.101
70,86 %.
0.103
C5H12O.
0.105
28,97 g mol-1
0.107
3,1 × 1023 molecole mol-1.
0.109
86,49 %.
0.111
4 %.
0.113
(a)
Sì.
(b)
Per una determinata quantità di carbonio, vi è 3 volte la quantità di idrogeno nell’etano rispetto
all’acetilene. Delle formule molecolari ragionevoli potrebbero essere:
C3H7NO. (b) C6H14N2O2.
Etano
CH3
C2H6
Acetilene
CH
C2H2
0.115
Manganese, Mn.
0.117
NaBr = 24,03%; Na2SO4 = 75,97%.
0.119
C2H5Cl.
CHAPTER 0: THE LANGUAGE OF CHEMISTRY
0.121
BaBr2.
0.123
6,15 ml.
5