20/03/2013
I rafts lipidici sono
microdomini ricchi in
sfingolipidi e colesterolo che
si trovano nel foglietto
esterno della membrana
plasmatica.
Rafts
SEMINARIO – TEMI CHE POTREBBERO ESSERE SFRUTTATI X ESAME
Pierce SK. Lipid rafts and B-cell activation. Nat Rev Immunol.
2002
F b 2(2) 96 105
Proteina Chinasi Src (1)
Proteina Chinasi Src (2)
Per attivare le chinasi ci vogliono due input specifici: rimozione del gruppo fosfato nel C‐terminale e legame del dominio SH3 ad una proteina specifica:
La proteina Src fu la prima tirosina chinasi ad essere scoperta; ora si sa che appartiene ad una sottofamiglia di nove proteine chinasi molto simili, che si trovano solo negli animali multicellulari.
La proteina Src e i suoi omologhi contengono una corta regione N‐terminale che si lega covalentemente ad un acido grasso fortemente idrofobico, che trattiene la chinasi nella faccia citoplasmatica della membrana plasmatica. Dopo ci sono due moduli di legame a peptidi, detti un dominio Src di omologia 3 (“Src homology 3”; SH3) e un dominio SH2, seguiti da un dominio catalitico ad attività chinasica.
Queste chinasi normalmente esistono in una conformazione inattiva, nella quale una tirosina fosforilata vicino al C‐terminale è legata al dominio SH2, e il dominio SH3 è legato ad un peptide interno in un modo che distroce il sito attivo dell’enzima ed aiuta a renderlo inattivo.
http://www.ncbi.nlm.nih.gov/books/bv.fcgi?highlight=src,kinase&rid=mboc4.section.452#507
Proteina Chinasi Src (3)
L’attivazione della SRC chinasi segnala che un determinato insieme di eventi a monte è stato completato.
Perciò la famiglia Src funge da integratore di segnali specifici. Che aiuta a generare una complessa tete di eventi di informazione e processamento che permettono alla cellula di calcolare le risposte logiche ad un complesso insieme di eventi. Src-family kinases are associated with
antigen receptors and phosphorylate the
tyrosines in ITAMs
The membrane-bound Src-family kinases Fyn,
Blk, and Lyn associate with the B-cell antigen
receptor by binding to ITAM motifs, either
through their amino-terminal domains or, as
shown in the figure, by binding a single
phosphorylated tyrosine through their SH2
domains. After ligand binding and receptor
clustering, they phosphorylate tyrosines in the
ITAMs on the cytoplasmic tails of Igα and Igβ.
http://www.ncbi.nlm.nih.gov/books/NBK27130/figure/A692/?report=objectonly
1
20/03/2013
Regulation of Src‐family kinase activity
Src-family kinases contain two tyrosine residues
(red bars) that are targets for phosphorylation.
Phosphorylation of the tyrosine in the kinase
domain (bottom left panel) stimulates kinase
activity, and this tyrosine is a target for
phosphorylation by receptor-associated tyrosine
kinases. The second tyrosine lies near the carboxy
terminus and has a regulatory function. When it
has been phosphorylated, the kinase is inactive as
a result of an interaction between the inhibitory
phosphotyrosine and the SH2 domain, as shown in
the lower right panel.
Lipid rafts
INVASIONE GERMI & TOSSINE
http://www.ncbi.nlm.nih.gov/books/NBK27130/figure/A693/?report=objectonly
The fluid mosaic model of the plasma membrane has evolved considerably since its original formulation
30 years ago. Membrane lipids do not form a homogeneous phase consisting of glycerophospholipids
(GPLs) and cholesterol, but a mosaic of domains with unique biochemical compositions. Among these
domains, those containing sphingolipids and cholesterol, referred to as membrane or lipid rafts, have
received much attention in the past few years. Lipid rafts have unique physicochemical properties that
direct their organisation into liquid-ordered phases floating in a liquid-crystalline ocean of GPLs. These
domains are resistant to detergent solubilisation at 4 degrees C and are destabilised by cholesterol- and
sphingolipid-depleting agents. Lipid rafts have been morphologically characterised as small membrane
patches that are tens of nanometres in diameter. Cellular and/or exogenous proteins that interact with
lipid rafts can use them as transport shuttles on the cell surface. Thus, rafts act as molecular sorting
machines capable of co-ordinating the spatiotemporal organisation of signal transduction pathways
within selected areas ('signalosomes') of the plasma membrane. In addition, rafts serve as a portal of
entry for various pathogens and toxins, such as human immunodeficiency virus 1 (HIV-1). In the case of
HIV-1, raft microdomains mediate the lateral assemblies and the conformational changes required for
fusion of HIV-1 with the host cell. Lipid rafts are also preferential sites of formation for pathological forms
of the prion protein (PrPSc) and of the [beta]-amyloid peptide associated with Alzheimer's disease. The
possibility of modulating raft homeostasis, using statins and synthetic sphingolipid analogues, offers
new approaches for therapeutic interventions in raft-associated diseases.
2002
Fantini J. Interaction of proteins with lipid rafts through glycolipid‐binding
domains: biochemical background and potential therapeutic applications.
Curr Med Chem. 2007;14(27):2911‐7.
La grande diversità biochimica dei glicolipidi nelle membrane spiega perchè queste molecule sono spesso selezionate da patogeni (virus, batteri, protein prioniche) come siti primari di interazioni con la superficie cellulare.
Inoltre, i glicolipidi si concentrano in microdomini ricchi in colesterolo/glicolipidi dove essi possono raggiungere elevate concentrazioni locali consistenti con il legame mulitivalente dei patogeni alla superficie cellulare. Infine, è stato dimostrato che i glicolipidi sono in grado di modulare la conformazione delle proteine.
Questa attività tipo chaperonina dei glicolipidi è stata associata a diversi processi patogenici che includono l’infezione da HIV, la propagazione della proteina prionica, e l’aggregazione amiloide nelle malattie di Alzheimer e Creutzfeldt‐Jakob.
2
20/03/2013
I rafts come portali d’ingresso per patogeni
Un’ampia gamma di germi patogeni (es. Virus, parassiti, batteri e loro tossine) usano i rafts lipidici come strategia di infezione per penetrare nelle cellule ospite, utilizzando sia proteine di superficie legate an ancora GPI che lipidi tipici dei rafts (GSL, sfingomielina, colesterolo).
Rafts lipidici
TOSSINE BATTERICHE
Interazione tossine del tetano e del bottulino
con i neuroni (1)
•
•
Affinità delle tossine per i recettori di‐ e tri‐sialogangliosidi è sorprendentemente bassa se si pensa che la tossina è estremamente tossica a concentrazioni dell’ordine del picomolare.
Modello del doppio recettore (Montecucco):
– L tossina si lega alla superficie carica negativamente delle membrane pre‐sinaptiche mediante interazioni a bassa affinità con un elevata concentrazione di recettori gangliosidici
– In seguito diffonde lateralmente per legarsi ad un ipotetico recettore proteico, probabilmente una proteina a 58 kDa (sinaptosomi di cervello di ratto) che lega quelle tossine solo in presenza di GT1b e GD1a.
– L’affinità finale è il prodotto delle due costanti di legame..
• Un’ulteriore ipotesi è che il legame a bassa affinità della tossina con i recettori gangliosidici induca nella tossina un cambiamente di conformazione che aumenta l’affinità verso il recettore proteico.
Tossina del colera: lega ganglioside GM1
Tossina Shiga: lega glicolipide neutro Gn3
Micobatteri: legano il colesterolo
Ceppi di Escherichia coli che esprimono l’adesina FimH: si legano alla proteina CD48, GPI‐anchored.
Tossine del tetano e del botulino: si legano a diversi di‐ e tri‐
sialogangliosidi (sopratutto GD1a, GD1b e GT1b) sulla superficie delle membrane pre‐sinaptiche.
Particolarità dei rafts particolarmente utili ai patogeni e loro tossina (invasori) 1. L’ambiente del raft fornisce un’elevata concentrazione di recettori a bassa affinità che stabilizzano l’invasore sulla superficie cellulare.
2. Il raft può consegnare l’invasore ad adeguati recettori ad alta affinità.
3. Dei lipidi specifici dell’ambiente del raft possono fungere da «chaperones» inducendo alterazioni conformazionali sulla struttura dell’invasore nella vicinanza di recettori ad alta affinità.
Questo modello è sorprendentemente consistente con la reazione di fusione che ha luogo durante l’infezione provocata dal virus dell’immunodeficienza umano 1 (HIV‐1)
3
20/03/2013
Rafts lipidici
INFEZIONE DA HIV‐1
http://en.wikipedia.org/wiki/HIV
•
HIV is different in structure from other retroviruses. It is roughly spherical[12] with a diameter of about 120 nm, around 60 times smaller than a red blood cell, yet large for a virus.[13] It is composed of two copies of positive single‐stranded RNA that codes for the virus's nine genes enclosed by a conical capsid composed of 2,000 copies of the viral protein p24.[14] The single‐stranded RNA is tightly bound to nucleocapsid proteins, p7, and enzymes needed for the development of the virion such as reverse transcriptase, proteases, ribonuclease and integrase. A matrix composed of the viral protein p17 surrounds the capsid ensuring the integrity of the virion particle.[
•
This is, in turn, surrounded by the viral envelope that is composed of two layers of fatty molecules called phospholipids taken from the membrane of a human cell when a newly formed virus particle buds from the cell. Embedded in the viral envelope are proteins from the host cell and about 70 copies of a complex HIV protein that protrudes through the surface of the virus particle.[14] This protein, known as Env, consists of a cap made of three molecules called glycoprotein (gp) 120, and a stem consisting of three gp41 molecules that anchor the structure into the viral envelope.[15] This glycoprotein complex enables the virus to attach to and fuse with target cells to initiate the infectious cycle.[15] Both these surface proteins, especially gp120, have been considered as targets of future treatments or vaccines against HIV
Legame e fusione dell’HIV
The first step in fusion involves the high‐affinity attachment of the CD4 binding domains of gp120 to CD4. Once gp120
is bound with the CD4 protein, the envelope complex undergoes a structural change, exposing the chemokine binding
domains of gp120 and allowing them to interact with the target chemokine receptor.[37][38] This allows for a more stable
two‐pronged attachment, which allows the N‐
terminal fusion peptide gp41 to penetrate the cell membrane.[37][38]
Repeat sequences in gp41, HR1, and HR2 then interact, causing the collapse of the extracellular portion of gp41 into a
hairpin. This loop structure brings the virus and cell membranes close together, allowing fusion of the membranes and
subsequent entry of the viral capsid.[
L’HIV‐1 è un virus ad involucro che si fonde con la membrane plasmatica per consegnare il suo RNA genomico alle cellule ospite.
La fusione dell’HIV‐1 con linfociti T CD4+ (linfociti T helper) è un processo altamente controllato, totalmente automatico e irreversibile.
Per questo evento cruciale, il virus ha il suo proprio “arpione”, che è dato dalla parte N‐terminale idrofobica della gp41, una glicoproteina transmembrana dell’involucro virale, che è nota come “peptide di fusione”.
A causa della sua idrofobicità, il peptide di fusione è inizialmente sepolto in una tasca della glicoproteine gp120 della superficie dell’involucro virale in modo da essere protteto dall’ambiente acquoso.
In seguito ad un riarrangiamento strutturale dell’involucro virale, il peptide di fusione viene improvvisamente espulso fuori dagli “spikes” virali dove deve affrontare un ambiente acquoso altamente polare.
Per minimizzare la sua energia, il peptide di fusione penetra nella membrana plasmatica della cellula bersaglio dove trova condizioni idrofobiche che lo stabilizzano. «viral mouse trap model»
(Fantini et al., 2002)
4
20/03/2013
I rafts lipidici giocano un ruolo findamentale nella fusione dell’HIV (1)
L’assemblaggio del machinario di fusion dell’HIV‐1, che funziona essenzialmente per smascherare il peptide di fusione, richiede un recettore ad alta affinità (CD4), GSLs leganti la gp120 a bassa affinità (il ganglioside GM3 e il globotriaosilceramide neutro Gb3) e un cofattore di fusione, detto HIV‐1 co‐recettore.
I HIV‐1 co‐recettori identificati includono recettori per le chemochine (sopratutto CXCR4, CCR5, CCR3 e CCR2b) e una serie di recettori orfani, che appartengono tutti alla famiglia di recettori accoppiati a proteine G con sette domini transmembrana.
Il legame della gp120 (virale) ai GSLs (dell’ospite) è mediato da un dominio legato da ponti S‐S, detto il loop V3, che corresponde al principale dominio di neutralizzazione della gp120 ed è chiaramente distinto dalla regione di legame al CD4.
Fantini et al., 2002
I rafts lipidici giocano un ruolo findamentale nella fusione dell’HIV (2)
Nel primo passo della fusione dell’HIV‐1 con le cellule T CD4+ si forma un complesso trimolecolare fra la gp120, il CD40 e i GSLs in aree di rafts della membrana plasmatica .
I GSLs mediano diversi ruoli in questo processo:
1.
Stabilizzano il virus sulla superficie cellulare
2.
Facilitano la migrazione dei complessi CD4‐gp120 fino ad un co‐
recettore appropriato, così mediando gli assemblaggi laterali richiesti per il machinario di fusione dell’HIV‐1.
3.
Collaborano alle modificazioni conformazionali della gp120 che portano alla fine al rilascio del peptide di fusione fuori dagli “virus spike” Fantini et al., 2002
I rafts lipidici giocano un ruolo findamentale nella fusione dell’HIV (3)
La stabilizzazione del virus sulla piattaforma che si muove risulta da molteplici interazioni a bassa affinità fra il dominio V3 della gp120 e la porzione di carboidrati del GM3 e/o Gb3.
Il raft potrebbe allora galleggiare sulla superficie cellulare finchè non trova un co‐recettore adeguato, la cui scelta è guidata da un processo di selezione molecolare basata su interazioni V3 – co‐
recettore.
Interazione tra i rafts lipidici e la pp120 dell’HIV‐1
5
20/03/2013
Rafts lipidici
PROPAGAZIONE PRIONICA
Marco Falchetto, Dottorato 2013
Βeta‐eliche
Struttura proteica formata dall’associazione di foglietti beta paralleli in un pattern elicoidale con sia due che tre facce.
E’ un tipo di dominio proteico solenoidale.
La struttura è stabilizzata da legami di idrogeno intra‐catenari, da interazioni proteina‐proteina e talvolta da ioni metallici legati.
Sono state identificate beta‐eliche sia destrorse che sinistrorse.
http://en.wikipedia.org/wiki/Beta_helix
6
20/03/2013
Prions, familiar from their role in mad cow disease, can take on two rather different conformations. The prion on the right, in a helical conformation, dissolves easily in water and is relatively benign. The prion on the left, in a beta‐sheet conformation, tends to stick to other similar prions and forms plaques. These plaques disrupt the structure of healthy tissue, resulting in the "spongy" texture found in the brains of infected animals. http://www.learner.org/courses/physics/visual/visual.html?shortname=protein_folding
7
20/03/2013
Fantini et al., 2002
Rafts lipidici
MALATTIA DI ALZHEIMER
8
20/03/2013
9
20/03/2013
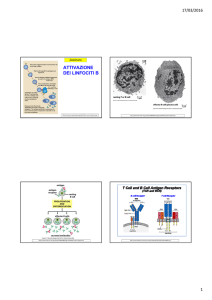
Lipid rafts
ATTIVAZIONE DEI LINFOCITI B
http://www.mcld.co.uk/hiv/?q=B%20cells
Struttura dei recettori per l’antigene
e vie di segnalazione
I recettori per l’antigene sulle cellule B (B‐cell receptor, BCR) e T (T‐cell receptor, TCR) sono complessi multiproteici fatti da catene di legame con l’antigene variabili clonalmente che sono associate con proteine accessorie invarianti. Catene immunoglobuliniche pesante e leggera nel BCR
Catene TCRα e TCRβ nel TCR chains in the T‐cell receptor. Le catene invarianti sono necessarie sia per il trasporto dei recettori fino alla superficie cellulare che, in modo più importante, per iniziare il processo di segnalamento quando i recettori si legano ad un ligando extracellulare. Il legame di un antigene con un recettore genera segnali che portano come conseguenza finale l’attivazione di fattori di trascrizone nucleari che accendono una nuova espressione genica e spengono geni tipicamente espressi nelle cellule non attivate. http://www.ncbi.nlm.nih.gov/books/NBK27130/
10
20/03/2013
Attivazione dei linfociti B (1)
http://commons.wikimedia.org/wiki/File:B_cell_activation.png
http://www.ncbi.nlm.nih.gov/books/NBK27130/figure/A689/?report=objectonly
Attivazione dei linfociti B (2)
In seguito alla maturazione nel midollo osseo e milza, le cellule immunocompetenti B rimangono nei tessuti periferici finchè non incontrano un antigene e vengono attivate.
L’attivazione delle cellule B richiede due segnali distinti e dà origine al differenziamento delle cellule B in “cellule B della memoria” o in plasmacellule. Il primo segnale di attivazione ha luogo dopo legame dell’antigene a “B cell receptors”, (BCRs). Dopo legame con il BCR l’antigene viene internalizzato mediante endocitosi mediata da recettore, digerito, e complessato con molecole di MHC II sulla superficie delle cellule B. http://www.rndsystems.com/molecule_group.aspx?r=1&g=3175
Attivazione dei linfociti B (4)
Una volta attivate, le cellule B proliferano e formano centri germinali dove si differenziano in cellule B della memoria o in plasmacellule. In seguito al differenziamento in plasmacellule, segnali addizionali iniziano la comutazione della classe di anticorpi della plasmacellule e regolano la secrezione degli anticorpi. La funzione principale delle plasmacellule è la secrezione di anticorpi specifici per il clone di cellule B. Ogni plasma cellula secerne anticorpi contenenti una regione di legame con l’anticorpo unica clonalmente riunita ad una regione costante definente l’isotipo di immunoglobulina (Ig).
Attivazione dei linfociti B (3)
Il secondo segnale di attivazione ha luogo sia mediante meccanismi timo‐
dipendenti o indipendenti. La maggior parte delle risposte delle cellule B all’antigene richiedono l’interazione delle cellule B con cellule “T helper” (attivazione timo‐
dipendente). La presentazione di una complesso antigene‐class II MHC da una cellula B le permette di agire come cellule presentatrice di antigene (APC) alle cellule T. I “T cell receptors”, TCR) sulle cellule “T helper” si legano alla molecola MHC di classe II complessata all’antigene sulla superficie della cellula B provocando l’attivazione della cellula T. La cellula T attivata a sua volta fornisce un secondo segnale alla cellula B, che può avere luogo mediante una gran varietà di proteine. Viceversa, ci sono alcuni tipi di antigeni che possono fornire direttamente un secondo segnale di attivazione per le cellule B (attivazione timo‐indipendente). Questi antigeni includono componenti di della parete cellulare di alcuni batteri (ad es. lipopolisaccaride) o antigeni contenenti molecole altamente ripetute (ad es. flagellina batterica).
Attivazione dei linfociti B (5)
Delle chinasi della famiglia Src sono associate ai recettori per l’antigene e fosforilano le tirosine negli ITAMs
Le chinasi della famiglia Src legate alla membrana Fyn, Blk, e Lyn si associano con il “B‐cell antigen receptor” mediante legame ai motivi ITAMs, sia mediante i loro N‐terminali o, come illustrato, mediante legame a tirosine fosforilate singole tramite i loro domini SH2. Dopo legame con il ligando e aggregazione dei recettori, essi fosforilano le tirosine negli ITAMs delle catene citoplasmatiche di Igα e Igβ.
http://www.ncbi.nlm.nih.gov/books/NBK27130/figure/A692/?report=objectonly
11
20/03/2013
The function of the BCR in B‐cell activation
Following antigen binding (a), the B‐cell receptor (BCR) triggers a signal‐transduction cascade (b), which leads to the transcriptional activation of genes associated with B‐cell activation. The BCR is internalized (c) and either degraded (d) or trafficked to an intracellular compartment termed the MIIC (e), where newly synthesized major histocompatibility complex class II (MHC) molecules and peptides derived from the antigen bound to the BCR are formed into complexes. The antigen‐processing and BCR‐degradation pathway might not be identical and are shown here to occur in two different endosomal compartments. The peptide–MHC complexes are subsequently transported to the cell surface, where they are recognized by the T‐cell receptor (TCR) of T‐helper cells (f), leading to T‐cell activation (g). The activated T cell provides 'help' to the B cell, leading to full B‐cell activation (h) through both secreted cytokines and cell–cell interactions mediated by receptor pairs such as CD40–CD154. Ig, immunoglobulin. Pierce SK. Lipid rafts and B‐cell activation. Nat Rev Immunol. 2002 Feb;2(2):96‐105. Nat Rev Immunol. 2002 Feb;2(2):96‐105. Lipid rafts and B‐cell activation. Pierce SK. Pierce SK. Lipid rafts and B‐cell activation. Nat Rev Immunol. 2002 Feb;2(2):96‐105. Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31‐9. Attivazione dei linfociti B (2)
In seguito alla maturazione nel midollo osseo e milza, le cellule immunocompetenti B
rimangono nei tessuti periferici finchè non incontrano un antigene e vengono attivate.
L’attivazione delle cellule B richiede due segnali distinti e dà origine al differenziamento delle cellule B in “cellule B della memoria” o in plasmacellule. Il primo segnale di attivazione ha luogo dopo legame dell’antigene a “B cell receptors”, (BCRs). Dopo legame con il BCR l’antigene viene internalizzato mediante endocitosi mediata da recettore, digerito, e complessato con molecole di MHC II sulla superficie delle cellule B. Il secondo segnale di attivazione ha luogo sia mediante meccanismi timo‐dipendenti o indipendenti. La maggior parte delle risposte delle cellule B all’antigene richiedono l’interazione delle cellule B con cellule “T helper” (attivazione timo‐dipendente). La presentazione di una complesso antigene‐class II MHC da una cellula B le permette di agire come cellule presentatrice di antigene (APC) alle cellule T. I “T cell receptors”, TCR) sulle cellule “T helper” si legano alla molecola MHC di classe II complessata all’antigene sulla superficie della cellula B provocando l’attivazione della cellula T. La cellula T attivata a sua volta fornisce un secondo segnale alla cellula B, che può avere luogo mediante una gran varietà di proteine. Viceversa, ci sono alcuni tipi di antigeni che possono fornire direttamente un secondo segnale di attivazione per le cellule B (attivazione timo‐indipendente). Questi antigeni includono componenti di della parete cellulare di alcuni batteri (ad es. lipopolisaccaride) o antigeni contenenti molecole altamente ripetute (ad es. flagellina batterica).
ATTIVAZIONE LINFOCITI T
http://www.rndsystems.com/molecule_group.aspx?r=1&g=3175
12
20/03/2013
Clustering of the T‐cell receptor and a co‐receptor initiates signaling within the T cell
When T‐cell receptors become clustered on binding MHC:peptide complexes on the surface of an antigen‐presenting cell, activation of receptor‐associated kinases such as Fyn leads to phosphorylation of the CD3γ, δ, and ε ITAMs as well as those on the ζ chain. The tyrosine kinase ZAP‐70 binds to the phosphorylated ITAMs of the ζ chain, but is not activated until binding of the co‐receptor to the MHC molecule on the antigen‐presenting cell (here shown as CD4 binding to an MHC class II molecule) brings the kinase Lck into the complex. Lck then phosphorylates and activates ZAP‐70.
http://www.ncbi.nlm.nih.gov/books/NBK27130/figure/A695/?report=objectonly
T‐cell receptor, TCR
Signalling in rafts
mediato da T‐cell antigen receptor (TCR)
http://www.ncbi.nlm.nih.gov/books/NBK27130/figure/A690/?report=objectonly
Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31‐9. Segnalamento mediato dal recettore per l’antigene dei linfociti T (1)
Segnalamento mediato dal recettore per l’antigene dei linfociti T (2)
Anche il «T‐cell antigen receptor» (TCR) è un recettore multisubunità per la risposta immune che si inserisce nei rafts lipidici durante il processo di segnalamento.
IL TCR è composto da eterodimeri αβ che si associano con il complesso CD3 (γδε) e con l’omodimero ζ.
Mentre le subunità α e β contengono i siti extracellulari di legame per peptidi che sono presentati dal complesso di proteine di classe I e II del complesso di maggiore istocompatibilità «MAJOR HISTOCOMPATIBILITY COMPLEX» (MHC) sulla superficie di cellule presentatrici di antigene
(“ANTIGENPRESENTING CELLS2, APCs), le subunità CD3 e ζcontengono motivi citoplasmatici ITAMs. Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31‐9. • L’evento di segnalamento più precoce dopo il collegamento con il TCR è la fosforilazione dei residui di tirosina dei motivi ITAM da tirosina chinasi Src‐like doppiamente acilate (non recettrici), Lyn e Fyn.
• Quando ZAP‐70 si lega agli ITAMs fosforilati viene attivata e asua volta fosforila LAT, una proteina transmembrana che accoppia l’attivazione mediata dal TCR a diverse altre vie di segnalamento.
• Diverse proteine GPI‐linked e molecole acessorie aiutano ad amplificare gli eventi di attivazione delle cellule T.
• Le fosfatasi sono anche esse richieste per accendere o spegnere quelle vie.
Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31‐9. 13
20/03/2013
Segnalamento mediato dal recettore per l’antigene dei linfociti T (3)
• Una serie complessa di eventi che coinvolgono il citoscheletro di actina porta alla formazione della sinapsi immunologica – zona di contatto fra cellule APC e le cellule T –dove ha luogo l’attivazione delle cellule T.
• Durante la formazione della sinapsi immunologica, la cellula T polarizza le reti di actina e dei microtubuli verso il sito di contatto e inoltre dirigge il traffico di membrane in quella direzione.
T‐cell antigen receptor signaling (1)
http://en.wikipedia.org/wiki/Lipid_raft
T‐cell antigen receptor signaling (1)
Il T cell antigen receptor (TCR) è una molecola che si trova sulla superficie dei linfociti T (T cells).
E’ composto da eterodimeti αβ, complesso CD3 (γδε) e omodimero ξ.
Le subunità α‐ e β contengono siti di legame extracellulare per peptidi che sono presentati dalla maggior parte delle proteine dei complessi di maggiore istocompatibilità (MHC) di classe I e classe II sulla superficie di cellule che presentano l’antigene (antigen presenting cells (APCs)).
Le subunità CD3 e ξ‐ contengono motivi citoplasmatici ITAm.
Durante i processi di segnalamento, il legame delle MHCs ai TCRs avvicina due o più recettori.
Questo legame incrociato, somigliante al segnalamento da IgE, allora recluta “doubly acylated non‐receptor Src‐like tyrosine kinases”a fosforilare i residui di tirosina delle ITAMs. Oltre a reclutare Lyn, il segnalamento indotto da TCR recluta anche Fyn.
T‐cell antigen receptor signaling (2)
Successivamente, ZAP‐70 (che è pure diversa nel caso da segnalamento mediato da IgE) si lega a ITMS fosforilati, il che porta alla sua stessa fosforilazone e all’attivazione di LAT.
L’attivazione di LAT è la sorgente dell’amplificazione del segnale.
Un’altra differenza fra il segnalamento modulato da IgE e del TCR è che l’attivazione di Lck svolta dal TCR potrebbe dare origine ad un’aggregazione più stretta e quindi ad una maggiore amplificazione del segnale.
Per sotto‐regolare il segnale, una possibile via è il legame della Csk citosolica alla proteina associata ai raft CBK.
La Csk può allora sopprimere gli effetti indotti dalle chinasi della famiglia Src mediante fosforilazione.
14
20/03/2013
Probabili eventi di segnalazione iniziali per un recettore per le IgE (FcεRI) e per il “T‐cell antigen receptor” (TCR)
1.
2.
3.
4.
5.
6.
La dimerizzazione del Fc receptor o di TCR/CD3 indotta dal ligando
probabilmente aumenta la loro associazione ai rafts; Ciò porta alla fosforilazione dei motivi “immune receptor tyrosine‐based activation motifs” (ITAMs) del recettore da parte della famiglia Src delle proteina tirosina chinasi (es. Lyn, Lck e Fyn).
Gli ITAMs fosforilati fungono da punti di ancoraggio sulla membrana per la Syk/ZAP‐70 citoplasmatica; anche queste sono tirosina chinasi e sono attivate nel raft mediante fosforilazione delle tirosine.
La Syk/ZAP‐70 può, a sua volta, attivare alter proteine quali LAT, un adattatore associato ai rafts. Mediante crosslinking, la LAT può reclutare altre proteine verso il rafts e amplificare ulteriormente il segnale. La complessa cascata di eventi ulteriori di segnalamento a valle non è nota.
Un possibile modo di sottoregolare il segnale può avere luogo mediante legame di Csk citosolica alla proteina assciata ai raft CBP.
La csk può allora inattivare le chinasi della famiglia Src mediante fosforilazione.
Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31‐9. Kabouridisa & Jury, 2008
A model that correlates changes in the plasma membrane with TCR stimulation. In non‐stimulated T‐cells, the TCR is in monomeric form and its interaction with lipid rafts is transitory and unable to initiate signalling. Upon antigenic challenge, the reorganization of actin cytoskeleton results in formation of TCR microclusters
and reduces the mobility of lipid rafts thus creating an environment conducive to long‐lasting interactions. Concomitantly, the activity of Lck in lipid rafts increases owing to the action of a pool of CD45 molecules that moves to close proximity. These changes favour phosphorylation of ITAMs and initiation of signalling. Alonso & Milan,
2001
The role of signals 1 and 2 in T‐cell activation. ‘Professional’ APCs, such as dendritic cells, provide more‐effective costimulation (signal 2) and, therefore, efficently activate T cells. By contrast, even though ‘non‐professional’ APCs, such as B cells or activated endothelial cells, can provide signal 1, they are less efficient at providing signal 2 and are more likely to induce anergy. Abbreviations used: APC, antigen‐presenting cell; MHC, major histocompatibility complex; TCR, T‐cell receptor 15
20/03/2013
Probabili eventi di segnalazione iniziali per un recettore per le IgE (FcεRI) e per il “T‐cell antigen receptor” (TCR)
1.
2.
3.
4.
5.
6.
La dimerizzazione del Fc receptor o di TCR/CD3 indotta dal ligando
probabilmente aumenta la loro associazione ai rafts; Ciò porta alla fosforilazione dei motivi “immune receptor tyrosine‐based activation motifs” (ITAMs) del recettore da parte della famiglia Src delle proteina tirosina chinasi (es. Lyn, Lck e Fyn).
Gli ITAMs fosforilati fungono da punti di ancoraggio sulla membrana per la Syk/ZAP‐70 citoplasmatica; anche queste sono tirosina chinasi e sono attivate nel raft mediante fosforilazione delle tirosine.
La Syk/ZAP‐70 può, a sua volta, attivare alter proteine quali LAT, un adattatore associato ai rafts. Mediante crosslinking, la LAT può reclutare altre proteine verso il rafts e amplificare ulteriormente il segnale. La complessa cascata di eventi ulteriori di segnalamento a valle non è nota.
Un possibile modo di sottoregolare il segnale può avere luogo mediante legame di Csk citosolica alla proteina assciata ai raft CBP.
La csk può allora inattivare le chinasi della famiglia Src mediante fosforilazione.
Modelli su come il s egnalamento potrebbe iniziare nei rafts
Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31‐9. Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31‐9. SIGNALLING MEDIATO DA IMMUNOGLOBULINA E NELLA RISPOSTA IMMUNE ALLERGICA Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31‐9. http://www.zuniv.net/physiology/book/chapter32.html
Signalamento indotto dalle IgE
Viene attivato quando una IgE si lega, mediante il suo segmento Fc a recettori (FcεRI) che resiedono nella membrana plasmatica di mast cells e basofili.
Il crosslinking del FcεRI da antigeni oligomerici attiva il processo di segnalamento transmembrana, portando come risultato finale al rilascio dei mediatori chimici delle reazioni allergiche.
Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31‐9. 16
20/03/2013
Signaling da IgE (1) – Mast cells, basofili
Signaling da IgE (2)
La IgE prima si lega, mediante il segmento Fc, a recettori Fc‐epsilon (FcεR) che risiedono nella membrana plasmatica di mast cells e basofili.
Il FcεR è un tetramero che consiste di una catena α, una β e due γ. E’ monomerico e si lega ad una molecola di IgE.
La catena α si lega a IgE e le altre tre catene contengono motivi di attivazione “immune receptor tyrosine‐based activation motifs (ITAMs).
Antigeni oligomerici si legano alla IgE legata al recettore per formare legami incrociati tra due o più recettori.
I legami incrociati a loro volta reclutano la “doubly acylated non‐receptor Src‐like tyrosine kinase Lyn” per fosforilare gli ITAMs.
A questo punto, componenti della famiglia Syk di tirosina chinasi si legano a questi residui fosforilati degli ITAMs per iniziare le cascate di fosforilazione.
Il Syk can, a sua volta, attivare altre proteine come la “linker for activation of T cells” (LAT).
Mediante legami incrociati, la LAT può reclutare altre proteine verso il raft e ampliare ulteriormente il segnale.
Modelli su come il s egnalamento potrebbe iniziare nei rafts
http://en.wikipedia.org/wiki/Lipid_raft
Simons K, Toomre D. Lipid rafts and signal transduction. Nat Rev Mol Cell Biol. 2000 Oct;1(1):31‐9. http://www.nature.com/ni/journal/v7/n12/fig_tab/ni1206‐1286_F1.html
GSL‐Enriched Membrane Microdomains
in Innate Immune Responses
Many pathogens target glycosphingolipids (GSLs), which, together with cholesterol, GPI‐anchored proteins, and various signaling molecules, cluster on host cell membranes to form GSL‐enriched membrane microdomains (lipid rafts). These GSL‐enriched membrane microdomains may therefore be involved in host–pathogen interactions. Innate immune responses are triggered by the association of pathogens with phagocytes, such as neutrophils, macrophages and dendritic cells. Phagocytes express a diverse array of pattern‐recognition receptors (PRRs), which sense invading microorganisms and trigger pathogen‐ specific signaling. PRRs can recognize highly conserved pathogen‐associated molecular patterns expressed on microorganisms.
The GSL lactosylceramide (LacCer, CDw17), which binds to various microorganisms, including Candida albicans, is expressed predominantly on the plasma membranes of human mature neutrophils and forms membrane microdomains together with the Src family tyrosine kinase Lyn. These LacCer‐enriched membrane microdomains can mediate superoxide generation, migration, and phagocytosis, indicating that LacCer functions as a PRR in innate immunity.
Moreover, the interactions of GSL‐enriched membrane microdomains with membrane proteins, such as growth factor receptors, are important in mediating the physiological properties of these proteins. Similarly, we recently found that interactions between LacCer‐enriched membrane microdomains and CD11b/CD18 (Mac‐1, CR3, or aMb2‐integrin) are significant for neutrophil phagocytosis of non‐opsonized microorganisms. This review describes the functional role of LacCer‐enriched membrane microdomains and their interactions with CD11b/CD18. Nakayama H, Ogawa H, Takamori K, Iwabuchi K. Arch Immunol Ther Exp (Warsz). 2013 Feb 28. 17
20/03/2013
LacCer‐enriched membrane microdomains mediate CD11b/ CD18‐dependent neutrophil phagocytosis. Upon binding to CD11b/ CD18 of PAMPs expressed on pathogens, such as b‐glucan (a), CD11b/CD18 is activated and undergoes a conformational change, resulting in the rearrangement of cytoskeletal proteins, such as talin and a‐actinin (b). The CD11b/CD18 subsequently translocates into LacCer‐enriched membrane microdomains, allowing CD11b/CD18 to transmit stimulatory signals to Lyn through the interaction of LacCer with residues 514–553 in the C‐
terminal portion of the conserved domain of CD18, although it is unclear whether this interaction is direct or indirect (c). ‘‘?’’ indicates an adaptor molecule. These signaling cascades lead to the formation of actin‐enriched phagocytic cups, Rafts lipidici e formazione di una sinapsi immunologica
resulting in phagosome formation (d)
Nakayama H, Ogawa H, Takamori K, Iwabuchi K. GSL‐Enriched Membrane Microdomains in Innate Immune Responses. Arch Immunol Ther Exp (Warsz). 2013 Feb 28. Dykstra M, Cherukuri A, Sohn HW, Tzeng SJ, Pierce SK. Location is everything: lipid rafts and immune cell signaling. Annu Rev
Immunol. 2003;21:457‐81. 18