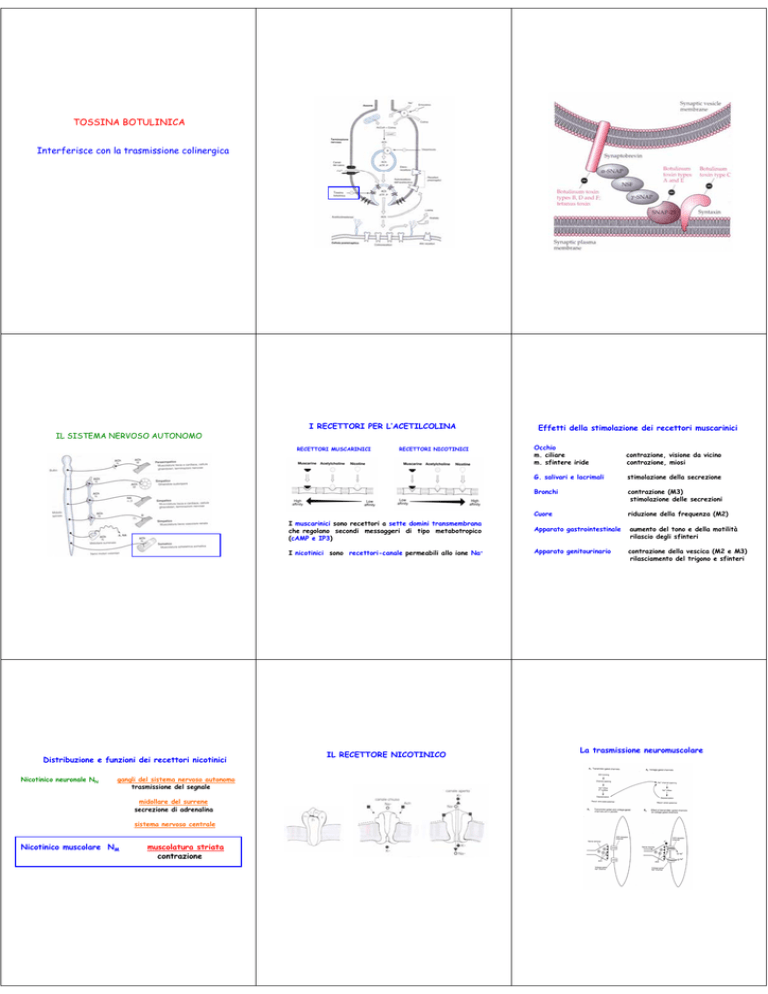
TOSSINA BOTULINICA
Interferisce con la trasmissione colinergica
I RECETTORI PER L’ACETILCOLINA
IL SISTEMA NERVOSO AUTONOMO
RECETTORI MUSCARINICI
Distribuzione e funzioni dei recettori nicotinici
Nicotinico neuronale NN
gangli del sistema nervoso autonomo
trasmissione del segnale
midollare del surrene
secrezione di adrenalina
sistema nervoso centrale
Nicotinico muscolare NM
muscolatura striata
contrazione
RECETTORI NICOTINICI
Effetti della stimolazione dei recettori muscarinici
Occhio
m. ciliare
m. sfintere iride
contrazione, visione da vicino
contrazione, miosi
G. salivari e lacrimali
stimolazione della secrezione
Bronchi
contrazione (M3)
stimolazione delle secrezioni
Cuore
riduzione della frequenza (M2)
I muscarinici sono recettori a sette domini transmembrana
che regolano secondi messaggeri di tipo metabotropico
(cAMP e IP3)
Apparato gastrointestinale
aumento del tono e della motilità
rilascio degli sfinteri
I nicotinici sono recettori-canale permeabili allo ione Na+
Apparato genitourinario
contrazione della vescica (M2 e M3)
rilasciamento del trigono e sfinteri
IL RECETTORE NICOTINICO
La trasmissione neuromuscolare
TRASMISSIONE DEL DOLORE
La tossina botulinica viene utilizzata in terapia per il
trattamento dello spasmo muscolare locale e nel
trattamento dei disturbi spastici dovuti a lesione
neurologica.
L’uso implica la somministrazione locale. I benefici
persistono per un periodo da settimane a mesi dopo
un singolo trattamento
Impieghi: blefarospasmo, emispasmo facciale,
torcicollo,
Effetti indesiderati
Blefarospasmo o emispasmo facciale
Lacrimazione, irritazione (secchezza oculare,
fotofobia)
Oppioidi
Torcicollo
Disfagia, ristagno di saliva, secchezza della bocca,
cambiamenti di voce, ipostenia dei muscoli del collo,
nausea, difficoltà respiratoria (raro), visione
offuscata, sonnolenza, torpore, cefalea (dosi alte)
FANS
DOLORE CRONICO MALIGNO
DOLORE ACUTO
±
±
Post-operatorio
Trauma Viscerale (infarto, colica)
±
Muscolare
±
±
Parto
Manovra diagnostica o terapeutica
Si utilizzano FANS ed oppiacei, a secondo della gravita’
del dolore
Il tempo di somministrazione e’ breve e gli effetti
collaterali generalmente trascurabili
Derivati dell’oppio
Si utilizza la scala OMS: in relazione all’aumentare del
dolore:
FANS
DOLORE CRONICO BENIGNO
±
± Articolare
Neuropatico (Post-herpetico, trigemino)
± Centrale
± Cefalea
Oppiacei agonisti parziali: Ossicodone, buprenorfina,
codeina, tramadolo
I farmaci utilizzati sono:
Oppiacei agonisti puri: Morfina, Metadone
FANS, antidepressivi, carbamazepina
I FANS possono essere sempre mantenuti in associazione
Secondo le necessita’ farmaci adiuvanti per il controllo
degli effetti collaterali, del dolore incidente e per la
qualita’ di vita (benzodiazepine, antideprssivi)
OPPIACEI
Oppiacei naturali: Morfina (analgesico)
Codeina (antitosse)
Oppiacei di sintesi: Eroina
Levorfano
Buprenorfina
Metadone
Meperidina
Fentanyl
Destropropossifene
Pentazocina
Tramadolo
Antagonisti:
Naloxone
Naltrexone
Si sta facendo strada l’impiego di farmaci oppiacei anche
nel dolore cronico benigno, soprattutto quando gli effetti
collaterali dei farmaci utilizzati sono inaccettabili (es.
nell’anziano, nel nefropatico) oppure quando il dolore non
risponde ad altri trattamenti
EFFETTI DEGLI OPPIACEI
SISTEMA NERVOSO CENTRALE
analgesia soglia dolorifica reattività al dolore
euforia
attivazione dei recettoriP nella VTA
disforia
attivazione dei recettori k nella VTA
sedazione depressione del locus ceoeruleus
depressione respiratoria
sensibilità alla CO2
miosi
stimolazione nucleo di Edinger-Westphal
emesi
attivazione della CTZ
antitosse
inibizione del centro della tosse
ipotensione da rilascio di istamina (che provoca
anche PRURITO)
vasodilatazione cerebrale dopo aumento di PCO2 e
pressione intracranica
SISTEMA NEUROENDOCRINO
I peptidi oppioidi esercitano un’attività regolatoria a
livello ipotalamico: ADH, PRL, GH
LH , CRF
Stomaco
secrez. HCl e motilità
atonia
Sfintere Oddi
La morfina inibisce la attività del linfociti Natural
Killer, la fagocitosi e la proliferazione linfocitaria:
immunosoppressione
Questo effetto non si osserva con altri agonisti come il
metadone.
Piccolo intestino secrezioni
Contrazione
Colon attività peristaltica ed aumento del tono
riduzione della velocità di transito
Meccanismo d’azione degli oppiacei
SISTEMA IMMUNITARIO
SISTEMA GASTROINTESTINALE
SISTEMA CARDIOVASCOLARE
Rari effetti sul sistema cardiovascolare
EFFETTI DEGLI OPPIACEI
EFFETTI DEGLI OPPIACEI
EFFETTI DEGLI OPPIACEI
La diversa struttura chimica
degli oppioidi
influenza la
depressione immunitaria:
SOLO gli agonisti che nella
loro molecola presentano un
gruppo OH in posizione 6
danno immunosoppressione
PRECURSORI DEI PEPTIDI OPPIOIDI ENDOGENI
RUOLO DEI PEPTIDI OPPIOIDI ENDOGENI
Gli oppiacei riproducono gli effetti di alcuni peptidi
endogeni
(Nociceptina)
OPPIOIDI ENDOGENI
Modulazione delle fibre sensitive: inibiscono la
risposta a stimoli dolorifici
ß-Endorfina: ipofisi, corteccia
Q
Q
Modulazione
delle
funzioni
endocrine e del sistema autonomo
Encefaline : ampia distribuzione, midollo spinale
Dinorfine: ampia distribuzione
Nociceptina: corteccia, midollo spinale
gastrointestinali,
Q
Modulazione delle risposte emotive
Q
Modulazione dell’apprendimento e della memoria
Endomorfina 1: corteccia, PEG
Endomorfina 2: ipotalamo, midollo spinale
Oppiodi: modulazione delle fibre sensitive a livello spinale
Distribuzione dei peptidi oppioidi
e dei loro recettori
RECETTORI PER GLI OPPIOIDI
Sono stati identificati tre recettori per gli oppioidi
chiamati PGN
RUOLO FISIOLOGICO
Analgesia
spinale
sopraspinale
PGN
PG
Inibizione della tosse
P
Depressione respiratoria
P
Comportamento, affettività
PGN
APPLICAZIONI TERAPEUTICHE DEGLI OPPIACEI
Analgesia 10 mg morfina, utilizzando diverse vie di
somministrazione.
Catetere epidurale o subaracnideo: 3-5 mg morfina
seguita da infusione lenta (6-30 ore)
ATTENZIONE ALLA DEPRESSIONE RESPIRATORIA
Qualsiasi via di somministrazione degli oppioidi e’
lecita, per favorire la qualità di vita del paziente e la
compliance.
APPLICAZIONI TERAPEUTICHE DEGLI OPPIACEI
ansiolitico,
Edema
polmonare
acuto: effetto
venodilatazione, riduzione sovraccarico cardiaco
Tosse: l’effetto è ottenuto con dosi basse. Si utilizza
la codeina
Diarrea si usano agonisti degli oppioidi che non
passano la barriera ematoencefalica (loperamide
Imodium)
Anestesia sono utilizzati in preanestesia per le
proprietà sedative, ansiolitiche ed analgesiche.
Possono anche essere utilizzati in anestesia, in
aggiunta ad altri anestetici
AGONISTI PURI
METADONE (Eptadone): Ha emivita lunga (15-40 ore)
ed una minore intensità d’azione.
Per questo motivo causa una sindrome d’astinenza meno
grave di morfina e eroina.
E’ ben assorbito per via orale.
Il picco plasmatico si osserva dopo 4 ore.
Il 90% è legato alle proteine plasmatiche.
Si accumula a livello tissutale, da dove viene rilasciato
lentamente nella circolazione sistemica.
SELETTIVITA’ D’AZIONE DEI FARMACI
SUI RECETTORI PER GLI OPPIOIDI
CHE AGISCONO
PGN
MORFINA: Può essere assorbita per os, anche se la
biodisponibilità è ridotta al 25%.
AGONISTI PURI
Morfina
Metadone
Fentanyl
Sufentanil
Petidina
Codeina
Destropropossifene
Loperamide
AGONISTI PARZIALI
Buprenorfina
Pentazocina
ANTAGONISTI
Naloxone
Naltrexone
+++
+++
+++
+++
+++
+
++
+
+
+
+
---
P
P
-----
-
AGONISTI PURI
----
AGONISTI PURI
FENTANIL (Fentanest, Duragesic)
SUFENTANIL (Fentatenil)
Vengono molto utilizzati in anestesia e nell’immediato
post-operatorio per la rapidità d’azione e per la breve
emivita, che li rende molto maneggevoli.
Possono dare però rigidità muscolare.
Sono molto liposolubili. In caso di sovradosaggio, si può
osservare depressione respiratoria.
Non hanno grossi effetti sul sistema cardiovascolare.
Si usano soprattutto vie di somministrazione
parenterali, per ottenere rapidamente un effetto
terapeutico.
E’ legata per circa il 35% alle proteine plasmatiche ed
ha un metabolismo epatico che comporta la
glicuronazione della morfina.
I due metaboliti che si formano sono attivi e la
morfina-6-glicuronata è più potente della morfina
stessa.
AGONISTI PURI
CODEINA: E’ un agonista a bassa affinità.
E’ attiva anche se somministrata per os e presenta uno
scarso effetto di I passaggio. In seguito a metabolismo
epatico, circa il 10% della codeina è convertito in
morfina.
La codeina è un agonista con affinità molto bassa per i
recettori P e N e l’efficacia come analgesico è dovuta alla
quota di codeina metabolizzata in morfina.
E’ anche un efficace antitosse, ma sembra che questa
azione sia mediata da recettori diversi da quelli per gli
oppioidi, e specifici per la codeina.
AGONISTI PURI
PETIDINA: E’ un potente agonista dei recettori P, ma ha
proprietà anticolinergiche che ne possono limitare l’uso.
DESTROPROPOSSIFENE (Liberen): E’ strutturalmente
correlato al metadone.
Si lega in modo selettivo ai recettori P, anche se con una
affinità minore rispetto alla morfina.
Ha un’elevata biodisponibilità dopo somministrazione per
os ed ha un’emivita che varia da 6 a 12 ore.
AGONISTI PARZIALI
AGONISTI PURI
PENTAZOCINA (Talwintab): E’ un agonista N e P, con
una lieve azione P antagonista
LOPERAMIDE (Imodium): Passa poco la barriera
ematoencefalica.
Viene utilizzata nel trattamento della diarrea per la
sua azione sui recettori P localizzati nella muscolatura
liscia intestinale.
Riduce inoltre le secrezioni delle ghiandole intestinali.
Somministrata per os, ha un assorbimento variabile ed
una emivita che può variare da 7 a 14 ore.
BUPRENORFINA (Temgesic, Subutrex): E’ un
farmaco potente con una lunga durata d’azione,
probabilmente a causa della lenta dissociazione dai
recettori P anche se ha un’emivita relativamente
breve, di circa 2,5 ore.
Viene somministrata per via parenterale e per via
sublinguale (il picco plasmatico si ottiene dopo 5
min).
Essendo un agonista-antagonista, è in grado di
antagonizzare la depressione respiratoria da
morfina.
TRAMADOLO (Contramal)
E’ un debole agonista dei recettori P.
E’ in grado di inibire parzialmente la ricaptazione di
noradrenalina e serotonina a livello del SNC.
Può essere somministrato per os o per via
intramuscolare
Viene metabolizzato a livello epatico con la
formazione di un metabolita attivo che ha un’emivita
più lunga del tramadolo.
E’ dotato di un buon effetto analgesico, anche se di
minore entità rispetto alla morfina.
L’assorbimento è buono e l’emivita è di circa 4-5 ore.
Può aggravare la sindrome di astinenza da morfina per
l’antagonismo sui recettori P
Dà sedazione per l’effetto sui recettori N e in caso di
sovradosaggio dà depressione respiratoria
Dopo metabolismo epatico, dà origine ad un metabolita
(norpropossifene) con un’emivita di circa 30 ore.
AGONISTI PARZIALI
La somministrazione di 30-60 mg per os induce un
effetto analgesico simile a quello ottenuto con 10 mg
di morfina.
ANTAGONISTI
ANTAGONISTI
NALOXONE
(Narcan):
Viene
utilizzato
trattamento dell’intossicazione acuta da oppioidi.
NALTREXONE (Nalorex, Antarone): Viene ben
assorbito per os e ha emivita di 10-14 ore.
nel
100 mg per os bloccano gli effetti della morfina per
48 h.
Si somministrano generalmente 0.1-0.4 mg e.v. E’ in
grado di antagonizzare la depressione respiratoria in
circa 2 min.
Oltre che per trattare l’intossicazione acuta, viene
utilizzato per la diagnosi di dipendenza fisica da
oppioidi.
Ha breve durata d’azione (1-2 ore).
Sembra inoltre che sia efficace nel ridurre la
dipendenza da alcool.
Presenta un elevatissimo effetto di I passaggio che ne
provoca l’inattivazione.
Viene quindi somministrato per via parenterale.
INTOSSICAZIONE ACUTA DA OPPIACEI
TOLLERANZA
L’intossicazione acuta si osserva con l’uso (o abuso) degli
agonisti puri con un’elevata affinità per i recettori P.
depressione respiratoria
euforia/disforia, tremore irrequietezza
sedazione
ipotensione arteriosa
stipsi
miosi/midriasi
Per il trattamento dell’intossicazione si somministra
il naloxone
L’uso cronico
tolleranza.
di
agonisti
degli
oppioidi
induce
La tolleranza non si sviluppa in modo uniforme per
tutti gli effetti.
Diminuiscono l’intensità e la durata di:
analgesia
euforia
sedazione
depressione respiratoria
DIPENDENZA E SINDROME DA ASTINENZA
Dipendenza psichica: Necessità di assumere il
farmaco per mantenere uno stato di benessere.
Dipendenza fisica: modificazioni dello stato
fisiologico provocato dalla somministrazione del
farmaco che richiede la prosecuzione della
somministrazione.
La dipendenza fisica da oppiacei comincia con la
somministrazione della prima dose
SINDROME D’ASTINENZA
Dopo 48-72 ore la crisi raggiunge il massimo
insonnia
anoressia
violenti sbadigli
lacrimazione
debolezza e depressione
nausea e vomito
spasmi intestinali e diarrea: perdita di peso,disidratazione
8-12 ore dopo l’ultima somministrazione compaiono:
lacrimazione
rinorrea
sudorazione
La sindrome da astinenza è una sindrome
fisica dovuta alla sospensione del farmaco
ed è caratterizzata da effetti rimbalzo in
quegli stessi sistemi fisiologici che sono stati
modificati dal farmaco.
Portano all’uso compulsivo del farmaco
Attivazione dei meccanismi dopaminergici di
gratificazione e ricompensa
SINDROME D’ASTINENZA
DIPENDENZA E SINDROME DA ASTINENZA
La gravità della sindrome da astinenza è
legata alla rapidità con cui il farmaco viene
eliminato
SINDROME D’ASTINENZA
Aumento della frequenza cardiaca
Aumento della pressione
Dopo 12-14 ore compaiono:
disturbi del sonno (agitato e irrequieto)
midriasi
anoressia
irrequietezza
irritabilità
tremore
SINDROME D’ASTINENZA PROTRATTA
Brividi accentuati
Sudorazione
Piloerezione
Incapacità a tollerare gli stress
Diminuzione dell’autostima
Paura
Stanchezza
Debolezza
Ipocondria
Dolore alle ossa e ai muscoli del dorso e delle
estremità
Questi sintomi sono la causa di recidive nei consumatori
compulsivi
Collasso cardiocircolatorio
alterazioni dell’eq. acido-base
I sintomi macroscopici scompaiono in 7-10 giorni
TRATTAMENTO DELLA CRISI DI ASTINENZA
Interazioni tra analgesici oppioidi ed altri farmaci
La somministrazione di un agonista abolisce
rapidamente la sintomatologia della crisi di
astinenza.
SEDATIVI IPNOTICI: Potenziamento della depressione
del sistema nervoso centrale e, in particolare, della
depressione respiratoria.
In genere si somministra metadone, per la più lunga
emivita e la ridotta sintomatologia in caso di crisi
d’astinenza. Il soggetto sviluppa dipendenza al
metadone
ANTIPSICOTICI: Aumentata sedazione. Effetti variabili
sulla depressione respiratoria. Potenziamento degli
effetti cardiovascolari (per l’azione antimuscarinica ed Dbloccante).
Si associano anche farmaci ansiolitici e sedativi
(benzodiazepine) e farmaci come la clonidina,
agonista D2 ad azione centrale, per bloccare gli
effetti dell’attivazione del sistema simpatico.
INIBITORI DELLE MAO: Controindicazione assoluta
all’associazione per l’elevata incidenza di coma
iperpiretico.
L’associazione terapeutica fra un FANS ed un
analgesico oppioide è una buona associazione, perchè i
due gruppi di farmaci hanno meccanismo d’azione
diverso. In questo modo si può diminuire la dose di
ciascun farmaco, riducendo gli effetti collaterali di
entrambi i farmaci. Le associazioni migliori sono:
Paracetamolo + Codeina
Paracetamolo + Tramadolo
ANTINFIAMMATORI
STEROIDEI
Meccanismo d’azione degli steroidi
Interazioni tra corticosteroidi e sistema
immunitario
Vie di somministrazione
Meccanismo d’azione degli steroidi
Inibiscono importanti fattori di trascrizione, quali
NF-NB e AP1, inibendo l’espressione di molti geni
(citochine, COX-2, collagenasi, ecc.)
Glucocorticoidi: effetti metabolici
Cortisonici a diversa durata d’azione
METABOLISMO DEI CARBOIDRATI E DELLE
PROTEINE
•Stimolano la gluconeogenesi e stimolano la
glicogenosintesi epatica.
•Diminuiscono la captazione e l’utilizzo del
glucosio nei tessuti: aumento della glicemia
e della secrezione di insulina
•Aumentano il catabolismo delle proteine.
METABOLISMO LIPIDICO
•Attivano la lipolisi
•Inducono la ridistribuzione del grasso corporeo
al collo,spalle e viso
METABOLISMO DEL CALCIO
•Riducono l’assorbimento del Calcio e la sintesi
del collagene con riduzione della crescita ossea
e induzione di osteoporosi
Glucocorticoidi: azioni antiinfiammatorie
e immunosoppressive
Riducono le manifestazioni dell’infiammazione
per:
•Diminuzione del numero, distribuzione e
attività dei leucociti periferici che solitamente
migrano nei tessuti infiammati. Diminuzione del
numero dei monociti, dei linfociti T e B.
•Riduzione delle funzioni dei leucociti e dei
macrofagi tra cui la capacità di rispondere ad
antigeni e mitogeni
•Diminuiscono la produzione di citochine
infiammatorie, di PG e leucotrieni, del fattore
attivante le piastrine, dell’istamina
Riducono la produzione di anticorpi
Riducono l’infiammazione cronica e le reazioni
autoimmuni.
Usi clinici dei cortisonici
Glucocorticoidi: effetti cardiovascolari
Diminuzione dell’escrezione renale del Na
Aumento delle sensibilità dei vasi alle sostanze
vasoattive come l’angiotensina II.
Questi due effetti possono dare ipertensione
Glucocorticoidi: effetti sull’osso
Inibizione dell’attività degli osteoblasti
Inibizione dell’assorbimento del Ca
Stimolazione della secrezione del paratormone
(PTH) che agisce sugli osteoclasti aumentando
il riassobimento osseo.
Il risultato è una diminuzione della densità
dell’osso
Terapia antiinfiammatoria
•malattie infiammatorie reumatiche gravi come lupus
eritematoso sistemico e artrite reumatoide. Vengono
somministrati localmente nel caso di osteoartrite.
•Asma e broncopatie croniche ostruttive
Effetti collaterali dei cortisonici
Metabolici: Sindrome di Cushing iatrogenica
Aumento di peso
Malattie allergiche
Deposito di grasso
Malattie delle pelle
Diminuzione delle masse muscolari
Trapianti
Assottigliamento della cute con strie
e smagliature violacee
Terapia antineoplastica
Chemioterapia della leucemia linfocitica acuta e dei
linfomi
Iperglicemia e comparsa di diabete
Osteoporosi
Edema cerebrale
Per ridurre l’edema cerebrale in pazienti con
neoplasie o metastasi cerebrali
Necrosi asettica dell’anca
Terapia sostitutiva
In pazienti con insufficienza corticosurrenalica
Effetti collaterali dei cortisonici
Soppressione corticosurrenalica
Alcalosi ipocloremica e ipokalemica con edemi
ed eventualmente aumento della pressione
arteriosa
Controindicazioni all’uso dei cortisonici
Ulcera
Cardiopatie
Ipertensione con insufficienza cardiaca
Infezioni
Diabete
Psicosi
Osteoporosi
Glaucoma
Quando
un
cortisonico
viene
somministrato per
un
periodo
prolungato si verifica la soppressione
della funzione corticosurrenalica.
Sviluppo di ulcere
Miopatia
La sospensione della terapia deve
quindi essere effettuata lentamente.
Sono generalmente necessari 2-3
mesi per il ripristino della funzione
ipofisaria mentre la produzione di
cortisolo può richiedere anche 6-9
mesi per tornare alla normalità.
Cataratte
Aumentata suscettibilità alle infezioni
Ritardo della crescita nei bambini
SNC: Nervosismo
insonnia
psicosi
Precauzioni durante l’uso dei cortisonici
I pazienti vanno osservati per la comparsa di:
iperglicemia
glicosuria
ritenzione di sodio e edemi
ipertensione
ipokalemia
ulcera peptica
osteoporosi
infezioni
Se la dose viene ridotta troppo
rapidamente possono ripresentarsi
i sintomi della malattia con maggiore
intensità.
REGOLAZIONE FISIOLOGICA DELLA
SECREZIONE ACIDA GASTRICA
GASTRIN
ACh
ECL cell
TERAPIA DELL’ULCERA PEPTICA
M3 +
M3
CCK2
+
Hist
CCK2
Hist
ACh
H2
+
+
+
Ca 2+dep
e
path ndent
way
Possibili siti d’azione per il trattamento dell’ulcera peptica
e del reflusso gastroesofageo
• antagonisti muscarinici:
pirenzepina
riducono la secrezione acida del 40-50%
non utilizzati per i pesanti effetti collaterali
telenzepina
• antagonisti dei recettori H2: cimetidina
ranetidina
• antagonisti dei recettori CCK2 della gastrina:
in studio
• agonisti delle PG: misoprostolo
• inibitori della pompa protonica:
+
M?
ACh
ECL cells: enterocromaffin-like
omeprazolo e derivati
• protettori della mucosa gastrica: sulcrafato
• antibiotici nel caso di presenza di H.pylori
• antiacidi
ANTAGONISTI DEI RECETTORI H2
Sono antagonisti competitivi del recettore H2 per l’istamina. Nella
molecola, l’etilamina dell’istamina è sostituita da un gruppo
aromatico, che ne permette la classificazione in tre classi:
derivati con anello IMIDAZOLICO
derivati con anello FURANICO
CIMETIDINA
RANITIDINA
derivati con anello TIAZOLICO
EFFETTI FARMACOLOGICI
Tutti gli antagonisti H2 inibiscono la secrezione
di HCl basale, notturna e, indotta da stimoli
come cibo, distensione gastrica, stimolazione
vagale.
Dopo somministrazione orale il picco plasmatico
viene raggiunto in 1-3 ore.
Hanno scarso effetto sulla muscolatura liscia
gastrica e sulla pressione dello sfintere
esofageo inferiore
Hanno uno scarso metabolismo epatico (10-35%) e
vengono eliminati per via renale.
FAMOTIDINA
NIZATIDINA
EFFETTI INDESIDERATI
Sono farmaci ben tollerati.
PROPRIETA’ DEGLI ANTAGONISTI H2
FARMACOCINETICA
Possono venire somministrati anche per e.v. o i.m.
Sono debolmente legati alle proteine plasmatiche
I tre farmaci hanno la stessa efficacia, ma diversa
potenza: ranitidina e nizatidina sono più potenti
della cimetidina
AGONISTI DEI RECETTORI PER LE PG:
MISOPROSTOLO
Con la cimetidina sono stati osservati
stati confusionali nei pazienti anziani
cimetidina
ranitidina
40
nizatidina
biodisponibilità (%)
80
potenza
1
5-10
32
5-10
1.5-2.3
1.6-2.4
2.5-4
1.1-1.6
emivita (ore)
50
famotidina
> 90
aumento della prolattinemia e ginecomastia (terapia
prolungata e ad alte dosi), effetto collaterale riportato solo
raramente con ranitidina, famotidina e nizatidina.
La cimetidina inibisce il sistema microsomiale epatico e quindi
aumenta l’emivita di alcuni farmaci
come warfarin,
diazepam, fenitoina. Gli altri farmaci del gruppo non
modificano l’attivitàdei sistemi di biotrasformazione.
durata d’azione (ore)
6
8
12
8
Cefalea nei pazienti che assumono ranitidina o famotidina
attività relativa sul
citocromo P450
1
0.1
0
0
Aumento del pH gastrico, con possibilità (anche se in casi
rari ) di colonizzazione dell’intestino da parte di miceti.
Rallentamento della digestione, con disturbi quali gonfiore,
pesantezza, sonnolenza.
MISOPROSTOLO
L’indicazione terapeutica principale è la gastroprotezione in
corso di terapia cronica con FANS
INIBITORI DELLA POMPA PROTONICA:
OMEPRAZOLO LANSOPRAZOLO PANTOPRAZOLO
È un analogo delle PG, agonista recettoriale dei recettori
EP3, che sono attivati dalle PGE2 e PGI2
Inibisce la secrezione acida basale e dopo stimolo e
favorisce la secrezione di muco e bicarbonati
FARMACOCINETICA
Gli inibitori della pompa protonica sono instabili a pH acido e la
somministrazione per os avviene in capsule gastroprotette.
Sono in assoluto i più efficaci inibitori della secrezione gastrica, al
punto che sono i farmaci più prescritti nella terapia dell’ulcera
peptica e della sindrome da reflusso gastro-esofageo
Sono rapidamente assorbiti nell’intestino, si legano fortemente
alle proteine plasmatiche e sono metabolizzati a livello epatico.
Sono dei profarmaci, dal punto di vista chimico sono delle basi
deboli, che vengono protonate e attivate a pH acido.
L’emivita è breve, ma la durata dell’effetto terapeutico è lunga,
a causa del legame irreversibile con la pompa.
Effetti collaterali: diarrea e dolore addominale che possono
causare la sospensione del farmaco in circa il 30% dei pz.
Somministrati per os, entrano nella cellula parietale dal sangue e
si accumulano nei canalicoli secretori, dove vengono attivati.
EFFETTI COLLATERALI
Assolutamente controindicato in gravidanza: provoca
aborto o parto prematuro per induzione della
contrattilità uterina
Formano ponti disulfuro con la pompa protonica, e quindi si legano
in modo irreversibile.
Farmacocinetica: è rapidamente assorbito per os ed ha un
elevato effetto di primo passaggio, con produzione di un
metabolita attivo.
Ha una breve emivita, la durata dell’effetto è di circa 3 ore e
l’eliminazione è per via renale
20 mg/die di omeprazolo per 7 giorni inibiscono la secrezione acida
di circa il 95%. (trattamento a breve durata: 4-8 settimane))
Gli stessi effetti descritti per gli antiH2, inoltre sono in grado di
inibire alcuni tipi di citocromo P450.
Il trattamento cronico con omeprazolo
l’assorbimento della vitamina B12.
rallenta,
Colonizzazione batterica dello stomaco e ipergastrinemia
inoltre,
SUCRALFATO
Il complesso del sucralfato è costituito da SACCAROSIO
OCTASOLFATO E IDROSSIDO DI ALLUMINIO.
ANTIACIDI
HELICOBACTER PYLORI
Reagiscono con l’HCl dello stomaco formando un sale e acqua e
quindi riducono l’acidità gastrica
E’ utilizzato nella terapia dell’ulcera duodenale
Si lega al tessuto necrotico ulceroso e svolge un effetto
citoprotettivo formando una barrieranei confronti di HCl,
pepsina e bile.
CaCO3 può causare ipercalcemia transitoria. Effetti non
prevedibili sulla motilità intestinale
NaHCO3 può causare alcalosi
Sono stati proposti altri meccanismi d’azione del sucralfato,
quali:
stimolazione della sintesi di PGE2 e PGI2
assorbimento della pepsina
stimolazione della produzione di EGF
Al(OH)3 può causare stipsi ed alterare l’equilibrio acido-base
Il sucralfato non viene assorbito e si somministra prima dei
pasti e alla sera
Alterando il pH gastrico e intestinale, si possono verificare
interazioni con l’assorbimento di altri farmaci: intervallo di
almeno 2 ore fra le somministrazioni dei farmaci.
in pazienti con insufficienza renale cronica
Mg(OH)2 può causare diarrea
INTERVENTI TERAPEUTICi PER L’ERADICAZIONE
DI HELICOBACTER PYLORI
MODULZIONE FARMACOLOGICA DELLA
SECREZIONE ACIDA GASTRICA
• AMOXICILLINA: penicillina semisintetica ad ampio spettro
d’azione. Sensibile alle penicillasi.
batteriostatico. Normalmente
somministrata 2 volte/die, per l’eradicazione dei Helicobacter,
si somministra tre volte/die.
GASTRIN
+
• CLARITROMICINA: macrolide
ECL cell
SI SONO GIA’ MANIFESTATI NUMEROSI CASI DI
RESISTENZA BATTERICA
M3 +
Muscarinic
antagonists
M3
CCK2
+
Hist
CCK2
+
+
anti H2
H2
+
Ca 2+dep
e
path ndent
way
proton pump
inhibitors
• TETRACICLINE:
antibiotici ad ampio spettro d’azione, hanno
però parecchi effetti collaterali.
• METRONIDAZOLO: è un farmaco attivo sui protozoi e sui
batteri anaerobi
H. pylori bismuth
metronidazole
antibiotics
IMPORTANZA DI UNA TERAPIA COMBINATA
antacids
M?
Higher centers
CEREBELLUM
(H1
FARMACI
ANTIEMETICI
sucralfate
+
Muscarinic antagonists
• SALI DI BISMUTO: hanno un un effetto citoprotettivo.
Sembra, inoltre, che abbiano un effetto antibatterico nei
confronti di Helicobacter.
(medulla)
emetic center
M)
Inner ear
(motion)
aminoglycosides
Sensory input
(pain, smell, sight)
SOLITARY
TRACT NUCLEUS
(5-HT3, D2, M, H1)
(area postrema)
CHEMO RECEPTOR
TRIGGER ZONE
(5-HT3, D2, M1)
Blood-borne emetics
cytotoxic drugs
opioids
cholinomimetics
cardiac glycosides
L-DOPA
bromocriptine
apomorphine
emetine
memory
fear
anticipation
Stomach
small intestine
(5-HT3)
Local irritants
cytotoxic drugs
radiation
bacteria
viruses
Vagal and
sympathetic
afferents
Trigeminal
afferents
PHARYNX
(gagging)
FARMACI USATI PER LA TRATTARE LA NAUSEA ED IL VOMITO
5-HT3 ANTAGONISTS
ONDANSETRON
e derivati
CENTRALLY ACTING
DA RECEPTOR
ANTAGONISTS
METOCLOPRAMIDE cytotoxic drug-induced emesis
PROMETAZINE
H1 RECEPTOR
ANTAGONISTS
MUSCARINIC
RECEPTOR
ANTAGONISTS
CANNABINOID
RECEPTOR
AGONISTS
cytotoxic drug-induced emesis
(pediatric gastroenteritis ?)
CYCLIZINE
DIPHENHYDRAMINE
SCOPOLAMINE
DRONABINOLO
motion sickness
motion sickness
cytotoxic drug-induced emesis
VIE DI SOMMINISTRAZIONE
La farmacocinetica, dal punto di vista concettuale,
può essere distinta in tre fasi
ASSORBIMENTO DEI FARMACI
è il processo per mezzo del quale un
farmaco
passa
dal
sito
di
somministrazione al plasma
VIE DI SOMMINISTRAZIONE PARENTERALI
ENDOVENOSA:
non c’è assorbimento, il farmaco
viene somministrato direttamente
in circolo
VIE DI SOMMINISTRAZIONE PARENTERALI
INTRAMUSCOLARE: assorbimento rapido per le soluzioni
acquose; gli effetti compaiono dopo
10-30 minuti
assorbimento lento per farmaci
sospesi in soluzioni oleose
utilizzata in emergenza
possono essere iniettati grossi volumi
si possono somministrare sostanze
irritanti diluite
si possono utilizzare volumi moderati
(fino a 5 ml)
si utilizza per somministrare soluzioni
oleose
aumentato rischio di effetti collaterali
l’infusione deve essere lenta
non si possono somministrare sostanze
oleose
VIE DI SOMMINISTRAZIONE PARENTERALI
SOTTOCUTANEA: assorbimento rapido per le soluzioni
acquose
assorbimento lento per i farmaci sospesi
in soluzioni oleose
è utilizzata per somministrare farmaci
insolubili e per l’impianto di pellets
solidi
si possono somministrare piccoli volumi
(non più di 2 ml)
può essere dolorosa se si somministrano
sostanze irritanti
VIE DI SOMMINISTRAZIONE ENTERALI
VIE DI SOMMINISTRAZIONE ENTERALI
VIE D’ORGANO
INALATORIA: i farmaci vengono somministrati sotto
forma di gas o di aerosol.
possono essere destinati sia ad un uso
topico che sistemico
l’assorbimento è molto rapido data la
grande estensione della
superficie
e la stretta
assorbente (200 m2)
vicinanza tra epitelio alveolare ed
endotelio capillare
ORALE:
assorbimento variabile
gli effetti compaiono dopo 45-60 min
è la via più economica e più sicura
si possono utilizzare preparazioni
retard
il paziente deve essere sveglio e
collaborante
effetto di primo passaggio
RETTALE: assorbimento variabile e incompleto
effetto più rapido rispetto alla via orale
parziale effetto di primo passaggio
SUBLINGUALE: assorbimento rapido; l’effetto
compare dopo pochi minuti
utilizzata in emergenza
non c’è effetto di primo passaggio
aumentato rischio di effetti collaterali
ALTRE VIE DI SOMMINISTRAZIONE
MECCANISMI DI PASSAGGIO DEI FARMACI ATTRAVERSO LA
MEMBRANA PLASMATICA
A
TRANSCUTANEA:
B
C
D
LA MAGGIOR PARTE DEI FARMACI ATTRAVERSA
LE MEMBRANE PER DIFFUSIONE PASSIVA
E
assorbimento molto lento
non c’è effetto di primo
passaggio
durata d’azione prolungata
A: diffusione passiva: il passaggio è regolato dal grado di lipofilia
del farmaco
B: diffusione attraverso canale
C: diffusione mediata da trasportatore
D: endocitosi in fase fluida
E: endocitosi mediata da recettore
COEFFICIENTE DI RIPARTIZIONE OLIO/ACQUA
I FARMACI SONO ACIDI E BASI DEBOLI
La capacità di un farmaco di attraversare le membrane
cellulari dipende dal suo coefficiente di ripartizione
olio/acqua, un parametro che permette di valutarne il
grado di idro-lipofilia
COEFFICIENTE DI
=
RIPARTIZIONE
[farmaco] nella fase oleosa
----------------------------------[farmaco] nella fase acquosa
Quando il coefficiente di ripartizione è superiore a 1
il farmaco è lipofilo, quando è inferiore a 1 il farmaco
è idrofilo. Il coefficiente di ripartizione si avvicina a 0
per i farmaci molto idrofili.
FATTORI CHE INFLUENZANO LA DIFFUSIONE
PASSIVA ATTRAVERSO LE MEMBRANE
I farmaci sono liposolubili e quindi possono attraversare
le membrane cellulari quando si trovano nella forma non
dissociata
I capillari hanno un’organizzazione morfo-funzionale
diversa a seconda della sede in cui si trovano
QUINDI: la
permeabilità del
letto vascolare
per un certo
farmaco è diversa
a seconda del
distretto irrorato
Il grado di dissociazione di un farmaco dipende dal
pH dell’ambiente in cui si trova
Un acido debole, come l’acido
acetilsalicilico, varia il proprio
coefficiente di ripartizione a
seconda del pH dell’ambiente in
cui si trova. Nello stomaco dove
il pH è acido si trova nella forma
indissociata, mentre nel plasma
dove il pH è neutro prevale la
forma dissociata.
LA BARRIERA EMATOENCEFALICA
L’endotelio dei vasi cerebrali ha caratteristiche morfologiche e
funzionali che permettono la realizzazione della barriera
ematoencefalica che impedisce l’ingresso nel liquido interstiziale di
qualunque sostanza incapace di diffondere liberamente attraverso
le membrane
CINETICHE DI ASSORBIMENTO
Nel SNC possono quindi penetrare solamente:
i farmaci con un adeguato coefficiente
di ripartizione
PROPRIETA’ CHIMICO-FISICHE E VARIABILI
FISIOLOGICHE CHE INFLUENZANO L’ASSORBIMENTO
DI UN FARMACO
Proprietà chimico-fisiche natura chimica
peso molecolare
solubilità
coefficiente di ripartizione
forma farmaceutica
i farmaci capaci di utilizzare i sistemi di
trasporto presenti
a
livello della
barriera ematoencefalica
Lo stato di impermeabilità è ridotto a livello dei plessi coroidei e di
altre regioni periventricolari, dove hanno normalmente luogo i
processi di filtrazione e secrezione.
Inoltre, l’impermeabilità della barriera è ridotta in corso di
infiammazione e infezione (meningite).
La velocità di assorbimento determina il picco
plasmatico ed il tempo necessario per raggiungerlo
Variabili fisiologiche
mobilità gastrica
presenza di cibo nello stomaco
pH nel sito di assorbimento
area della superficie assorbente
permeabilità della superficie
assorbente
flusso ematico
La velocità di assorbimento varia a seconda della via di
somministrazione utilizzata
Un farmaco viene somministrato
in due muscoli con irrorazione
diversa. Nel primo caso (grafici
A e C) l’assorbimento ha emivita
di 28’, nel secondo (grafici B e
D) di 84’.
Le
diverse
velocità
di
assorbimento (linea tratteggiata)
influenzano sia i flussi di
eliminazione (linea continua) che
le concentrazioni plasmatiche (C
e D).
Il tempo di picco corrisponde al
momento in cui i flussi di
assorbimento e di eliminazione
hanno pari valore.
La biodisponibilità di un
farmaco somministrato per
via orale è il rapporto tra
l’area calcolata per la via
orale e l’area calcolata
per la via endovenosa
Il
picco
di
concentrazione
plasmatica
di
un
farmaco
dipende
dalla
velocità
di
assorbimento:
più
lento
è
l’assorbimento, più basso e
ritardato è il picco plasmatico
FATTORI CHE INFLUENZANO LA BIODISPONIBILITA’
concentrazione plasmatica digossina (ug/ml)
DETERMINAZIONE DELLA BIODISPONIBILITA’
Se si riporta in un grafico la concentrazione plasmatica di
un farmaco rispetto al tempo, si determina l’AREA SOTTO LA
CURVA che rappresenta la quantità di farmaco che raggiunge
la circolazione
La concentrazione plasmatica di
un farmaco nell’unità di tempo
dipende dalla differenza tra la
quantità assorbita e la quantità
eliminata
I farmaci vengono assorbiti con due principali cinetiche:
di
primo ordine e di ordine zero.
I farmaci che vengono assorbiti per diffusione passiva
seguono una cinetica di I ordine, quelli che vengono
assorbiti per trasporto attivo una cinetica di ordine 0.
Cinetiche di I ordine
Nell’unità di tempo viene assorbita una frazione costante
del farmaco che è proporzionale alla quantità che resta da
assorbire.
Cinetiche do ordine 0
Sono caratteristiche dei processi saturabili.
Nell’unità di tempo viene assorbita una quantità costante
del farmaco che dipende dalla disponibilità dei siti di
trasporto.
BIODISPONIBILITA’
Si definisce biodisponibilità la frazione di farmaco non
modificato che raggiunge la circolazione sistemica a
seguito di somministrazione attraverso una qualsiasi via
Vie di somministrazione e biodisponibilità
Endovenosa
Intramuscolare
Sottocutanea
Orale
Rettale
Inalatoria
Transdermica
100%
d 100%
d 100%
100%
100%
100%
d 100%
FINESTRA TERAPEUTICA
1. Effetto di primo passaggio
2. Solubilità del farmaco
3. Forma farmaceutica
3
2
A
1
B
C
D
0
1
2
3
4
5
tempo (ore)
La dose e la via
di somministrazione
influenzano l’altezza
del picco plasmatico
che
deve trovarsi
tra la concentrazione
minima efficace e la
concentrazione tossica
Prescrizioni di benzodiazepine
ansiolitico
BENZODIAZEPINE
prescrizioni per mille pazienti seguiti
500
450
maschi
400
femmine
sedativo
350
300
Effetti farmacologici
delle benzodiazepine
250
200
150
anticonvulsivante
100
miorilassante
50
0
15 - 44
45 - 54
65 e oltre
amnesico
età (anni)
Effetto ansiolitico e sedativo
Diminuzione della capacità di risposta ad un livello
costante di stimolazione con diminuzione dell’attività
spontanea e dell’ideazione. Si verificano ai livelli più
bassi della dose efficace.
Effetto ipnotico
Induzione del sonno. Diminuzione del tempo necessario
per addormentarsi; aumento della durata dello stadio
2; diminuzione del sonno REM.
Anestesia
Non sono in grado di indurre e mantenere l’anestesia
chirurgica
Classificazione delle benzodiazepine
Benzodiazepine a emivita lunga (1 - 4 giorni)
diazepam
Flurazepam
(43h)
(74h)
ansiolin, noan, tranquirit, valium
oxazepam
(8h)
dalmadorm, felison, flunox,
lorazepam
(14h)
control, lorans, tavor
temazepam
(11h)
euipnos, normison
nitrazepam
(26h)
mogadon
clonazepam
(24h)
rivotril
bromazepam
Benzodiazepine a emivita intermedia (10 - 20 ore)
alprazolam
(24h)
flunitrazepam
(12h)
(15h)
limbial
frontal, valeans, xanax
darkene, roipnol, valsera
compendium, lexotan
Amnesia anterograda
Sistemi GABA-ergici
Benzodiazepine a emivita breve (1.5 - 6 ore)
triazolam (3h)
halcion, songar
midazolam (2h)
ipnovel
clorazepato
transene
prazepam
prazene, trepidan
Meccanismo d’azione delle benzodiazepine
La trasmissione GABA-ergica
Recettore delle benzodiazepine
Subunità del recettore GABA-A
BZD (D1,3,5)
(D1-D6)
GABA
E1-E3)
(J1-J3)
Siti d’azione dei farmaci attivi sul recettore GABA
Le benzodiazepine modulano l’azione del GABA sul
canale del cloro
ansiolitico
sedativo
In assenza di GABA le benzodiazepine non sono in grado
di aprire il canale del Cloro.
Le benzodiazepine aumentano la frequenza di apertura
del canale in risposta al GABA. La loro efficacia
dipende quindi dall’entità della trasmissione GABAergica.
Effetti farmacologici
delle benzodiazepine
anticonvulsivante
miorilassante
Al contrario i barbiturici, l’etanolo e gli anestetici
generali inducono l’apertura del canale anche in assenza
di GABA
amnesico
Effetti collaterali delle benzodiazepine
Indicazioni terapeutiche delle benzodiazepine
• terapia dell’ insonnia
Indicazioni terapeutiche delle benzodiazepine
•controllo dell’astinenza da etanolo
• terapia dei disturbi di ansia
• terapia dell’epilessia in casi selezionati
• premedicazione in anestesia
• sedazione e amnesia durante l’esecuzione di
manovre diagnostiche o terapeutiche
•rilasciamento muscolare (muscolatura striata)
nella spasticità di origine centrale
Si tratta di farmaci dal buon indice terapeutico.
I principali effetti indesiderati sono legati ad
un’accentuazione delle loro proprietà farmacologiche:
• ridotte performances di tipo cognitivo e
psicomotorio
(aumentato tempo di reazione,
confusione, incoordinazione dei movimenti)
•
sedazione residua diurna
•
amnesia anterograda
•L’intensità di questi effetti generalmente aumenta con
l’età
Altri effetti collaterali relativamente comuni
Debolezza
Cefalea
Visione confusa
Vertigini
Nausea e vomito
Effetti collaterali delle benzodiazepine
Cautele particolari vanno osservate nei pazienti anziani
Effetti delle benzodiazepine sul respiro
Alle dosi terapeutiche solitamente non modificano il
respiro nei soggetti normali.
Alle dosi più alte come quelle usate in anestesia e in
endoscopia le benzodiazepine deprimono leggermente la
ventilazione alveolare e causano acidosi respiratoria
Problemi della terapia cronica con
benzodiazepine
Tolleranza
Si sviluppa per gli effetti anticonvulsivante e
ipnotico, in minor misura per quello ansiolitico.
La tolleranza all’effetto sedativo può essere
un elemento favorevole nel trattamento
dell’ansia.
EFFETTI PARADOSSI
Incubi, ansietà, irritabilità, tachicardia, sudorazione
(specialmente all’inizio della terapia).
Reazioni di disinibizione: Euforia, allucinazioni e
comportamento ipomaniacale. Occasionalmente paranoia,
depressione e ideazione suicida.
L’incidenza degli effetti paradossi è rara e sembra
essere dose-dipendente
DEPOSITI TISSUTALI
libero
legato
CIRCOLAZIONE
SISTEMICA
ASSORBIMENTO
¾L’assunzione di etanolo potenzia gli effetti
L’eventuale sovradosaggio delle benzodiazepine
raramente mette a rischio le funzioni vitali,
ma può risultare letale l’associazione con
alcolici o con farmaci ad azione deprimente il
SNC.
Sono sconsigliate in gravidanza e durante l’allattamento
Problemi della terapia cronica con
benzodiazepine
Dipendenza
Essa si manifesta con una sindrome di
astinenza alla brusca sospensione del
trattamento, con stato d’ansia, insonnia,
irritabilità, nausea, cefalea, palpitazioni,
tremore, sudorazione.
Le molecole più pericolose per gravità della
dipendenza e severità delle crisi sono quelle a
breve emivita ed elevata attività intrinseca.
LEGAME DEI FARMACI ALLE PROTEINE
PLASMATICHE
SITO D’AZIONE
libero
legato
Effetti collaterali delle benzodiazepine
Antagonisti delle benzodiazepine
Flumazenil (Anexate): antidoto in caso di
sovradosaggio.
Recupero dalla sedazione indotta da questi
farmaci. Se il risveglio è troppo rapido:
agitazione, ansietà e paura.
Farmacocinetica Ha emivita breve (meno di
1 ora), più breve del midazolam. Questo
può comportare la necessità di
somministrazioni multiple.
LEGAME DEI FARMACI ALLE PROTEINE PLASMATICHE
Il plasma è costituito da due compartimenti: la fase proteica
che funge da organo di deposito circolante per il farmaco e
la fase liquida nella quale si trova il farmaco libero.
La quota libera è quella che si distribuisce ai tessuti e che
viene metabolizzata ed eliminata.
Farmaco libero
ESCREZIONE
Il legame alle proteine plasmatiche è saturabile
Metaboliti
Farmaco legato
Il grado di legame di un farmaco alle proteine plasmatiche
è espresso dal rapporto tra concentrazione di farmaco legato
e concentrazione totale di farmaco nel plasma.
BIOTRASFORMAZIONE
Un farmaco è fortemente legato se il rapporto è > 0.9
Un farmaco è scarsamente legato se il rapporto è < 0.2
I siti di legame sono in eccesso
rispetto alla dose. La frazione di
farmaco legata è alta e la
frazione libera è bassa.
La dose è in eccesso rispetto
ai siti di legame. La frazione di
farmaco libero è alta.
I FARMACI COMPETONO TRA LORO PER IL LEGAME
CON LE PROTEINE PLASMATICHE
DISTRIBUZIONE DEI FARMACI
La proteine plasmatiche più importanti per l’interazione con
i
farmaci
sono
l’albumina,
l’D1 glicoproteina acida,
l’D2 macroglobulina.
Il legame dei farmaci alle proteine plasmatiche non è
selettivo ed è quindi facile che, nel caso in cui vengano
somministrati due o più farmaci, si verifichino fenomeni di
competizione tra le varie molecole per il legame ad uno
stesso sito.
Questo può determinare variazioni importanti nei livelli di
farmaco libero che possono raggiungere la concentrazione
tossica
DISTRIBUZIONE DEI FARMACI
AFFINITA’ DEI FARMACI PER I DIVERSI TESSUTI
La velocità con cui un farmaco si distribuisce tra il sangue
e i vari compartimenti tissutali e l’entità della distribuzione
dipendono da vari fattori:
I vari tessuti, o compartimenti, differiscono per la
composizione in lipidi o altre macromolecole a cui i
farmaci possono legarsi.
*
*
*
*
I farmaci possono quindi avere affinità diverse per i
diversi tessuti.
DISTRIBUZIONE DEI FARMACI
Il termine DISTRIBUZIONE definisce i
fenomeni che sono alla base del trasferimento
dei farmaci dal sangue ai vari compartimenti
dell’organismo
il flusso ematico di ciascun compartimento
il volume di ciascun compartimento
la capacità del farmaco di passare le membrane
la capacità del farmaco di legarsi alle proteine
plasmatiche.
* l’affinità del farmaco per i diversi compartimenti
L’insieme di questi fattori porta a stabilire concentrazioni
nel sangue e nei tessuti che possono essere diverse tra loro
anche una volta raggiunto l’equilibrio di distribuzione.
L’affinità di un farmaco per i tessuti (Kp) determina la
velocità e l’entità della distribuzione
Il flusso ematico di ciascun compartimento determina la
velocità e l’entità della distribuzione
Il rapporto tra le concentrazioni di farmaco in un tessuto
e nel sangue all’equilibrio di distribuzione, che è definito
Kp del tessuto, è quindi diverso da 1 ed è diverso da
tessuto a tessuto.
Kp = Ct/Cp
I capillari hanno un’organizzazione morfo-funzionale
diversa a seconda della sede in cui si trovano
Kp = 1
Kp = 5
Andamento della concentrazione
di farmaci diversi, con Kp
diverse, in uno stesso tessuto.
Kp = 2
Kp = 1
Kp = 1
Valori più alti di Kp determinano
il raggiungimento dell’equilibrio di
distribuzione in tempi più lunghi
e con livelli di concentrazione
tissutale più alti.
Kp = 1
A parità di affinità per il
tessuto (Kp = 1) gli organi più
perfusi si
equilibrano più
rapidamente con il plasma.
Con il passare del tempo la
curva per il tessuto adiposo
raggiungerà il
valore di
equilibrio
osservato per
cervello e rene
QUINDI: la
permeabilità del
letto vascolare
per un certo
farmaco è diversa
a seconda del
distretto irrorato
LA BARRIERA EMATOENCEFALICA
Influenza della liposolubilità sulla distribuzione
dei farmaci
Nel SNC possono quindi penetrare solamente:
Differenze nella velocità con
cui
alcuni
farmaci si
distribuiscono al SNC.
i farmaci con un adeguato coefficiente
di ripartizione
I diversi farmaci hanno la
stessa Kp per il cervello.
i farmaci capaci di utilizzare i sistemi di
trasporto presenti
a
livello della
barriera ematoencefalica
L’endotelio dei vasi cerebrali ha caratteristiche morfologiche e
funzionali che permettono la realizzazione della barriera
ematoencefalica che impedisce l’ingresso nel liquido interstiziale di
qualunque sostanza incapace di diffondere liberamente attraverso
le membrane
I diversi farmaci hanno un
diverso
coefficiente di
ripartizione olio/acqua.
Lo stato di impermeabilità è ridotto a livello dei plessi coroidei e di
altre regioni periventricolari, dove hanno normalmente luogo i
processi di filtrazione e secrezione.
Inoltre, l’impermeabilità della barriera è ridotta in corso di
infiammazione e infezione (meningite).
A determinare la diversa
velocità di distribuzione è la
diversa capacità di superare
la barriera ematoencefalica.
VOLUME DI DISTRIBUZIONE
IL VOLUME DI DISTRIBUZIONE
Si definisce VOLUME DI DISTRIBUZIONE (VD) il volume
apparente nel quale il farmaco è distribuito.
Per i tessuti che riescono ad equilibrarsi con il plasma,
una volta raggiunto l’equilibrio di distribuzione, il rapporto
tra la concentrazione del farmaco nel tessuto e la
concentrazione del farmaco nel plasma rimane COSTANTE
benchè tutte le concentrazioni diminuiscano a causa dei
processi di eliminazione
Volume
intracellulare
28 litri
La concentrazione di un farmaco non è la stessa in tutti i
compartimenti dell’organismo.
Il volume calcolato dal rapporto tra dose somministrata
e concentrazione plasmatica misurata non è uguale al
volume dell’acqua corporea, ma
è un
volume di
distribuzione apparente che dipende dalle caratteristiche
del farmaco (coefficiente di ripartizione, legame alle
proteine plasmatiche, affinità per i tessuti (Kp)
Volume
totale
42 litri
Acqua
interstiziale
10 litri
Volume
extracellulare
indica che il farmaco è sequestrato nel
plasma
Un VD < 15 litri
indica che il farmaco si distribusce ai
liquidi extracellulari
Un VD > 15 litri
indica che il farmaco è distribuito
nell’acqua corporea totale
Un VD > 42 litri
indica che il farmaco si concentra in un
tessuto che funge da deposito.
I farmaci ionizzati rimangono
nel fluido extracellulare
I farmaci fortemente legati alle
proteine plasmatiche e quelli con
un alto peso molecolare rimangono
nel plasma
Plasma
4 litri
ELIMINAZIONE RENALE
ELIMINAZIONE DEI FARMACI
riassorbimento passivo
Il VD indica quanto un farmaco si distribuisce ai tessuti
Un VD < 5 litri
I farmaci liposolubili entrano
nelle cellule
14 litri
VD = Dose/Cp
VOLUME DI DISTRIBUZIONE
Acqua
intracellulare
L’eliminazione di un farmaco avviene per escrezione
del farmaco immodificato o dei suoi metaboliti.
secrezione
attiva
Le principali vie di escrezione sono:
LA VIA RENALE
LA VIA EPATICA
filtrazione
glomerulare
Eliminazione renale: filtrazione glomerulare
Eliminazione renale: secrezione tubulare
Eliminazione renale: secrezione tubulare
Il 20% circa della componente acquosa del sangue viene
filtrato a livello glomerulare.
I capillari glomerulari sono caratterizzati da
permeabilità particolarmente elevata.
Due meccanismi di trasporto sono responsabili della
secrezione attiva di composti endogeni e farmaci a
livello tubulare.
una
Con l’acqua sono filtrate a livello glomerulare sostanze
con peso molecolare fino a diverse migliaia di Dalton.
I due sistemi di secrezione attiva distinguono gli
ANIONI dai CATIONI e sono entrambi localizzati
nel tubulo prossimale.
Le proteine plasmatiche NON vengono filtrate.
I farmaci liberi o i metaboliti con basso peso molecolare
vengono quindi eliminati per filtrazione glomerulare.
La secrezione attiva è un meccanismo SATURABILE
Il sistema di trasporto degli anioni è responsabile della
escrezione di composti organici e metaboliti coniugati con
glicina, solfato e acido glucuronico
Attraverso questa via vengono escreti l’aspirina, la penicillina
e le ciclosporine, i diuretici.
Poiché i meccanismi di secrezione attiva sono saturabili
è possibile sfruttare la competizione dei vari anioni per
questo sistema allo scopo di interferire con la escrezione di un
farmaco e prolungarne la permanenza nell’organismo.
Ad esempio il probenecid compete con la penicillina per la
secrezione tubulare. La somministrazione di questa molecola
diminuisce l’escrezione della penicillina
La quota di farmaco legata alle proteine plasmatiche
NON PUO’ essere eliminata con questo meccanismo.
Escrezione epatica
Eliminazione renale: riassorbimento passivo
Eliminazione renale: secrezione tubulare
I tubuli contorti prossimale e distale sono deputati al
riassorbimento di una notevole quantità di filtrato glomerulare.
Sistema di trasporto dei cationi
Questo sistema saturabile
permette
l’escrezione
neurotrasmettitori endogeni (acetilcolina, dopamina,
istamina, serotonina) e loro metaboliti.
Sistema di trasporto degli anioni
Il fegato svolge due funzioni principali sui farmaci:
metabolismo ed escrezione
I farmaci liposolubili e non ionizzati vengono riassorbiti a livello
dei tubuli renali e tornano in circolo.
di
I substrati di questo sistema di trasporto devono presentare
un gruppo aminico carico positivamente al pH fisiologico.
Vengono eliminati con questo sistema gli alcaloidi naturali e
i loro d erivati (atropina e neostigmina), gli
analgesici
oppiacei come la morfina.
Poiché il grado di ionizzazione di un farmaco (acido o base
debole) dipende dal pH dell’ambiente in cui si trovano,
alterazioni del pH delle urine possono modificare l’escrezione
di alcuni farmaci.
Per la particolare struttura
del circolo epatico i farmaci
entrano facilmente nello spazio
di Disse e da qui vengono
trasportati nell’epatocita dove
vengono metabolizzati.
L’alcalinizzazione delle urine, che si ottiene somministrando
bicarbonato, favorisce l’eliminazione dei farmaci acidi come
il fenobarbitale e l’aspirina e riduce l’escrezione dei
farmaci basici come l’amfetamina.
Alcuni metaboliti sono escreti
attivamente nella bile
L’acidificazione delle urine con NH4Cl favorisce l’eliminazione
dei farmaci basici.
Escrezione epatica
CLEARANCE
Il circolo entero-epatico
La cinetica di eliminazione dei farmaci è di I ordine
L’escrezione dei f armaci nella bile è influenzata
principalmente da due caratteristiche fisiche:
la polarità e il peso molecolare
La presenza di un gruppo polare aumenta l’escrezione
Solo composti con peso molecolare > 300-500 vengono
escreti nella bile
Nella secrezione biliare sono coinvolti 4 sistemi di
trasporto attivo: anioni, cationi, acidi biliari e
sostanze neutre.
L’escrezione biliare ha particolare importanza per i
farmaci somministrati per via orale (effetto di primo
passaggio o eliminazione presistemica).
I farmaci escreti nella bile possono e ssere riassorbiti
nell’intestino.
Questo è particolarmente frequente per i farmaci coniugati
conl’acido glucuronico.
Nell’unità di tempo viene eliminata una frazione
costante (Ke) della quantità di farmaco presente
nell’organismo.
Questi coniugati vengono scissi dalla E-glucuronidasi intestinale
e il farmaco libero viene riassorbito.
Con il termine CLEARANCE (Cl) si intende il
volume di sangue virtualmente ripulito nell’unità
di tempo dai processi di eliminazione.
In questi casi si verifica un continuo c ircolo entero-epatico
che può mantenere il composto nell’organismo finchè esso non
viene ulteriormente metabolizzato o escreto per via renale.
La Cl è data dal prodotto tra frazione eliminata
nell’unità di tempo (Ke) e il VD
Questo meccanismo di ricircolo è essenziale per evitare
la deplezione continua di sostanze endogene come gli acidi
biliari, gli estrogeni e le vitamine D e B12.
Cl =Ke x VD
Per ogni farmaco la clearance ha un valore costante
indipendente dalla concentrazione plasmatica
Fattori che influenzano la clearance renale
I fattori che influenzano i valori di clearance renale
di un farmaco sono numerosi.
Favoriscono l’eliminazione renale:
* Assenza di legame alle proteine plasmatiche
* Elevata idrofilia
EMIVITA DEI FARMACI
EMIVITA DEI FARMACI
Si definisce EMIVITA o tempo di dimezzamento (t1/2) il
tempo necessario perché la concentrazione del farmaco
nel plasma si dimezzi.
Il valore di emivita esprime l’efficienza dei processi di
eliminazione, è indipendente dalla concentrazione del
farmaco e dipende dalla funzionalità dei sistemi di
eliminazione.
I farmaci con emivita breve sono eliminati rapidamente; i
farmaci con emivita lunga sono eliminati lentamente
* Grado di ionizzazione
* Sistemi di trasporto attivo a livello tubulare
Ogni farmaco è caratterizzato da un suo valore di emivita
che può variare da pochi minuti ad una settimana
Alterazioni patologiche degli organi di eliminazione
portano ad un aumento dell’emivita dei farmaci
e quindi
ad un prolungamento dei loro effetti.
Difetti nei processi di eliminazione determinano
un
aumento dell’emivita
e
della
concentrazione
plasmatica massima conseguente alla somministrazione
di una dose di farmaco.
Alterazioni dei valori di emivita richiedono correzioni
del dosaggio dei farmaci, soprattutto di quelli per i
quali la finestra terapeutica è ristretta.
I farmaci che hanno un VD elevato hanno emivita lunga in
quanto il farmaco che viene eliminato viene continuamente
rimpiazzato daquello accumulato nei tessuti di deposito.
FARMACI ANTI-INFIAMMATORI NON STEROIDEI
(FANS)
EFFETTI FARMACOLOGICI
Anti-infiammatorio
Analgesico
Antipiretico
USI TERAPEUTICI
Artrite reumatoide
Spondilite anchilosante
Osteoartrite
Dolori muscolo-scheletrici
Cefalea
Dolore postoperatorio
Dismenorrea primaria
CLASSIFICAZIONE CHIMICA DEI FANS
Derivati dell’acido salicilico: acido acetilsalicilico, diflunisal
Derivati dell’anilina: paracetamolo
Derivati dell’acido indolacetico: indometacina, sulindac
Derivati dell’acido fenilacetico: diclofenac, ketorolac
CLASSIFICAZIONE FARMACOLOGICA DEI FANS
FARMACI DOTATI DI EFFETTO ANALGESICO E SCARSA
AZIONE ANTI-INFIAMMATORIA
Paracetamolo, ketorolac
FARMACI DOTATI DI EFFETTO ANALGESICO ED AZIONE
ANTI-INFIAMMATORIA MODERATA
Derivati dell’acido propionico, derivati dell’acido antranilico
Derivati dell’acido antranilico: acido mefenamico
Derivati dell’acido propionico: ibuprofene, naproxene
Derivati dell’acido enolico: piroxicam
FARMACI DOTATI DI EFFETTO ANALGESICO E AZIONE
ANTI-INFIAMMATORIA NOTEVOLE
Salicilati, derivati dell’acido acetico, derivati dell’acido enolico,
sulfonanilidi
Sulfonanilidi: nimesulide
STIMOLI: COLLAGENE, TROMBINA, BRADICHININA
MECCANISMO D’AZIONE
ACIDO ARACHIDONICO
Fosfolipasi
INIBIZIONE DEL’ENZIMA
CICLO-OSSIGENASI (COX) CON
CONSEGUENTE DIMINUZIONE
DELLA PRODUZIONE DI
PROSTAGLANDINE
Fosfolipidi
COX
FANS
ACIDO ARACHIDONICO
PGH2
LPOX
COX
PROSTAGLANDINE
TROMBOXANO
LEUCOTRIENI
EPOX
PGE2, PGI2, PGF2
EPOSSIDI
TXA2
PROSTAGLANDINE E TRASMISSIONE DEL DOLORE
BIOSINTESI DELLE PROSTAGLANDINE
PROSTAGLANDINE E INFIAMMAZIONE
Vasodilatazione
PGE2
Acido
arachidonico
COX
Dolore
PGE2
+ bradichinina
Edema
PGE2
PROSTAGLANDINE E AGGREGAZIONE PIASTRINICA
RUOLO FISIOLOGICO DELLE PROSTAGLANDINE:
SECREZIONI
AGONISTA
PGE2
PGI2
PGF2D
GASTRICA
ACIDO / PEPSINA
MUCO
- - -
INTESTINALE
++
++
++
++
+
RUOLO FISIOLOGICO DELLE PROSTAGLANDINE:
AGGREGAZIONE DELLE PIASTRINE
AGONISTA
AGGREGAZIONE
RECETTORE
EFFETTORE
TXA2
+++++
TP
DG / IP3
PGI2
---
IP
cAMP
PGD2
--
DP
cAMP
Pro-aggregante
Piastrina
AA
COX
TXA2
AA
COX
PGI2
FANS
cAMP
Anti-aggregante
Effetto anti-infiammatorio: inibizione della produzione
di PGE2 e PGI2 in siti
specifici
Effetto analgesico: inibizione della produzione di
PGE2
PGH2
PGE2, PGI2, PGF2
AC
EFFETTI FARMACOLOGICI DEI FANS IN RELAZIONE
ALLA INIBIZIONE DELLA COX
ACIDO ARACHIDONICO
COX
Ca
Piastrina
Cellula endoteliale
La PGF2D è un potente induttore
della contrattilità uterina
DG/IP3
TXA2
Effetto antipiretico: inibizione della produzione di
PGE2 a livello ipotalamico
EFFETTI COLLATERALI DEI FANS IN RELAZIONE ALLA
INIBIZIONE DELLA COX
Sistema
Effetto
Sintesi PG
Gastrointestinale
Gastrite erosiva
Ulcera peptica
Inibizione della
PGE2 e PGI2
Piastrine
Inibizione
dell’aggregazione
Inibizione del
TXA2
Renale
Ritenzione di
liquidi, ridotta
escrezione di Na
Inibizione della
PGE2 renale
Uterino
Ritarato travaglio
Inibizione della
PGE2 e PGF2a
Bronchi
Broncospasmo,
orticaria, rinite
Prevalenza dei
prodotti della LPX
ACIDO ACETILSALICILICO
ACIDO ACETILSALICILICO (Aspirina)
E’ un acido debole, rapidamente assorbito dallo
stomaco e dal primo tratto dell’intestino tenue.
EFFETTI FARMACOLOGICI
ANALGESICO: attivo sul dolore di lieve-media entità
ANTIPIRETICO: riduce la febbre, ma non modifica
la temperatura corporea normale.
ANTI-INFIAMMATORIO: ad alte dosi è un potente
anti-infiammatorio
ACIDO ACETILSALICILICO
EFFETTI COLLATERALI
EFFETTI COLLATERALI
GASTRICI: intolleranza gastrica, dolore epigastrico,
vomito.
Alle dosi più alte aumenta l’incidenza di ulcera gastrica.
La lesione tipica da aspirina è una erosione superficiale
con sanguinamento.
ASPIRINA: RELAZIONI DOSE-EFFETTO
ACIDO ACETILSALICILICO
inibisce l’aggregazione
piastrinica.
Questo effetto è evidente a basse dosi: 40-300 mg/die.
EFFETTO ANTITROMBOTICO:
Viene usata per ridurre l’incidenza di trombosi nel corso
di interventi di by-pass aorto-coronarico e per ridurre
l’incidenza di attacchi ischemici in pazienti con ischemia
cerebrale transitoria.
Per questo effetto l’aspirina è controindicata in pazienti
con:
Danno epatico grave
Ipoprotrombinemia
Deficit di vitamina K
Emofilia
ACIDO ACETILSALICILICO
EFFETTI COLLATERALI
RESPIRAZIONE ED EQUILIBRIO ACIDO-BASE
Ad alte dosi stimola i centri del respiro e induce
alcalosi respiratoria che viene compensata da
un aumento dell’escrezione renale dei bicarbonati.
Dosi tossiche deprimono i centri respiratori con
conseguente acidosi respiratoria non compensata.
Questi eventi causano anche alterazioni
dell’equilibrio degli elettroliti e dell’acqua
provocando disidratazione.
ACIDO ACETILSALICILICO
USI TERAPEUTICI:
Effetti neurologici: ai dosaggi più elevati l’aspirina
provoca una sindrome neurologica , il salicilismo,
caratterizzata da acufeni, diminuzione dell’udito e
vertigini.
Effetto antiaggregante piastrinico: aumenta il tempo
di sanguinamento
Reazioni allergiche: asma, orticaria, eruzioni cutanee
PARACETAMOLO (Tachipirina)
PROPRIETA’ FARMACOLOGICHE
E’ analgesico e antipiretico, ma non è anti-infiammatorio.
Analgesia: nei dolori di lieve entità di diversa origine,
ma non di origine viscerale. Dose: 600 mg
Quest’ultima caratteristica viene attribuita al fatto che il
paracetamolo è un debole inibitore delle COX in presenza di
elevate concentrazioni di perossidi come accade nelle lesioni
Infiammazione: ad alte dosi viene usata nel trattamento
dell’artrite reumatoide, dell’osteoartrite e della febbre
reumatica. Dose: 3-4 g
infiammatorie.
Antipiretico: trattamento sintomatico della febbre.
Dose: 600 mg
Non influenza l’aggregazione piastrinica
Non modifica la respirazione e l’equilibrio acido-base
E’ scarsamente gastrolesivo
Antiaggregante: per ridurre l’incidenza di trombosi.
Dose: 40-300 mg
Viene usato come ANALGESICO e ANTIPIRETICO
in alternativa all’aspirina
PARACETAMOLO: FARMACOCINETICA
Assorbito bene per via orale, è debolmente legato
alle proteine plasmatiche.
Ha breve emivita, circa 2 ore.
Viene metabolizzato dal fegato e per l’80-90% è
coniugato con l’acido glucuronico.
Un metabolita minore (N-acetil-p-benzochinone) è
importante per la sua tossicità epatica e renale.
In condizioni normali questo composto si lega al
glutatione. In caso di sovradosaggio il metabolita
si accumula e provoca epatotossicità.
EFFETTI INDESIDERATI
Irritazione gastrica caratterizzata da dolore
epigastrico, nausea, bruciore. L’incidenza di questi
effetti è meno frequente rispetto all’aspirina e
all’indometacina.
Alle dosi più alte
gastroduodenali.
aumentano
l’incidenza di ulcere
PARACETAMOLO: EFFETTI INDESIDERATI
Alle dosi terapeutiche non ha effetti collaterali
significativi.
Ibuprofene (Moment, Brufen, Nurofen).
Naproxene (Momendol, Naprosyn, Artroxen)
A dosi più alte sono stati osservati vertigine,
eccitazione e disorientamento. Può dare rash cutanei
e discrasie ematiche (neutropenia e trombocitopenia).
L’effetto collaterale più serio è la epatotossicità.
L’assunzione di 15 g di paracetamolo nell’adulto e di
4 g nel bambino può essere fatale. La morte è causata
da epatotossicità con necrosi lobulare centrale, talvolta
associata con necrosi tubulare renale.
I sintomi precoci del danno epatico sono nausea, vomito,
diarrea, dolori addominali.
DERIVATI DELL’ACIDO ACETICO
Questo farmaco è dotato di una una potente azione
anti-infiammatoria.
Alle posologie più elevate induce formazione di
ulcere, emorragie gastro-intestinali, pancreatite.
E’ più tossico, ma più efficace dell’aspirina.
Il 15-25% dei pazienti soffre di cefalea, vertigini,
confusione e depressione.
Effetti collaterali più rari ed evidenti alle dosi alte
sono eritema, acufeni, vertigini, ansietà, ritenzione
idrica, nefrotossicità.
Raramente sono stati segnalati
aplastica e agranulocitosi.
Non viene utilizzato come analgesico o per le patologie
infiammatorie minori.
DERIVATI DELL’ACIDO ACETICO
DICLOFENAC: EFFETTI INDESIDERATI
Diclofenac (Voltaren)
Ha proprietà analgesiche, anti-infiammatorie e
antipiretiche e potenza maggiore dell’indometacina,
del naproxene e di altri FANS.
L’effetto collaterale
più
comune
gastrolesività. Può indurre ulcere.
E’ indicato per le patologie infiammatorie croniche
come l’artrite reumatoide e l’osteoartrite alla dose
di 100-200 mg/die.
Effetti centrali come sonnolenza e confusione.
Viene anche utilizzato come analgesico nel caso di
lesioni muscolo-scheletriche, tendiniti, dolore postoperatorio e dismenorrea (50 mg).
Utilizzati
come
anti-infiammatori
nell’artrite reumatoide, osteoartrosi, periartriti,
lombalgie, sciatalgie. A dosi basse sono privi di
attività anti-infiammatoria e vengono usati
come analgesici in
varie forme dolorose
tra cui cefalea e dismenorrea.
INDOMETACINA: EFFETTI INDESIDERATI
Indometacina (Metacen, Indoxen)
Viene utilizzato nella terapia dell’artrite reumatoide,
spondilite anchilosante,
osteoartrite dell’anca e
gotta acuta ed è efficace anche in condizioni
infiammatorie extra-articolari come la pericardite.
casi di anemia
DERIVATI DELL’ACIDO PROPIONICO
è
la
Altri effetti indesiderati sono ritenzione di
liquidi e formazione di edemi.
Reazioni allergiche e, raramente, diminuzione
della funzionalità renale.
Raramente da’ episodi psicotici con allucinazioni
Induce
reazioni
ematologiche
trombocitopenia e anemia aplastica.
serie
come
L’inibizione della COX da parte dei FANS
determina diminuzione della produzione di tutte le
prostaglandine e dei trombossani, meccanismo
responsabile sia degli effetti terapeutici,
analgesico anti-infiammatorio e antipiretico, che
degli effetti indesiderati a carico del sistema
gastrointestinale, renale e delle piastrine.
Sono state identificate due cicloossigenasi
chiamate COX-1 e COX-2.
Differenze nella conformazione
spaziale della COX1 e della COX2
LA COX-1: UN ENZIMA COSTITUTIVO
La COX-1 è una isoforma costitutiva espressa in
tutte le cellule dell’organismo e in particolare
nei vasi, nello stomaco, nelle piastrine e nel rene.
La COX-1
svolge
un ruolo importante nella
formazione
fisiologica
delle
prostaglandine
coinvolte nella modulazione
locale di funzioni
quali la secrezione di acido
e di muco nello
stomaco, l’aggregazione piastrinica e la funzionalità
renale
LA COX-2: UN ENZIMA INDUCIBILE
La COX-2 è una isoforma inducibile che non è
normalmente
presente
nelle
cellule
differenziate e che viene rapidamente indotta
dagli stimoli pro-infiammatori in diversi tipi
cellulari
come
macrofagi,
sinoviociti,
fibroblasti e cellule endoteliali dei vasi.
La COX-2 non è presente a livello gastrointestinale e nelle piastrine
SULFONANILIDI
La specificità di distribuzione tissutale e di
inducibilità della COX-1 e della COX-2 ha portato
alla formulazione di un nuovo paradigma con il
quale affrontare il problema degli effetti
collaterali più comuni dei FANS: la gastrolesività
e l’inibizione dell’aggregazione piastrinica
LA COX-2 E’ RESPONSABILE
DELL’INFIAMMAZIONE E DELL’IPERALGESIA
LA COX-1 E’ CRITICA PER LA PROTEZIONE
GASTRICA E PER LA FUNZIONALITA’
PIASTRINICA
CELECOXIB E ROFECOXIB
Nimesulide (Aulin)
E’ un inibitore preferenziale della COX-2.
Viene utilizzato come anti-infiammatorio e analgesico
e nei pazienti allergici alla aspirina o ad altri FANS.
E’ rapidamente assorbito dopo somministrazione orale
e ha emivita di circa 3 ore.
Sono efficaci nel ridurre il dolore articolare e
l’infiammazione nei pazienti affetti da osteoartrite
o da artrite reumatoide.
Non aumentano l’incidenza di ulcera
Non modificano l’aggregazione piastrinica
NB: aumentano il rischio di patologie cardiovascolari.
Per questo motivo il Rofecoxib è stato ritirato dal
commercio
Gli inibitori selettivi della COX-2 hanno
effetti anti-infiammatori e analgesici, non
sono gastrolesivi e non hanno attività
antiaggregante piastrinica
Effetti collaterali: i più comuni sono intolleranza
gastrica (è meno gastrolesiva della aspirina) e reazioni
cutanee.
CLASSIFICAZIONE DEI FANS IN BASE ALLA
SELETTIVITA’ PER COX-1 E COX-2
Sono inibitori selettivi della COX2
EFFICACIA CLINICA
FARMACI NUOVI
FARMACODINAMICA
La farmacodinamica studia gli effetti biochimici
e il meccanismo d’azione dei farmaci.
FANS NON SELETTIVI:
FANS classici
FANS COX-2 PREFERENZIALI:
NIMESULIDE
FANS COX-2 SELETTIVI:
CELECOXIB
ROFECOXIB
La farmacodinamica si propone di:
* identificare i siti d’azione dei farmaci
* delineare le interazioni fisiche o chimiche tra
farmaco e cellula
* caratterizzare la sequenza completa farmacoeffetto
I RECETTORI
FARMACODINAMICA
Sono recettori per i farmaci:
Gli effetti terapeutici e tossici dei farmaci traggono
origine dalle loro interazioni con molecole presenti
nell’organismo.
Per lo più i farmaci agiscono combinandosi con
macromolecole specifiche in modo tale da alterarne le
proprietà biochimichee biofisiche.
Si definisce RECETTORE il componente di una cellula
che interagisce con un farmaco dando inizio alla catena
di eventibiochimici che portano agli effetti
farmacologici osservati.
I RECETTORI
*
*
*
*
I farmaci influenzano in modo quantitativo le funzioni
fisiologiche delle cellule bersaglio, ma non impartiscono
nuove funzioni
recettori per i neurotrasmettitori e gli ormoni
enzimi
canali ionici
acidi nucleici
I recettori determinano le relazioni quantitative
tra dose ed effetti farmacologici
I recettori sono responsabili della selettività
dell’azione farmacologica
I RECETTORI
Meccanismi di trasduzione del segnale
I recettori a sette domini transmembrana
I recettori canale
I recettori per i neurotrasmettitori sono proteine
intrinseche delle membrane cellulari delle cellule
bersaglio
I recettori a sette domini transmembrana
cAMP, cGMP
IP3, diacilglicerolo
INTERAZIONE FARMACO-RECETTORE
SOTTOTIPI RECETTORIALI
INTERAZIONE FARMACO-RECETTORE
L’interazione tra farmaco e recettore è mediata da legami
chimici deboli come :
Il legame farmaco-recettore è:
ponti idrogeno
forze di van der Waals
interazioni idrofobiche
SATURABILE
STEREOSPECIFICO
REVERSIBILE
L’interazione farmaco-recettore è responsabile
degli effetti farmacologici e degli effetti
indesiderati (es beta-bloccanti, neurolettici,
aspirina).
Sottotipi recettoriali
INTERAZIONE FARMACO-RECETTORE
INTERAZIONE FARMACO-RECETTORE
INTERAZIONE FARMACO-RECETTORE
L’interazione tra farmaco e recettore è saturabile
Il legame tra farmaco e recettore è
stereospecifico
L’interazione tra un farmaco e un recettore segue la legge
dell’azione di massa.
Il farmaco interagisce con un recettore e l’effetto risultante
è proporzionale al numero dei recettori occupati
CURVE DOSE-RISPOSTA
FARMACI AGONISTI
L’effetto di un farmaco è proporzionale al numero di recettori
occupati, quindi aumenta all’aumentare della dose.
L’effetto massimo si verifica quando tutti i recettori sono
occupati.
Si definisce AGONISTA un farmaco che si lega ad un recettore
e genera una risposta biologica. Generalmente un agonista
riproduce gli effetti dei composti endogeni.
Il legame tra farmaco e recettore aumenta all’aumentare
della dose. Tuttavia con il crescere delle dosi l’incremento
del legame si attenua fino a scomparire.
FARMACI AGONISTI
efficacia
Effetto
Effetto massimo
Dose efficace media
DE50
potenza
Dose (Log)
POTENZA
POTENZA
EFFICACIA
Si definisce EFFICACIA di un farmaco l’entità
massima dell’effetto che esso può indurre.
La potenza è indice della dipendenza dell’effetto
dalla dose del farmaco. E’ uguale alla affinità del
farmaco per
il recettore.
L’altezza della curva dose-risposta rispecchia
l’efficacia.
L’efficacia non dipende dalla dose, ma è indice
dell’attività intrinseca del farmaco nell’indurre
un determinato effetto.
La posizione della curva dose-risposta sull’asse
delle ascisse rispecchia la potenza del farmaco.
La potenza influenza la dose necessaria per
ottenere un determinato effetto.
ANTAGONISTI
EFFICACIA
In base alla ATTIVITA’ INTRINSECA i farmaci
sono classificati in:
AGONISTI
attività intrinseca = 1
ANTAGONISTI
Gli antagonisti sono farmaci che si legano con alta affinità ai
recettori, ma non sono in grado di indurre di per sé una risposta
biologica.
L’effetto farmacologico di un antagonista è dovuto alla sua proprietà
di inibire l’effetto dell’agonista endogeno che agisce attraverso lo
stesso recettore.
attività intrinseca = 0
AGONISTI PARZIALI 0 < attività intrinseca <1
ANTAGONISTI COMPETITIVI
Gli antagonisti possono agire con due
meccanismi diversi, producendo un
effetto “sormontabile” o “insormontabile”
Gli antagonisti si classificano in:
ANTAGONISTI COMPETITIVI
ANTAGONISTI NON COMPETITIVI
Gli antagonisti competitivi si legano reversibilmente
allo stesso sito a cui si lega l’agonista. Le due molecole
perciòcompetono per un sito comune.
ANTAGONISTI COMPETITIVI
ANTAGONISTI NON COMPETITIVI
ANTAGONISTI COMPETITIVI
Un antagonista competitivo sposta
la curva dose-risposta dell’agonista
verso destra
ANTAGONISTI NON COMPETITIVI
Gli antagonisti non competitivi possono agire con due meccanismi:
1. interagiscono in modo irreversibile con lo stesso sito
dell’agonista.
2. si legano ad un sito del recettore diverso da quello occupato
dall’agonista (meccanismo allosterico).
Aumentando la concentrazione di
agonista si può generare lo stesso
effetto massimo ottenuto in
assenza dell’antagonista
Un antagonista competitivo riduce
la potenza dell’agonista
ANTAGONISTI NON COMPETITIVI
L’interazione farmaco-recettore è responsabile degli effetti
terapeutici e degli effetti tossici dei farmaci
INDICE TERAPEUTICO
L’indice terapeutico (IT)
di un farmaco è il
rapporto tra la dose
tossica media (DT50)
e
la dose efficace
media (DE50)
Un
antagonista
non
competitivo deprime l’effetto
massimo ottenibile anche con
dosi elevate dell’agonista senza
modificarne la potenza.
IT = DT50/DE50
INDICE TERAPEUTICO
L’indice terapeutico è un indice della sicurezza di un farmaco.
I farmaci che hanno un alto indice terapeutico sono sicuri
I farmaci che hanno un basso indice terapeutico sono poco
maneggevoli
Alto indice terapeutico
Basso indice terapeutico
METABOLISMO DEI FARMACI
Per essere assorbiti e distribuiti ai vari distretti
dell’organismo i farmaci devono
possedere
caratteristiche fisico-chimiche che sono diverse
da quelle che ne favoriscono l’eliminazione.
La lipofilia e l’assenza di cariche elettriche
facilitano l’assorbimento, ma sono caratteristiche
sfavorevoli per l’eliminazione che viene favorita
se la sostanza possiede caratteristiche idrofile.
E’ quindi necessario che l’organismo provveda
alla trasformazione delle
molecole lipofile in
idrofile modificandone la struttura.
METABOLISMO DEI FARMACI
METABOLISMO DEI FARMACI
OGNI FARMACO PUO’ DARE ORIGINE A PIU’ DI UN
METABOLITA
Il processo di
biotrasformazione delle
sostanze e in particolare dei farmaci è detto
metabolismo dei farmaci.
Il metabolismo ha lo scopo di trasformare,
all’interno dell’organismo, le sostanze estranee
in composti più polari e più idrosolubili,
aumentandone l’escrezione.
METABOLISMO DEI FARMACI
B
A
C
D
E
OGNI FARMACO PUO’ DARE ORIGINE A PIU’ DI UN
METABOLITA: L’ESEMPIO DELL’ACIDO ACETILSALICILICO
F
G
H
I
Metaboliti attivi dotati di spettro farmacologico uguale
a quello del composto d’origine: l’esempio del diazepam
Metaboliti tossici: l’esempio del paracetamolo
metaboliti inattivi
La benzodiazepina DIAZEPAM genera due metaboliti
dotati della stessa attività farmacologica: OXAZEPAM
e NORDIAZEPAM.
Il paracetamolo è un farmaco antiinfiammatorio che
viene biotrasformato in un metabolita tossico,
il parabenzochinone.
metaboliti attivi dotati di spettro farmacologico
ugualea quello del composto d’origine
L’emivita dell’oxazepam è circa ¼ di quella del diazepam
Se il paracetamolo viene somministrato a dosi
terapeutiche il metabolita tossico viene coniugato con
il glutatione ed eliminato.
La biotrasformazione di un farmaco può portare alla
formazione di:
metaboliti attivi dotati di spettro farmacologico
diverso da quello del composto di origine
metaboliti tossici
PROFARMACI
L’emivita del nordiazepam è circa il doppio di quella del
diazepam.
La durata d’azione del diazepam dipende quindi da quale
dei due composti viene generato dal corredo di enzimi
del paziente
DOVE AVVIENE LA BIOTRASFORMAZIONE?
Se il paracetamolo viene somministrato a dosi troppo
elevate, il metabolita tossico, dopo aver saturato
tutto il glutatione disponibile, si lega alle proteine
degli epatociti e causa epatotossicità
REAZIONI DI BIOTRASFORMAZIONE
Il metabolismo dei farmaci si attua attraverso due fasi
Vi è la possibilità che un farmaco non sia di per sé
attivo e che lo diventi solo dopo la biotrasformazione.
In questo caso le biotrasformazioni prendono il nome
di bioattivazioni e il farmaco viene definito profarmaco.
Nel caso dei profarmaci l’attività farmacologica dipende
dalle capacità metaboliche dell’individuo
Sebbene ogni tessuto sia dotato di una
certa capacità di metabolizzare i farmaci,
il FEGATO è la sede principale del
metabolismo.
Anche altri tessuti come
POLMONI,
INTESTINO e RENE hanno una attività
metabolizzante significativa.
ASSORBIMENTO
METABOLISMO
Fase I
Farmaco
Metabolita
Fase II
Coniugato
ELIMINAZIONE
REAZIONI DI FASE I
Le reazioni di fase I o di FUNZIONALIZZAZIONE
hanno la finalità di inserire o mettere in evidenza nella
molecola gruppi funzionali come –OH, -NH2, -COOH.
Sono reazioni di fase I: ossidazione, riduzione, idrolisi,
idrossilazione.
Le reazioni di fase I avvengono ad opera di una famiglia
di enzimi, chiamati ossidasi a funzione mista localizzati
nei microsomi epatici.
Queste reazioni dipendono da una catena enzimatica di
trasporto di elettroni che ha come terminale il citocromo
P450.
REAZIONI DI FASE II
Le reazioni di fase II o di CONIUGAZIONE sono
reazioni enzimatiche d i biosintesi per mezzo delle
quali un composto esogeno o un metabolita derivato
dalle reazioni di fase I si lega in modo covalente
con una molecola endogena.
EFFETTO DI PRIMO PASSAGGIO
Dopo somministrazione orale molti farmaci sono
assorbiti dall’intestino tenue e subito trasportati
attraverso il sistema portale al fegato dove subiscono
una notevole metabolizzazione.
In generale i coniugati sono molecole polari facilmente
eliminabili.
Le più importanti reazioni di coniugazione sono:
Glucuronazione o coniugazione con l’acido glucuronico
Acetilazione o coniugazione con l’acetato
Coniugazione con il glutatione
Coniugazione con la glicina
L’effetto di primo passaggio può
limitare così notevolmente la
biodisponibilità di un farmaco
somministrato per via orale da
costringere ad impiegare altre
vie di somministrazione.
Polimorfismi
Questo polimorfismo su base genetica ha permesso di classificare gli
individui in acetilatori “veloci” e acetilatori “lenti” e ha permesso di
spiegare la diversa tossicità di alcune sostanze in individui della stessa
specie.
Il metabolismo dei farmaci dipende
dal corredo
enzimatico di ogni soggetto
Distribuzione delle concentrazioni plasmatiche di isoniazide in 267 individui 6
ore dopo una dose orale di isoniazide.
Individui con una concentrazione plsmatica >2.5 Pg/ml sono considerati “lenti”
IL METABOLISMO DEI FARMACI DIPENDE DALL’ETA’
ONTOGENESI DEL METABOLISMO EPATICO
CORRELAZIONE TRA METABOLISMO
DEL DIAZEPAM ED ETA’
INFLUENZA DELLE PATOLOGIE EPATICHE SULLA
CAPACITA’ DI METABOLIZZARE I FARMACI
Concentrazione plasmatica della nortriptilina dopo una singola dose orale
in soggetti con un diverso numero di geni CYP2D6 funzionali
LA DIETA PUO’ INFLUENZARE IL METABOLISMO
DEI FARMACI
INDUZIONE FARMACO-METABOLICA
Una caratteristica degli enzimi epatici è
che la loro sintesi e attività possono
aumentare in seguito a somministrazione
ripetuta di sostanze come farmaci,
pesticidi, sostanze chimiche di origine
industriale e alimenti (etanolo).
SOSTANZE INDUCENTI LA BIOTRASFORMAZIONE
DEI FARMACI
FARMACI
Fenobarbitale
Rifampicina
Sedativo/ipnotico
Antibiotico
INSETTICIDI
DDT, aldrin
Pesticidi
IDROCARBURI
POLICICLICI
L’induzione farmaco-metabolica si traduce in una
accelerazione del metabolismo e, normalmente, in
una riduzione dell’azione farmacologica non solo della
sostanza induttrice,
ma
anche
di farmaci
somministrati contemporaneamente all’induttore.
ELIMINAZIONE RENALE
Benzopirene
3-metilcolantrene
L’eliminazione di un farmaco avviene per escrezione
del farmaco immodificato o dei suoi metaboliti.
Le principali vie di escrezione sono:
Prodotti della
combustione
ALCOL
Etanolo
Componente di bevande
IDROCARBURI
ALOGENATI
TCDD
Contaminante di erbicidi
ADDITIVI
ALIMENTARI
ELIMINAZIONE DEI FARMACI
LA VIA RENALE
LA VIA EPATICA
Idrossianisolo butilato Antiossidante
Eliminazione renale: filtrazione glomerulare
Eliminazione renale: secrezione tubulare
Il 20% circa della componente acquosa del sangue viene
filtrato a livello glomerulare.
riassorbimento passivo
I capillari glomerulari sono caratterizzati da
permeabilità particolarmente elevata.
secrezione
attiva
Due meccanismi di trasporto sono responsabili della
secrezione attiva di composti endogeni e farmaci a
livello tubulare.
una
Con l’acqua sono filtrate a livello glomerulare sostanze
con peso molecolare fino a diverse migliaia di Dalton.
I due sistemi di secrezione attiva distinguono gli
ANIONI dai CATIONI e sono entrambi localizzati
nel tubulo prossimale.
Le proteine plasmatiche NON vengono filtrate.
filtrazione
glomerulare
I farmaci liberi o i metaboliti con basso peso molecolare
vengono quindi eliminati per filtrazione glomerulare.
La secrezione attiva è un meccanismo SATURABILE
La quota di farmaco legata alle proteine plasmatiche
NON PUO’ essere eliminata con questo meccanismo.
Eliminazione renale: secrezione tubulare
Eliminazione renale: riassorbimento passivo
Eliminazione renale: secrezione tubulare
I tubuli contorti prossimale e distale sono deputati al
riassorbimento di una notevole quantità di filtrato glomerulare.
Sistema di trasporto degli anioni
Il sistema di trasporto degli anioni è responsabile della
escrezione di composti organici e metaboliti coniugati con
glicina, solfato e acido glucuronico
Attraverso questa via vengono escreti l’aspirina, la penicillina
e le ciclosporine, i diuretici.
Poiché i meccanismi di secrezione attiva sono saturabili
è possibile sfruttare la competizione dei vari anioni per
questo sistema allo scopo di interferire con la escrezione di un
farmaco e prolungarne la permanenza nell’organismo.
Ad esempio il probenecid compete con la penicillina per la
secrezione tubulare. La somministrazione di questa molecola
diminuisce l’escrezione della penicillina
Sistema di trasporto dei cationi
Questo sistema saturabile
permette
l’escrezione
neurotrasmettitori endogeni (acetilcolina, dopamina,
istamina, serotonina) e loro metaboliti.
I farmaci liposolubili e non ionizzati vengono riassorbiti a livello
dei tubuli renali e tornano in circolo.
di
I substrati di questo sistema di trasporto devono presentare
un gruppo aminico carico positivamente al pH fisiologico.
Vengono eliminati con questo sistema gli alcaloidi naturali e
i loro d erivati (atropina e neostigmina), gli
analgesici
oppiacei come la morfina.
Poiché il grado di ionizzazione di un farmaco (acido o base
debole) dipende dal pH dell’ambiente in cui si trovano,
alterazioni del pH delle urine possono modificare l’escrezione
di alcuni farmaci.
L’alcalinizzazione delle urine, che si ottiene somministrando
bicarbonato, favorisce l’eliminazione dei farmaci acidi come
il fenobarbitale e l’aspirina e riduce l’escrezione dei
farmaci basici come l’amfetamina.
L’acidificazione delle urine con NH4Cl favorisce l’eliminazione
dei farmaci basici.
Escrezione epatica
Il fegato svolge due funzioni principali sui farmaci:
metabolismo ed escrezione
Escrezione epatica
Il circolo entero-epatico
L’escrezione dei f armaci nella bile è influenzata
principalmente da due caratteristiche fisiche:
I farmaci escreti nella bile possono e ssere riassorbiti
nell’intestino.
la polarità e il peso molecolare
La presenza di un gruppo polare aumenta l’escrezione
Per la particolare struttura
del circolo epatico i farmaci
entrano facilmente nello spazio
di Disse e da qui vengono
trasportati nell’epatocita dove
vengono metabolizzati.
Alcuni metaboliti sono escreti
attivamente nella bile
CLEARANCE
Solo composti con peso molecolare > 300-500 vengono
escreti nella bile
Nella secrezione biliare sono coinvolti 4 sistemi di
trasporto attivo: anioni, cationi, acidi biliari e
sostanze neutre.
L’escrezione biliare ha particolare importanza per i
farmaci somministrati per via orale (effetto di primo
passaggio o eliminazione presistemica).
I fattori che influenzano i valori di clearance renale
di un farmaco sono numerosi.
Favoriscono l’eliminazione renale:
Con il termine CLEARANCE (Cl) si intende il
volume di sangue virtualmente ripulito nell’unità
di tempo dai processi di eliminazione.
* Assenza di legame alle proteine plasmatiche
La Cl è data dal prodotto tra frazione eliminata
nell’unità di tempo (Ke) e il VD
* Grado di ionizzazione
Cl =Ke x VD
* Sistemi di trasporto attivo a livello tubulare
* Elevata idrofilia
Alterazioni patologiche degli organi di eliminazione
portano ad un aumento dell’emivita dei farmaci
e quindi
ad un prolungamento dei loro effetti.
Difetti nei processi di eliminazione determinano
un
aumento dell’emivita
e
della
concentrazione
plasmatica massima conseguente alla somministrazione
di una dose di farmaco.
Alterazioni dei valori di emivita richiedono correzioni
del dosaggio dei farmaci, soprattutto di quelli per i
quali la finestra terapeutica è ristretta.
In questi casi si verifica un continuo c ircolo entero-epatico
che può mantenere il composto nell’organismo finchè esso non
viene ulteriormente metabolizzato o escreto per via renale.
Questo meccanismo di ricircolo è essenziale per evitare
la deplezione continua di sostanze endogene come gli acidi
biliari, gli estrogeni e le vitamine D e B12.
EMIVITA DEI FARMACI
Si definisce EMIVITA o tempo di dimezzamento (t1/2) il
tempo necessario perché la concentrazione del farmaco
nel plasma si dimezzi.
Il valore di emivita esprime l’efficienza dei processi di
eliminazione, è indipendente dalla concentrazione del
farmaco e dipende dalla funzionalità dei sistemi di
eliminazione.
I farmaci con emivita breve sono eliminati rapidamente; i
farmaci con emivita lunga sono eliminati lentamente
Ogni farmaco è caratterizzato da un suo valore di emivita
che può variare da pochi minuti ad una settimana
I farmaci che hanno un VD elevato hanno emivita lunga in
quanto il farmaco che viene eliminato viene continuamente
rimpiazzato daquello accumulato nei tessuti di deposito.
Per ogni farmaco la clearance ha un valore costante
indipendente dalla concentrazione plasmatica
EMIVITA DEI FARMACI
Questi coniugati vengono scissi dalla E-glucuronidasi intestinale
e il farmaco libero viene riassorbito.
Fattori che influenzano la clearance renale
La cinetica di eliminazione dei farmaci è di I ordine
Nell’unità di tempo viene eliminata una frazione
costante (Ke) della quantità di farmaco presente
nell’organismo.
Questo è particolarmente frequente per i farmaci coniugati
conl’acido glucuronico.
Lo spasmo muscolare è una contrazione involontaria
e dolorosa di un muscolo che può causare movimenti
involontari e interferire con la funzionalità.
Ia
D
La paralisi spastica è dovuta ad una contrazione
ipertonica del muscolo ed è spesso associata a
patologie neurologiche come paralisi cerebrale,
sclerosi multipla e ictus.
La spasticità è invalidante e difficile da trattare
quando è grave, ma le forme leggere e moderate
rispondono alla terapia farmacologica.
I meccanismi che sono
alla base della spasticità
non sembrano coinvolgere
l’arco riflesso di
stiramento, ma i neuroni
piramidali superiori con
danno delle vie discendenti
e ipereccitabilità dei
motoneuroni-alfa.
I farmaci impiegati,
riducono l’attività della
fibra Ia, proveniente
dal fuso muscolare, che
stimola il motoneurone
alfa.
SITI D’AZIONE DEL BACLOFEN E DEL DIAZEPAM
Farmaci usati nel trattamento degli spasmi
muscolari cronici o della spasticità da sclerosi
multipla e altre malattie neurologiche
Non indicati per spasmi secondari a traumi di
lieve entità
Il baclofen è un agonista del recettore GABA-B
Baclofene (Lioresal)
E’ un agonista per i recettori GABAB.
Riduce il rilascio di trasmettitori eccitatori in tutto il SNC.
Blocca anche il rilascio di Sostanza P con effetto analgesico.
A differenza del dandrolene non riduce la forza muscolare
generale.
GABAB
Il recettore GABAB è accoppiato alla adenilico ciclasi
in maniera inibitoria
Altri farmaci che agiscono sul midollo spinale
Progabide e glicina
Riducono la spasticità in alcuni pazienti.
La progabide è un agonista dei recettori GABA-A e
GABA-B.
La glicina è un neurotrasmettitore inibitorio. E’
attiva se somministrata per os e attraversa
facilmente la barriera emato-encefalica.
E’ ben assorbito per os (30-100 mg die).
Ha emivita plasmatica di 3-4 ore.
Viene applicato anche per via intratecale
Può indurre sonnolenza (meno del diazepam) effetto che va
incontro a tolleranza
Diazepam (Valium)
Facilita la trasmissione GABAergica a livello del recettore
GABAA
Oltre ad avere azione centrale ha azione anche a livello del
midollo: produce miorilassamento anche nei pazienti con
gravi lesioni midollari
Esercita una inibizione presinaptica sulle afferenze Ia
al motoneurone-alfa.
Causa sedazione.
Viene utilizzato alle dosi di 4-60 mg/die
Dopo mesi di terapia può verificarsi una parziale tolleranza
Farmaci attivi a livello muscolare: Dantrolene
(Dantrium)
Dantrolene
Agisce a livello muscolare, non interferisce con la
trasmissione centrale o della giunzione neuro-muscolare
Non interferisce con i meccanismi di rilascio del calcio
a livello cardiaco o del muscolo liscio, che sono
influenzati solo lievemente dal dantrolene.
Blocca nel muscolo l’accoppiamento eccitazionecontrazione
EFFETTI INDESIDERATI
Inibisce
la
liberazione
di
calcio
dal
reticolo sarcoplasmatico. Da ciò dipende il blocco
dell’interazione actina-miosina e quindi della contrazione
muscolare.
Le unità motorie che si contraggono rapidamentesono più
sensibili al farmaco di quelle che si contraggono
lentamente
Causa debolezza muscolare generalizzata, sedazione e,
sporadicamente, epatite, vertigini, diarrea, anoressia,
nausea, cefalea
Ha biodisponibilità del 30% ed emivita di 8 ore
Tizanidina (Sirdalud)
E’ un agonista Danalogo della clonidina.
Potenzia sia l’inibizione pre-sinaptica che post-sinaptica
nel midollo spinale e quindi riduce la spasticità in modo
simile al diazepam e al baclofen.
Inoltre inibisce la trasmissione nocicettiva a livello
delle corna dorsali del midollo spinale (come la
clonidina), e quindi ha anche un effetto analgesico.
IL SISTEMA NERVOSO AUTONOMO
Tiocolchicoside (Muscoril)
E’ un rilassante muscolare che sembra possedere azioni
GABA-mimetiche.
E’ utilizzato nel trattamento sintomatico degli spasmi
muscolari.
Induce diversi effetti collaterali, ipotensione,
sonnolenza, xerostomia, astenia
La dose richiesta varia da paziente a paziente e deve
essere personalizzata per ottenere l’effetto ottimale
LE CATECOLAMINE
EFFETTI DELLA STIMOLAZIONE DEL SIMPATICO
Simpatico
Ghiandole salivari
Vasocostrizione
Vasodilatazione e
secrezione
Ghiandole
lacrimali
Polmoni
Vasocostrizione
Vasodilatazione e
secrezione
Rilasciamento
musc.
bronchiale
Contrazione musc
bronchiale; stim
secrezioni
contrazione,midri
asi
Manca
innervazione
Rilasciamento
Vescica:
Detrusore
Trigone e
sfinteri
Organi
genitali:
Tessuto
erettile
Simpatico
Parasimpatico
Vasocostrizione
Secrezione di
renina
Manca innervazione
Riduzione di:
frequenza, periodo
refrattario
Fegato
glicogenolisi
Manca innervazione
Vie biliari
Diminuzione flusso
biliare
Stomaco
Aumento di: tono e
motilità; rilasc.
sfinteri, stimolaz.
secrezioni
Contraz. aumento
flusso biliare
Effetti centrali della noradrenalina
Controllo del tono dell’umore
Contrazione
Rilasciamento
contraz. sfinteri
venosi: erezione
Aumento di:
frequenza, forza
contrazione
conduzione
Diminuzione di tono
e motilità, contr.
sfinteri
Contrazione: visione
da vicino
Sistema del tronco
dell’encefalo
Manca
innervazione
Parasimpatico
Organo
effettore
Cuore
Sistema del Locus Coeruleus
Rilasciamento
Contrazione
Simpatico
Manca innervazione
Contrazione, miosi
EFFETTI DELLA STIMOLAZIONE DEL SIMPATICO
Organo
effettore
Rene
EFFETTI DELLA STIMOLAZIONE DEL SIMPATICO
Parasimpatico
Organo effettore
Occhio:
m. radiale
dell’iride
m. sfintere
dell’iride
Muscolo ciliare
Controllo delle funzioni sonno-veglia: le
funzioni sonno-veglia dipendono dall’attività
dei sistemi neuronali a proiezione diffusa
noradrenergici, serotoninergici, colinergici e
istaminergici.
Lo stato di veglia è controllato dai sistemi
catecolaminergici e colinergici. La rete
neuronale noradrenergica è deputata al
controllo della vigilanza e dell’attenzione.
BIOSINTESI DELLE CATECOLAMINE
RECETTORI PER LE CATECOLAMINE
LA SINAPSI NORADRENERGICA
*
Dopamina
DOPA
decarbossilasi
tirosina
idrossilasi
Tirosina
Studi di tipo farmacologico hanno inizialmente
identificato due diversi recettori per le catecolamine
definiti D e E
DOPA
Dopamina
E-idrossilasi
Noradrenalina
metiltransferasi
*
Adrenalina
*
RECETTORI PER LE CATECOLAMINE
Famiglia
Sottotipi
Trasduzione
D1A
D1B
D1C
D1D
IP3/DAG
IP3/DAG
IP3/DAG
D1
D2
D2A
D2B
D2C
cAMP
cAMP
cAMP
E1
E2
E3
cAMP
cAMP
cAMP
E
LOCALIZZAZIONE DEI RECETTORI
*
D2
TERMINAZIONI
NORADRENERGICHE
inibizione liberazione di NA
ARTERIOLE
contrazione
MUSCOLATURE LISCE
rilassamento
RENE
diminuzione escrezione di
Na+, K+ e Cl-
CELLULE E PANCREAS
diminuzione della secrezione
di insulina
PIASTRINE
aggregazione
SNC
inibizione scarica simpatica
aumento assunzione cibo
aumento secrezione GH
I RECETTORI
D1 e D2 HANNO DIVERSA LOCALIZZAZIONE
LOCALIZZAZIONE DEI RECETTORI
SINAPTICA
D2 presinaptici
autorecettori
D1 postsinaptici
contrazione
MUSCOLATURA LISCIA VASALE
arteriole e vene
contrazione
MUSCOLATURA LISCIA ORGANI
stomaco
rilassamento
intestino: pareti
sfinteri
rilassamento
contrazione
tratto genitourinario
contrazione
FEGATO
glicogenolisi
SNC
DISTRIBUZIONE DEI RECETTORI
E
stato di veglia
secrezione ACTH e LH
DISTRIBUZIONE DEI RECETTORI
RECETTORI
RECETTORI
CUORE
RENE
aumento
aumento
aumento
aumento
D1
OCCHIO
muscolo radiale dell’iride
E
E2
E1
della frequenza
della contrattilità
della velocità conduzione
dell’automatismo
aumento della secrezione di renina
VASI
arteriole: coronarie
muscoli scheletrici
polmonari
renali
vasodilatazione
MUSCOLATURE LISCE
stomaco
intestino
bronchi
rilassamento
FEGATO
glicogenolisi
FUNZIONI DEI RECETTORI PER LE CATECOLAMINE
DISTRIBUZIONE DEI RECETTORI
RECETTORI
E
E3
TERAPIA DELL’IPERTENSIONE
TESSUTO ADIPOSO
lipolisi
sympathetic activity
Siti d’azione dei principali
farmaci anti-ipertensivi
Ipertensione: pressione diastolica > 90 mmHg
pressione sistolica > 140 mmHg
Una prolungata ipertensione arteriosa danneggia i
vasi del rene, del cuore e del cervello ed è un
fattore di rischio per l’insufficienza renale, le
malattie coronariche e l’ictus.
D2 agonisti
E-bloccanti
D-bloccanti
vasodilatatori
Ca-antagonisti
Diuretici
E’ stato accertato che una efficace riduzione della
pressione riduce l’incidenza della morbilità e mortalità
per le patologie descritte sopra.
ACE-inibitori
Angiotensina I
CLASSIFICAZIONE DEI FARMACI ANTIIPERTENSIVI
CLASSIFICAZIONE DEI FARMACI ANTIIPERTENSIVI
DIURETICI
BLOCCANTI I CANALI DEL Ca++
¾ verapamil dilatiazem
¾ nifedipina, nimodipina, amlodipina
¾ tiazidici e derivati (idrocoloritazide, clortalidone)
¾ diuretici dell’ansa (furosemide, bumetanide)
¾ risparmiatori di K+ (spironolattone, amiloride)
FARMACI SIMPATICOLITICI
¾ ad azione centrale (clonidina, metildopa)
¾ E bloccanti (propranolo, atenololo)
¾ D antagonisti (terazosina, doxazosina, fenossibenzamina)
¾ D e E antagonisti (labetalolo, carvedilolo)
ACE
Angiotensina II
FARMACI SIMPATICOLITICI
ACE INIBITORI
captopril, enalapril
¾ ad azione centrale (agonisti dei recettori D2)
ANTAGONISTI DEI RECETTORI AII
losartan, candesartan, valsartan
VASODILATATORI
¾ arteriosi (idralazina, minoxidil, diazossido)
¾ arteriosi e venosi (nitroprussiato)
¾ ad azione
recettori D1)
periferica
(antagonisti
dei
D-METILDOPA (Aldomet)
Farmaci simpaticolitici ad azione centrale
OH
OH
MECCANISMO D’AZIONE
La clonidina è un agonista selettivo per i
recettori D2.
La stimolazione dei recettori D2 provoca
diminuzione del tono simpatico con riduzione
dei livelli di noradrenalina circolante e dei
suoi metaboliti.
SIMPATICOLITICI AD AZIONE PERIFERICA
FARMACI D BLOCCANTI
FENOSSIBENZAMINA e FENTOLAMINA
La clonidina non dovrebbe essere somministrata
in pazienti a rischio per depressione e dovrebbe
essere sospesa se durante la terapia dovesse
comparire tale sindrome.
Un trattamento concomitante con farmaci
antidepressivi triciclici può abolire l’effetto
antiipertensivo della clonidina.
SIMPATICOLITICI AD AZIONE PERIFERICA
FARMACI D1 ANTAGONISTI
TERAZOSINA (Ezosina, Itrin)
DOXAZOSINA (Cardura, Dedralen, Normothen)
Bloccano i recettori D1 nelle arteriole e nelle venule e
quindi provocano vasodilatazione e riduzione della
pressione arteriosa per riduzione delle resistenze
periferiche.
MECCANISMO D’AZIONE
Bloccano i recettori D1 nelle arteriole e nelle venule e
quindi provocano vasodilatazione e riduzione della
pressione arteriosa per riduzione delle resistenze
periferiche.
Non interagiscono con i recettori D2 e quindi non
modificano il rilascio di noradrenalina. La tachicardia
riflessa è meno marcata rispetto ai farmaci non
selettivi.
EFFETTI FARMACOLOGICI
CUORE (E1)
diminuzione di:
contrattilità
frequenza
velocità di conduzione
automatismo
CH2
C
COOH
NH2
MECCANISMO D’AZIONE
L’D-metildopa entra nella via biosintetica delle
catecolamine
e
viene
metabolizzata
ad
Dmetilnoradrenalina. Il farmaco dà quindi origine a un
falso trasmettitore che riconosce solo i recettori D2.
Questo farmaco agisce quindi come la clonidina a livello
bulbare.
I E-BLOCCANTI
PRAZOSINA
Sono antagonisti competitivi dei recettori D1 e D2.
Il blocco dei recettori D2 è responsabile di un aumento
della secrezione di catecolamine che comporta lo sviluppo
di tachicardia riflessa e aumento della gittata cardiaca.
CH3
CONTROINDICAZIONI
CLONIDINA (Catapresan)
EFFETTI FARMACOLOGICI
MECCANISMO D’AZIONE
¾ Antagonisti competitivi dei recettori E per
le catecolamine.
Il blocco dei recettori E è responsabile degli
effetti terapeutici e della maggior parte
degli effetti indesiderati di questi farmaci
INDICAZIONI TERAPEUTICHE
RENE (E1) diminuzione della produzione di renina
Angina stabile ed instabile
VASI (E2) vasocostrizione
Post-infarto (< eventi ischemici e mortalità)
BRONCHI (E) broncocostrizione
Tachiaritmie sopraventricolari
PANCREAS (E2) diminuzione della secrezione di
insulina
Ipertensione arteriosa
FEGATO (E2) diminuzione della glicogenolisi
Insufficienza cardiaca (II-III classe NYHA)
TESSUTO ADIPOSO (E3) diminuzione della lipolisi
Glaucoma, Cefalee, Ipertiroidismo
Caratteristiche Differenziali
dei E bloccanti: CARDIOSELETTIVITA’
EFFETTI INDESIDERATI
legati al meccanismo d’azione
BRONCOSPASMO blocco dei recettori E2
nei bronchi
VASOCOSTRIZIONE blocco dei recettori
E2 nei vasi
IPOGLICEMIA
fegato
blocco dei recettori E2 nel
Caratteristiche differenziali dei Ebloccanti: liposolubilità
Liposolubilità (propranololo, Inderal)
Idrosolubilità (atenololo)
Metabolismo epatico (effetto primo passaggio):
Ebloccanti liposolubili
Eliminazione urinaria:
E-bloccanti idrosolubili
CONTROINDICAZIONI ALL’USO DEI betaBLOCCANTI
ASMA e BRONCOPATIE CRONOCHE
OSTRUTTIVE
ARTERIOPATIE PERIFERICHE
DIABETE: potenziamento dell’ipoglicemia da
insulina dovuto al blocco della glicogenolisi
Effetti Collaterali dei E bloccanti
¾ Ipotensione
¾ Effetti Cardiaci
Bradicardia
Blocchi seno-atriali ed atrio-ventricolari
Effetto inotropo negativo
¾ Astenia
¾ Broncospasmo
Effetti sul sistema nervoso centrale:
(Depressione, Incubi notturni, Impotenza)
E-bloccanti liposolubili
¾ Effetti Vascolari
Peggioramento arteriopatia periferica
LA SECREZIONE DI RENINA E’ SOTTOPOSTA A
DIVERSI MECCANISMI DI CONTROLLO:
ACE-inibitori
metoprololo, acebutololo, atenololo, bisoprololo
¾ Sistema nervoso centrale
Depressione
(va in tolleranza dopo qualche settimana)
Incubi notturni
Impotenza
¾ Effetti Gastrointestinali
Nausea, diarrea o stipsi
¾ Effetti Metabolici
Ipoglicemia in diabetici in terapia insulinica
¾ Rash cutanei
¾ Sindrome da sospensione improvvisa
aritmie
Il sistema renina-angiotensina
macula densa: le cellule epiteliali nella parte
corticale dell’ansa di Henle sono i “sensori” di [NaCl]:
l’aumento di [NaCl] induce riduzione del rilascio di
renina
barocettori intrarenali: l’aumento della tensione
parietale delle arteriole pre-renali per aumento della
pressione arteriosa induce riduzione della secrezione
di renina.
sistema simpatico: la stimolazione dei recettori E1
nell’apparato juxta-glomerulare stimola la secrezione
di renina
Am J Cardiol vol 89, 2002
CLASSIFICAZIONE DEGLI ACE INIBITORI
ANGIOTENSIN II
Alterazioni
strutturali
Vasocostrizione
RAPID PRESSOR
RESPONSE
Alterazione funzionalità
renale
VASCULAR AND
CARDIAC
HYPERTROPHY AND
REMODELLING
SLOW PRESSOR RESPONSE
¾ ACE inibitori contenenti un gruppo
sulfidrilico, strutturalmente correlati al
CAPTOPRIL
¾ACE inibitori contenenti un gruppo
dicarbossilico, strutturalmente correlati all’
ENALAPRIL e LISINOPRIL
CARATTERISTICHE FARMACOLOGICHE
Le diverse molecole disponibili hanno la stessa
efficacia. Differiscono fra loro per:
9 potenza
9caratteristiche farmacocinetiche
¾ACE inibitori contenenti un gruppo fosfato,
strutturalmente correlati al FOSINOPRIL
IL SISTEMA NERVOSO AUTONOMO
EFFETTI COLLATERALI
IL SISTEMA NERVOSO AUTONOMO
IPOTENSIONE
TOSSE: in circa il 5-20% dei pz si ha una
tosse secca e persistente
TERATOGENICITA’:
altamente teratogeni
gli
ACE
inibitori
I SISTEMI COLINERGICI PERIFERICI
sono
SISTEMI COLINERGICI CENTRALI
A: abenula
BO: bulbo olfattorio
BB: banda diagonale del Broca
CC: corpo calloso
I: ippocampo
Ipo: ipotalamo
NB: nucleo basale magnocellulare
NC: nucleo caudato
SM: setto mediale
T: talamo
C: corteccia
NPP: nucleo tegmentale laterodorsale
EFFETTI DELLA STIMOLAZIONE DEL SNA
Organo effettore
Simpatico
Parasimpatico
Occhio:
m. radiale dell’iride
m. sfintere dell’iride
contrazione,midriasi
Manca innervazione
Manca innervazione
Contrazione, miosi
Muscolo ciliare
Rilasciamento
Contrazione: visione da
vicino
Ghiandole salivari
Vasocostrizione
Vasodilatazione e
secrezione
Ghiandole lacrimali
Vasocostrizione
Vasodilatazione e
secrezione
Polmoni
Rilasciamento musc.
bronchiale
Contrazione muscolatura
bronchiale;
stimolazione secrezioni
EFFETTI DELLA STIMOLAZIONE DEL SNA
Organo effettore Simpatico
Parasimpatico
Cuore
Aumento di: frequenza,
forza contrazione
conduzione
Riduzione di:
frequenza, periodo
refrattario
Stomaco
Diminuzione di tono e
motilità, contr. sfinteri
Aumento di: tono e
motilità; rilasc.
sfinteri, stimolaz.
secrezioni
Fegato
glicogenolisi
Manca innervazione
Vie biliari
Diminuzione flusso biliare
Contraz. aumento
flusso biliare
I RECETTORI PER L’ACETILCOLINA
RECETTORI MUSCARINICI
RECETTORI NICOTINICI
EFFETTI DELLA STIMOLAZIONE DEL SNA
Organo effettore
Simpatico
Parasimpatico
Rene
Vasocostrizione
Secrezione di renina
Manca innervazione
Vescica:
Detrusore
Trigone e sfinteri
Rilasciamento
Contrazione
Contrazione
Rilasciamento
Organi genitali:
Tessuto erettile
Manca innervazione
contraz. sfinteri
venosi: erezione
Effetti della stimolazione dei recettori muscarinici
Occhio
m. ciliare
m. sfintere iride
contrazione, visione da vicino
contrazione, miosi
Distribuzione e funzioni dei recettori nicotinici
Nicotinico neuronale NN
gangli del sistema nervoso autonomo
trasmissione del segnale
G. salivari e lacrimali
stimolazione della secrezione (M3)
midollare del surrene
secrezione di adrenalina
Bronchi
contrazione (M3)
stimolazione delle secrezioni
sistema nervoso centrale
Cuore
riduzione della frequenza (M2)
I muscarinici sono recettori a sette domini transmembrana
che regolano secondi messaggeri di tipo metabotropico
(cAMP e IP3)
Apparato gastrointestinale
aumento del tono e della motilità
rilascio degli sfinteri (M3)
I nicotinici sono recettori-canale permeabili allo ione Na+
Apparato genitourinario
contrazione della vescica (M2 e M3)
rilasciamento del trigono e sfinteri
IL RECETTORE NICOTINICO
La trasmissione neuromuscolare
Nicotinico muscolare NM
muscolatura striata
contrazione
FARMACI AGONISTI COLINERGICI
AGONISTI DIRETTI
• acetilcolina
• betanecolo
• carbacolo
• pilocarpina
AGONISTI INDIRETTI ad azione reversibile
• fisostigmina
• neostigmina
• edrofonio
AGONISTI INDIRETTI ad azione irreversibile
• organofosforici
• gas nervini
Il meccanismo d’azione dei farmaci
agonisti indiretti dell’acetilcolina
Impieghi terapeutici degli inibitori della colinesterasi
Effetti collaterali
Atonia della muscolatura liscia del tratto gastrointestinale
e urinario
Glaucoma: contrazione del muscolo sfintere della pupilla e del
muscolo ciliare con diminuzione della pressione
intraoculare per facilitazione dell’efflusso di umore
acqueo
Diarrea
Sudorazione
Miosi
Miastenia grave
Nausea
Intossicazione da anticolinergici
Cautela nei pazienti asmatici
Malattia di Alzheimer: tacrina, donepezil, rivastigmina 15-30%
dei pazienti ha mostrato miglioramento dei
sintomi cognitivi
Intossicazione da inibitori irreversibili
Miosi
Salivazione abbondante
Broncocostrizione
Ipersecrezione bronchiale
Bradicardia
Diarrea
Vomito
Scosse muscolari seguite da paralisi
Paralisi della muscolatura respiratoria
Confusione mentale
Coma
La morte è dovuta a paralisi respiratoria e può avvenire entro
5 minuti o 24 ore a seconda della dose, del composto e della via
di somministrazione.
Proprietà farmacologiche degli antimuscarinici
OCCHIO: Midriasi, Fotofobia, Perdita della capacità di
accomodazione: l’occhio rimane paralizzato sulla visione da
lontano, Riduzione della secrezione lacrimale
CUORE: tachicardia per blocco dei recettori M2 nel nodo SA
SECREZIONE SALIVARE: è bloccata. La bocca secca è un
sintomo frequente nei pazienti trattati con antimuscarinici
MOTILITA’ INTESTINALE: E’ inibita dallo stomaco fino
al colon. Le pareti intestinali sono rilassate, il tono e i movimenti
propulsivi sono diminuiti.
SISTEMA RESPIRATORIO: broncodilatazione e inibizione
delle secrezioni bronchiali
FARMACI ANTAGONISTI COLINERGICI
ANTIMUSCARINICI
• atropina
• scopolamina
• pirenzepina
• orfenadrina
BLOCCANTI NEUROMUSCOLARI
• tubocurarina (antagonista competitivo)
• pancuronio
• succinilcolina (agente depolarizzante)
Farmaci antimuscarinici
Atropina
Scopolamina
Butilscpolamina
Biperidene
Ciclopentolato
Orfenadrina
Pirenzepina
Prociclidina
Triesifenidile
Tropicamide
Usi terapeutici degli antimuscarinici
Morbo di Parkinson
Chinetosi
Oftalmologia
Medicazione preanestetica
Infarto del miocardio
Disturbi gastrointestinali
Disturbi infiammatori a carico della vescica
Avvelenamento da anticolinesterasici
Avvelenamento da funghi
EFFETTI COLLATERALI
DEI FARMACI ANTIMUSCARINICI
Antagonisti del recettore nicotinico
I curari competitivi
I curari competitivi
COMPETITIVI
d-tubocurarina
Diminuiscono la frequenza di apertura del canale, ma
non influenzano la conduttanza e la durata della
apertura del canale
DEPOLARIZZANTI
Succinilcolina
Tubocurarina
Pancuronio
Atracurio
Vecuronio
SENSIBILITA’ AI CURARI
CURARI DEPOLARIZZANTI
Agonisti del recettore nicotinico
lentamente idrolizzati dalla AchE
I primi ad essere bloccati sono i muscoli piccoli
Occhio
Braccia
Collo
Tronco
Intercostali
Diaframma
Curari depolarizzanti
Poiché depolarizzano come l’acetilcolina, aprendo il canale, c’è un
periodo iniziale di stimolazione caratterizzato da fascicolazioni.
La fase successiva è la paralisi flaccida dovuta alla desensitizzazione
del recettore.
Sensibilità: collo
braccia
gambe
tronco
facciali
masticatori
faringe
laringe
respiratori
poco influenzati
Diminuiscono l’ampiezza del potenziale di placca ad un
valore che non è sufficiente per dare il potenziale
d’azione
TOSSINA BOTULINICA
Interferisce con la trasmissione colinergica
Curari depolarizzanti
La tossina botulinica viene utilizzata in terapia per il
trattamento dello spasmo muscolare locale e nel
trattamento dei disturbi spastici dovuti a lesione
neurologica.
L’uso implica la somministrazione locale. I benefici
persistono per un periodo da settimane a mesi dopo
un singolo trattamento
Impieghi: blefarospasmo, emispasmo facciale,
torcicollo,
Effetti indesiderati
Blefarospasmo o emispasmo facciale
Lacrimazione, irritazione (secchezza oculare,
fotofobia)
Torcicollo
Disfagia, ristagno di saliva, secchezza della bocca,
cambiamenti di voce, ipostenia dei muscoli del collo,
nausea, difficoltà respiratoria (raro), visione
offuscata, sonnolenza, torpore, cefalea (dosi alte)
Sintomi principali della malattia di Parkinson
Malattia di Parkinson
Terapia della malattia
di Parkinson
• E’ una malattia neurologica di tipo
degenerativo
• Prevalenza 0.3% nella popolazione
generale
• Può insorgere ad ogni età, ma è più
frequente nell’anziano
• L’età media di esordio è a 55 anni, ma nel
10% dei casi esordisce prima dei 40 anni
• Bradicinesia - lentezza nell’inizio e
nell’esecuzione dei movimenti volontari
• Rigidità - aumentato tono muscolare e
resistenza ai movimenti passivi degli arti
• Tremore - si manifesta a riposo
• Instabilità posturale - alterazioni
dell’equilibrio
• Disturbi della deambulazione
Tardivamente in alcuni pazienti si possono
manifestare sintomi cognitivi (demenza) o
depressivi
Sintomatologia della malattia di Parkinson
Neurochimica della malattia di Parkinson
• Perdita di neuroni dopaminergici nella pars
compacta della substantia nigra che proiettano al
corpo striato; i sintomi non compaiono sinchè i livelli
di dopamina nel corpo striato non calano del 70-80%.
• Sbilanciamento tra i livelli dei neurotrasmettitori
acetilcolina e dopamina a livello dei gangli della
base.
DA
ACh
I SISTEMI DOPAMINERGICI
Ruolo fisiologico della dopamina
LE CATECOLAMINE
Recettori dopaminergici e loro distribuzione nel SNC
La sinapsi dopaminergica
FARMACI ATTIVI SUI SISTEMI DOPAMINERGICI
Agonisti indiretti: terapia del morbo di Parkinson
l-DOPA
Agonisti diretti: terapia del morbo di Parkinson e delle
Bromocriptina
iperprolattinemie
Inibitori delle MAO: morbo di Parkinson
Deprenil
Antagonisti recettoriali: terapia della schizofrenia
Aloperidolo
Sostanze attive sul trasportatore
Cocaina
Amfetamina
Circuiti neuronali coinvolti nella malattia di Parkinson
acetilcolina
GABA
dopamina
Farmaci che aumentano la funzione DAergica: l-DOPA
Farmaci che aumentano la funzione DAergica. I
Precursore della DA
L-DOPA (levodopa), si associa a inibitori della DOPA
decarbossilasi che non passano la barriera EE
L-DOPA + carbidopa
L-DOPA + benserazide
sinemet
madopar
• si tratta della terapia più efficace
• migliora la bradicinesia e la rigidità più che il tremore
Effetti collaterali della L-DOPA
Fasi iniziali della terapia:
• Anoressia, nausea e vomito nell’80% dei pazienti, per
stimolazione della chemoreceptor trigger zone;
controllabili con domperidone (peridon, motilium)
• Ipotensione ortostatica nel 30% dei pazienti
Terapia a lungo termine:
• Disturbi di tipo psicotico nel 20 % dei pazienti
(allucinazioni, deliri)
• Discinesie: movimenti anomali involontari
• Effetti “wearing off” e ”on/off”: fluttuazioni più o meno
improvvise dei sintomi motori, che si manifestano dopo
2 o più anni di terapia
Farmaci che riducono la funzione colinergica
Antagonisti muscarinici
triesifenidile
artane
biperidene
akineton
orfenadrina
disipal
Farmaci che aumentano la funzione DAergica. II
bromocriptina
lisuride
pergolide
parlodel
dopergin
nopar
Agonisti dopaminergici: non derivati dell’ergot
pramipexolo
mirapexin
ropinirolo
requip
• Mostrano una buona efficacia.
selegilina
jumex, egibren, seledat
• E’ un inibitore delle MAO-B, riduce il catabolismo
della DA.
• Si è pensato per un certo periodo che rallentasse la
progressione della malattia, ma ad oggi si è più
orientati a negare questa ipotesi.
• E’ utilizzato principalmente per ridurre l’effetto
“wearing off” della L-DOPA.
• Presentano effetti collaterali a breve termine simili a
quelli della L-DOPA.
Proprietà farmacologiche degli antimuscarinici
Altri farmaci utilizzati nella terapia
amantadina
SISTEMA NERVOSO CENTRALE
Biperidene, Orfenadrina, Prociclidina, Triesifenidile
Utilizzati nel morbo di Parkinson in associazione alla l-DOPA
• Esercitano la loro azione correggendo il relativo
eccesso di attività colinergica che si verifica in
seguito al deficit di DA.
• Sono molto meno efficaci della L-DOPA.
• Sono controindicati nei pazienti anziani, soprattutto
in presenza di disturbi cognitivi.
• Sono utili principalmente nelle forme di Parkinson
iatrogeno (indotto da farmaci antipsicotici).
Farmaci che aumentano la funzione DAergica. III
Agonisti dopaminergici: derivati dell’ergot
mantadan
• Si pensava che favorisse il release di DA.
• Oggi il meccanismo d’azione sembra da ricondurre
al blocco del recettore NMDA (N-metil-D-aspartato)
al quale si lega l’acido glutamico.
• L’efficacia sulla sintomatologia parkinsoniana é
modesta; ha un ruolo nel controllo delle discinesie
da trattamento cronico con levodopa.
• Gli effetti collaterali più importanti sono incubi,
confusione mentale, allucinazioni visive, "livedo
reticularis” (macchie sulle gambe), edema alle
caviglie.
Terapie neurochirurgiche
• Talamotomia, pallidotomia, nucleotomia subtalamica
• Stimolazione cerebrale profonda: talamo, pallido,
nucleo subtalamico
L’osteoporosi è una malattia scheletrica caratterizzata
da diminuzione della massa ossea e deterioramento della
microarchitettura del tessuto osseo con conseguente
aumento della fragilità dell’osso e della suscettibilità alle
fratture
Terapie all’orizzonte
• Fattori neurotrofici
• Farmaci neuroprotettivi
• Trapianti di cellule nervose o geneticamente
modificate
La soglia di frattura viene raggiunta molto prima nelle donne
in conseguenza alla perdita della funzione ovarica.
L’OSTEOPOROSI, condizione di fragilità scheletrica dovuta a
perdita progressiva di massa ossea, è la causa primaria di
invalidità negli anziani di entrambi i sessi.
Gli osteoblasti
Vita media
3 mesi
Vita media
2 settimane
Ciclo di remodeling dell’osso
L’esercizio fisico aumenta l’attività degli osteoblasti
Metabolismo del calcio
Assunzione ottimale di calcio
Alimento
ETA’
2-8 anni
1 g /die
9-17 anni
1,6 g/die
18-30 anni
anziani
Principali sorgenti dietetiche di calcio
1,1 g/die
> 1,5 g/die
Vitamina D e metabolismo del calcio
Metabolismo della vitamina D
Ca(mg/100g)
Latte
Yogurt
Formaggio
120
134
600-1000
Fagioli
Noci
Mandorle
Spinaci
Cavolo
65
75
250
160
200
Preparati di vitamina D e suoi metaboliti
Alfacalcidolo
Ergocalciferolo
Colecalciferolo
Calcifediolo
Calcitriolo
La vit. D si somministra nell’anziano
EFFETTI COLLATERALI DELLA VIT. D
Ipercalcemia: depositi di Ca nei tessuti molli
-nefrolitiasi
-nefrocalcinosi diffusa
Aumento della tossicità della digitale
TRATTAMENTO DELL’INTOSSICAZIONE
Sospensione immediata
Glucocorticoidi per diminuire l’assorbimento di Calcio.
(possono essere necessari periodi molto lunghi di
trattamento perché la vit D è liposolubile e si accumula
nel tessuto adiposo)
Siti d’azione degli ormoni calcemici sull’osso
PARATORMONE
INTESTINO: aumenta l’assorbimento del Ca
RENE: aumenta il riassorbimento del Ca
OSSO: Accelera la maturazione degli osteoclasti
A basse dosi aumenta l’attività degli osteoblasti
Calcitonina
E’ un peptide di 32 aa prodotto dalle cellule
parafollicolari della tiroide in risposta agli aumenti di
calcio nel plasma.
Effetti biologici
OSSO: Inibisce gli osteoclasti e rallenta la perdita
ossea
INTESTINO: aumenta l’assorbimento di Ca
Calcitonina
Non può essere somministrata per os in quanto
sarebbe degradata nel tratto gastrointestinale.
Viene somministrata (umana o di salmone) come
spray nasale
Bisfosfonati
Sono analoghi del pirofosfato (P-C-P) e hanno grande
affinità per il fosfato di Calcio.
Bisfosfonati di prima generazione: Etidronato
Clodronato (Clastenol)
Inibiscono la mineralizzazione
Bisfosfati di seconda generazione: Pamidronato
Alendronato
(Adronat, Alendros Fosamax)
Effetti collaterali: vampate, nausea, vomito diarrea
Bisfosfati di terza generazione: Tiludronato
Risedronato (maggior
CERVELLO: azione analgesica
potenza)
Non inibiscono la mineralizzazione
Bisfosfonati: effetti farmacologici
Inibiscono il riassorbimento osseo con una latenza
di 48 ore dopo la loro somministrazione.
Riducono l’attivazione e aumentano l’apoptosi degli
osteoclasti
Aumentano la densità ossea e riducono del 50% il
rischio di fratture
Bisfosfonati: meccanismo d’azione
Bisfosfonati
•Vengono somministrati per os lontano dai pasti, mai in
presenza di calcio che ridurrebbe il loro assorbimento.
Sono poco assorbiti (1-10%)
•Sono ben tollerati. Possono essere somministrati
ininterrottamente per più di 10 anni.
•Si fissano all’osso e mantengono i loro effetti anche
dopo sospensione della terapia
Steroidi sessuali e osso
Fluoruro di sodio
A basse dosi è un potente stimolatore della formazione
ossea
Meccanismo d’azione: -mitogenico per gli osteoblasti
-aumenta la stabilità della fase
minerale
Estrogeni
L’osso di ambo i sessi esprime identici livelli di recettori per estrogeni
e per androgeni.
Estrogeni e androgeni
Esercitano effetto antiapoptotico su osteoblasti e osteociti.
Controllano la funzione degli osteoclasti
Alte dosi (somministrazione continua giornaliera): tossico per
l’osso.
Estrogeni
Diminuiscono la produzione di citochine da parte degli
osteoblasti
Reazioni avverse: intolleranza gastrica
dolori agli arti inferiori
formazioni di tessuto osteoide
Diminuiscono la sensibilità scheletrica al PTH
E’ la terapia più efficace nell’osteoporosi post-menopausa
Dietilstilbestrolo
Estradiolo
Estriolo
Etinilestradiolo
Mestranolo
Quinestrolo
Possono essere somministrati :
IM - esteri dell’estradiolo
Per os - etinilestradiolo, mestranolo
Cerotto td – Estradiolo
Aumentano i recettori per la calcitonina
Sono metabolizzati dal fegato ed eliminati a livello renale
Effetti degli Estrogeni
Diminuiscono il riassorbimento dell’osso senza inibirne
la formazione.
Stile di vita e precauzioni per prevenire l’osteoporosi
Effetti collaterali degli
estrogeni
Aumentare l’assunzione di calcio
Diminuiscono l’incidenza di frattura dell’anca.
Limitare l’assunzione di alcol (diminuisce l’attività degli
osteoblasti e attiva gli osteoclasti)
Il trattamento deve iniziare entro 2-3 anni dalla
menopausa
Diminuire l’assunzione di sodio (aumenta l’escrezione
urinaria di calcio)
Incrementare l’attività fisica
Terapia sostitutiva in menopausa
Principali fattori di rischi per l’osteoporosi
Incidenza di fratture vertebrali in gruppi di pazienti con
osteoporosi post-menopausale
Età (avanzata)
Sesso (femminile)
Trattamento
Incidenza di fratture
su 1000 persone
Razza (caucasica e asiatica)
Nessuno
834
Costituzione (minuta o sottile)
Calcio + vit D
419
Menopausa
Calcio + vit D + estrogeni
181
Predisposizione familiare
calcio + vit D + estrogeni + fluoro
Stile di vita (fumo, alcol, scarso esercizio
fisico, dieta povera di calcio
53










