SOCIETÀ ITALIANA DI ENDOCRINOLOGIA
E DIABETOLOGIA PEDIATRICA
Logo azienda sanitaria
MODULO DI CONSENSO INFORMATO AD INDAGINI DIAGNOSTICHE
I/Il sottoscritti/o …………………..……..………..……..………..…………………………………
in
qualità
di
genitori/e
(rappresentanti/e
legali/e
del
minore)
…………………………………………………………………………………………………………
dichiarano/a di essere stati/o informati/o:
che il minore verrà sottoposto ad indagini che potranno prevedere la somministrazione per
via endovenosa od orale di una o più delle seguenti sostanze internazionalmente
utilizzate:
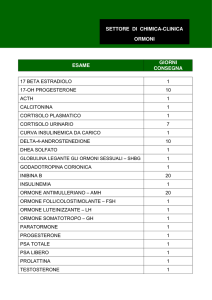
[ ] Arginina, [ ] Insulina, [ ] Clonidina, [ ] Glucagone, [ ] GHRH+Arginina;
[ ] GHRH (nella diagnosi del deficit dell’ormone della crescita);
[ ] TRH (nella diagnosi di tireopatie); [ ] GnRH (nella diagnosi di pubertà precoce; ritardi
puberali);
[ ] CRH, [ ] ACTH sintetico (nella diagnosi di patologia del surrene);
[ ] Soluzione glucosata per uso orale e/o endovenoso (nella diagnosi di intolleranza agli
zuccheri o diabete);
[ ] Test con HCG (nella diagnosi di patologia gonadica)
……..………………………………………..…………………………………………………………
……..………………………………………..…………………………………………………………
……..………………………………………..…………………………………………………………
In particolare, l'uso di:
TRH: ormone usato nella diagnostica di patologia tiroidea, che ha la funzione di stimolare
la produzione dell’ormone dell’ipofisi (TSH) che, a sua volta, consente una corretta
funzionalità della tiroide e nella valutazione di un altro ormone (prolattina) prodotto sempre
dall’ipofisi, il quale agisce a livello della ghiandola mammaria;
CRH: ormone usato nella diagnostica delle malattie della ghiandola del surrene, che ha la
funzione di stimolare la produzione dell’ormone ipofisario (ACTH) che, a sua volta,
consente una corretta funzionalità del surrene mediante produzione di cortisolo,
androstenedione, testosterone, aldosterone,
non sono autorizzati dal Ministero della Sanità, in quanto tuttora non registrati in Italia per
tale indicazione. Ciò nonostante, l’uso di tali ormoni è ormai noto e di prassi, in conformità
ai numerosi lavori apparsi su pubblicazioni scientifiche accreditate in campo internazionale
e nazionale (come da L. 08/04/1998 n° 94, Conversione D.L. 17/02/1998 n° 23, art. 3
comma 2);
che, qualora risulti necessario, il minore e/o i genitori verranno sottoposti ad a indagini di
genetica molecolare eseguite su materiale biologico (DNA o RNA) allo scopo di definire le
cause genetiche della malattia di cui si sospetta essere affetto il minore.
Autorizzano/o pertanto l’esame del materiale biologico per la ricerca di:
– geni noti legati alla patologia in oggetto
SI [ ]
NO [ ]
– altri geni legati alla patologia in oggetto
SI [ ]
NO [ ]
– geni legati ad altre patologie
SI [ ]
NO [ ]
Autorizzano/o la conservazione del materiale residuo:
–
–
–
–
–
presso il centro
SI [ ]
o presso una banca centralizzata
SI [ ]
nei limiti del mantenimento qualitativo possibile:
per la durata di anni cinque
SI [ ]
per più di 5 anni
SI [ ]
NO [ ]
NO [ ]
NO [ ]
NO [ ]
di essersi resi/o conto di quanto sia importante sottoporre il minore ad una indagine mirata
alla diagnosi del tipo di disfunzione: altrimenti, diversamente operando, non sarebbe
possibile confermare/escludere l’attuale sospetto di patologia;
Dichiarano/a, inoltre, di essere stati/o messi/o a conoscenza in particolare:
Del tipo di indagine
Delle modalità di esecuzione della stessa
Dei vantaggi ai fini di una precisa diagnosi
Dei rischi ad essa correlati
Nel caso specifico.
Le procedure prevedono una serie di prelievi a tempi stabiliti per la durata da 1 a 3 ore a
seconda del test previsto.
La quantità totale di sangue prelevato è limitata ed adeguata al peso corporeo del
bambino.
La somministrazione di arginina (una sostanza che stimola la produzione di ormone della
crescita) non comporta rischi. È segnalata una reazione infiammatoria (necrosi cutanea)
nel caso in cui il farmaco non sia iniettato in vena ma si diffonda nel sottocute (per rottura
della vena, fuoriuscita dell’ago, ecc.).
La somministrazione di insulina può provocare abbassamento della glicemia (zuccheri nel
sangue) e, conseguentemente, tremori, sudorazione, pallore e sonnolenza per un periodo
di tempo molto limitato (20-30 minuti) dalla sua somministrazione. Raramente si possono
manifestare convulsioni (solo in caso di ipoglicemia grave) o coma ipoglicemico: per tali
motivi, il test viene eseguito sottoponendo il paziente ad una assistenza qualificata
continua. In caso di ipoglicemia grave e prolungata il medico interromperà il test.
Considerando che l'insulina è controindicata nei soggetti con cardiopatia o malattie
neurologiche note, il sottoscritto dichiara che il minore non è affetto da tali patologie.
La clonidina (farmaco che agisce direttamente sul sistema nervoso centrale e serve a
stimolare la produzione dell’ormone della crescita) causa una ipotensione reversibile con
conseguenzte transitoria sonnolenza.
Il glucagone (sostanza che agisce indirettamente sul sistema nervoso centrale e serve a
stimolare la produzione dell’ormone della crescita) determina una ipoglicemia lieve (vedi
sopra) dopo 90-150 minuti dalla sua somministrazione.
Il GHRH (ormone che stimola direttamente la produzione dell’ormone della crescita) e il
CRH (vedi sopra) possono determinare un arrossamento facciale di breve durata e il TRH
(vedi sopra) un forte stimolo, ma temporaneo, ad urinare.
Quanto alla soluzione glucosata per uso endovenoso (necessaria per valutare la
l’intolleranza agli zuccheri e per escludere la presenza di un diabete, anche a
concentrazioni superiori a quelle previste dalle indicazioni correnti), si può,
accidentalmente, verificare che tale soluzione non venga iniettata in vena ma si diffonda
nel sottocute (per rottura della vena, fuoriuscita dell’ago, ecc.): in tal caso, si può
manifestare una reazione infiammatoria locale, rarissimamente di notevole entità.
Per valutare la secrezione dell’ormone della crescita, nei casi in cui il paziente presenti
una pubertà ritardata, il medico può ritenere opportuno, prima del test diagnostico,
sottoporre il paziente ad una pre-stimolazione della durata di 3 giorni: ai maschi viene
somministrato del testosterone (intramuscolo); alle femmine vengono somministrati degli
estrogeni per bocca. In tal caso, si possono verificare piccoli fastidi di lieve entità: nelle
femmine, nausea, mal di testa, piccole perdite vaginali, ecc.; nei maschi, irrequietezza,
arrossamento dei testicoli, irrigidimento del pene.
In occasione della consegna/firma del presente modulo, il sottoscritto richiede ulteriori
precisazioni in merito a:
……..………………………………………..…………………………………………………………
……..………………………………………..…………………………………………………………
……..………………………………………..…………………………………………………………
I/Il sottoscritti/o …………………………………………………….. dichiarano/a che il
Dott./Prof. ………………………………………………………. ha esposto quanto sopra in
modo chiaro e comprensibile ed ha risposto esaurientemente ad ogni quesito.
In data …………………………….. è stata consegnata copia del presente modulo al fine di
consentire una attenta lettura e valutazione di quanto sin qui esposto
Firma del ricevente ………………..………………………………………………………………
Essendo il paziente incapace di esercitare il proprio diritto al consenso in quanto
minorenne i/il sottoscritti/o ………………………………………………………………………..
…………..…………………………………..…………………………………………………………
in data ……………………………………... dichiarano/a di acconsentire in sua vece
all'esecuzione delle indagini precedentemente specificate apponendo la propria firma in
calce al presente modulo composto da 3 pagine.
(ulteriori dichiarazioni in merito alla rappresentanza legale del minore)
……..………………………………………..…………………………………………………………
……..………………………………………..…………………………………………………………
……..………………………………………..…………………………………………………………
Data ……………………………………
Firma per rilascio del consenso ………….…………………………………………………….
Il Medico: Dott./Prof. …………………………………… Firma ……………………………….
Persone eventualmente presenti:
…………………………………………………………………
…………………………………………………………………
…………………………………………………………………
Con la presente, i/il sottoscritti/o rilasciano/a espresso consenso anche al trattamento dei propri dati
personali [e di quelli del figlio/a] ai sensi della Legge 31.12.96 n° 675 sulla privacy per gli usi consentiti dalla
legge.
Data ……………………………………
Firma per rilascio del consenso ………….…………………………………………………….
Modulo predisposto da G. Bona°, A. Petri°, S. De Franco°, P. d'Agostino*, con
*Cattedra
di Diritto
Penale, Università
degli Studi
di Torino
il supporto
di Industria
Farmaceutica
Serono
S.p.A.
°Clinica Pediatrica di Novara, Università degli Studi del Piemonte Orientale
"A. Avogadro"
*Cattedra di Diritto Penale, Università degli Studi di Torino