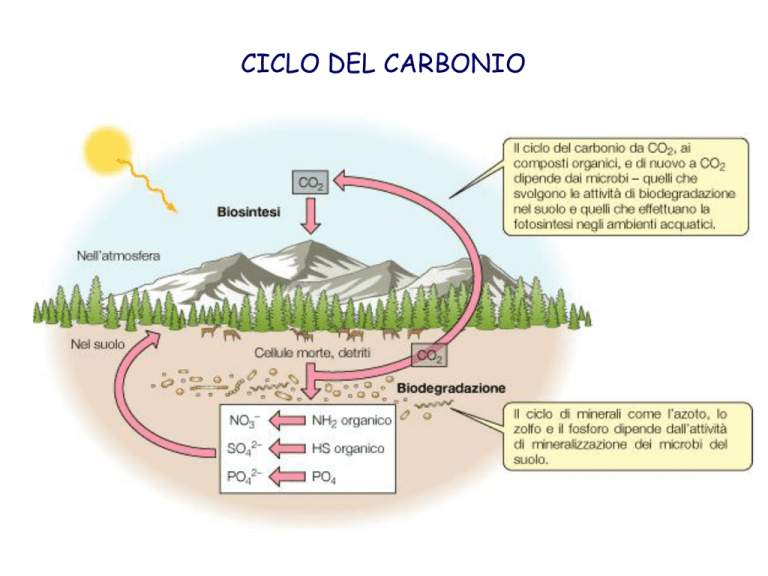
CICLO DEL CARBONIO
CICLO DEL CARBONIO
1. L’anidride carbonica è incorporata, o fissata, nei composti organici dai
fotoautotrofi e dai chemoautotrofi.
2. Questi composti organici rappresentano i nutrienti per i chemoeterotrofi.
3. I chemoeterotrofi rilasciano CO2 che è utilizzata dagli autotrofi.
4. Il carbonio è rimosso dal ciclo quando è incorporato in CaCO3 e
combustibile fossile.
La fissazione del Carbonio comporta la incorporazione del carbonio dalla
anidride carbonica in molecole organiche.
A. FISSAZIONE DI CO2 .
La fissazione fotosintetica del C è responsabile della grande
maggioranza del C fissato in natura. Coinvolge l’uso dell’energia
luminosa per fissare il C negli zuccheri (e successivamente nelle altre
molecole biologiche):
CO2 + H2O + energia -----> (CH2O)n + O2
La fissazione fotosintetica del C può avvenire in ambiente aerobio o anaerobio.
Nella reazione descritta, l’uso dell’acqua come donatore di elettroni ha come
risultato la formazione di ossigeno. Questo tipo di reazione è portata avanti da
organismi ossigenici come alghe, cianobatteri, e piante verdi. Donatori di
elettroni alternativi sono utilizzati da altri fissatori di C fotosintetici, come i
batteri sulfurei fototrofi verdi e rossi, che vivono in un ambiente anossigenico.
Distinguiamo due gruppi di organismi:
Fototrofi
aerobi - cianobatteri, alghe, piante verdi
anaerobi – batteri fototrofi verdi e rossi
Litotrofi
batteri che ossidano substrati inorganici – idrogeno batteri, batteri nitrificanti,
solfo ossidanti.
(CH2O)n + O2 -----> CO2 + H2O + energia
La Respirazione comporta l’ossidazione dei carboidrati
per ottenere energia. Può avvenire in ambiente aerobio o
anaerobio. Nella reazione descritta, l’ossigeno serve come
accettore di elettroni, e si ha la formazione di acqua.
Questa reazione avviene in tutti gli organismi viventi in
ambienti aerobi, compresi piante, animali e microorganismi.
Questa reazione è l’inverso della reazione di fissazione
del C in ambiente aerobio. Accettori di elettroni
alternativi sono usati dagli organismi che effettuano una
respirazione anaerobia in ambienti anossici.
La Fermentazione è un processo portato avanti dai
microrganismi in ambienti anossici, dove l’energia è
ottenuta dalla parziale ossidazioone delle molecole
organiche.
Il materiale vegetale rappresenta la fonte primaria per la formazione di
sostanza organica nel suolo. La biomassa totale, la sua composizione e le
sue proprietà sono i fattori chiave per la sua formazione e per i
processi di umificazione (la stabilizzazione a lungo termine di sostanze
organiche che previene la loro biodegradazione). Anche la biomassa
microbica rappresenta un comparto significativo per la formazione di
humus.
Nelle foreste i residui vegetali sono rappresentati principalmente da
foglie o aghi di conifere. I rami, le cortecce, i frutti, ne rappresentano
il 21% in climi freddi-temperati e il 20±40% in foreste conifere,
mentre il contributo della vegetazione erbacea ammonta a <5% nelle
foreste temperate. . Si stima che la massa totale del fogliame nelle
foreste conifere sia circa 200± 600 g d.m. m-2y-1. Simili dati si
ottengono anche per le foreste decidue.
In agroecosistemi gli input variano con il tipo e la quantità di residui
delle colture e delle applicazioni di fertilizzanti. Valori tipici di input di
letame di fattoria in Europa variano da 100 a 360 g di Carbonio m-2y-1 (
Parte del materiale organico è incorporato nel suolo i.e. come resicui di
radice e rizodeposizioni. La media globale: circa il 30, 50, e 75% della
biomassa totale radicale si trova nei primi 10, 20, e 40 cm di suolo.
Nella tundra, foreste boreali, e praterie temperate l’80±90% delle
radici si trova nei primi 30 cm, mentre nei deserti e nelle foreste
conifere temperate solo il 50% delle radici si trova nei primi 30 cm.
Due tipi di tessuto vegetale raggiunge il suolo per la decomposizione:
- Tessuto parenchimatico = foglie verdi, corteccia di rami giovani e
radici fini
- Tessuto legnoso = xilema, parte legnosa e il tessuto di supporto,
sclerenchima dei rami, epidermide delle folgie, cortecce.
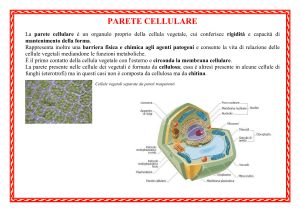
Le pareti cellulari legnose consistono di diversi strati (lamella mediana,
parete primaria, parete secondaria, parete terziaria) che si
differenziano per struttura e composizione chimica.
Per es. la lamella mediana, che agisce come legante tra le cellule,
consiste di pectina e nei tessuti legnosi di lignina. Le pareti consistono
in cellulosa, emicellulose e lignina.
La lamella mediana e la parete primaria contengono la più alta
concentrazione di lignina (40-60%).
I composti organici maggiormente rappresentati nei residui vegetali:
polisaccaridi e lignina.
Aghi abete: 20% cellulosa e lignina, 12% poliosi, 1± 5% proteine e 1 ±
6% ceneri. Foglie: 8 ± 14% ceneri, 10±19% emicellulose, 10±22%
cellulosa, 5±8% lignina e 2±15% proteine.
I PIU’ COMUNI POLIMERI VEGETALI
COMPONENTE
% IN PESO SECCO DELLA PIANTA
Cellulosa
Emicellulosa
Lignina
Proteine e acidi nucleici
15-60
10-30
5-30
2-15
A QUESTI SI DEVONO AGGIUNGERE: Chitina e Peptidoglicano
COMPOSIZIONE DI DIVERSI MATERIALI LIGNOCELLULOSICI
COMPONENTE
FAGGIO ABETE PAGLIA RISO PAGLIA GRANO
% IN PESO SECCO DELLA PIANTA
Cellulosa
Emicellulosa
Lignina
47-48
30-33
21-24
42-44
27-28
26-30
36-38
28-30
11-12
40-41
28-29
16-17
Proteine
Decomposte da un gran numero di microrganismi, hanno un alto tasso di
turnover.
Amido
Polisaccaride di riserva. L’amido è facilmente degradato da microbi
aerobi e anaerobi.
Consiste di due polimeri del glucosio, amilosio (25%) e amilopectina.
Amilosio: consiste in lunghe catene di alfa-D-glucosio connesse da legami
(1-4)-glicosidici, che producono una struttura terziaria a elica..
Amilopectina: composta da simili catene di glucosio, ma distinta
dall’amilosio per le ramificazioni laterali legate da legami (1-6)glicosidici. Tali ramificazioni avvengono dopo circa 24±30 unità di
glucosio.
Fruttani
Polisaccaride di riserva nelle piante erbacee. Decomposti facilmente dai
battei.Polimero solubile in acqua del fruttosio, con un alfa-D-glucosio
come gruppo terminale. Esempi: inulina e levani.
Polisaccaridi non cellulosici
Emicellulose. Decomposte da molti tipi di batteri e funghi.
Differiscono dalla cellulosa per composizione delle unità zuccherine
(pentosi, esosi, desossiesosi), catene laterali e ramificazioni. Gruppo di
polisaccharidi di differente composizione, consistente in unità
zuccherine simili alla cellulosa, legate da legami glicosidici, ma più o
meno ramificate e con un grado minore di polimerizzazione. Il contenuto
e la composizione delle emicellulose sono differenti nei residui di legno
di conifere o di piente decidue. Il legno deciduo contiene 3/4 di pentosi
e 1/4 di esosi, mentre nelle conifere il rapporto è inverso.
Polisaccaridi non cellulosici
Xilani
Gli xilani sono emicellulose diffuse consistenti in of unità (1-4)glicosidiche di beta-D-xilosio. In più contengono anche altre sostanze,
come, alfa-L-arabinosio e acido 4-O-metil-D-glucuronico legati nella
posizione C2 o C3 dello xilosio. Comprendono il 5±30% dei polisaccaridi
dei tessuti legnosi.
Mannani
Composti di catene di beta-D-mannosio legato con legami (1-4)glicosidici.
Pectine
Polisaccaridi complessi e altamente ramificati, consistono
principalmente di galattosio, arabinosio, acidi exuronici.
Formano la sostanza di legame tra le cellule, specie nelle piante erbacee
e nei frutti e sono presenti nella parete primaria.
Rappresentano una piccola proporzione dei tessuti legnosi (circa 1%)..
Decomposte da molti tipi diversi di batteri e funghi. Tasso di
decomposizione più alto di quello della cellulosa.
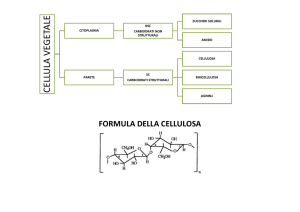
Cellulosa
Componente strutturale maggiormente rappresentato nelle pareti
vegetali, è il biopolimero più abbondante.
La cellulosa è un polimero lineare di glucano composto da unità di
glucosio (>10 000) che sono legate da legami beta-(1-4)- glicosidici.
L’arrangiamento regolare dei gruppi idrossilici lungo la catena porta alla
formazione di ponti H e ad una struttura fibrillare con proprietà
cristalline. Circa il 15% della molecola di cellulosa ha una struttura
amorfa. Le fibrille di cellulosa costituiscono la struttura di base, che è
strettamente associata con emicellulose e nelle pareti legnose con
lignina.
Parete cellulare
Cellula vegetale
Fibrilla
Microfibrilla
Cellulosa
Lignina
Macromolecola tridimensionale formata da unità di fenilpropano.
Riempie le pareti cellulari di piante vascolari, felci, fornendo una
rigidità strutturale. Alghe e microrganismi non contengono lignina.
Insieme alle emicellulose, si trova nella parete primaria, secondaria e
nella lamella mediana . Serve da connessione tra le cellule e rinforza le
pareti cellulari del tessuto xilematico. Inoltre protegge le cellule
dall’attacco dei microrganismi patogeni. Dopo i polisaccaridi, è il più
abbondante biopolimero in natura.
Le unità strutturali della lignina sono gli alcooli coniferilico, sinapilico e
cumarilico.
I monomeri reagiscono attraverso polimerizzazione deidrogenativa per
formare una macromolecola tridimensionale che contiene molti legami CC e eteri.
La maggior parte dei legami della lignina non sono idrolizzabili.
La lignina nelle gimnosperme, angiosperme e erbacee è classificata in
base alle differenze nella composizione delle unità. Nelle gimnosperme è
composta quasi escusivamente di monomeri derivati dall’alcool
coniferilico. Nelle angiosperme contiene circa uguali proporzioni di unità
di guaiacil propano e siringil propano units, derivati dall’acool sinapilico.
La lignina delle piante erbacee è composta di proporzioni uguali di guaiacil
propano, siringil propano e p-idrossifenil propano.
Le proporzioni di alcool coniferilico, sinapilico e cumarilico sono circa
94:1:5 nella lignina di abete, 56:40:4 nella lignina di faggio e 1:1:1 nelle
piante erbacee.
Parte delle cellulose o emicellulose è legata alla lignina attraverso il
cosiddetto complesso ligno-cellulosico- o lignin-polisaccaride. La
struttura di questo complesso è ancora poco chiara. Sia tenuto insieme
da legami idrogeno e covalenti. La lignina è resistente alla degradazione
microbica. Solo pochi funghi dono capaci di decomporla completamente ad
anidride carbonica e acqua. Altri funghi inducono cambiamenti
strutturali. Nel suolo, agiscono consorzi microbici. La decomposizione è
un processo ossidativo e non avviene in anaerobiosi.
Tannini
I tannini sono polifenoli
presenti nelle piante
superiori. Capaci di
precipitare le proteine in
soluzione acquosa.
PRIMA TAPPA DELLA DEGRADAZIONE DELLA S.O.
Tra i più importanti batteri del suolo eterotrofi:
Attinomiceti (Streptomyces, G+ aerobio filamentoso, rappresenta dal 5
al 20% dei coltivabili), Bacillus (G+ aerobio, rappresenta 2-10% dei
coltivabili), Clostridium (G+ anaerobio), Arthrobacter (aerobio, fino al
40% dei batteri coltivabili), Pseudomonas (G- , rappresenta 10-20% dei
coltivabili).
BIOMASSA DEI MAGGIORI COMPONENTI DEL BIOTA IN UN
SUOLO TEMPERATO COLTIVATO A PRATO
SOIL BIOTA
BIOMASSA (ton/ha)
Radici piante
Batteri
Attinomiceti
Funghi
Protozoi
Nematodi
Lombrichi
Altri animali
fino a 90, ma generalmente circa 20
1-2
0-2
2-5
0-0.5
0-0.2
0-2.5
0-0.5
CELLULOSA
Insolubile in acqua
IN NATURA LA MAGGIOR PARTE E' DEGRADATA IN AEROBIOSI:
C6H12O6+6H2O = 6CO2+6H2O
I microrganismi cellulosolitici, sono in natura sempre associati ad altri
non cellulosolitici, che utilizzano il glucosio, rimuovendolo dal substrato ed
impedendo la inibizione della degradazione.
Esempio: Sporocytophaga sp. ed un batterio non cellulosolitico come
Flavobacterium sp., vivono in consorzio. Isolati in co-coltura da fanghi,
trasferita la co-coltuta per mesi in lab., è stabile. E molto più efficiente
della Sporocytophaga da sola.
La degradazione della cellulosa dipende dalla azione sinergica dei 3 enzimi.
ENZIMI EXTRACELLULARI - INDUCUBILI
Glucosio prodotto finale, causa la repressione da cataboliti della
produzione di ENDO-b-1,4-glucanasi, alla concentrazione di 50 mg/l.
Struttura e degradazione enzimatica della cellulosa. Tre tipi di enzimi sono coinvolti nella
degradazione completa della catena nelle unità di glucosio che la costituiscono, e alcuni di questi
enzimi esistono in forme multiple di diversa massa molecolare. Collettivamente prendono il nome
di ‘cellulasi’ o, più precisamente, di complesso enzimatico cellulasi.
I tre principali enzimi per la degradazione della cellulosa:
(1) Una endoglucanasi (endo-ß-1,4-glucanasi), che agisce a caso all’interno
della catena di cellulosa, rompendo le molecole in frammenti più piccoli. Questo
enzima si trova in diverse forme –da circa 11.000 a 65.000 Da.
(2) Una esoglucanasi (eso-ß-1,4-glucanasi o cellobiohydrolase) che agisce
solo alle estremità della catena, rilasciando unità di cellobiosio. Questo enzima è
più uniforme della endoglucanasi, e va da 50,000 a 60,000 Da.
(3) ß-glucosidasi (o ‘cellobiasi’), che rompe il disaccaride cellobiosio in due
molecole di glucosio, che può essere assorbito dal fungo. Questo è un enzima
legato alla parete, come molti enzimi coinvolti negli stadi finali della degradazione
dei polimeri.
I tre enzimi agiscono sinergicamente e sono strettamente regolati, per assicurare che un fungo
che degrada la cellulosa non rilasci zuccheri ad un tasso più veloce di quello di assorbimento.
Le endoglucanasi, attaccando le catene di cellulosa a random, progressivamente creano più
estremità libere sulle quali può agire la cellobioidrolasi.
Il cellobiosio prodotto può legarsi al sito attivo della cellobioidrolasi, e inibire competitivamente
l’azione enzimatica. Così, se il cellobiosio si accumula, il tasso di degradazione della cellulosa
diminuisce automaticamente, and questo tipo di regolazione lega il tasso di degradazione al tasso
di assorbimento ed utilizzazione del glucosio da parte del fungo.
Inoltre, la regolazione della degradazione della cellulosa è ottenuta attraverso il sistema
comunemente utilizzato a feedback, chiamato repressione da cataboliti, in cui i geni che
codificano per gli enzimi sono repressi quando substrati più prontamente utilizzabili (come il
glucosio) sono disponibili nell’ambiente.
IL 5-10% DELLA CELLULOSA E' COVERTITA ANAEROBICAMENTE IN METANO:
C6H12O6 = 3CH4+3CO2
ALCUNI MICRORGANISMI CAPACI DI UTILIZZARE LA CELLULOSA
FUNGHI
Chaetomium cellulolyticum
Humicola grisea
Thrichoderma reesei
Trichoderma koningii
Polyporus versicolor
BATTERI
Aerobi
Cellulomonas
Bacillus
Cellvibrio
Cytophaga
ATTINOMICETI
Streptomyces
Micromonospora
Nocardia
Anaerobi
Clostridium cellobioparum
Clostridium thermocellum
http://www.microbelibrary.org/library/fungi/3180-soil-actinomycetes
ATTINOMICETI
Presenti ed attivi cellulosolitici anche in sedimenti marini ed a 3.5% NaCl
Attivi al pari di Trichoderma viride
Thermoactinomyces e Thermomonospora più efficienti di T. viride, attivi anche a
65°C.
BATTERI ANAEROBI
Dove? Rumine, digestori di fanghi, terreno, compost, sedimenti marini.
Acetovibrio cellulolyticus, anaerobio obbligato, attivo a temperature da 20 a 40°C.
Prodotti finali: H2, CO2, acetato, tracce etanolo, butanolo, fino a CH4.
CO2+4H2 = CH4+2H2O
METANOBATTERI
2CO2+4H2 = CH3COOH+2H2O
ACETOGENICI
l'ACETATO, FORMATO DIRETTAMENTE DALLA CELLULOSA PER
FERMENTAZIONE, è UN PRECURSORE DEL CH4 in anaerobiosi.
ACETATO CONVERTITO IN CH4 E CO2 DAI METANOGENI Methanosarcina,
Methanobacterium, Methanococcus:
CH3COOH = CH4+CO2
SE E' PRESENTE SOLFATO, E' RIDOTTO PREFERENZIALMENTE INVECE DELLA
CO2, CIOE' ESISTE COMPETIZIONE PER H2 TRA SOLFATO-RIDUTTORI E
METANOGENI
Clostridi, anaerobi stretti.
C. thermocellum, termofilo: i suoi enzimi danno come prodotti CELLOBIOSIO E
DESTRINE che entrano nella cellula e attraverso la cellobiosio fosforilasi producono
glucosio-1-fosfato e glucosio, poi fermentati attraverso la glicolisi, = piruvato, ed in
seguito a fermentazione H2, CO2, acetato, etanolo.
EMICELLULOSE
Processo di degradazione simile a quello della cellulosa. Siccome la molecola è più
eterogenea, sono coinvolti più enzimi extracellulari.
ENDOENZIMI che tagliano i legami interni a caso
ESOENZIMI che erodono la molecola dall'esterno, come nella cellulosa.
PRODOTTI DI DEGRADAZIONE: anidride carbonica, acqua, piccoli carboidrati
monomeri e dimeri.
NEL COMPLESSO PRENDONO IL NOME DI EMICELLULASI
MICRORGANISMI CHE UTILIZZANO LE EMICELLULOSE
_________________________________________________________________
BATTERI
Bacillus
Mannano, xylano
Pseudomonas
Xylano
Cytophaga
Galattano
ATTINOMICETI
Streptomyces
Mannano, xylano
FUNGHI
Trichoderma
Arabano
Chaetomium
Arabinoxylano
Aspergillus
Arabano, mannano
_________________________________________________________________
AMIDO
Degradato dalle AMILASI: enzimi extracellulari, consistenti in
Alfa- 1, 4 eso ed endoglucanasi.
- AMILOSIO degradato completamente. AMILOPECTINA decomposta parzialmente per
la presenza dei legami 1, 6, su cui le AMILASI sono inattive. Intervangono enzimi del tipo
AMILO- ALFA- 1, 6 GLUCOSIDASI.
Batteri: Bacillus subtilis, B. cereus, Clostridium.
Funghi: moltissimi.
LIEVITI NON SONO AMILOLITICI.
CHITINA
E' UN AMINOZUCCHERO ACETILATO. COSTITUITA DA SUBUNITA' DI NACETILGLUCOSAMINA LEGATE DA LEGAMI BETA I, 4.
MOLECOLA LINEARE
ENZIMI: CHITINASI, che rompono il polimero a partire dalle estremità, dando luogo
alla formazione di unità di DIACETILCHITOBIOSIO, che è successivamente idrolizzato
al monomero di acetilglucosammina da ACETILGLUCOSAMINIDASI.
Dopo diacetilazione, si hanno: GLUCOSAMINA, ACIDO ACETICO, GLUCOSIO,
AMMONIACA.
Microrganismi piu' attivi: ATTINOMICETI
LIGNINA
La casualità del processo di polimerizzazione rende il processo enzimatico di degradazione
piu' difficile. I tassi di degradazione sono molto più lenti di quelli della cellulosa. Si
degrada lentamente anche perché oltre ad essere un polimero eterogeneo contiene molti
residui aromatici.
UN ENZIMA EXTRACELLULARE NON SPECIFICO, LA LIGNINA-PEROSSIDASI H2O2DIPENDENTE E' USATO CON UN ENZIMA EXTRACELLULARE, UNA OSSIDASI CHE
GENERA H2O2. LA PEROSSIDASI E LA H2O2 GENERANO RADICALI LIBERI CHE
REAGISCONO CON LA LIGNINA E RILASCIANO RESIDUI DI FENILPROPANO,
SUCCESSIVAMENTE DEGRADATI DAI MICRORGANISMI.
LA DEGRADAZIONE DELLA LIGNINA E' AEROBIA, IN QUANTO E' NECESSARIO
L'OSSIGENO ATTIVO PER POTER RILASCIARE I RESIDUI
Il legno intatto è prima attaccato dagli enzimi dei funghi del marciume bruno, che agiscono
su cellulose ed emicellulose: i rami si spezzano e rilasciano una polvere scura consistente in
LIGNINA liberata.
Contemporaneamente e sequenzialmente agiscono gli enzimi dei funghi del marciume
bianco, che degradano la lignina ad anidride carbonica ed acqua, rilasciando residui di
cellulosa morbidi e fibrosi.
Componenti strutturali della lignina, con le tre unità di fenil-propano e con
i tre principali tipi di legame chimico che li unisce. Nel riquadro rosso, una
una piccola parte della molecola della lignina.
Rottura degli anelli aromatici. A sinistra: durante la degradazione della lignina, per il processo
di orto fissione. A destra: durante la degradazione dei pesticidi e altri xenobiotici, per meta
fissione. Initialmente l’anello è sostituito da due gruppi idrossili sugli atomi di C adiacenti. Poi
l’anello è aperto sia tra questi due C (orto fissione) o vicino ad uno di essi (meta fissione).
DEGRADAZIONE LIGNINA: PROCESSO OSSIDATIVO COMPLESSO
COME PER LA FORMAZIONE, E' INDIRETTO E CASUALE
Fungo del marciume bianco più studiato:basidiomicete Phanerochaete chrysosporium
LA DEPOLIMERIZZAZIONE DELLA LIGNINA PRODUCE UNA VARIETA' DI FENOLI,
ALCOOL, ACIDI AROMATICI. ALCUNI SONO MINERALIZZATI A CO2 ED H2O, MA
ALTRI DANNO LUOGO A COMPOSTI UMICI.
Si hanno anche processi di ripolomerizzazione spontanea, o catalizzati da
polifenolossidasi, laccasi e perossidasi microbiche.
I RESIDUI DEI FENILPROPANI, COMPOSTI AROMATICI, SONO SIMILI IN
STRUTTURA A DIVERSI TIPI DI MOLECOLE INQUINANTI ORGANICHE COME
BENZENE, TOLUENE, XYLENE, COMPOSTI POLIAROMATICI. Le vie naturali per la loro
biodegradazione sono importanti per la Bioremediation. Ad esempio, Phanerochete
chrysosporium è capace di degradare diverse molecole inquinanti con strutture simili a
quelle della lignina.
MICRORGANISMI CHE DEGRADANO E/O MODIFICANO LA LIGNINA
Organismo
Modifica p.mol.
EUCARIOTI
Funghi marciume bianco
Pleorotus osteratus
Phanerochaete chrysosporium
Coriolus verisicolor
Funghi marciume bruno
Lenzites trabea
Lentinus lepideus
Funghi marciume molle
Thielavia terrestris
Chaetomium piluliferum
PROCARIOTI
Sreptomyces badius
Bacillus megaterium
Pseudomonas spp.
Degradazione completa
+
+
+
+
+
+
+
+
-
+
+
nd
nd
+
+
+
nd
nd
nd
Parte di un tronco di pino con il caratteristico aspetto a mattoncini causato dalla
degradazione del legno ad opera dei funghi del marciume nero.
Fasi della mineralizzazione della sostanza
organica vegetale nel suolo