Capitolo 18 • Dotto arterioso previo
157
Capitolo 18
Dotto arterioso pervio
Descrizione della lesione
Il dotto arterioso pervio (PDA) consiste nella presenza di una comunicazione che connette la porzione prossimale dell’arteria polmonare sinistra
all’aorta discendente toracica, appena distalmente all’origine dell’arteria
succlavia di sinistra (Fig. 18.1). Durante la vita fetale il PDA è una struttura vitale per bypassare la circolazione polmonare convogliando il sangue
dal ventricolo destro all’aorta discendente toracica. Il PDA fu per la prima
volta descritto da Galeno nel 131 d.C.
La forma e la dimensione del dotto arterioso pervio possono variare
molto e hanno un impatto sulla fisiopatologia e sulla possibilità della chiusura con cateterismo interventistico. Dal punto di vista clinico il PDA nell’adulto può presentarsi nelle forme seguenti.
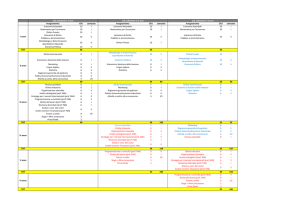
Dotto arterioso
pervio con shunt
sistemico-polmonare
A
AS
P
AD
VS
VD
Figura 18.1 Dotto arterioso pervio con shunt sinistro-destro. AD, atrio destro; VD, ventricolo destro; AS, atrio sinistro; VS, ventricolo sinistro; A, aorta; P, arteria polmonare
158 Cardiopatie congenite
• Silente: piccolo PDA diagnosticato occasionalmente (generalmente attraverso una
ecocardiografia); assenza di soffi cardiaci.
• Piccolo: presenza di soffio cardiaco lungo eiettivo, o continuo irradiato posteriormente. Piccole modifiche emodinamiche. Normali polsi periferici, normali dimensioni delle sezioni cardiache sinistre senza segni di ipertensione polmonare.
• Medio: polsi periferici scoccanti (come nell’insufficienza aortica severa). Soffio continuo facilmente auscultabile. Dilatazione dell’atrio sinistro e del ventricolo sinistro
e vari gradi di ipertensione polmonare (normalmente reversibile).
• Grande: normalmente negli adulti con fisiologia di Eisenmenger. Segni di ipertensione polmonare. Assenza di soffio continuo. Cianosi differenziale (saturazione della porzione inferiore del corpo, più bassa che al braccio destro) e dita a bacchetta
di tamburo.
Anomalie associate
• Nei pazienti pediatrici sono frequenti anomalie associate.
• Coartazione dell’aorta e difetto interventricolare (DIV) sono le forme
più frequenti.
• Anello vascolare (normalmente PDA posto a sinistra con arco aortico
destro).
• Il PDA è sempre presente alla nascita nei pazienti con cardiopatia congenita associata a ridotto o interrotto flusso polmonare o sistemico
(come nei pazienti con atresia polmonare o sindrome del cuore sinistro
ipoplasico). La circolazione in queste situazioni è dotto-dipendente, e la
pervietà del dotto arterioso è fondamentale per garantire la vita al
paziente fino al momento della chirurgia.
Incidenza ed eziologia
• 12%; la terza forma più comune di cardiopatia congenita.
• Lesione frequente nei prematuri (0,8%) e nelle forme materne di rosolia.
Presentazione e decorso in età pediatrica
• La maggior parte dei bambini con PDA è asintomatica.
• I neonati possono presentarsi con scompenso cardiaco quando è presente un grande PDA, causa di iperafflusso polmonare (normalmente
dopo la prima settimana di vita, quando le resistenze vascolari polmonari cadono e raggiungono i livelli normali).
• Alcuni neonati possono presentarsi con soffio cardiaco e polsi scoccanti.
• Altri bambini con PDA grande e non restrittivo spesso sviluppano una
malattia vascolare polmonare irreversibile (normalmente all’età di 18-24
mesi), che gradualmente limita il flusso polmonare. In queste situazioni un
rinforzo della componente polmonare del secondo tono cardiaco è la caratteristica più chiara, con marcata riduzione o scomparsa del soffio sistolico.
Capitolo 18 • Dotto arterioso previo
159
Decorso in età adulta
• I pazienti con un piccolo, silente PDA hanno una aspettativa di vita normale.
• Un’aspettativa di vita normale vale anche nei pazienti che sono stati sottoposti a chiusura chirurgica o transcatetere del PDA in periodo neonatale o nella prima infanzia. Particolare attenzione dovrebbe essere
data ai pazienti che, al momento della chiusura del PDA, hanno avuto
un aumento delle resistenze vascolari polmonari. Questi pazienti possono presentarsi in seguito con sintomi di ipertensione polmonare.
• Anche i pazienti con PDA di dimensioni medie possono presentarsi
durante l’età adulta (Fig. 18.2). La manifestazione clinica tardiva può
essere un soffio continuo e polsi scoccanti o lo sviluppo di una dilatazione delle sezioni sinistre del cuore e uno shunt sinistro-destro dipendente dal grado di ipertensione polmonare. La maggior parte dei pazienti adulti con un PDA medio diverrà sintomatica con dispnea e/o palpitazioni (fibrillazione atriale secondaria alla dilatazione atriale sinistra
prolungata), ma può insorgere anche un franco scompenso cardiaco.
• Un grande PDA è raro nell’età adulta, poiché la maggior parte dei
pazienti è stata trattata nel periodo neonatale o nell’infanzia. L’ipertensione polmonare è la regola e può anche non regredire completamente
alla chiusura del difetto. La maggior parte dei pazienti con un grande
PDA è sintomatica, con dispnea e palpitazioni. L’Eisenmenger da PDA ha
la stessa prognosi dell’Eisenmenger per DIV, anche se i sintomi possono
essere meno marcati e la tolleranza allo sforzo fisico migliore (vedi
Capitolo 20).
Esame fisico
• Saturazione dell’ossigeno: dovrebbe essere normale nelle forme di PDA piccolo o
moderato. Si rileva cianosi differenziale nelle forme di PDA grande, in presenza di
ipertensione polmonare, con la parte inferiore del corpo (dopo il PDA) desaturata
con piedi blu e scuri e mani rosa.
• Caratteristiche d’ampiezza dei polsi femorali.
• Polsi scoccanti: suggeriscono un importante run-off aortico con ampio shunt sinistro-destro.
• Ritmo: normalmente sinusale.
• Toni cardiaci: particolarmente presenti a sinistra nelle forme con ampio shunt e
dilatazione delle sezioni cardiache sinistre.
• Soffio continuo: tipico del PDA medio e dello shunt sinistro-destro senza ipertensione polmonare.
• Prolungato soffio sistolico: suggestivo per un PDA piccolo.
• Ventricolo destro sollevato: con ipertensione polmonare secondaria a un ampio
PDA non restrittivo.
• Soffio cardiaco diastolico: soffio da flusso mitralico all’apice.
• Soffio cardiaco pansistolico: dovuto a un piccolo DIV.
160 Cardiopatie congenite
Indagini strumentali utili
• Radiografia del torace: spesso normale; può evidenziare cardiomegalia
(per PDA medio e grande); possono essere presenti calcificazioni del
PDA.
• ECG: di regola normale; ipertrofia ventricolare sinistra nei PDA grandi;
ipertrofia ventricolare destra in caso di ipertensione polmonare.
• Ecocardiogramma: normalmente diagnostico (Fig. 18.2); l’ecocardiografia transesofagea è raramente indicata.
• Cateterismo cardiaco (Fig. 18.2): per la chiusura transcatetere delle
PDA. Si prenda in considerazione una coronarografia nei pazienti oltre
i 40 anni di età.
• Altri test: non indicati.
La chiusura del PDA negli adulti dovrebbe essere presa in considerazione
nelle seguenti situazioni.
• Presenza di PDA a eccezione di (1) dotti silenti molto piccoli e (2)
malattia vascolare polmonare irreversibile.
a
b
Figura 18.2 Dotto arterioso
pervio medio (angiografia ed
ecocardiogramma). a Aortografia in paziente con dotto arterioso pervio (PDA) restrittivo di
misura piccola o media prima
della chiusura transcatetere. Il
termine restrittivo denota assenza di malattia vascolare polmonare irreversibile. b Flusso
Doppler continuo nello stesso
paziente che evidenzia una elevata velocità, superiore ai 4 m/s
sia durante la sistole che la diastole, a indicare una bassa pressione arteriosa polmonare. Le
principali indicazioni alla chiusura del PDA in questo paziente
sono l’arresto della dilatazione
delle sezioni cardiache sinistre
dovuta a sovraccarico di volume e l’eliminazione del rischio
di endocardite
Capitolo 18 • Dotto arterioso previo
161
• Episodio di endocardite, indipendentemente dalle dimensioni del PDA.
• La chiusura dei PDA molto piccoli e non auscultabili rimane controversa e
non dovrebbe essere eseguita di routine, nonostante la semplicità dell’intervento transcatetere e dato il rischio di endocardite estremamente basso.
• Se l’ipertensione polmonare è presente (pressione polmonare arteriosa
superiore ai 2/3 della pressione arteriosa sistemica o resistenze polmonari arteriolari superiori ai 2/3 delle resistenze arteriolari sistemiche), ci
deve essere un netto shunt sinistro-destro di 1,5:1 o più, o un’evidente reattività polmonare con studi di reversibilità, o in casi particolarmente selezionati, una biopsia polmonare con netta evidenza che le modificazioni
arteriolari polmonari sono ancora potenzialmente reversibili.
Gestione chirurgica o transcatetere
• Al giorno d’oggi la chiusura con dispositivo è il metodo di scelta per la
stragrande maggioranza dei PDA e nella stragrande maggioranza dei
centri. Se possibile la si dovrebbe pianificare in concomitanza con il
cateterismo diagnostico. Una ecocardiografia transtoracica pre-intervento normalmente fornisce informazioni indirette sull’entità dello
shunt sinistro-destro e sulla pressione polmonare.
• La presenza di calcificazioni del dotto aumenta il rischio chirurgico, in
favore della chiusura transcatetere. Qualora la chiusura chirurgica dovesse essere eseguita, indipendentemente dalle motivazioni, i pazienti
dovranno essere sottoposti alla divisione del dotto, spesso in bypass cardio-polmonare, in quanto normalmente la legatura del PDA è inefficace.
• La chiusura chirurgica del PDA dovrebbe essere riservata ai pazienti con
un dotto troppo grande per la chiusura transcatetere. Assai raramente,
l’anatomia del dotto può essere così alterata (aneurisma del dotto o dotto post-endocardite) da rendere impossibile la chiusura transcatetere.
Gestione medica
• Consiste prevalentemente nel trattamento delle complicazioni associate
al sovraccarico di volume delle sezioni sinistre quali tachiaritmia atriale e, occasionalmente, ipertensione polmonare (vedi Capitolo 20 per il
trattamento dei pazienti con fisiologia di Eisenmenger).
Outcome a lungo termine
Chiusura transcatetere
• Nella maggior parte dei casi si ottengono ottimi risultati usando differenti dispositivi (Fig. 18.3).
162 Cardiopatie congenite
Figura 18.3 Chiusura transcatetere con coil di un piccolo dotto arterioso pervio (PDA).
Approccio transvenoso. Si noti il sistema di rilascio attraverso l’arteria polmonare, attraverso il PDA all’interno dell’aorta discendente toracica (in alto a sinistra), la porzione
distale del coil viene rilasciata all’interno dell’aorta (in alto al centro e a destra), il coil e il
sistema di rilascio vengono tirati indietro all’interno del PDA (in basso a sinistra e nel
mezzo) infine la porzione prossimale del coil viene rilasciata e il sistema di rilascio viene
rimosso (in basso al centro e a destra)
• Più dell’85% dei dotti è chiuso completamente a un anno dall’impianto.
• L’embolizzazione del dispositivo (normalmente nell’arteria polmonare
sinistra) può verificarsi ma è rara, e normalmente il dispositivo può
essere recuperato per via percutanea.
• In un piccolo gruppo di pazienti possono rendersi necessari un secondo o eventualmente un terzo dispositivo per la chiusura completa. Tale
operazione viene generalmente posposta da un minimo di sei mesi a un
anno dal primo intervento per dare tempo alla potenziale chiusura
spontanea.
• La ricanalizzazione è rara, ma può avvenire.
Chiusura chirurgica
• Più del 95% dei dotti può essere chiuso chirurgicamente. La ricanalizzazione è rara, ma nota.
• Le complicanze post-operatorie possono includere una lesione ricorrente del nervo laringeo o del nervo frenico e una lesione del dotto
toracico.
Capitolo 18 • Dotto arterioso previo
163
Raccomandazioni per il follow-up
• I pazienti sottoposti a chiusura chirurgica del PDA possono beneficiare
di valutazioni cardiologiche periodiche non frequenti, poiché può avvenire la ricanalizzazione, o possono persistere o svilupparsi problemi
residui (ipertensione polmonare, disfunzione ventricolare sinistra,
fibrillazione atriale).
• I pazienti sottoposti a chiusura del PDA con dispositivo devono ugualmente essere seguiti con follow-up, in quanto i risultati a lungo termine di tale procedura non sono ancora conosciuti.
Raccomandazioni per l’endocardite
• La profilassi dell’endocardite batterica è suggerita per sei mesi dopo la
chiusura del PDA sia chirurgica che transcatetere, e per il resto della vita
se persistono difetti residui.
• Pazienti con un PDA silente piccolo non richiedono controlli di followup o profilassi dell’endocardite.
Attività fisica
• I pazienti con un PDA e uno shunt sinistro-destro in generale non
richiedono alcuna restrizione dell’attività fisica.
• Per i pazienti con ipertensione polmonare si rimanda al Capitolo 22, e
al Capitolo 20 per la trattazione del complesso di Eisenmenger.
Gravidanza
La gravidanza è ben tollerata nelle donne con PDA e shunt sinistro-destro.
• Nelle pazienti con shunt moderato e dilatazione delle sezioni sinistre
antecedenti alla gravidanza può insorgere uno scompenso cardiocongestizio. Queste pazienti necessitano di un supporto cardiologico e di uno
specialista ostetrico durante la gravidanza e il parto.
• Le pazienti con un PDA clinicamente evidente dovrebbero essere considerate per la profilassi dell’endocardite batterica al momento del parto.
• La gravidanza è controindicata nelle pazienti con ampio PDA e sindrome di Eisenmenger a causa dell’alta mortalità fetale e materna.
Complicanze tardive
• Endocardite: rara.
• Aneurisma del PDA: comune nell’infanzia o dopo endocardite; altrimenti rara.
• Calcificazione del PDA: comune nei pazienti più anziani.
164 Cardiopatie congenite
• Aritmia atriale: complicanza tardiva nei casi di PDA medio.
• Disfunzione ventricolare: complicanza tardiva (vedi sopra).
• Ipertensione polmonare progressiva: dipende dalle dimensioni del PDA
e dal grado di shunt sinistro-destro. Insorge precocemente (entro i primi 1 o 2 anni di vita) sfociando in malattia vascolare polmonare irreversibile nei pazienti con dotto molto ampio e flusso non restrittivo. Col
tempo i pazienti sviluppano fisiologia di Eisenmenger, con cianosi differenziale (nella parte inferiore del corpo).
Elementi clinici chiave
• I dotti ampi necessitano di una chiusura precoce al fine di evitare l’ipertensione
polmonare.
• I dotti di medie dimensioni con dilatazione delle sezioni sinistre del cuore dovrebbero essere chiusi elettivamente per motivi prognostici (vedi il testo).
• I dotti piccoli e silenti dal punto di vista clinico non necessitano di intervento o di
specifiche precauzioni.
• La chiusura transcatetere è il trattamento di scelta nella maggior parte dei pazienti con PDA in età adulta.
• Le prospettive di vita e normale sopravvivenza nei pazienti sottoposti a chiusura di
PDA e in assenza di ipertensione polmonare residua sono eccellenti.
• Il follow-up è necessario per i pazienti con comunicazioni residue a livello del dotto
(e profilassi dell’endocardite batterica) e nei pazienti con ipertensione polmonare.
Letture consigliate
Campbell M (1968) Natural history of persistent ductus arteriosus. British Heart
Journal, 30, 4
Cheung Y, Leung MP & Chau K (2001) Transcatheter closure of persistent arterial
ducts with different types of coils. American Heart Journal, 141(1), 87-91
Faella HJ & Hijazi ZM (2000) Closure of the patent ductus arteriosus with the
Amplatzer PDA device: immediate results of the international clinical trial.
Catheterization and Cardiovascular Interventions, 51(1), 50-54
Mavroudis C, Backer CL & Gevitz M (1994) Forty-six years of patent ductus arteriosus division at Children’s Memorial Hospital of Chicago. Standards for comparison. Annals of Surgery, 220(3), 402-409
Therrien J, Connelly MS & Webb GD (1999) Patent ductus arteriosus. Current
Treatment Options in Cardiovascular Medicine, 4, 341-346