UNIVERSITA’ DEGLI STUDI DI CATANZARO
“MAGNA GRAECIA”
FACOLTA’ DI FARMACIA
SCUOLA DI SPECIALIZZAZIONE IN FARMACIA OSPEDALIERA
ANNO ACCADEMICO 2002-2003
ANTIBIOTICI INTERCALANTI:
ANTRACICLINE
Specializzanda:
Grande Santina
INTRODUZIONE
Il cancro è sostanzialmente una malattia delle cellule, caratterizzata da una
deviazione nei meccanismi di controllo che presiedono alla proliferazione e
differenziazione cellulare. Queste cellule proliferano in maniera eccessiva e formano
tumori locali che possono comprimere o invadere le normali strutture adiacenti.
Inoltre, andando incontro a ripetuti cicli di proliferazione, possono migrare a sedi
distanti nell’organismo colonizzando diversi organi nel processo chiamato metastasi.
Tali cellule, dette cellule tumorali staminali, possono formare colonie e presentano
spesso anomalie cromosomiche che riflettono la loro instabilità genetica, portante alla
selezione progressiva di subcloni che possono sopravvivere più facilmente
nell’ambiente multicellulare dell’ospite. Di conseguenza si osservano alterazioni
quantitative in varie vie metaboliche e in vari compartimenti cellulari dell’ospite1.
Negli ultimi quindici anni si è assistito a una amplificazione di conoscenze che
riguardano la biologia dei tumori, con l’identificazione di oncogeni, di geni
oncosoppressori, di alterazione di geni che codificano per proteine coinvolte nella
riparazione del DNA, nella regolazione del ciclo cellulare, nel differenziamento e
morte cellulare2.
I farmaci antitumorali correntemente utilizzati nei protocolli terapeutici agiscono su
bersagli molecolari specifici. Per esempio, molti antibiotici si legano al DNA,
intercalandosi tra basi specifiche, bloccano la sintesi di nuovo DNA o RNA (o di
entrambi), causano la scissione dei filamenti di DNA e interferiscono con la
replicazione cellulare. Tutti gli antibiotici clinicamente utili sono prodotti da vari
ceppi di Streptomyces, funghi del suolo, e comprendono le antracicline, le
actinomicine, la bleomicina, la mitomicina e la plicamicina1.
In particolare, gli antibiotici antraciclinici, facenti parte di un gruppo di prodotti
chiamati rodomicine, isolati dallo Streptomyces peucetius var. caesius, sono tra i più
utili farmaci antineoplastici1.
L’importanza di tale classe di farmaci si è evidenziata con la scoperta della
daunorubicina (inizialmente chiamata daunomicina) e della dossorubicina (o
adriamicina), Fig. 1.
Fig. 1
R= H Daunorubicina
R= OH Dossorubicina
ANTIBIOTICI INTERCALANTI: ANTRACICLINE
Struttura chimica e biosintesi
Dal punto di vista strutturale, gli antibiotici antraciclinici constano di una porzione
agliconica, derivato tetraidrotetracenchinonico planare, legata glicosidicamente a un
aminozucchero (daunosamina). Le strutture molecolari delle due antracicline in
questione, daunorubicina e dossorubicina, differiscono solamente in uno dei
sostituenti terminali (Fig. 1).
Biosinteticamente, le antracicline sono derivate inizialmente dalla condensazione di
nove unità acetato e una unità propinato che portano alla formazione di un intermedio
polichetonico, il quale a sua volta subirà una condensazione aldolica. Per azione di
enzimi presenti nello Streptomyces, si formerà la dossorubicina come è indicato
sommariamente nel seguente schema:
L’aminozucchero, L-daunosamina, è stato sintetizzato a partire dal D-mannosio:
Farmacocinetica e usi clinici
Le antracicline (daunorubicina e dossorubicina) di uso clinico sono somministrate
esclusivamente per via endovenosa. Le concentrazioni ematiche massime si
dimezzano nei primi 30 minuti dopo la somministrazione, ma livelli significativi
permangono sino a 20 ore1.
Tali farmaci subiscono metabolismo epatico con riduzione o idrolisi dei sostituenti
dell’anello. Un derivato alcolico è un metabolica attivo, mentre l’aglicone è inattivo.
La loro via d’escrezione principale è quella biliare, ma questa via comporta il
ricircolo enteroepatico di molecole citotossiche. Pertanto, in presenza di rilevanti
aumenti di bilirubina sierica ( 2,5 mg %), la dose iniziale di antracicline deve essere
ridotta del 75%. Circa 1/6 del farmaco somministrato e dei suoi metaboliti è
eliminato attraverso le urine1.
La dossorubicina è uno dei più importanti farmaci antineoplastici, con applicazioni
cliniche di rilievo nei tumori solidi come nel carcinoma mammario, dell’endometrio,
delle ovaia, dei testicoli, della tiroide, dei polmoni e nel trattamento di molti sarcomi,
tra cui il neuroblastoma, l’osteosarcoma e il rabdomiosarcoma. E’ utile anche in
neoplasie maligne dell’apparato emopoietico come la leucemia acuta e il mieloma
multiplo.
La principale indicazione della daunorubicina è la leucemia acuta, forma in cui il
farmaco può avere un’attività leggermente superiore alla dossorubicina. Tuttavia, la
daunorubicina possiede uno spettro d’azione più ristretto e la sua efficacia nei tumori
solidi appare limitata.
Come altri farmaci citotossici, le antracicline provocano depressione midollare, di
breve durata ma con rapida ripresa. La loro tossicità specifica è rappresentata da una
tossicità cardiaca potenzialmente irreversibile e correlata alla dose cumulativa.
Ulteriore aspetto tossicologico è rappresentato dall’alopecia grave o totale a dosaggi
standard1.
La daunorubicina (Daunoblastina), introdotta in Italia e in Francia nel 1968, viene
presentata in flaconcini da 20 mg di prodotto liofilo sterile. La si somministra per via
endovenosa alla dose di 0,8-1 mg/Kg/giorno per 4 giorni (esame ematologico
giornaliero, aggiustamento successivo della posologia a seconda dei risultaiti
conseguiti). Il cloridrato di daunorubicina, il sale correntemente utilizzato, si
presenta come polvere cristallina rosso-arancione, solubile in acqua, in metanolo e
nelle soluzioni idroalcoliche3.
La dossorubicina è il principio attivo delle specialità medicinali Adriblastina e
Caelyx. Si somministra anch’essa per via endovenosa.
Come tutti i citostatici, sono farmaci inseriti nella Tabella V della F.U. XI Ed.; si
tratta di medicinali concedibili dal S.S.N. con impiego limitato nell’ambito degli
ospedali o delle strutture assimilate (case di cura e cliniche).
Meccanismo d’azione
L’attività biologica delle antracicline, dosso- e daunorubicina, è ampia.
I principali meccanismi, alla base della loro tossicità nei confronti delle cellule
neoplastiche o delle strutture dell’organismo, sono tre: 1) un legame ad alta affinità
per il DNA, dovuto ad intercalazione e che determina un blocco della sintesi degli
acidi nucleici oltre che una scissione dei filamenti del DNA, mediata da
modificazioni della topoisomerasi II; 2) un legame alle membrane che ne altera la
fluidità e il trasporto degli ioni; 3) la produzione di un radicale libero semichinonico e
di radicali dell’ossigeno attraverso un processo enzimatico di riduzione. Questo
ultimo meccanismo potrebbe essere responsabile della cardiotossicità, a seguito di un
danno di membrana causato da radicali dell’ossigeno soprattutto in presenza di ioni
ferrosi1.
Possedendo, infatti, gruppi chinonici e fenolici, le antracicline sono in grado di
formare complessi chelati con cationi bivalenti (calcio e ferroII), complessi questi più
attivi e meno cardiotossici. Sebbene gli ioni ferrosi possano reagire con l’O 2 per dare
O2.-, H2O2 e OH., sempre per la presenza del sistema chinone-idrochinone, le
antracicline possono partecipare alle reazioni ossidoriduttive che avvengono nei
sistemi biologici4.
L’importanza dell’attività ossidante come evento responsabile della citotossicità è
suggerita anche dall’osservazione che cellule con spiccata attività dismutasica o
catalasica sono molto meno sensibili alle antracicline. In particolare la daunorubicina
possiede una spiccata miocardiotossicità legata alla formazione di radicali liberi in
grado di danneggiare le membrane cellulari2.
Ancora più importante è la capacità del sistema planare dell’antrachinone ad
intercalarsi tra le coppie di basi del DNA. L’intercalazione è un processo di legame al
DNA che ha luogo facendo intervenire solo forze di tipo fisico. Durante
l’intercalazione, l’intercalante con la sua struttura generalmente planare si inserisce in
maniera parallela alle coppie adiacenti di basi. Uno dei risultati di tale processo è
l’allungamento del DNA; ciò provoca variazioni nelle proprietà idrodinamiche,
distorsioni dell’elica dell’acido nucleico e modificazioni nella topologia delle basi
nucleari4. La presenza di un agente intercalante nel DNA va a perturbare anche
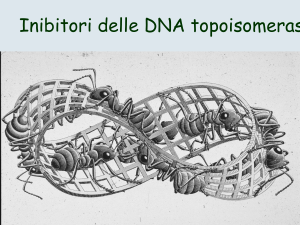
l’azione delle topoisomerasi impedendo così l’avvolgimento delle due catene.
Si pensa che il principale meccanismo d’azione della daunorubicina e della
dossorubicina sia un loro legame reversibile con la molecola di DNA nucleare che
causa l’inibizione dei processi di replicazione e di conseguenza la morte cellulare.
Numerosi studi biochimici, supportati da risultati cristallografici ottenuti mediante
raggi-X e spettroscopici ottenuti mediante NMR, hanno dimostrato che dauno- e
dossorubicina si intercalano nella forma B del DNA bicatenario con interazione sitospecifico guanina-citosina d(CpG)5 (Fig. 2).
Fig. 2
La Fig. 2 è
un esempio di intercalazione di un’antraciclina, in particolare la
daunorubicina, col DNA6. Il sistema aromatico planare della antraciclina si inserisce
perpendicolarmente all’asse della doppia elica, preferenzialmente e in maniera quasi
parallela tra due coppie di basi G-C e C-G del DNA. La stabilità del complesso è
conferita
ulteriormente
dall’anello
dell’aminozucchero
(daunosamina)
che,
inserendosi nel solco minore del DNA, interagisce a sua volta con lo scheletro di
zucchero e fosfato dell’acido nucleico (Fig.37). Questo legame col DNA è l’elemento
necessario per l’inibizione della sintesi degli acidi nucleici nelle cellule cancerose (in
particolare viene inibita la sintesi del DNA e del RNA, DNA dipendente) ed è la
causa dell’attività antitumorale e citotossica4.
Fig. 3
In particolare, le coppie di basi sopra e sotto il farmaco cambiano conformazione
provocando una distorsione nell’elica del DNA, prevenendo così il legame con la
DNA elicasi, con la DNA topoisomerasi e con la famiglia delle polimerasi, enzimi
tutti che danno inizio alla duplicazione del DNA attraverso la sintesi del RNA, la
formazione di proteine e quindi la divisione cellulare.
Come conseguenza dell’intercalazione con la daunorubicina, risulta che le coppie di
basi G-C e C-G si “curvino” di circa 9e 15 rispettivamente per prevenire eccessivi
legami di Van der Waal’s. Inoltre tra le coppie di basi intercorre una distanza
da 3.4 A a 6.8 A quando è presente l’intercalante e queste distorsioni portano a un
totale svolgimento del DNA di circa 8 e a una distorsione della struttura terziaria
dell’elica sebbene è ancora vicina alla conformazione B del DNA.
Parecchi fattori giocano un ruolo importante nella stabilizzazione del complesso
farmaco-DNA. L’antraciclina è stabilizzata dal legame idrogeno elettrostatico e dai
legami- tra il cromoforo chinone elettron-deficiente e le basi purine-pirimidine
ricche di elettroni.
Si è visto che una antraciclina mancante del gruppo idrossilico in C-9 a destra
dell’anello A (Fig. 1) è priva di attività antitumorale.
Inoltre l’atomo di idrogeno del gruppo amminico solvatato si lega all’O-2 della
tiamina (T10) e a due molecole di acqua.
La sostituzione dell’atomo di idrogeno in C-13 dell’antraciclina con il gruppo
idrossilico, come avviene per la dossorubicina, ha creato ulteriori legami idrogeno
coi solventi attorno al sostituente5.
Conclusioni e prospettive
Sia la daunorubicina che la dossirubicina provocano la rottura a singola catena del
DNA e pregiudicano la possibilità di riparo. Diverse teorie sono state avanzate a tal
proposito.
Una suggerisce che l’intercalazione porti a variazioni della topografia del DNA
cromatinico che rendono questo acido nucleico irriconoscibile agli enzimi di riparo 4.
Infatti il bersaglio delle antracicline è anche la topoisomerasi II, enzima che modifica
la topologia del DNA durante la trascrizione, replicazione e ricombinazione del
DNA. Produce rotture transitorie del doppio filamento, ma ne catalizzano anche la
“ligazione”. Questi farmaci inducono la formazione di un complesso ternario DNAfarmaco-topoisomerasi II, in cui i filamenti del DNA sono rotti e legati in 5’ a un
residuo tirosinico dell’enzima2.
Questo processo può causare delezioni, inserzioni e aberrazioni cromosomiali che
conducono a danno e morte cellulare6.
Un’altra teoria prevede che le antracicline siano attivate a radicali che causano la
formazione di superossidi, i quali a loro volta danneggerebbero il DNA. Questa
trasformazione a radicali è promossa da una P450 reduttasi di membrana.
Tuttavia è stato proposto che la tossicità a livello cardiaco (uno degli effetti collaterali
specifici delle antracicline) sia dovuta a queste specie radicaliche, mentre la risposta
dei tumori sia dovuta al legame col DNA. A sostegno di questa ipotesi c’è il fatto che
sostanze in grado di disattivare i radicali, come il tocoferolo, riducono la tossicità
cardiaca ma non l’efficacia antitumorale.
Nonostante ciò, la sperimentazione clinica con sostanze in grado di rimuovere i
radicali, come la vitamina E e la N-acetilcisteina, non hanno dato risultati
soddisfacenti.
Tra l’altro, i tessuti cardiaci sono privi dell’enzima catalasi, che converte il perossido
di idrogeno ad acqua ed ossigeno e pertanto queste antracicline non trovano
meccanismi di difesa contro i loro metabolici tossici.
Comunque resta problema serio nell’uso delle antracicline la tossicità nei confronti
del muscolo cardiaco, che si aggrava con dosi cumulative del farmaco 4.
Oltre alle antracicline sono in fase sperimentale per la cura dei tumori alcuni farmaci
intercalanti il DNA come il mitoxantrone e il bisantrene, derivati dell’antracene; altri
agenti invece trovano già impiego clinico come la dactinomicina.
BIBLIOGRAFIA
1. B.G.Katsung, ”Farmacologia generale e clinica”, IV Edizione Italiana, Piccin
Nuova libraria, S.p.A., Padova, 2000, 55, 950.
2. R.Paletti, S.Nicosia, F. Clementi, G.Fumagalli, “Farmacologia generale e
molecolare”, II Edizione, UTET, Torino, 1999, 24, 331.
3. Carlo Runti, “Fondamenti di chimica farmaceutica”, 855.
4. Foye, “Principi di chimica farmaceutica”, 37, 958.
5. www.jonathanpmiller.com/intercalation/
6. Xiaogang Qu, Chaozhi Wan, Hans-Christian Becker, Dongping Zhong, and
Ahmed H. Zewail, “The anticancer drug-DNA complex: Femtosecond primary
dynamics for anthracycline antibiotics function”,PNAS, December 4, 2001,
vol. 98, no.25, 14212-14217.
7. www.proteindatabank.it


![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)


![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)