T.A.R.M. 2009
www.minerva.unito.it
Luigi Cerruti
Lezioni di chimica
5-6
La definizione di mole
La mole è la quantità di sostanza di un sistema
che contiene tante entità elementari quanti sono
gli atomi in 0,012 kg di carbonio 12.
Le entità elementari devono essere specificate e
possono essere atomi, molecole, ioni, elettroni,
ecc, ovvero gruppi specificati di tali particelle.
Le grandezze molari
• Si definiscono molari tutte le grandezze riferite ad
una mole di sostanza. Due esempi importanti
sono i seguenti:
– massa molare: è la massa di una mole di sostanza, ed
è espressa in g mol-1
– volume molare: è il volume di una mole di sostanza, ed
è espresso in cm3 mol-1
• Nel caso dei gas il volume molare è espresso in
L mol-1, e a TPS vale 22,4 L mol-1
L'unità di massa atomica
Si è definita come unità di
massa atomica un dodicesimo
della massa dell'isotopo 12C
Il nome di questa unità di
misura è dalton (uma)
1 uma = 1,66059 • 10-24 g
Massa atomica relativa (mar)
E' il rapporto tra la massa di un atomo di un elemento naturale
(spesso una miscela di isotopi ) e la dodicesima parte della massa
dell’atomo di carbonio 12.
La massa atomica relativa è detta anche peso atomico, in ogni
caso questa grandezza è adimensionale.
Masse molari degli elementi
• Il rame Cu ha massa atomica relativa
63,546
• La massa di una mole di Cu è 63,54 g
• La massa molare del Cu 63,54 g mol-1
Masse molari degli elementi
• L'ossigeno ha m.a.r. 15,9994
• La massa di una mole di O è 15,99 g
• La massa molare dell'ossigeno atomico è
15,99 g mol-1
ll volume molare
• E' una grandezza importante per la comprensione di molte proprietà.
Definizione:
massa molare
volume molare = —————————
massa volumica
• Sostituendo alle grandezze le unità di misura otteniamo:
g mol-1
cm3 mol-1 = —————————
g cm-3
Moli di elementi e di composti
Nella fila di bicchieri davanti: una mole di Cu, Pb, Hg, Fe
Nella fila di bicchieri dietro: una mole di zucchero, acqua, S8, S, NaCl
La formula dello zucchero è C12H22O11
La formula
12H22
11 -1
La massa
molare dello
dello zucchero
zucchero èè C342
gO
mol
La massa molare dello zucchero è 342 g mol-1
La mole
4 elementi, tre stati
fisici
Nei vetrini d'orologio:
63,54 g di rame, 1 mole di Cu
32,06 g di zolfo, 1 mole di S
Il bicchiere contiene 200,59 g
di mercurio, 1 mole di Hg
Il pallone contiene 4,00 g di
elio, 1 mole di He
Il volume di una mole di gas a TPS: 22,4 L
Qualche confronto
Pallone da basket, 7,5 L
Pallone da calcio, 6 L
Pallone da rugby, 4,4 L
Proprietà atomiche e periodicità
• Si ottiene un diagramma molto interessante se i volumi molari
sono riportati in funzione del numero atomico
Ossidazione e riduzione
• La reazione di ossido-riduzione è una delle reazioni più
importanti
• Essa consiste nel trasferimento di elettroni da una entità
microscopica che si ossida ad un'altra che viene ridotta
• La reazione di ossido-riduzione è il risultato di due reazioni
distinte:
Reazione di ossidazione. Perdita di uno o più elettroni:
Cu → Cu+ + e-
Cu+ → Cu2+ + e-
Reazione di riduzione. Acquisto di uno o più elettroni:
F + e- → F-
• Il processo complessivo è descritto con la reazione:
Cu + F2 → CuF2
Ossidazione e potenziali di ionizzazione
• La più semplice reazione di ossidazione consiste nella perdita di
un elettrone da parte di un atomo isolato
• Per ogni elemento, questo processo di ionizzazione è riferito ad
un atomo allo stato gassoso:
Mg (g) → Mg+ (g) + eI1 = 738 kJ mol-1
• Il processo può proseguire con una seconda ionizzazione:
Mg+ (g) → Mg2+ (g) + eI2 = 1451 kJ mol-1
• I valori I1 e I2 sono detti rispettivamente energie di prima e
seconda ionizzazione
• I valori I1 e I2 sono chiamati anche potenziali di ionizzazione
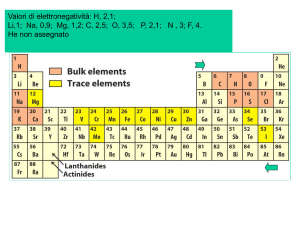
Elementi elettropositivi ed elettronegativi
• Gli atomi degli elementi elettropositivi hanno bassi potenziali di
ionizzazione, tendono a dare ioni positivi e quindi si ossidano
facilmente
– Es.: Na, K, Mg, Ca
• Gli atomi degli elementi elettronegativi hanno alti potenziali di
ionizzazione, tendono a dare ioni negativi e quindi si riducono
facilmente
– Es.: F, Cl, O, S
Elementi elettropositivi ed elettronegativi
• Si deve comunque tener conto che il rapporto fra le proprietà
degli atomi nei composti è sempre relativo
• In FeS, Fe è l'atomo elettropositivo, S è l'atomo elettronegativo
• In SO2, S è l'atomo elettropositivo, gli atomi di O sono
elettronegativi
Proprietà periodiche: Ionizzazione
• Impiegando sufficiente energia possiamo rimuovere un elettrone
da un atomo
Z+Z
(Z-1)Energy
+Z
e-
• L'elettrone è completamente 'rimosso' quando l'energia
potenziale dell'elettrone rispetto all'atomo è nulla
Il potenziale di prima ionizzazione
Valori riferiti ad una mole di elemento
Aumenta quando si considera
un periodo perché cresce Z
Diminuisce quando si considera
un gruppo perché aumenta la
distanza dal nucleo
Potenziali di ionizzazione
Valori riferiti ad un singolo atomo
Valori espressi in eV (elettronvolt)
1 eV = 1.60217653 ×10−19 J
Sistema periodico
Variazione dei potenziali di ionizzazione
Elettroaffinità
E' la variazione di energia associata con l'acquisizione
di un elettrone da parte di un atomo allo stato di gas
F(g) + e- → F- (g)
In questo caso il processo avviene con cessione di
energia dal sistema atomico all'ambiente, quindi è
esotermico:
EA:
-322,2 kJ mol-1
Quando il processo è endotermico l'elettroaffinità è
espressa con un valore positivo:
Ne (g) + e- → Ne- (g)
EA: + 29 kJ mol-1
Elettroaffinità e sistema periodico
•
•
•
Fluoro e cloro, gli alogeni, sono fortemente elettroaffini: il sistema X- è ad
energia molto minore dei due sistemi separati X ed e-.
Gli atomi di Na e K, metalli alcalini, rilasciano pochissima energia quando
acquisiscono un elettrone.
La transizione da F a Na segna il passaggio dal secondo al terzo periodo, e
quella da Cl a K segna il passaggio dal terzo al quarto periodo.
Aufbau
(!?)
Ovvero:
configurazioni
elettroniche
Aufbau
Il caso dello
zolfo
Configurazioni Elettroniche