Prof. Michele Giugliano (Dicembre 2001)
Complementi di
Termologia.
IV parte
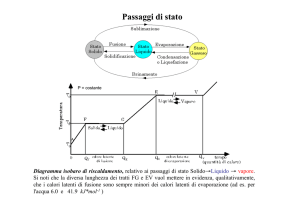
N. 4. - Cambiamenti di stato.
I corpi si presentano, ordinariamente, sotto tre stati di aggregazione: solido, liquido ed aeriforme.
E' tuttavia possibile il passaggio da uno stato ad un altro, mediante somministrazione o sottrazione di calore.
I cambiamenti di stato sono i seguenti:
1)
2)
3)
4)
5)
Fusione.
Solidificazione.
Vaporizzazione.
Liquefazione.
Sublimazione.
1) Fusione. E' il passaggio dallo stato solido a quello liquido.
Avviene generalmente per somministrazione di calore.
§
Leggi della fusione (valida per una estesa categoria di sostanze).
§
§
Per le sostanze soggette a questo fenomeno, la fusione avviene ad una determinata temperatura (detta punto o temperatura di fusione), che dipende anche dalla pressione esterna esercitata sul corpo;
durante la fusione la temperatura rimane costante.
§
Calore di fusione Cf delle sostanze allo stato solido.
Si dimostra sperimentalmente che il calore Q somministrato ad un corpo e la massa m di esso che
subisce la fusione (alla temperatura di fusione e sotto la pressione di 1 atm) sono direttamente proporzionali, per cui il loro rapporto, indicato con Cf, è costante, ossia:
Cf =
Q
m
(Definizione del calore di fusione di un corpo)
Dalla precedente si deduce facilmente, ponendo Q = 1 (kcal); ed m = 1 (kg), che la misura del calore di fusione di un corpo è uguale alla misura della quantità di calore (in kcal) richiesta per ottenere
la fusione di 1 kg di quella sostanza, alla sua temperatura di fusione.
1
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
Dalla stessa definizione, si deduce che l’unità di misura del calore di fusione si ottiene dal rapporto fra l’unità di misura del calore e quello della massa, ad esempio
I valori di Cf per i vari corpi, espressi in
kcal
.
kg
kcal
, si ricavano da opportune tabelle.
kg
Ad esempio, per il ghiaccio si ha
Cf =
Q
=
m
79,67 kcal
kg
2) Solidificazione di una sostanza liquida.
E' il passaggio dallo stato liquido a quello solido.
Avviene generalmente per sottrazione di calore.
Il fenomeno si verifica ad una determinata temperatura detta punto o temperatura di solidificazione, che coincide con la temperatura di fusione.
§
Calare di solidificazione.
Con procedimento identico a quello visto per il calore di fusione si ricava che la misura del calore
di solidificazione Cs di una sostanza (definito in modo analogo a quello visto per il Cf) è uguale alla
misura della quantità di calore che occorre sottrarre al corpo per ottenerne la solidificazione di un chilogrammo (alla temperatura di solidificazione, e sotto la pressione di 1 atm).
Risulta, infine, che il calore di solidificazione è uguale a quello di fusione.
3) Vaporizzazione di un liquido.
E' il passaggio dallo stato liquido a quello aeriforme.
Generalmente avviene per somministrazione di calore.
Il fenomeno può avvenire lentamente, gradualmente (ossia interessa solo lo strato superficiale del
liquido) e a qualunque temperatura, e allora si dice evaporazione, oppure bruscamente e ad una determinata temperatura (che dipende anche dalla pressione esterna), interessando contemporaneamente tutta la massa del liquido, e allora si dice ebollizione.
3.1. Evaporazione.
Conviene considerare tre casi notevoli di evaporazione.
a) evaporazione che avviene in un ambiente limitato e vuoto (a temperatura costante).
b) evaporazione che avviene in un ambiente limitato ma contenente altri aeriformi.
c) evaporazione in ambiente illimitato e contenente altri aeriformi (come avviene per
l'evaporazione dell'acqua nell'aria atmosferica).
a) Nel caso che l’evaporazione avvenga in ambiente limitato e vuoto, il liquido immesso in tale ambiente vaporizza rapidamente ed esercita una pressione (detta tensione di vapore) sulle pareti del
recipiente che lo contiene, che aumenta con l’evaporazione.
Ad un certo punto l’evaporazione termina e la tensione di vapore non aumenta più : il liquido è in
presenza del suo vapore.
2
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
In tal caso si dice che il vapore è saturo (significa occupato), ossia non puòcontenere altro vapore
a quella temperatura (a meno che non si aumenti la temperatura).
Sempre in condizione di saturazione, la tensione di vapore è detta tensione massima di vapore saturo o anche tensione di saturazione.
Enunciamo anche alcune proprietà e definizioni dei vapori saturi e non:
•
La tensione massima di un vapore saturo dipende dalla natura del liquido, aumenta con la
temperatura ed è indipendente dal volume occupato.
•
Vapore surriscaldato.
E' detto così un vapore non saturo, che si trovi cioè in fase gassosa, in presenza del suo liquido, ma non ancora in equilibrio con esso (significa che puòancora vaporizzare fino alla
saturazione).
•
Soprasaturazione.
Se si abbassa la temperatura del vapore, ordinariamente si abbassa anche la tensione di saturazione e parte del vapore ritorna allo stato liquido (si condensa).
Ma qualche volta, se l'ambiente è quieto e libero da impurità, può accadere che la tensione
di vapore non si abbassi (e quindi non si produca la condensazione).
In tal caso il vapore si dice soprasaturo: la sua tensione (di vapore) è superiore a quella
massima. Ma basta una piccola perturbazione per far ritornare tutto nella normalità.
•
Principio della parete fredda.
Se si abbassa la temperatura del vapore, una parte di esso deve condensare (come avviene
per la pioggia). Ma se l'ambiente che contiene il vapore è limitato (anche se contiene altri
aeriformi), l'esperienza insegna che per ottenere la condensazione del vapore in eccedenza,
non è necessario abbassare la temperatura di tutto l'ambiente: basta abbassare la temperatura
solo di una parte dell'ambiente. In tal caso il vapore in eccedenza si condensa sulla parte più
fredda dell'ambiente.
E' questa la ragione per cui i vetri di una finestra, d'inverno, si possono appannare. La temperatura dei vetri è più bassa rispetto a quella della parte rimanente della stanza, quindi un
abbassamento di temperatura provoca la condensazione di una parte del vapore acqueo contenuto nella stanza, ma esso si deposita sui vetri della finestra (la parete fredda).
§
Ricordiamo infine la definizione del calore di vaporizzazione:
Calore di vaporizzazione (di un liquido), ad una data temperatura, si definisce in maniera
analoga a quella vista per il calore di fusione. La sua misura risulta uguale a quella della
quantità di calore che occorre somministrare al liquido per ottenerne l'evaporazione della
massa di 1 kg, alla data temperatura.
b) Se l’evaporazione avviene in ambiente limitato e contenente altri aeriformi (come l'aria,… ), i
fenomeni visti nel caso precedente si verificano allo stesso modo, ma in maniera più lenta.
Alla fine si ottengono le stesse conclusioni.
c) Anche nel caso c) avvengono fenomeni analoghi.
3
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
3.2. - Ebollizione.
Ricordiamo brevemente le leggi dell’ebollizione:
• Un liquido bolle quando raggiunge la temperatura alla quale la sua tensione massima di
vapore è uguale alla pressione esterna.
• Durante l’ebollizione la temperatura del liquido non varia.
• Per il meccanismo dell’ebollizione (la formazione di bolle all’interno del liquido), rinvio alle lezioni.
3.3. - Liquido surriscaldato.
Qualche volta (a causa di mancanza di corpuscoli solidi o di tracce di aria nel liquido, come
l'acqua) la temperatura di un liquido sale oltre quella di ebollizione, ma l'ebollizione non avviene.
In tal caso il liquido si dice surriscaldato.
4) Liquefazione (di un aeriforme).
E' il passaggio dallo stato aeriforme a quello liquido.
Generalmente avviene per azione di una pressione sull'aeriforme.
Ma non si pensi che la trasformazione sia possibile sempre: essa dipende anche dalla temperatura
dell'aeriforme.
§ Infatti, l'esperienza insegna che per ciascun aeriforme esiste una particolare temperatura
(detta temperatura critica), tale che quando la temperatura dell'aeriforme sia maggiore di
questa, non è possibile la sua liquefazione, qualunque sia la pressione cui venga sottoposto.
La pressione corrispondente a questa temperatura è detta pressione critica dell'aeriforme (è
la pressione che bisogna esercitare sull'aeriforme, alla temperatura critica, per ottenerne la
liquefazione).
Il volume corrispondente alla temperatura critica è detto volume critico.
Punto critico.
Se rappresentiamo il diagramma delle fasi (v. più avanti) nel piano p,T, il punto C, che ha
per coordinate la temperatura critica e la pressione critica, è detto punto critico.
Valori critici.
E' importante notare che esistono tabelle che forniscono i valori critici (temperatura e pressione critica) per varie sostanze.
I valori critici servono per decidere se una sostanza è allo stato liquido o aeriforme.
Infatti se la temperatura di esercizio della sostanza è superiore a quella critica, esso è necessariamente allo stato aeriforme (poiché la temperatura critica è la minima possibile per
avere lo stato liquido).
Quindi per ottenere la liquefazione bisogna abbassare la temperatura almeno fino a quella
critica.
§
Gas e vapori.
Ora possiamo evidenziare la differenza fra gas e vapori (entrambi aeriformi).
E' gas l'aeriforme che si trovi a temperatura superiore a quella critica (e quindi non puòessere trasformato in liquido); è vapore quell'aeriforme che si trovi a temperatura minore o
uguale a quella critica (e quindi con un'opportuna pressione è possibile ottenerne la liquefazione).
4
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
§
Calore (latente) di liquefazione.
L'evaporazione richiede assorbimento di calore (v. calore di vaporizzazione), invece la liquefazione avviene con sottrazione di calore dall'aeriforme.
Il calore di liquefazione è definito in maniera analoga a quella vista per il calore di vaporizzazione o a quello di fusione. La sua misura è uguale a quella del calore che l'aeriforme
cede affinché si ottenga la condensazione della massa di 1 kg di esso.
§
In ogni caso, durante ogni fenomeno di cambiamento di stato (fusione, solidificazione, vaporizzazione, liquefazione) la temperatura rimane costante.
Il calore fornito o ceduto serve per realizzare il cambiamento di stato e non per far variare
la temperatura (in aumento o in diminuzione).
§
Calore latente.
Si chiamano così i calori di liquefazione, di ebollizione, di fusione, … , perché corrispondono a fenomeni che avvengono senza variazione di temperatura, durante i passaggi di stato.
Il calore, in queste situazioni, sembra nascosto, invisibile.
§
Produzione del freddo.
La liquefazione di un gas si ottiene solo a temperature inferiori a quella critica.
Quindi se si riesce ad ottenere la liquefazione di un gas, si ottiene anche una bassa temper atura, perché le temperature critiche dei gas sono molto basse (ad esempio, la temperatura
critica dell'ossigeno è −182,8 ° C e la pressione critica è 50 atm; per l'aria, si ha temperatura
critica di −191° C e pressione critica di 35 atm).
Di conseguenza, per ottenere basse temperature basta realizzare la liquefazione di un gas.
§
Frigorifero. E' quanto avviene in un frigorifero.
Esso è costituito, essenzialmente, da un motore compressore che ha il compito di forzare la vaporizzazione di un gas (come il freon) in modo che il fenomeno provochi un assorbimento di calore, un condensatore, che è un dispositivo in cui avviene la condensazione del gas,e quindi emissione di calore.
In tal modo, si produce un assorbimento di calore nell'interno del frigorifero ed emissione dello stesso all'esterno.
5) Sublimazione.
E' il passaggio dallo stato solido a quello aeriforme (come avviene per la naftalina) e viceversa (ad
esempio il brinamento, in cui si ottengono pezzetti di ghiaccio provenienti dal vapore acqueo).
N. 5. - Diagramma delle fasi (o di stato) dell'acqua (nel piano p, T).
Interessante è il grafico che mostra le tre curve (relative ai passaggi di stato dell'acqua):
a. curva di vaporizzazione;
b. curva di fusione;
c. curva di sublimazione.
5
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
Queste individuano tre regioni di piano relative ai tre stati di aggregazione dell'acqua (le tre fasi
dell'acqua).
p(atm)
pc
C (tc, pc)
(punto critico)
• A
fusione
LIQUIDO
vaporizzazione
SOL.
ptr
P
AERIFORME
sublimazione
O
ttr
tc
t (° C)
Punto triplo (dell'acqua).
Il punto P, nel quale le tre curve s'incontrano, è detto punto triplo; esso rappresenta il punto del
piano le cui coordinate indicano la temperatura e la pressione in cui le tre fasi dell'acqua (ma anche
di altre sostanze) coesistono (in equilibrio dinamico).
Nel caso dell’acqua la temperatura corrispondente al punto triplo è ttr = 0,01 °C, e la pressione è
ptr = 0,006 atm.
Altro punto importante del grafico è il punto critico C(374 °C; 218 atm).
Dalla figura si deduce che:
•
Se conosciamo temperatura t e pressione p di una sostanza è possibile sapere il suo stato
di aggregazione (solido, liquido o aeriforme).
Basta rappresentare, nel piano Tp, il punto A(t, p) e notare in quale delle tre regioni di piano
(delimitate dalle suddette curve di trasformazione ) esso si trovi.
Ad esempio, il punto A in figura indica che la sostanza è in fase liquida.
•
La curva di sublimazione termina nel punto triplo P.
Essa puòcominciare, teoricamente, anche dallo zero assoluto = −273,15 ° C = 0 K.
Questo significo che una sostanza è allo stato solido solo se la sua temperatura è minore di
quella del suo punto triplo.
•
La curva di vaporizzazione comincia nel punto triplo P e termina nel punto critico C.
Questo significa che la sostanza puòessere allo stato di vapore solo se la sua temperatura è
compresa fra quella del suo punto triplo P e quella del suo punto critico C.
Per temperature superiori a quella del suo punto critico essa è allo stato aeriforme.
N. 6. – Entropia.
(Premesse). Termodinamica: si rinvia alle lezioni tenute durante il corso.
Ora vogliamo solo accennare al concetto di Entropia.
6
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
§
L’entropia è una funzione di stato (come l'energia interna di un sistema), ossia il suo
valore dipende solo dagli stati iniziale e finale del sistema termodinamico e non dalla
particolare trasformazione che porta dallo stato iniziale a quello finale. Si indica con S.
§
La variazione di entropia ∆S si definisce così:
∆S =
∆Q
T
Ossia: la variazione di entropia subita da una trasformazione (qualsiasi) di un sistema
termodinamico è data dal rapporto fra la quantità di calore ∆Q scambiata e la temperatura T alla quale lo scambio avviene.
§
Si dimostra che se la trasformazione subita da un sistema isolato è reversibile (ossia costituita da una successione continua di piccole trasformazioni che possono avvenire in
un senso e anche in senso inverso) allora la variazione della sua entropia è nulla:
∆Srev = 0
Se, invece, la trasformazione (del sistema isolato) è irreversibile (lo sono tutte le trasformazioni reali, ossia quelle che avvengono in natura), allora la variazione di entropia è sempre positiva (ossia l'entropia aumenta sempre), quindi:
∆Sirr > 0
•
Vogliamo concludere con qualche osservazione riguardante l’Universo in cui ci troviamo.
Ammettendo che l’Universo sia un sistema isolato (è l’unico veramente isolato), la sua energia
interna totale deve essere costante (Principio di conservazione dell’
energia, inclusa l’energia nucleare).
Ora, è anche noto che tutte le trasformazioni che avvengono in Natura sono irreversibili, quindi
deve essere valida l’ultima formula relativa alla variazione dell’entropia, ossia
∆Sirr > 0,
cioè : l’entropia dell’Universo tende ad aumentare.
Continuando ad aumentare, l’entropia dell’Universo raggiungerà un valore massimo (si ritiene
fra circa 1010 anni), ed allora si troverà in una condizione di equilibrio, per cui non sarà possibile più
alcuna trasformazione, alcun fenomeno.
Del resto, già sappiamo, dal II Principio della Termodinamica, che in ogni trasformazione termodinamica vi è una quantità di energia che si degrada, ossia si trasforma in energia termica non più
riconvertibile in energia di specie superiore (per questa ragione tale principio è anche detto Principio
di degradazione dell’energia). Ora, poiché la quantità di energia dell’Universo è finita, allora dovrà
7
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com
pur venire un tempo in cui tutta l’energia disponibile si sarà trasformata in energia termica a bassa temperatura.
In definitiva: l’energia dell’Universo tende a trasformarsi tutta in energia termica alla stessa
temperatura, cosìcome le acque dei fiumi tendono a disporsi tutte allo stesso livello (quello del mare).
Quando il processo si sarà concluso, nell’Universo (e quindi sulla nostra Terra), non sarà possibile più alcuna ulteriore trasformazione, alcuna forma di vita.
Osservazioni conclusive.
Ma questo processo, tutt’ora in atto, perché non si è ancora concluso definitivamente?
Ogni processo che ha un inizio deve avere anche una fine.
Quindi dobbiamo ritenere che il processo stesso si sia concluso già infinite volte, oppure un
numero finito di volte, se ammettiamo che l’Universo stesso abbia un inizio, ossia sia stato creato dal
nulla.
In entrambi i casi, una volta concluso il processo di trasformazione di tutte le energie
dell’Universo in energia termica a bassa temperatura e non più convertibile in energie di specie superiori, come sia stato possibile riavviare il processo medesimo??
Ciòè sicuramente avvenuto, dal momento che il processo medesimo è in atto!
Per noi cattolici la spiegazione è una sola, e porta un solo nome: DIO.
8
PDF created with FinePrint pdfFactory trial version http://www.fineprint.com