DAVIDE GIROLA
CAPITOLO 1
FONDAMENTI DI ANATOMIA
E FISIOLOGIA CARDIOVASCOLARE
1. 1
IL
CUORE E LA CIRCOLAZIONE
Il cuore, classicamente definito sotto il profilo funzionale
come una doppia in serie, è un organo muscolare cavo, di
forma conoide tronca, situato nel mediastino anteriore, appoggiato sul centro tendineo del diaframma, ricoperto ai lati e sulla
faccia sterno-costale dai polmoni; nel normotipo e nella maggior parte dei casi, il cuore si dispone sull’asse longitudinale,
avente una direzione obliqua da destra a sinistra, dall’alto in
basso e dal dietro in avanti. Rispetto al suo asse, il cuore si
trova ruotato disponendo il ventricolo destro in posizione ventrale ed il ventricolo sinistro in posizione parzialmente dorsale:
soltanto una minima parte faccia anteriore risulta essere in
contatto diretto con la faccia posteriore dello sterno.
All’indagine radiografica, l’angolo “alfa” del cuore, rappresentato dall’intersezione del diametro longitudinale con la perpendicolare alla linea mediana sternale - indicante l’inclinazione
cardiaca - dipende da vari fattori, quali, ad esempio, l’ectotipo
costituzionale, le deformità dell’apparato scheletrico, la tonicità
dal muscolo diaframma, la capacità polmonare, l’età, il sesso
e, non ultimo, dai vari adattamenti morfo-funzionali indotti dal
training. Il cuore del normotipo, generalmente, è disposto per
2/3 nell’emitorace sinistro e per 1/3 in quello destro, con
angolo α uguale a 45 gradi e viene definito “cuore obliquo del
normotipo” (Le “malposizioni del cuore”, sono determinate
dall’anomala posizione anatomica dell’apice cardiaco; si posso19
CARDIOLOGIA & FITNESS
a. anonima
arco aortico
vena cava
superiore
atrio dx
solco
coronario
ventricolo dx
FIG 1
Faccia cardiaca
sterno-costale.
arteria carotide
comune sx
no distinguere così le destrocardie e le mesocardie, con l’apice
cardiaco situato rispettivamente
ramo sx arteria
a destra o all’altezza della linea
polmonare
mediana del torace; si parla
invece di “levocardia”, quando il
arteria polmonare
cuore occupa la sua normale
auricola sx
posizione anatomica ma è anosolco
mala quella degli altri visceri) La
coronario
lunghezza del cuore normale
arteria
coronaria sx
(diametro longitudinale), nell’adulto è in media di circa 14cm,
ventricolo
mentre la larghezza (diametro
sx
trasverso) è di circa 13cm (nella
solco
donna i valori sono sensibilmenlongitudinale
te inferiori, rispettivamente di 13
anteriore
e 12 cm). In particolare, la faccia
sterno-costale del cuore possiede una forma triangolare ed è
convessa (fig1), mentre la faccia diaframmatica (fig. 2) è triangolare e pianeggiante e si adatta al centro frenico del diaframma. Il volume cardiaco totale di un soggetto sedentario corrisponde a 600-800 ml con un peso indicativamente compreso
tra i 300 e i 350 grammi. La parete del cuore è costituita da tre
strati; dall’interno all’esterno si distinguono l’endocardio, il miocardio e, esternamente al miocardio, il pericardio viscerale; il
pericardio viscerale costituisce una membrana di tipo sieroso
che si separa dal pericardio parietale (sacco fibroso), tramite
una quantità minima di ultrafiltrato plasmatico (circa 15-50ml). Il
pericardio impedisce la dilatazione delle cavità cardiache in
caso di ipervolemia e durante l’esercizio fisico, facilitandone il
riempimento atriale; inoltre, il pericardio, in condizioni fisiologiche, delimitando anatomicamente il cuore, riduce gli attriti con
le strutture vicine impedendo la torsione dei grandi vasi e, sino
ad una certa misura, proteggendolo dalle eventuali infezioni
pleuriche e polmonari. L’endocardio ricopre le cavità interne ed
è costituito da endotelio e da una lamina sottile di tessuto connettivo, avente funzione di sostegno; dal punto di vista funzionale, il miocardio è lo strato più importante, e le sue proprietà
verranno esposte dettagliatamente nel prossimo paragrafo. La
arteria succlavia sx
20
DAVIDE GIROLA
vene polmonari sx
a. polmonare
aorta
definizione di “doppia pompa
in serie”, è dovuta al fatto
atrio sx
che il cuore funziona come
vene
due pompe distinte, ciascupolmonari
na costituita da due camere,
dx
l’atrio ed il ventricolo; gli atrii
possiedono fondamentalsolco
coronario
mente la funzione di raccolta
del sangue, ma compiono
anche una piccola azione di
pompaggio che facilita il passaggio del sangue ai corrivena cava
inferiore
spettivi ventricoli; infatti il
sangue, per il 75% passa
ventricolo dx
direttamente dagli atrii ai
ventricoli, prima ancora che ventricolo sx
margine acuto
siano avvenute le contrazioni
atriali: in pratica, soltanto il rimanente 25% del sangue viene FIG 2
Faccia cardiaca
spinto nei ventricoli tramite le pompe atriali. I ventricoli sono diaframmatica.
quindi le vere pompe. La metà destra del cuore e quella sinistra risulta essere divisa da una parete longitudinale chiamata FIG 3
setto che, a sua volta, è divisa da una seconda parete che le è Schema
del sistema
sostanzialmente perpendicolare: suddiviso così, l’organo pre- di conduzione.
senta quattro cavità
fascio di His
distinte con diverse
nodo senoatriale
dimensioni. Il setto è
ramo penetrante
dunque diviso nel setto
interatriale e nel setto
branca del
fascio
interventricolare; lo
principale sx
spessore del setto
interventricolare è
maggiore di quello interatriale (8-11 mm nei
sedentari, sino a raggiungere i 12-13mm
nodo A-V
negli atleti di endurance); nel setto interatriasetto
fascio dx
le si distigue la plica di
interventricolare
Vieussens che costitui-
21
CARDIOLOGIA & FITNESS
sce il residuo di un piccolo foro, attraverso il quale, nella vita
prenatale, il sangue ossigenato passa dall’atrio destro a quello
sinistro, per evitare il circolo polmonare non ancora funzionante. L’atrio destro, disposto sul suo asse maggiore perpendicolarmente, possiede una forma ovale e raccoglie il sangue venoso superiormente dalla vena cava superiore, inferiormente
dalla vena cava inferiore e posteriormente dal seno coronario,
che raccoglie il sangue derivante dalle pareti cardiache; ventralmente all’atrio destro si trova l’auricola destra; il ventricolo
destro ha una forma piramidale con una base a semiluna e raccoglie, per poi pomparle, grandi quantità di sangue in un sistema vascolare a bassa pressione media (circa 15 mmHg), il circolo polmonare. Il sangue è sospinto dal ventricolo destro nell’arteria polmonare, che da esso si separa tramite le valvole
semilunari polmonari. L’atrio sinistro ha la forma di un parallelepipedo e rappresentata la porzione più estesa della base cardiaca, nella quale si immettono, per ciascuno dei due lati, due
vene polmonari, prive di valvole. Le vene polmonari hanno anatomicamente un tragitto orizzontale rispetto alle vene cave e,
così disposte, formano la così detta croce venosa cardiaca. Il
ventricolo sinistro è cuneiforme, ma può assumere, nei soggetti praticanti sports di resistenza, un aspetto più arrotondato
e globoso; la massa ventricolare sinistra, in condizioni normali,
equivale a valori compresi tra i 160 e i 220-230 grammi, mentre il diametro telediastolico ventricolare (quando il ventricolo si
riempie di sangue durante la diastole) assume, nell’uomo
sedentario, valori compresi tra i 43 e i 53 mm, con un relativo
volume telediastolico (sangue contenente nel ventricolo in diastole) generalmente compreso tra gli 80 e i 120/130 ml. Il ventricolo sinistro pompa il sangue nell’aorta. Il sistema valvolare
dei ventricoli sinistro e destro sono dunque, rispettivamente, le
valvole semilunari delle arterie aorta e polmonare; esse sono
formate da tre lembi connettivali (tasche semilunari rivestite da
endotelio) ed hanno il compito di impedire il reflusso del sangue, durante la diastole, dall’aorta e dall’arteria ai ventricoli. Le
valvole atrio- ventricolari impediscono, invece, il reflusso di
sangue dai ventricoli agli atrii. La valvola atrio-ventricolare di
destra è formata da tre lembi membranosi di endocardio e
prende il nome di valvola tricuspide, la valvola atrio- ventricola22
DAVIDE GIROLA
re sinistra possiede invece due cuspidi ed è denominata valvola mitrale; alle cuspidi, attraverso delle sottili corde tendinee,
sono collegati i minuscoli muscoli
che, contraendosi simultaneamente ai ventricoli ma senza facilitare la chiusura valvolare, impediscono che i lembi possano
ribaltarsi negli atrii durante la sistole. Tali valvole, quindi, sono
attivate passivamente e dipendono esclusivamente dai vari
gradienti di pressione.
Disposte a corona intorno al cuore, le arterie coronarie originano come rami collaterali del primo tratto dell’aorta, l’aorta
ascendente, e a loro spetta il compito di nutrire quasi completamente tutto il cuore, tant’è che soltanto l’endocardio può
ricevere nutrimento direttamente dal sangue delle cavità cardiache che penetra per un centinaio di micron massivi. L’arteria
coronaria destra dona sangue al cuore destro, al setto interventricolare nella sua parte posteriore ed alla porzione posteriore del ventricolo sinistro.
L’arteria coronaria sinistra origina con un tronco comune, dalla
lunghezza variabile (pochi millimetri a circa 2,5 cm), per poi
dividersi in due consistenti rami: l’arteria discendente comune
(interventricolare anteriore) e l’arteria circonflessa; l’arteria
discendente comune è considerata la più importante per l’estensione dell’area cardiaca da essa irrorata: il suo decorso
comprende il solco interventricolare per poi raggiungere l’apice
cardiaco, dove termina “anastomizzandosi” con le ramificazioni terminali dell’arteria coronaria destra. Da essa prendono origine importanti branche che nutrono la maggior parte del ventricolo sinistro, come le arterie diagonali e le arterie settali; l’arteria circonflessa, ha il suo decorso che si diparte lungo il
solco atrio-ventricolare posteriore, e dalla parete posteriore
del ventricolo sinistro scende verso la punta, offrendo sangue
anche ad una parte del ventricolo destro. Ogni ramo delle arterie coronarie si divide in maniera dicotomica, così che ogni
ramo si divide in due più piccoli ed attraversa il muscolo cardiaco, fino a raggiungere gli strati più interni perpendicolarmente
allo spessore delle pareti. Alla periferia, le arterie coronarie, si
suddividono in tanti piccoli vasi che si anastomizzano tra loro,
formando il circolo collaterale, che può essere definito omocoronarico o intercoronarico a seconda se l’anastomosi è avve23
CARDIOLOGIA & FITNESS
nuta rispettivamente tra i rami della circonflessa con i rami
della discendente anteriore, oppure tra i rami della coronaria
sinistra con quelli di destra.
Le vene coronarie confluiscono in un unico vaso collettore, il
seno coronario, che raccoglie la circolazione venosa proveniente dal miocardio; è localizzato posteriormente al solco
atrioventricolare e immette, col suo tratto terminale regolato
da una valvola semicircolare, nell’atrio destro, fra l’orifizio atrioventricolare e lo sbocco della vena cava inferiore; il ventricolo
destro, invece, usufruisce per la sua circolazione venosa, delle
vene cardiache anteriori, che si immettono direttamente nell’atrio destro. Soltanto una piccola parte del sangue coronarico
torna a versarsi direttamente nelle cavità cardiache, grazie alle
vene di Tebesio. È durante la diastole che la circolazione coronarica svolge la sua funzione dato che, durante la sistole, le
coronarie sono compresse e il flusso coronarico è ridotto al
minimo, contrariamente a quanto accade al resto del corpo. In
condizioni di riposo il flusso coronarico varia dai 100 a poco
più di 200 ml di sangue al minuto, pari a 0,7-0,8 ml per grammo di muscolo cardiaco (50-60 ml per 100 mg al minuto di
miocardio a riposo). Durante la sistole la pressione agente sul
miocardio subendocardico risulta elevatissima ed i relativi vasi
subendocardici sono molto più compressi di quelli situati nella
parte intermedia (endocardio) ed esterna (epicardio). Per questa ragione, il plesso arterioso subendocardico, adiacente alla
cavità ventricolare, risulta essere molto più esteso di quello
epicardico, proprio per compensare la forza di compressione
della muscolatura miocardica, in grado di ridurre, nella fase
sistolica, il flusso subendocardico quasi a zero; per questo
motivo, in questa regione, il flusso ematico nella diastole è
maggiore rispetto a quello riscontrabile negli strati intermedio
ed esterno del muscolo cardiaco. Il flusso coronarico è dunque
dipendente dalla pressione sanguigna e dalle resistenze coronariche; in particolare, è proprio la pressione aortica, a sua
volta dipendente dalla “gittata cardiaca” e dalla condizione
anatomica e funzionale dell’organo in toto, oltre che delle valvole e pareti aortiche, che determina il grado di diffusione del
sangue attraverso gli osti coronarici; le resistenze coronariche
dipendono dalle arterie coronariche epicardiche di grosso cali24
DAVIDE GIROLA
bro (vasi di conduttanza) e dalle arterie coronariche subendocardiche più piccole (vasi di resistenza). In condizioni di normalità, dunque, il flusso ematico è determinato dal tempo di diastole (durata diastole per frequenza cardiaca) e dalle resistenze coronariche; le resistenze dei grossi vasi di conduttanza
sono trascurabili, a condizione che essi siano perfettamente
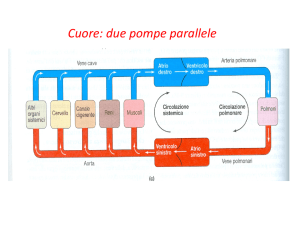
integri. La circolazione si suddivide, da un punto di vista anatomo-funzionale, in circolazione sistemica (grande circolazione) e
circolazione polmonare (piccola circolazione); la circolazione
sistemica, origina, tramite l’aorta, dal ventricolo sinistro e,
attraverso le arterie trasporta sotto pressione il sangue ai tessuti; nel circolo arterioso la pressione media, in condizioni di
riposo, è di circa 100 mmHg. Le arterie si ramificano via via
nelle arteriole che rappresentano l’apparato di distribuzione del
sangue arterioso, definito come “sistema valvolare di controllo”, in base alla capacità di regolazione del flusso sanguigno
nei capillari, in rapporto alle esigenze metaboliche dei tessuti.
Ai capillari spetta il compito di attivare lo scambio di sostanze
nutritive, acqua, ormoni, elettroliti e sostanze gassose e prodotti di rifiuto tra gli spazi interstiziali ed il sangue. Il “letto
capillare” (300-600 m2), è la sede di interposizione tra il sistema arterioso e quello venoso; il sistema venoso rappresenta il
sistema di raccolta del sangue caratterizzato da valori bassi di
pressione ma elevata capacità, dato che il volume ematico che
si trova nelle vene sistemiche è pari a circa il 60-65% di quello
dell’intero organismo e soltanto il 13% è situato nelle arterie
(7% nel cuore, 9% nei vasi polmonari, 7% nelle arteriole e nei
capillari), e la superficie di sezione è, in media, di circa quattro
volte maggiore a quella delle arterie (2,5 cm2 dell’aorta, 40 cm2
delle arteriole, “contro” gli 8 cm2 delle vene cave e gli 80 e
250 cm2 delle piccole vene e delle venule). Raccolto il sangue
capillare, le venule divengono progressivamente sempre più
grandi e confluiscono nella vena cava inferiore, che si forma
dalle due vene iliache comuni all’altezza della quarta vertebra
lombare e che trasporta il sangue proveniente dalla metà inferiore del corpo e dal circolo portale alla metà destra del cuore,
nell’atrio destro (la circolazione portale è formata dalle vene
che, a livello del tubo digerente, ricevono i prodotti della digestione e si uniscono nella vena porta che confluisce nel fegato:
25
CARDIOLOGIA & FITNESS
il sangue refluo si carica dei prodotti derivanti dal metabolismo
epatico e, attraverso le vene epatiche, si immette nella vena cava
inferiore). Il circolo polmonare è un sistema a bassa pressione
media (15 mmHg) e bassa “resistenza”: la pompa è rappresentata dal ventricolo destro; dopo gli scambi gassosi a livello alveolare, il sangue di nuovo ricco di ossigeno ritorna all’atrio sinistro.
Compiti assolti dalla circolazione sono quindi, i sintesi, quelli inerenti il trasporto (nutrienti, metaboliti, gas, ormoni, acqua) il metabolismo (attraverso i capillari) e la termoregolazione.
1. 2
ANATOMIA
E FISIOLOGIA DEL MIOCARDIO
L’anatomia del miocardio rivela che la sua ultrasruttura molecolare è assai simile a quella della muscolo scheletrico; il miocardio è composto da cellule muscolari striate, aventi una lunghezza
di 30-60mµ e un diametro di 10-15mµ e che risultano dunque
sensibilmente più sottili rispetto a quelle muscolari scheletriche.
Queste fibre sono a loro volta composte da multipli fasci incrociati di miofibrille, costituite dalle tipiche unità funzionali e strutturali
della contrazione, disposte in serie nel senso della lunghezza, i
sarcomeri; le membrane cellulari di alcune cellule adiacenti formano particolari margini chiusi denominati dischi intercalari, che
attraversano obliquamente il miocardio. Una regione di questi
dischi, detta giunzione serrata, permette un contatto funzionale
da cellula a cellula, a bassissima resistenza elettrica, grazie al
quale gli ioni possono diffondere con facilità, così che i potenziali
d’azione possono propagarsi di fibra in fibra, pure lateralmente. In
tal modo, il miocardio si presenta come un reticolo, chiamato
“sincizio funzionale”. Come è stato affermato, quindi, la contrazione del miocardio avviene secondo la teoria dello “scorrimento” o dell’avanzamento (“walk-along”), valida pure per la muscolatura scheletrica, dove l’attivazione dei sarcomeri provoca interazioni ripetitive a livello dei ponti dell’actina con la miosina, dipendenti dalla presenza di Mg++ e di ATP e dalla concentrazione del
calcio ionico Ca2+ che, legandosi alla troponinaC, permette la
variazione conformazionale della tropomiosina, esponendo i siti di
legame actinici. La differenza della contrazione miocardica da
quella dei muscoli scheletrici si evince, in primo luogo, dallo stu26
DAVIDE GIROLA
dio dei potenziale d’azione del miocardio; questo potenziale, infatti, presenta un “plateau”, responsabile della maggior lentezza
della contrazione del miocardio rispetto a quella del muscolo
scheletrico. In particolare il potenziale d’azione del miocardio
dipende dall’apertura di due tipi di canali per il passaggio di ioni:1)
i canali rapidi del sodio (identici quelli del muscolo scheletrico) e i
2) canali lenti del calcio; sono proprio questi canali lenti che, rimanendo aperti per alcuni decimi di secondo, fanno rimanere depolarizzata la membrana della fibra che presenta, fra l’altro (a differenze di quanto accade nel muscolo scheletrico),dopo l’instaurarsi del potenziale d’azione, una ridotta permeabilità al potassio,
che impedisce ulteriormente una precoce ripolarizzazione. Per
questi motivi biochimici, la contrazione miocardica dura più a
lungo (da 20 a 50 volte) di quella che avviene nella muscolatura
scheletrica. In questo contesto, in particolare, si deve ricordare
un’altra importante differenza: durante la contrazione del muscolo
cardiaco una quota aggiuntiva di ioni calcio proviene anche da
tubuli T che, nel miocardio, hanno un diametro di 5 volte maggiore di quello del muscolo scheletrico ed un volume di 25 volte
superiore; questo fenomeno, noto come “liberazione rigenerativa” di Ca2+, compensa il fatto che l’estensione del reticolo sarcoplasmatico (fonte di calcio ionico) del muscolo cardiaco risulta
essere inferiore rispetto a quella del muscolo scheletrico.
Durante la ripolarizzazione, il reticolo sarcoplasmatico riaccumula
il Ca2+ contro il gradiente di concentrazione, provocando l’inibizione tra le proteine contrattili. Da queste considerazioni, si può
intuire che la forza di contrazione del muscolo cardiaco dipende
dalla concentrazione di ioni calcio extracellulare e che la durata
della contrazione miocardica è strettamente in funzione della
durata del potenziale d’azione.
1. 3
IL
CICLO CARDIACO
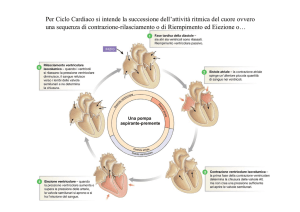
Il ciclo cardiaco (fig. 4) è composto da un periodo di rilasciamento chiamato diastole ed un periodo di contrazione chiamato sistole e, in sostanza, costituisce il periodo che intercorre tra l’inizio di una contrazione cardiaca e l’inizio di quella successiva. Le contrazioni cardiache sono sotto il controllo di un
27
CARDIOLOGIA & FITNESS
protodiastole
PRESSIONE (mmHg)
efflusso
sistolico
contrazione
isometrica
120
100
rilasciamento isometrico
riempimento rapido
diastasi
sistole atriale
apertura
valvola
aortica
chiusura
valvola aortica
(incisura)
pressione
aortica
80
60
40
chiusura
valvola A-V
apertura
valvola A-V
20
a
c
v
VOLUME (mL)
0
160
pressione
atriale
pressione
ventricolare
volume
ventricolare
120
R
80
Q
1° tono
FIG 4
Correlazione tra
eventi del ciclo
cardiaco ed
elettrocardiogramma.
T
P
2° tono 3° tono
ECG
S
fonocardiogramma
sistema specifico, responsabile della formazione e della conduzione degli impulsi ritmici che regolano l’attività della pompa
cardiaca, denominato “miocardio specifico”, la cui anatomia e
funzione verrà esplicata nel successivo paragrafo. In ogni singola fase dell’attività cardiaca, vengono ritmicamente esclusi
gli atri o i ventricoli. Il potenziale d’azione si propaga attraverso
le fibre del miocardio specifico, dopo che si è spontaneamente
generato nel nodo senoatriale (SA); gli atri si contraggono in
anticipo rispetto ai ventricoli. Come è stato detto nel primo
paragrafo, gli atri contribuiscono al riempimento ventricolare
soltanto per il 25%. Alla fine della sistole, quando le pressioni
ventricolari scendono a valori diastolici più bassi di quelli atriali,
le valvole atrio-ventricolari si aprono: durante il primo terzo
della diastole avviene il periodo di riempimento rapido ventricolare, mentre nel secondo terzo della diastole avviene il periodo
di riempimento lento ventricolare (diastasi); nell’ultimo terzo
della diastole gli atri si contraggono “innescando” i ventricoli.
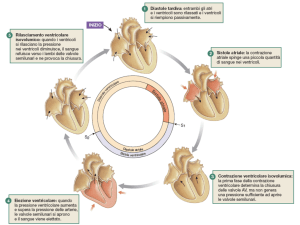
Subito dopo l’inizio della contrazione ventricolare, la pressione
dei ventricoli aumenta repentinamente, contribuendo alla chiusura delle valvole atrio-ventricolari; a questo punto i ventricoli
28
DAVIDE GIROLA
debbono sviluppare una pressione sufficiente per aprire le valvole semilunari aortica e polmonare: si ha quindi un periodo di
contrazione isometrica o isovolumetrica (in realtà l’accorciamento è ravvisabile in direzione punta-base con allungamento
della circonferenza). Il periodo di eiezione, avviene quando le
valvole semilunari si aprono (mediamente ciò accade quando la
pressione del ventricolo destro supera gli 8mmHg e quella del
ventricolo sinistro supera gli 80mmHg); durante il primo terzo
della sistole avviene un accorciamento delle fibre ventricolari
che determinano l’eiezione rapida di circa il 70% del sangue
(periodo di eiezione rapida). Durante i due terzi successivi,
avviene invece il periodo di eiezione lenta e, normalmente, l’efflusso corrisponde all’incirca al 30%: durante il periodo di eiezione lenta, accade che la pressione ventricolare risulta essere
leggermente inferiore a quella dell’aorta, ma il sangue viene
spinto ancora dal ventricolo perché possiede l’energia cinetica
necessaria affinché nell’aorta venga convertita in energia pressoria. Quando alla fine della sistole, i ventricoli si rilasciano, le
pressioni delle arterie spingono il sangue verso i ventricoli, provocando l’irruente chiusura delle valvole semilunari: per circa
3-6 centesimi di secondo, le pareti dei ventricoli si rilasciano,
senza che si modifichi il volume; questa fase corrisponde al
periodo di rilasciamento isometrico (isovolumetrico), in cui le
pressioni ventricolari scendono ai loro valori minimi, permettendo l’apertura delle valvole atrio-ventricolari per l’inizio di una
nuova diastole. Il riempimento ventricolare durante la diastole
provoca, come si è accennato nel paragrafo introduttivo, un
aumento di volume, chiamato “volume diastolico finale” o volume telediastolico che può raggiungere i 130 ml; normalmente,
circa il 60% del volume telediastolico, viene pompato dal ventricolo durante la sistole (frazione di eiezione). La quantità di
sangue che rimane nei ventricoli (40-60ml) è chiamata “volume
sistolico finale” (volume telesistolico), mentre quella che viene
espulsa costituisce la gittata sistolica (circa 70 ml in condizioni
di normalità). Caratteristiche sono le curve della pressione
atriale e aortica (vedi figura); nella curva di pressione atriale si
possono distinguere 3 tipologie di onde (a, c, v); l’onda a corrisponde alla sistole atriale e le pressioni nell’atrio destro e sinistro, sono fisiologiche per valori rispettivamente di 4-6 e 8
29
CARDIOLOGIA & FITNESS
FIG 5
Diagramma
forza/lunghezza
di una singola fibra
muscolare.
Il rapporto tra
la lunghezza
iniziale della fibra
e lo sviluppo
della forza
è di fondamentale
importanza
nella meccanica
cardiaca.
Da: Cavagna, 1988
mmHg; l’onda c è provocata dalla sporgenza delle valvole
atrio-ventricolari e dal piccolo reflusso verso gli atri all’inizio
dele contrazioni ventricolari; l’onda v è determinata dall’accumulo lento di sangue negli atri che accade alla fine delle contrazioni ventricolari e scompare con l’apertura delle valvole
atrio-ventricolari. La tipica “incisura” che si nota nella curva
della pressione aortica, è dovuta alla chiusura della valvola aortica contemporanea ad un lieve reflusso di sangue verso il ventricolo, proprio all’inizio del periodo isovolumetrico, alla fine
della sistole. I suoni udibili mediante l’auscultazione del cuore
attraverso uno stetoscopio, sono provocati dalla chiusura delle
valvole. Il primo tono cardiaco, è udibile all’inizio della sistole
ventricolare e corrisponde alla chiusura delle valvole atrio-ventricolari, mentre il secondo tono cardiaco, più rapido e marcato
del primo corrisponde alla chiusura delle valvole aortica e polmonare; non è raro udire poi, un terzo tono cardiaco, durante il
principio o la metà della distole, provocato dall’entrata del sangue nella camera ventricolare non del tutto ripiena.
1. 4
LA POMPA CARDIACA: MECCANISMI DI REGOLAZIONE
IL LAVORO DEL CUORE.
LEGGE DI FRANK STARLING E DI LAPLACE
Considerati gli eventi biochimici che sostengono e influenzano la contrazione cardiaca e che verranno ripresi nel para-
30
DAVIDE GIROLA
grafo concernente il sistema di conduzione specifico, si discute ora circa i meccanismi di regolazione della pompa cardiaca
che, di fatto, determinano il lavoro del cuore.
Come è noto, il muscolo può essere paragonato ad un motore
capace d trasformare l’energia chimica potenziale all’interno di
esso, in energia meccanica. La capacità di accorciarsi del
muscolo per una certa distanza L, spostando o sollevando un
carico P, oppure per accelerare l’energia cinetica di una massa
(ad esempio quella sanguigna) o per vincere degli attriti, genera una forza che instaura un lavoro meccanico positivo o motore W+ = P • L. Ma il muscolo in attività, altrettanto notoriamente, possiede anche la capacità di resistere ad un allungamento prodotto da una forza esterna: in questo contesto il
muscolo la funzione frenante del muscolo produce un lavoro
negativo W- = F (- L); siamo nel tipico caso in cui il muscolo
si contrae eccentricamente e la forza sviluppata dal muscolo è
diretta, come nel lavoro concentrico positivo, verso il centro
del muscolo stesso: in pratica il lavoro meccanico è svolto sul
muscolo invece che dal muscolo.
In base al rapporto tra lavoro positivo e lavoro negativo e considerando come esercizio muscolare il movimento promosso e
sostenuto esclusivamente dalla contrazione muscolare, il lavoro del cuore può essere annoverato tra gli esercizi in cui tale
∆
∆
∆
31
FIG 5b
Diagramma
forza/lunghezza
statico di un
muscolo sartorio di
rana.
l0 corrisponde
alla lungheza
ottimale alla quale
il muscolo sviluppa
la massima forza.
Da: Cavagna, 1988
CARDIOLOGIA & FITNESS
lavoro è usufruito per vincere gli attriti esterni ed il lavoro negativo dovuto all’azione frenante è nullo (rapporto W-/W+ =
zero), esattamente come il nuoto e vari tipi di volo. In realtà, il
lavoro sostenuto dalla pompa cardiaca (ventricolo) determinata
per accelerare la massa sanguigna attraverso le valvole semilunari, definito come lavoro di accelerazione (per fornire l’energia
cinetica di flusso sanguigno), costituisce solamente l’1% del
lavoro totale del ventricolo, impegnato invece compiere un
lavoro di “pressione-volume” che si instaura per trasportare il
sangue dal sistema venoso a bassa pressione alle alte pressioni del sistema arterioso. In particolare, rifacendosi all’anatomia
funzionale e alla fisiologia del muscolo, si capisce che la forza
di contrazione del muscolo è in stretta dipendenza da variabili
quali la velocità di accorciamento, la lunghezza del muscolo, gli
aspetti biochimici ed enzimatici, la temperatura. Anche nel
muscolo cardiaco è fondamentale riconsiderare il rapporto tra
forza-lunghezza, forza-velocità e relativi diagrammi e curve;
come in tutti muscoli striati pure nel muscolo cardiaco la forza
di contrazione dipende dalla lunghezza iniziale; considerando il
diagramma forza-lunghezza di una singola fibra muscolare (fig.
5) si intuisce che la lunghezza del sarcomero che si abbina alla
contrazione più vigorosa è di circa 2,2µm, in accordo alla ben
nota teoria dei “filamenti scorrevoli”: lo sviluppo della forza
muscolare diminuisce in maniera direttamente proporzionale
alla diminuzione del livello di affiancamento tra i filamenti spessi e quelli sottili, da cui dipende la diminuzione dei siti attivi. Ad
esempio, per una lunghezza di 3,65µm, i filamenti di actina si
trovano tutti al di fuori della banda A, per cui non può essere
sviluppata tensione; contrariamente, un accorciamento dei sarcomeri (avvicinamento delle linee Z) inferiore a 2µm, provoca
una sovrapposizione dei filamenti sottili e una diminuita sensibilità al Ca2+ dei siti attivi e dunque una riduzione della capacità
di sviluppare la forza. L’interpretazione critica del diagramma
forza-lunghezza della singola fibra muscolare suggerisce che
solamente a lunghezze inferiori a quella ottimale, l’allungamento dei sarcomeri è seguito da un aumento di forza che si oppone all’allungamento medesimo. Nel muscolo cardiaco le fibrocellule muscolari dei ventricoli si allungano in maniera proporzionale al volume telediastolico (riempimento ventricolare). Le
32
DAVIDE GIROLA
fibrocellule, in accordo col diagramma forza-lunghezza, risponderanno all’allungamento sviluppando una forza che è in funzione della lunghezza a cui sono sottoposte durante la diastole:
se tali lunghezze sono inferiori a quella ottimale, durante la
sistole le fibrocellule ventricolari, assicureranno lo sviluppo di
una forza che sarà ideale per lo svuotamento fisiologico dei
ventricoli, evitandone un eccessivo riempimento. In pratica il
diagramma forza-lunghezza del sarcomero (fig. 5) rappresenta
la base strutturale della legge del cuore di Frank-Starling. La
legge dice che la forza di contrazione del ventricolo dipende
dalla lunghezza che possiede alla fine della diastole (volume
ventricolare telediastolico) e, in pratica, entro limiti fisiologici, la
pompa cardiaca pompa tutto il sangue che ad essa giunge, evitando uno smodato ristagno di sangue nel sistema venoso.
Oltre il diagramma forza-lunghezza, per comprendere la funzione e il lavoro del cuore, bisogna considerare anche il diagramma forza-velocità di accorciamento (fig. 6) o della “funzione
motrice” di Hill, da cui si evincono importanti concetti che
descrivono la funzione muscolare, quali ad esempio, la relazione tra la velocità di accorciamento e la forza sviluppata, la velo-
33
FIG 6
Diagramma
forza/velocità
di un muscolo
sartorio di rana.
I valori negativi
indicano
la velocità
di allungamento
del muscolo,
i valori positivi
la velocità
di accorciamento.
CARDIOLOGIA & FITNESS
FIG 7
Diagramma
pressione/volume.
L’area EW
rappresenta
il lavoro netto
esterno
del ventricolo
durante il ciclo di
contrazione.
Se il cuore pompa
grandi quantità di
sangue il
diagramma si
estende verso
destra (maggior
riempimento
diastolico), verso
l’alto (maggior
pressione
ventricolare) e
verso sinistra
(maggior riduzione
di volume tramite
stimolazione
simpatica).
cità massima di contrazione muscolare (Vmax), i concetti, la
potenza e, in parte, il rendimento meccanico. La relazione
forza-velocità si applica dunque anche al miocardio, anche se
vi sono sostanziali differenze rispetto a quelle riscontrabili nel
muscolo scheletrico; il muscolo scheletrico presenta una curva
forza-velocità quasi
fissa (diagramma
forza-velocità come
un iperbole a traslaz i o n e
d’assi),
dove per
una data
lunghezza
iniziale la
forza e a
velocità sono sempre correlate nel medesimo modo. Nel
cuore, in pratica, contrariamente a quanto accade nel muscolo
scheletrico, il numero di miofibrille e di sarcomeri attivi durante
la contrazione è costante, e non dipende dal reclutamento di
unità motorie e dalla frequenza degli impulsi nervosi. Lo spostamento della curva forza-velocità del miocardio dipende da
modificazioni della lunghezza iniziale e dello stato di contrattilità
(stato inotropo), a sua volta dipendente, come verrà descritto
più avanti, da stimolazioni adrenergiche o da altri fattori, come i
farmaci inotropi cardiaci (glicosidi cardioattivi). Il lavoro del
cuore può essere espresso graficamente tramite il “diagramma volume-pressione” direttamente connesso al ciclo cardiaco
(fig. 7); i punti di riferimento fondamentali del diagramma sono
le due curve di pressione diastolica e sistolica ventricolare,
Fino ad un volume pari a circa 150ml di sangue, la pressione
diastolica non subisce importanti incrementi, mentre la pressione sistolica cresce fino a raggiungere un valore massimo in
corrispondenza ad un volume ventricolare di 150-170 ml circa,
per poi decrescere per le conseguenze anatomo-funzionali
34
DAVIDE GIROLA
FIG 8
Curve
della gettata
fisiologica
del cuore umano.
appena descritte. Le quattro fasi del ciclo cardiaco (periodo di
riempimento I, periodo di contazione isovolumetrica II, periodo
di eiezione III e periodo di rilasciamento isovolumetrico IV),
rappresentate graficamente, delimitano l’area EW, rappresentante il lavoro esterno netto del cuore. Le curve di funzione
ventricolare, (fig. 8) invece, rappresentano lo stato contrattile
o inotropo del ventricolo e sono ottenute dalla relazione tra
pressione atriale media (pressione telediastolica) e il lavoro
sistolico (grammo/metri). Il lavoro sistolico, entro i limiti fisiologici (legge di Frank-Starling), dipende dalle variazioni della
pressione atriale. Durante l’esercizio fisico, l’aumento della
contrattilità ventricolare fa spostare la curva verso l’alto e
verso sinistra, viceversa una riduzione della contrattilità ventricolare determina uno spstamento verso il basso e verso
destra; comunque durante la stimolazione adrenergica che si
riscontra durante l’attività fisica, il meccanismo di FrankStarling, come fattore determinante il lavoro del cuore, risulta
secondario, rispetto alle variazioni riguardanti la contrattilità
miocardica, la frequenza cardiaca, le resistenze vascolari periferiche, il ritorno venoso, i fattori neuro-ormonali, perché si
osserva una modesta variazione del volume telediastolico.
Lo stato di funzione ventricolare è ben rappresentato dalla frazione di eiezione, ovvero dal rapporto tra il volume telesistoli35
CARDIOLOGIA & FITNESS
co e telediastolico. La regolazione dell’attività cardiaca è dunque determinata da tre fattori:
1 il precarico (volume telediastolico ventricolare), ovvero la
lunghezza telediastolica delle fibre all’inizio della contrazione
(meccanismo di Frank-Starling)
2 lo stato inotropo, rappresentato dalla curva di funzione ventricolare e, dunque, dal rapporto forza-velocità-lunghezza e
dalle concentrazioni di Ca2+ (contrattilità miocardica) 1
3 il postcarico ventricolare, ovvero la “tensione” che il miocardio deve sviluppare durante la contrazione, 1rappresentato dalla gittata sistolica a sua volta dipendente dall’entità
d’accorciamento delle fibre ventricolari.
1 Uno dei metodi
utilizzati per la valutazione della contrattilità cardiaca
consiste
nella
determinazione del
rapporto dP/dt
(mmHg/sec) che
esprime la variazione di velocità della
pressione ventricolare nel tempo. I
dati sperimentali
suggeriscono che
la velocità (picco di
velocità) con la
quale la pressione
ventricolare
aumenta è correlata con la forza di
contrazione;
comunque il picco
dP/dt dipende sia
del precarico, sia
dal postcarico: per
evitare
queste
variabili, differenti
da soggetto a soggetto, si è dunque
ricorso ad altri criteri quantitatvi, dividendo per esempio, la dP/dt per la
pressione ventricolare istantanea P:
(dP/dt) /P.
Il precarico è determinato dal volume ematico totale, dalla sua
distribuzione e dal grado di contrazione atriale.
In particolare il volume telediastolico del ventricolo, al di là dell’entità del volume ematico totale, è determinato dalla distribuzione sanguigna tra i compartimenti intra ed extratoracici, a sua
volta dipendente dalla posizione del corpo, dalla pressione
intratoracica, dalla pressione intrapericardica, dal ritorno venoso e dall’azione di pompa dei muscoli scheletrici in attività.
La riduzione dei riempimenti e dunque del lavoro ventricolari, in
ortostasi e in posizione eretta, è determinata dall’aumento
della “frazione toracica”; durante l’inspirazione la pressione
intratoracica diviene più negativa ed il ritorno venoso risultata
aumentato; la venocostrizione che si riscontra durante l’esercizio fisico, ad opera della muscolatura liscia, e la spremitura del
letto venoso da parte della muscolatura scheletrica, oppure
durante gli stati ipotensivi o di stress emotivo, diminuisce la
frazione di sangue extratoracica e aumenta quella intratoracica
e dunque lo stato di contrattilità cardiaca.
Anche la contrazione atriale ha un’influenza diretta sulla funzione della pompa cardiaca, in quanto capace di fare aumentare il
riempimento ventricolare, il volume telediastolico e la frequenza cardiaca del 10-20%, fattore di importanza fondamentale
che si riscontra proprio quando v’è una perdita della contrazione atriale nei casi di ipertrofia ventricolare concentrica.
Lo stato inotropo o di contrattilità miocardica è correlato a
numerosi fattori capaci di influenzare dunque le relazioni esi36
DAVIDE GIROLA
stenti tra forza, lunghezza, velocità e concentrazione di calcio
ionico. Tralasciando il fattore precarico, la stato contrattile del
cuore è influenzato sinteticamente dai seguenti fattori:
• tono o “drive” simpatico (attività nervosa adrenergica), che agisce aumentando stato inotropo e frequenza i contrazione, tramite l’azione della noradrenalina agente sui recettori beta-adrenergici del miocardio e attraverso la liberazione di catecolamine
da parte della midollare del surrene e dei gangli simpatici
• depressori fisiologici e farmacologici: questi fattori deprimono la curva forza-velocità; tra i depressori fisiologici si menzionano l’ischemia, l’ipossia, l’acidosi miocardica, mentre
tra quelli farmacologici si ricordano i calcioantagonisti, i barbiturici, gli anestetici ed altri farmaci che verranno descritti
nel 5°capitolo
• agenti inotropi esogeni: tra questi si annoverano le sostanze “simpaticomimetiche” (calcio, caffeina ecc), i glicosidi
cardiaci (isoproterenolo), in grado di migliorare il rapporto
forza-velocità del miocardio e dunque potenziando la funzione ventricolare
• fattori deprimenti legati a patologie: tra questi, a titolo di
esempio, si ricorda la necrosi di una porzione di miocardio
dovuta ad attacchi ischemici (infarto miocardico) e gli eventi
legati all’insufficienza cardiaca cronica (scompenso cardiaco cronico), in grado di deprimere la funzione venticolare e
lo stato di inotropismo intrinseco del cuore, indipendentemente dal precarico (volume telediastolico).
Il postcarico ventricolare è valutabile durante il periodo di eiezione essendo rappresentato dalla tensione (o stiramento) che
le fibre muscolari della parete ventricolare producono durante
l’eiezione del sangue; la tensione delle fibre ventricolari dipende secondo la legge di Laplace 2 dal prodotto del raggio del 2 In base alla
legge di Laplace,
ventricolo per la pressione ventricolare intracavitaria diviso lo nel “cuore d’atlespessore di parete; in pratica la quota di accorciamento delle ta” (cap 2°) la tendella parete
fibre muscolari ventricolari, indipendentemente dal precarico e sione
ventricolare rimane
dallo stato inotropo, è inversamente proporzionale al postcari- costante:
co, che si oppone all’accorciaPressione Sistolica
mento. Il postarico dunque tende
= costante
a ridurre l’accorciamento delle spessore parete/raggio cavità ventricolare
37
CARDIOLOGIA & FITNESS
fibre muscolari, esattamente al contrario di quanto provoca
l’aumento del precarico e della contrattilità. L’aumento della
pressione arteriosa (che è in funzione del rapporto tra portata
cardiaca e resistenze periferiche) provoca a sua volta l’aumento del postcarico; tale aumento si oppone all’accorciamento
delle fibre del miocardio, riducendone la gittata sistolica (determinata all’entità d’accorciamento delle fibre e le dimensioni
ventricolari) e la portata cardiaca: questi meccanismi di regolazione della funzione cardiaca, associati ad importanti meccanismi umorali a breve termine, tramite feedback, tendono a riportare la pressione arteriosa alle condizioni di normalità.
1. 5
IL
MIOCARDIO SPECIFICO
Il miocardio specifico rappresenta il sistema di formazione
(autoeccitazione ritmica) e di conduzione degli impulsi cardiaci.
Prima ancora di entrare nei dettagli si ricorda che tramite il
sistema specifico, in condizioni di normalità:
• gli atri si contraggono prima dei ventricolo (circa 1/6 di
secondo prima, fungendo dunque da “pompe d’innesco” per
i ventricoli potenziandone l’aliquota di sangue ventricolare:
l’impulso viene “ritardato” nel nodo atrioventricolare A-V)
• tutte le parti ventricolari (attraverso il sistema di HisPurkinje) si contraggono simultaneamente in modo da rendere la pompa cardiaca potente ed ergonomica
• le fibre adrenergiche e colinergiche, innervando il miocardio
specifico, determinano la bilancia simpato-vagale, dalla quale
scaturisce la velocità di scarica degli impulsi e la funzione cardiovascolare in toto.
Anatomia (fig. 3). Il nodo senoatriale, denominato anche
nodo S-A o nodo del seno, identificato dai fisiologi inglesi
Keith e Flack nel 1907, è una struttura di miocardio specifico a
forma di fuso elissoidale (spessa 1 mm, larga 2-3 mm e lunga
15mm) posizionata sulla superficie epicardica dell’atrio destro
appena a lato e al di sotto dello sbocco della vena cava superiore; Il nodo S-A è irrorato, nella maggior parte dei casi, dall’arteria che origina dalla coronaria destra (60%) o dall’arteria
circonflessa (40% dei casi) la conduzione degli impulsi in alcu38
DAVIDE GIROLA
ne parti dell’atrio è più rapida: in particolare, nelle fibre del
fascio interatriale anteriore l’eccitamento cardiaco, dalle pareti
atriali anteriori fino all’atrio sinistro, raggiunge la velocità di
circa 1 metro/secondo, rispetto a quella di 0,3 metri/secondo
della restante muscolatura atriale. Le fibre del nodo S-A possiedono una ritmicità automatica di maggior grado rispetto alle
altre fibre del miocardio specifico ed alle altre fibre del miocardio; ciò è dovuto alla scarsa tenuta della membrana delle fibre
del nodo S-A al sodio ionico, così che il “potenziale di riposo”
risulta essere meno negativo (- 55 mV) rispetto a quello delle
fibre muscolari del ventricolo (variabile da – 85 a – 95 mV). Il
nodo del seno è riccamente innervato dalle fibre nervose adrenergiche e colinergiche postgangliari che regolandone la velocità di scarica; in particolare, la stimolazione vagale, attraverso
il rilascio di acetilcolina, rallenta la velocità di scarica, contrariamente agli effetti dovuti alla noradrenalina rilasciata dalle fibre
adrenergiche. L’impulso che si diparte dal nodo S-A e dal tessuto perinodale, giunge al nodo o giunzione atrioventricolare
(A-V) (descritto nel 1906 da Aschoff e Tawara), collocato sotto
l’endocardio atriale destro e anteriormente al seno coronarico
e aldisopra dell’annulus della valvola tricuspide; in flusso sanguigno nel nodo A-V è sostenuto nel 90% dei casi dall’arteria
coronaria discendente posteriore. Nel nodo A-V la conduzione
diventa lenta (circa 0,05 m/sec,1/8 di quella delle fibre del
miocardio non specifico); la lentezza è dovuta principalmente
dal fatto che le fibre nodali sono molto più piccole delle altre
fibre comuni atriali, fibre che, tra l’altro, contengono un esiguo
numero di giunzioni serrate (vedi “sincizio funzionale” del miocardio) che non facilitano il movimento ionico come avviene * In condizioni
nelle altre fibre miocardiche comuni. La contrazione atriale, in fisiologiche, la conduzione del potenanticipo rispetto a quella ventricolare (intervallo PR dell’elettro- ziale d’azione
cardiogramma), come è stato affermato precedentemente, lungo il fascio A-V
avviene soltanto in
permette agli atri di svuotare il loro contenuto ai ventricoli maniera anterograprima della loro sistole. Dal nodo A-V si origina il fascio di His da e cioè soltanto
atri ai ventri(1893) o fascio A-V * che, percorrendo la parete membrano- dagli
coli; del resto la
sa del setto interventricolare, giunge nella sua porzione dista- membrana fibrosa
le dando origine a due ramificazioni: la branca sinistra e la continua esistente
tra gli atri ed i venbranca di destra, più sottile. Le branche si ramificano origi- tricoli ha la stessa
nando il sistema periferico His-Purkinje che, in sede sottoen- funzione.
39
CARDIOLOGIA & FITNESS
FIG 9
Corrispondenza
tra il ciclo
QRS-T dell’ECG
e le diverse fasi
del potenziale
d’azione.
docardica ventricolare, formano fibre intrecciate che trasmettono l’impulso quasi contemporaneamente all’endocardio ventricolare sinistro e destro. Il fascio di His, dunque,
percorre il setto interventricolare per circa
5-15mm verso l’apice cardiaco ed è nutrito
dall’arteria del nodo A-V e dai rami della
coronaria discendente anteriore; l’impulso
cardiaco compie in media 0,03 secondi per
passare dal fascio A-V alle terminazioni delle
fibre di Purkinje. Dalle fibre di Purkinje l’impulso giunge alla muscolatura ventricolare
con una velocità inferiore a quella raggiunta
nelle fibre del miocardio specifico. In particolare, l’impulso cardiaco che si trasmette dalla superficie endocardica e quella
epicardica del ventricolo, segue un andamento obliquo dovuto
alla disposizione a spirale della muscolatura cardiaca; tale
impulso richiede altri 0,03 secondi, determinando un tempo
complessivo di trasmissione (dalle branche all’epicardio) di
circa 0,06 secondi.
L’attivazione della cellula cardiaca provoca un movimento ionico attraverso la membrana, in grado di generare una transitoria depolarizzazione della membrana, denominata “potenziale
d’azione”; nel muscolo atriale e ventricolare e nel sistema
His-Purkinjie, hanno parti ascendenti rapide (fase 0) grazie alla
presenza dei canali sodio-calcio rapidi, nel nodo S-A e del
nodo A-V la fase ascendente dei loro potenziali d’azione risultano essere lente per la prevalenza di canali calcio-sodio lenti.
Una rappresentazione schematica del potenziale d’azione di
una cellula cardiaca contempla 5 fasi (fig. 9) La fase 4, equivale al potenziale di membrana a riposo (come si è detto nel
ventricolo varia da -85 a -95 mV), dove la concentrazione di
potassio K+ intracellulare risulta essere elevata: uno stimolo
che riduce i potenziale di membrana al valore di soglia vicino a
-70mV (come accade nelle fibre di Purkinje), provoca un rapido aumento della permeabilità della membrana al sodio Na+
avviene dunque la depolarizzazione, determinando il tratto
rapido ascendente del potenziale d’azione (fase 0). L’inizio
della ripolarizzazione (fase 1) è rapida ma poi avviene il “pla40
DAVIDE GIROLA
teau” (fase 2) caratteristico delle cellule cardiache determinato dai canali calcio-sodio lenti ma anche dal fatto che la permeabilità della membrana del miocardio per il potassio K+
diminuisce di circa 5 volte durante il potenziale d’azione,fatto
che impedisce la ripolarizzazione precoce della membrana.
Dopo il “plateau”, la fase 3 è caratterizzata dall’emissione
degli ioni K+ e dunque dal ripristino della negatività intracellulare (ripolarizzazione rapida); il ritorno alla fase 4 è rappresentato dal ripristino dell’equilibrio ionico ed allo stato di riposo
con bassi livelli di Na+ intracellulare ed alta concentrazione di
K+intracellulare. Il periodo refrattario determina la refrattarietà
di una cellula cardiaca ad eccitarsi nuovamente per l’effetto di
un nuovo potenziale d’azione o, in altre parole, un secondo
potenziale d’azione, anche se molto intenso, non può aver
luogo fintanto che dura la depolarizzazione della fibra stessa
(periodo refrattario assoluto, determinato dall’inattivazione dei
canali del sodio e/o del calcio); nel periodo refrattario relativo
è possibile invece, tramite stimoli di intensità abnormale, rieccitare la fibra e rappresenta il proseguire del periodo refrattario effettivo, dove un nuovo stimolo è in grado di provocare
una risposta locale e non propagata (come avviene nel nodo
A-V). Dunque il nodo senoatriale S-A funge da “segnapassi”
o pacemaker ma, in talune situazioni patologiche, in un’altra
parte del cuore può accadere che si sviluppi una frequenza di
scarica ritmica più alta di quella del nodo S-A: questo pacemaker anomalo viene definito ectopico.
Riassunto. Le correnti elettriche che diffondono nel miocardio
derivano dalle cellule che regolano il ritmo (pacemaker), dal tessuto di conduzione specifico (miocardio specifico) e dal muscolo
cardiaco medesimo. Il potenziale di depolarizzazione (stimolazione) origina dal nodo S-A dove le cellule pacemaker sono dotate
di automatismo. Nella prima fase l’onda di depolarizzazione negli
atri è seguita dalla contrazione atriale: l’impulso poi si dirige verso
il nodo A-V e il fascio di His, che insieme formano la giunzione A-V.
Il fascio di His si divide in due fasce (branche),destra e sinistra
che, attraverso e fibre di Purkinje, trasmettono le onde di depolarizzazione al miocardio di ventricoli destro e sinistro, il fascio sinistro a sua volta si divide in nel ramo sinistro anteriore e nel ramo
41
CARDIOLOGIA & FITNESS
sinistro posteriore. L’elettrocardiogramma (ECG) registra solamente i potenziali di depolarizzazione e ripolarizzazione (riposo).
L’ECG è composto da un’onda P, di un complesso “QRS”, dal
segmento ST e dalle onde T e U. Le onde P e le componenti del
complesso QRS dunque sono onde di depolarizzazione, rispettivamente degli atri e dei ventricoli, mentre il tratto ST-T-U (segmento ST ed onde T e U) rappresentano la ripolarizzazione ventricolare (in condizioni di normalità le onde di ripolarizzazione degli atri
sono troppo basse per essere rilevate). Esiste una corrispondenza
tra le onde ORS-T e i potenziali di azione ventricolari (fig. 10): la
fase 0 corrisponde all’inizio del complesso QRS, la fase 2 (plateau) corrisponde al segmento ST, mentre la ripolarizzazione attiva (fase 3) corrisponde all’inizio dell’onda T. Dunque l’onda P
appare immediatamente prima dell’inizio della contrazione atriale
ed il complesso QRS appena prima dell’inizio della contrazione
ventricolare; i ventricoli, per alcuni millesimi di secondo, rimangono contratti sino dopo l’avvenuta ripolarzzazione (fine dell’onda
T). L’ECG (per approfondimenti vedi 4°capitolo) è registrato su
carta millimetrata e le suddivisioni orizzontali corrispondono più
piccole (1mm) corrispondono a 0,04 sec (40ms), mentre le linee
più marcate corrispondono ad intervalli di 5 mm (0,2 sec o
200ms) dato che la carta possiede normalmente una velocità di
25mm/s; nell’ECG si rilevano quattro intervalli principali: R-R, PR,
QRS e QT. La valutazione dell’intervallo può dare utili indicazioni
sulla bilancia “simpato-vagale” e sull’entità della frequenza cardiaca, l’intervallo PR (120-200ms) indica il tempo che passa tra la
depolarizzazione atriale e quella ventricolare; l’intervallo QRS
(100ms) indica la durata della depolarizzazione ventricolare, mentre l’intervallo QT (indica il tempo necessario per la depolarizzazione e la ripolarizzazione ventricolare e risulta essere inversamente proporzionale alla frequenza cardiaca (0,44 sec)
1. 6
PRINCIPI DI EMODINAMICA
FLUSSI, RESISTENZE E PRESSIONI
Il principio fondamentale dell’emodinamica è rappresentato
dalla legge di Ohm (Q= P/R), dove il flusso in un vaso sanguino (Q)
è direttamente alla differenza di pressione tra le due estremità del
∆
42
DAVIDE GIROLA
∆
vaso ( P) e inversamente proporzionale alla resistenza (R); dunque
il flusso è determinato dalla differenza di pressione esistente agli
estremi del vaso e non dal valore assoluto della pressione; il flusso
laminare è il flusso di sangue che scorre in maniera costante nella
direzione dell’asse vasale, disponendosi in strati concentrici; nel
flusso turbolento, opposto a quello laminare, il sangue si muove
anche nella direzione del diametro vasale: la tendenza alla turbolenza del flusso sanguigno è espressa dal numero di Reynold (Re) ed è
direttamente proporzionale al diametro del vaso d (cm) e alla velocità del flusso v (cm/sec) ed è inversamente proporzionale alla
viscosità ρ (poisies) divisa per la sua densità η; nelle arterie il numero di Reynold varia dai 200 ai 400, ma in prossimità dell’aorta e dell’arteria polmonare si eleva anche ad alcune migliaia. La resistenza4
rappresenta l’impedimento al flusso sanguigno all’interno di un vaso.
In base alle legge di Ohm, la resistenza nel letto vascolare sistemico
(RVS) 5, in condizioni di riposo, è direttamente proporzionale alla differenza tra la pressione media sistemica (pressione media in aorta
PAM: 100mmHg) e la pressione media nell’atrio destro (PAD: 28mmHg) e inversamente proporzionale al flusso sistemico (Fs in
l/min); la resistenza nel letto vascolare polmonare (RVP) è direttamente proporzionale alla differenza tra la pressione in arteria polmonare (PPM: 9-18mmHg) e la pressione in atrio sinistro (PAS e inversamente proporzionale al flusso polmonare Fp (l/min).
∆
P
Legge di Ohm: Q= ———
R
80 (PAM PAD)
80 (PPM – PAS)
RVS= ——————— ; RVP= ———————
Fs
Fp
ρ Pr4
Conduttanza ∝ Diametro 4; legge di Poiseuille Q = ————
8η l
∆
La conduttanza di un vaso è il reciproco della resistenza ed
è la quantità di flusso ematico in un vaso per un certo gradiente di pressione; in particolare la conduttanza aumenta
in proporzione della quarta potenza del diametro vasale.
Il marcato aumento della conduttanza in funzione del diametro (anche se quest’ultimo aumenta di soltanto di quat43
4 A riposo, il valore del flusso ematico è di circa 100
ml/sec e P tra
arterie e vene
sistemiche è di
circa 100mmHg:
da ciò deriva che
la resistenza complessiva della circolazione sistemica è (legge di
Ohm) a 100/100
ovvero 1, definita
come U. R. P.
(unità di resistenza
periferica); nel
corso dell’esercizio fisico (aumento
di flusso, pressioni
e vasodilatazione)
l’U. R. P può ridursi a circa 1/3 dei
valori a riposo
(0,3-0,2 U. R. P.).
Nel circolo polmonare l’U. R. P. è di
circa 0,14.
5 RVS e RVP
sono espresse in
unità del sistema
CGS (centrimetro,grammo,
secondo), ovvero
in dyne x sec/cm5;
80 è la costante di
conversione in
unità metrico-decimale; RVS risulta
essere normalmente compresa
tra i 700-1600
dyne x s/cm5,
mentre RVP può
assumere valori
compresi tra i 20 e
i 130 dyne x
s/cm5.
CARDIOLOGIA & FITNESS
6 La viscosità del
sangue è di circa 3
volte quella dell’acqua ed è in funzione
del volume percentuale di sangue rappresentato dalle cellule (ematocrito); in
particolare nei piccoli vasi, dove la
resistenza è maggiore, la viscosità
del sangue può
ridursi anche della
metà, grazie all’effetto FahraeusLindqvist caratterzzato da un allineamento dei globuli
rossi, effetto che
comunque viene
controbilanciato
dalla notevole riduzione della velocità
capillare
(0,3
mm/sec) e all’adesione delle emazie
fra di loro e alle
pareti vasali o al
blocco del flusso
capillare per qualche
frazione si secondo.
7 La gettata cardiaca viene espressa
mediante l’indice
cardiaco (I. C.) corrispondente alla gettata cardiaca per
metro quadrato di
superficie corporea.
Per un uomo di 70
Kg, la superficie
corporea di circa
1,7 m e l’I. C. risulta
essere circa 3-3,5
litri al minuto e per
metro quadrato.
8 È la pressione
rilevabile in qualsiasi
punto della circolazione sistemica se
si arrestasse completamente il flusso.
tro volte) si evince dalla legge di Jean Leon e Marie
Poiseuille, in cui l’entità del flusso sanguigno Q è direttamente proporzionale al gradiente pressorio tra gli estremi
del vaso moltiplicato per la quarta potenza del vaso r e
inversamente proporzionale alla sua lunghezza l e la viscosità 6 del sangue. In sostanza, la legge di Poiseuille è
sostenuta dalle caratteristiche intrinseche del “flusso laminare” in cui il sangue adiacente all’endotelio vasale scorre
con notevole difficoltà, mentre il flusso di. sangue che
scorre negli anelli concentrici più lontani dalla parete vasale
è via via sempre più veloce.
1. 7
GETTATA
CARDIACA E RITORNO VENOSO:
VALUTAZIONE E REGOLAZIONE
La gettata cardiaca Q rappresenta il volume di sangue che
la passa per il cuore ad ogni minuto (volume/minuto cardiaco);
nell’individuo adulto, allo stato di riposo, è di circa 5-6 l/min: in
ortostatismo si riduce del 10-20%, ed è influenzata dall’età, dal
sesso e dalle dimensioni corporee7.
La gettata cardiaca è influenzata da numerosi fattori e variabili.
1. Ritorno venoso (RV) (e dunque il precarico e la legge di
Frank-Starling), a sua volta determinato dai seguenti fattori:
a il riempimento ventricolare provoca uno “stretching” della
parete atriale destra che stimola il nodo del seno ed evoca
il riflesso nervoso di Bainbridge: questi due eventi contribuiscono ad aumentare la frequenza cardiaca di del 10-15%;
dunque la gettata cardiaca è determinata dall’entità dei flussi sanguigni locali e quindi dalla risultante del metabolismo
locale dei vari tessuti: è implicito che l’attività fisica (aumento dei flussi in determinati distretti, aumento del consumo di
ossigeno) costituisce un fattore determinante (incremento)
della gettata.
b la pressione circolatoria media di riempimento8 (MSFP) che
in condizioni di normalità assume valori medi di 7mmHg, è
in stretto rapporto col volume del sangue, e direttamente
influenzata dal ruolo de sistema nervoso autonomo;
c a resistenza al ritorno venoso (RRV) è quella che si oppone
44
DAVIDE GIROLA
alla spinta che subisce il sangue per ritornare al cuore
destro è determinato per 2/3 dalla resistenza venosa e 1/3
da quella delle piccole arterie e arteriole: il suo valore si evince dalla formula sotto enunciata e dipende dalla pressione
sistemica media di riempimento (MSFP), dalla pressione
atriale destra (PAD) e, logicamente, dal ritorno venoso (RV):
MSFP - PAD
RV = ———————
RRV
Normalmente il suo valore è di circa 1,4-1,5 mmHg, con
una pressione atriale destra di 0mmHg; in particolare un
lieve aumento della pressione atriale provoca la drastica
diminuzione del ritorno venoso e quindi della gettata e della
pressione arteriosa. Via via che la pressione atriale destra
aumenta, la pressione arteriosa subisce un decremento e
vengono ad equivalersi nel sull’asse delle ascisse (PSR)
della figura 10 corrispondente a 7 mmHg definito come
pressione sistemica media di riempimento;
d gradiente di pressione per il ritorno venoso: più è grande la
differenza tra la pressione sistemica media di riempimento
pressione dell’atrio destro, più elevato risulta essere il ritorno venoso.
2. Resistenza periferica totale: in base alla legge di Ohm, si
intuisce che un aumento della resistenza periferica totale fa
diminuire il valore di gettata cardiaca, mentre una sua diminuzione ne provoca un aumento.
45
FIG 10
Curva del ritorno
venoso
in condizioni
di normalità.
Il plateau
corrisponde
al collasso
delle grandi vene
che affluiscono
nel torace.
CARDIOLOGIA & FITNESS
Pressione Arteriosa
Gettata cardiaca = —————————————
Resistenza Periferica Totale
9 A livello capillare, l’aumento della
gettata cardiaca
provoca l’aumento
dell’essudato all’esterno dei capillari
(verso i tessuti)
con diminuzione
del volume a livelli
di norma; il fenomeno di stressrilasciamento
riguardante le vene
è particolarmente
evidente a livello
di fegato e milza
che diventano importanti serbatoi di
sangue; l’eccessivo flusso sanguigno periferico eleva
i valori di resistenza periferica.
3. Stimolazione e inibizione simpatica: la stimolazione simpatica
potenzia lo stato inotropo del cuore e, attraverso la vasocostrizione periferica, fa elevare la resistenza al ritorno venoso
senza cospicue variazioni della pressione atriale destra; le
stimolazioni massimali del simpatico provocano l’aumento
progressivo della gettata sino a valori anche doppi del normale; l’inibizione simpatica, attraverso una caduta dei valori
pressori medi di riempimento sistemico e la diminuzione dell’efficienza della pompa cardiaca anche del 70-80%, provoca
la riduzione della gettata di circa il 55-60% del normale.
4. Variazioni del volume sanguigno: l’aumento del volume sanguigno eleva il valore della pressione sistemica media di
riempimento e del ritorno venoso, il che corrisponde ad
aumento di gettata anche di 3 volte rispetto a quelle normali;
tale aumento viene comunque compensato nel giro di alcune
diecine di minuti da fenomeni9 in grado di determinare l’incremento di resistenza della circolazione periferica attraverso la costrizione vasale. Una diminuzione del volume di sangue e una dilatazione venosa acuta (per un’improvvisa e
anomala diminuzione del sistema simpatico) possono esssere responsabili di una marcata riduzione di gettata, tali da
provocare uno schock circolatorio.
5. Variazioni indotte dalle malattie sistemiche: l’aumento della
gettata cardiaca può essere determinato da alcune malattie
in grado di diminuire la resistenza periferica totale quali, ad
esempio,gli stati di ipovitaminosi (come il deficit di tiamina
nel “beri-beri), l’ipertiroidismo, l’anemia, la fistola arterovenosa (shunt), turbe psicologiche come l’ansia. Una diminuzione della gettata può essere determinata da importanti
patologie che hanno un’influenza diretta sul cuore alterandone profondamente la funzione di pompa (precarico, stato
inotropo e post carico) e i livelli metabolici del miocardio: tra
queste patologie vi sono l’infarto miocardico acuto, le lesioni
valvolari gravi, le miocarditi, le alterazioni determinate dall’artrite reumatoide e dalle collagenopatie vascolari e da neopla46
DAVIDE GIROLA
sie quali i carcinoidi e il feocromocitoma, nelle quali si possono riscontrare abnormi livelli di catecolamine e di altre
sostanze vasoattive (serotonina e chinina); altri importanti
effetti di patologie sul sistema cardiovascolare, in grado di
variarne l’emodinamica, saranno trattati nei prossimi capitoli.
1. 8
REGOLAZIONE
DELLA CIRCOLAZIONE E MECCANISMI
DI CONTROLLO DELL’OMEOSTASI PRESSORIA
Premessa
La regolazione della circolazione avviene sia a livello
locale (in base alle esigenze dei tessuti e meccanismi di
autoregolazione dei flussi sanguigni locali, tramite agenti
vasocostrittori e vasodilatatori di tipo umorale, siano essi
ormoni o ioni), sia a livello centrale, attraverso l’intervento
del sistema nervoso centrale che agisce a più livelli, in
prevalenza riguardanti l’attività della pompa cardiaca ed il
controllo “rapido” della pressione arteriosa. Il ruolo della
sezione simpatica è predominante rispetto a quello esercitato dalla sezione parasimpatica. Il sistema simpatico ha
un ruolo prevalentemente vasocostrittore, anche se possiede fibre vasodilatatrici; il sistema parasimpatico agisce
tramite i nervi vaghi e a livello del controllo della circolazione agisce in maniera importante soltanto sulla frequenza cardiaca. L’attività efferente simpatica origina nella formazione reticolare del bulbo e nel terzo inferiore del
ponte, chiamata “centro vasomotore”, in cui sono state
individuate 3 aree: l’area C-1 vasocostrittrice, l’area A-1
vasodilatatrice e l’area A-2 sensitiva che raccoglie i
segnali dai nervi vago e glossofaringeo, in grado di modulare l’attività vasomotoria (sia essa vasocostrittrice o
vasodilatatrice); il tono vasomotore, in condizioni di normalità, garantisce un parziale grado di tensione dei vasi
del sistema circolatorio, ed è il risultato della continua attività simpatica, senza il quale si avrebbe una drastica caduta dei livelli pressori. Il sistema nervoso simpatico esplica
la sua funzione attraverso la liberazione di catecolamine: la
noradrenalina (NA), l’adrenalina e la dopamina che sono
47
CARDIOLOGIA & FITNESS
sintetizzate a partire dall’aminoacido tirosina e vengono
immagazzinate nelle terminazioni simpatiche e nella midollare del surrene (tessuto cromaffine) in granuli sub cellulari, per poi essere liberate per esocitosi.
Le catecolamine interagiscono con le cellule effettrici che
possiedono recettori specifici disposti sulla loro superficie. I recettori alfa-adrenergici, interagendo con NA e A
mediano la vasocostrizione, il rilasciamento intestinale e la
pupilla, mentre i recettori beta-adrenergici mediano la
vasodilatazione e la broncodilatazione, la lipolisi e potenziano lo stato inotropo del cuore.
Meccanismi di controllo e regolazione della pressione arteriosa
I meccanismi deputati al controllo dell’omeostasi distinguono a seconda della velocità con cui manifestano la loro
funzione fisiologica.
Meccanismi di controllo ad azione rapida:
- riflesso barocettivo a feedback negativo (inclusi i recettori
di bassa pressione)
- meccanismo chemocettivo
- meccanismo ischemico del SNC
Meccanismi di controllo a medio termine:
- meccanismo vasocostrittore del sistema renina-angiotensina
- processo stress-rilasciamento delle strutture vascolari
- meccanismi di riequilibrio del volume ematico
Meccanismi di controllo a lungo termine:
- meccanismo reni-liquidi corporei (sistema renina-angiotensina-aldosterone)
10 Tale riflesso è
di estrema importanza durante la
variazioni di posture del corpo, ad
esempio quando
l’individuo passa
dal clino all’ortostatismo.
Il riflesso barocettivo10 è determinato dallo stiramento dei
barorecettori del seno carotideo e dell’arco aortico dovuto ad
un aumento della pressione arteriosa; gli impulsi afferenti provenienti dai seni carotidei passano, tramite il nervo di Hering al
nervo glossofaringeo, sino a raggiungere il nucleo del tratto
solitario del tronco encefalico NTS (fig. 11) dove, segnali di
secondo ordine provocano l’inibizione dell’attività simpatica
centrale, con riduzione del centro vasocostrittore ed eccitazione del centro vagale; in sostanza, il riflesso barocettivo rap48
DAVIDE GIROLA
presenta un sistema di regolazione a feedback negativo, dove
aumenti o diminuzioni dei valori pressori determinano rispettivamente l’inibizione o lo stimolo dell’attività neurovegetativa.
In pratica la riduzione della pressione arteriosa, in caso di rapido aumento, tramite l’intervento dei barocettori, avviene in
pochi decine di secondi, per diminuzione sia della gettata cardiaca, sia della resistenza periferica. Il meccanismo chemocettivo è la risultante della stimolazione dei chemocettori che
sono cellule influenzabili da un deficit di ossigeno ed ad un
eccesso di anidride carbonica ed idrogenioni, situate nei corpi
carotidei e nei corpi aortici; dai corpi carotidei e aortici, irrorati
da piccole arterie, le fibre afferenti decorrono lungo i nervi
vaghi e di Hering sino a raggiungere il centro vasomotore;
49
FIG 11
Regolazione
simpatica
della circolazione.
CARDIOLOGIA & FITNESS
FIG 12
Regolazione
della pressione
arteriosa.
11 A livello cerebrale esiste un’altra risposta ischemica del sistema
del sistema nervoso: la reazione di
Cusching, caratterizzazata.
quando la pressione arteriosa
diminuisce al di
sotto di un valore
critico, la riduzione dei livelli di
ossigeno e l’accumulo di anidride
carbonica e idrogenioni stimola i
chemocettori ad
eccitare la risposta simpatica centrale e viceversa. I
riflessi atriali e dell’arteria polmoare sono determinati da
recettori di bassa pressione disposti sulle pareti, sensibili alle
variazioni di volume sanguigno e contribuiscono all’omeostasi
pressoria malgrado variazioni volumetriche di una certa portata. Quando, a livello encefalico, si crea una situazione ischemica, essa provoca una potente e rapida stimolazione e risposta di vasocostrizione simpatica, tale da determinare un
aumento della pressione arteriosa; questo meccanismo definito come “risposta ischemica del sistema nervoso centrale”11
fornisce il suo massimo effetto soltanto quando la pressione
scende a livelli prossimi a quelli letali (15-25mmHg). Il meccanismo reni-liquidi corporei è un meccanismo di controllo della
pressione arteriosa a lungo termine e si basa sulla capacità
dei reni di eliminare il liquido extracellulare in eccesso (diuresi
da pressione) e il cloruro di sodio (natriuresi da pressione);
questo meccanismo viene bene rappresentato dalla figura rappresentante il confronto della curva di eliminazione renale con
la curva dell’assunzione di acqua e sale; il punto di equilibrio
definisce il livello al quale la pressione arteriosa viene regolata; dunque, da questo grafico, si capisce che la regolazione a
lungo termine della pressione primariamente sono (fig. 12):
a il grado di spostamento della curva della funzione renale
(che può modificarsi per una disfunzione dei reni12, senza
che si sia modificata il livello d’assunzione di acqua e sale)
50
DAVIDE GIROLA
b il livello della retta rappresentante l’assunzione di acqua e
sale (in grado di far salire la pressione arteriosa.
Il sistema renina-angiotensina13 vasocostrittore, esplica il suo
ruolo nel controllo della pressione arteriosa essendo soprattutto influenzato dalla volemia che determina il grado di secrezione dell’ enzima renina 14 dell’apparato iuxtaglomerulare del
rene (dove è immagazzinata in una forma inattiva, la (prorenina), la cui funzione globale è correlata all’aldosterone in un
ciclo di feedback negativo. La renina non è una sostanza
vasoattiva ma agisce su una plasmaproteina, il substrato della
renina (angiotensinogeno) in grado di liberare l‘angiotensina I,
la quale, tramite un’enzima convertitore presente nell’endotelio
dei vasi polmonari (Angiotensin Converting Enzyme - “ACE”),
viene trasformata in angiotensina II, un vasocostrittore molto
potente che viene inattivato nel giro di uno o due minuti dagli
enzimi chiamati angiotensinasi. L’angiotensina II innalza i valori
pressori tramite due meccanismi (fig. 13):
• la vasocostrizione delle arteriole e delle vene che aumenta
la resistenza periferica totale e il ritorno venoso aumentando lo stato inotropo cardiaco
• la ritenzione renale di cloruro di sodio e acqua, dovuta sia
all’azione diretta sui reni (vasocostrizione capillari peritubulari), sia attraverso la stimolazione e conseguente secrezione da parte della corteccia surrenale di aldosterone (che
agisce a livello dei tubuli renali): l’effetto produce l’aumento
del volume extracellulare di liquido e una diminuzione dell’eliminazione renale anche di 6 volte del normale.
1. 9
FLUSSO SANGUIGNO LOCALE: FATTORI DI REGOLAZIONE
CONTROLLO ACUTO
TESSUTALI E UMORALI.
E A LUNGO TERMINE DELLA MICROCIRCOLAZIONE
L’importanza fisiologica del controllo del flusso sanguigno
locale (fig. 14) da parte de tessuti è dovuta al fatto che se tutto
dipendesse dal sistema circolatorio, esso dovrebbe possedere
una portata molto più elevata di quanto la pompa cardiaca è in
grado di sopportare; il flusso sanguigno locale è principalmente
51
12 La pressione
arteriosa, in base
alla sua equazione
fondamentale, si
basa dal prodotto
della gettata cardiaca la resistenza
periferica totale; in
realtà l’aumento
della resistenza
periferica totale
non può essere
considerato come
meccanismo
a
lungo termine della
pressione, in quanto viene compensata nel giro di 24
ore. È infatti, l’aumento della resistenza vascolare
renale il fattore
responsabile dell’instaurarsi
dell’“ipertensione”a lungo termine. Inoltre ad un
aumento a lungo
termine della resistenza periferica
totale corrisponde
una diminuzione
della gettata cardiaca e viceversa.
13 Il sistema renina-angiotensina
esercita la sua
massima funzione
dopo 20 minuti
dalla sua attivazione e risulta essere
quindi molto più
lento dei meccanismi dettati dal
sistema simpatico
attraverso le catecolamine.
14 scoperta nel
1940 da Page,
Braun-Menendez
ed Helmer.
CARDIOLOGIA & FITNESS
FIG 13
Schema
del sistema
reninaangiotensina.
Ansiotensinogeno
(fegato)
Liberazione
di renina
RENE
Angiotensina
I
Regolazione
• S. N. Simpatico
• pressione
perfusione renale
• carico di sodio
del tubulo renale
• vasopressina
• K+, Ca++
Impulsi simpatici
15 Il flusso locale,
espresso
in
ml/min/100g di
organo, è molto
elevato nella tiroide
(150ml/min/100g)
e nelle ghiandole
s u r r e n a l i
(300ml/min/100g);
nei muscoli a riposo
risulta
essere
m olt o
b as so
(4ml/min/100g),
quasi come quello
relativo alle ossa ed
alla cute.
16 la vasomozione s i re aliz z a a
livello degli sfinteri
precapillari che si
aprono e si chiudono varie volte al
m inut o, ciclic a mente e in proporzione alle necessità metaboliche
del tessuto.
Angiotensina
II
Ritenzione del
sodio (azione
diretta sul tubulo)
Sete
Secrezione
aldosterone
Vasocostrizione
subordinato dal metabolismo dell’organo e del tessuto a cui ci
si riferisce15. Il flusso sanguigno viene mediato da:
sostanze vasodilatatrici: l’adenosina è la sostanza ritenuta più
importante soprattutto a livello coronarico, ma vengono considerati pure altri prodotti di degradazione dell’adenosintrifosfato, l’istamina, l’anidride carbonica, gli idrogenioni e gli ioni K+.
richiesta di ossigeno a livello tessutale e dunque alle richieste di sostanze nutritizie da parte del tessuto, in grado di
influenzare la vasomozione 16 di una “unità tessutale”, formata da una metarteriola, un capillare singolo ed il circostante tessuto.
Due fenomeni di regolazione metabolica del flusso sanguigno locale sono rappresentati dall’iperemia reattiva (che
avviene allorché il flusso di sangue in un distretto si viene
per qualche motivo interrompere, a cui sussegue, quando la
circolazione ritorna nella norma, un aumento del flusso che
52
DAVIDE GIROLA
p uò
e sse re
anche di 5 volte
s up e riore
a
quello fisiologico, se lo stop
c ircolat orio è
d ura t o ore ) , e
dall’iperemia
attiva, tipica del
muscolo scheletrico in attività, in cui la vasodilatazione è promossa dalle
cellule che hanno esaurito le sostanze nutritive del liquido
interstiziale e liberano così sostanze vasodilatatrici. Il flusso
sanguigno non subisce grandi variazioni, pure se i valori
della pressione arteriosa divengono rilevanti, grazie al fenomeno di autoregolazione del flusso sanguigno determinato,
secondo la fisiologia da due teorie:
la teoria metabolica, dove l’ingente flusso ematico che giunge in periferia, trasporta in loco eccessive quantità di
sostanze nutritive, allontanandone quelle vasodilatatrici
la teoria miogena,17 in cui i meccanismo di autoregolazione
fa sì che non vi sia una marcata vasodilatazione indotta da
aumenti pressori, proprio per un fenomeno di autodifesa
messo in atto dalla muscolatura liscia vasale che si oppone
allo stiramento per proteggere i capillari da aumenti repenti
ed eccessivi di pressione
Vasodilatazione delle arteriole e delle piccole
arterie: il fattore rilasciante endoteliale (EDRF)
L’endotelio, lo strato unicellulare a diretto contatto col sangue,
possiede cellule attive sotto il profilo metabolico; se l’endotelio
è sottoposto a “stress da taglio” determinato dall’aumento del
flusso sanguigno (dilatazione arteriolare secondaria all’aumento di flusso microvascolare), esso libera un fattore di rilasciamento a rapida diffusione e notevole labilità, chiamato
endothelium-derived relating factor (EDRF), tramite il quale
avviene il controllo del lume di arteriole e arterie. La liberazione
dell’EDRF è stimolata anche da sostanze quali L’ATP, l’ADP, la
serotonina, l’acetilcolina, la trombina. Un altro vasodilatatore di
53
FIG 14
Variazione
del flusso ematico
muscolare
in seguito
ad aumento
della pressione
arteriosa.
17 Nei reni il controllo del flusso
sanguigno è costituito dal feedback
tubuloglomerulare,composto da un
meccanismo vasodilatatore a fededback della arteriola
afferente e a un
meccanismo vasocostrittore a feedback della arteriola
efferente: in pratica, la composizione del liquido contenuto del primo
tratto del tubulo
distale
manda
segnali all’apparato
iuxtaglomerulare, in
rapporto con l’arteriola afferente.
CARDIOLOGIA & FITNESS
18 La prostaciclina
PGI2 è una delle
prostaglandine derivanti dal metabolismo dell’acido arachidonico; vennero
chiamate così perché si pensava che
fossero secrete
dalla prostata dopo
che furono identificate nel liquido
seminale. La proprietà vasodilatatrice della PGI2 è
accompagnata da
quella di un’altra
prostaglandina, la
PGE2, i cui effetti
dilatatori avvengono
a patto che si mantenga invariata la
pressione arteriosa:
in caso di ipotensione sistemica, la loro
funzione vasodilatatrice viene soppressa da quella vasocostrittrice indotta
dalle catecolamine.
19 L’angiogenesi
verrà ritrattata nel
capitolo 2° riguardante gli adattamenti indotti dal
training aerobico.
20 Gli stimoli
angiogenici determinano l’elongazione e la proliferazione delle cellule
endoteliali tramite
dei fattori di crescita endoteliale e da
fattori mitogeni
angiogenici costituiti da peptidi che
formano legami
con l’eparina.
origine endoteliale è la prostaciclina PGI218 che, interagendo
con l’EDRF, inibisce l’aggregazione piastrinica. In caso di compromissione dell’endotelio determinato da alcune patologie
(aterosclerosi, ipertensione, ischemia, iperlipidemia e traumi
meccanici), la sintesi di EDRF può risultare inibita. L’endotelio
produce pure due sostanze vasocostrittrici, un peptide formato
da 21 aminoacidi, l’endotelina (EDCF1) e l’EDCF2 al quale
sembra corrispondere la vasocostrizione indotta dall’ipossia.
1. 10 CONTROLLO DELLA VASCOLARIZZAZIONE A LUNGO
TERMINE: IL RUOLO DELL’OSSIGENO E L’ANGIOGENESI19
Il ruolo dell’ossigeno nella regolazione a lungo termine
della vascolarizzazione è evidente se si considera l’aumentata
vascolarizzazione dei tessuti riscontrabile in animali e soggetti
che vivono in luoghi ad elevata altitudine, dove la quota di ossigeno atmosferico è ridotta. Per contro un eccesso di ossigeno
blocca la neoformazione vascolare (riscontrata nei neonati
umani prematuri sottoposti a terapia con tende ad ossigeno): a
tale ipossia fa seguito una repente crescita vascolare.
L’endotelio ha la proprietà di secernere dei fattori di crescita20
che determinano la formazione di nuovi vasi sanguigni (angiogenesi); il fenomeno è rilevabile nei tessuti ischemici, nei tessuti ad elevato metabolismo e nei tessuti che stanno rapidamente evolvendo. L’angiogenesi a livello cardiaco con neoformazione di circoli collaterali diviene un fattore protettivo e terapeutico nei confronti della malattia coronarica. Gli ormoni steroidei provocano effetti opposti a quelli dei fattori angiogenetici, in grado di dissolvere le cellule vascolari e far scomparire
vasi sanguigni.
1. 11 COMPLIANCE
VASCOLARE
La compliance (o capacitanza) vascolare indica la quantità totale
di sangue che un determinato settore del circolo può contenere in
relazione ad ogni aumento pressorio di 1 mmHg. La compliance delle
vene è di circa 24 volte quella della arterie ed è data dal rapporto tra
54
DAVIDE GIROLA
l’aumento del volume e l’aumento di pressione in un dato segmento
vascolare. La compliance non va confusa con la “distensibilità”21,
che comunque risulta essere sempre più elevata nelle vene rispetto
alle arterie. La compliance ritardata, corrisponde al fenomeno di
“stress-rilasciamento” vascolare, che si verifica quando in un segmento vascolare la pressione aumenta grazie ad un aumento del
volume ematico ma va progressivamente a tornare ai valori normali
grazie all’adattamento delle pareti muscolari lisce dei vasi; con questa capacità il letto circolatorio può rispondere efficacemente a notevoli cambiamenti di volume sanguigno. Possedendo questa grande
capacità adattiva e capacitanza, la sezione venosa della circolazione
sistemica funge da “serbatoio” di sangue (il sistema venoso contiene circa il 60% di sangue dell’intero apparato circolatorio), grazie al
quale anche una importante emorragia può venire compensata, tramite la venocostrizione indotta dal sistema simpatico.
1. 12 PRESSIONE
VENOSA CENTRALE, PERIFERICA
E PRESSIONE IDROSTATICA.
La pressione venosa centrale è quella determinata dal ritorno venoso e, come è stato precedentemente descritto, dagli
stessi fattori influenzanti la gettata cardiaca. Essa è rilevabile nell’atrio destro e corrisponde più o meno al valore della pressione
atmosferica (0 mmHg) ma può elevarsi anche fino a 30mmHg nel
corso di alcune patologie come lo scompenso cronico di cuore
grave o in altre situazioni come un elevato aumento di volume di
sangue o ad un aumento delle pressioni venose periferiche; in
certi punti del corpo (tratto ascellare, endoaddominale e a livello
del tratto finale del braccio a livello della prima costa dove passa
la vena succlavia), per ragioni anatomiche, alcune vene di grosso
calibro determinano una certa resistenza al flusso, solitamente
più alta di 3-7mmHg rispetto alla pressione venosa centrale. La
pressione idrostatica22 determina notevoli differenze di pressione venosa nei vari punti del corpo così che, per esempio, a livello
dell’atrio destro, in condizioni di normalità, essa è uguale a zero
(grazie alla legge di Frank-Starling che evita ogni accumulo ed
eccesso di sangue nell’atrio) mentre in ortostasi, a livello dei piedi
la pressione venosa è di circa 90 mmHg. La pressione idrostatica
55
21 Distensibilità
vascolare: aumento di volume diviso
l’aumento di pressione moltiplicato
per il volume originario del vaso.
22 In una massa
di acqua, alla
superficie, la pressione sul liquido è
pari a zero ma, per
ogni 13,6mm di
profondità il peso
dell’acqua stessa
ne determina un
innalzamento pari
ad1 mmHg: questa
pressione è definita pressione idrostatica.
CARDIOLOGIA & FITNESS
determina variazioni di pressione anche nel sistema arterioso
(una pressione arteriosa di 90/100mmHg a livello cardiaco, a
livello dei piedi corrisponde a circa 180/190mmHg); quindi se si
afferma che in un soggetto i valori pressori sono di 100mmHg
circa è come se ci si riferisse alla “pressione al livello idrostatico
del cuore”23.
1. 13 LA
PRESSIONE ARTERIOSA: METODI DI VALUTAZIONE,
POLSI DI PRESSIONE, TONI CARDIACI
23 A livello della
valvola tricuspide
(grazie ai meccanismi di autoregolazione intrinseca
della pompa cardiaca descritti nei
primi paragrafi) vi è
un punto in cui le
misurazioni della
pressione sono
scevre da ogni
possibile influenza
data dalle varie
posture del corpo
e dalla pressione
idrostatica: tale
punto viene perciò
definito come il
livello zero di riferimento della press i o n e
(Milnor,WR.:Hemod
y n a m i c s .
Baltimore,Williams
& Willkins,1989).
Sono trascorsi poco più di cent’anni dalla presentazione dello
sfigmomanometro (sphygmòs=polso, métron=misura) del dottor
Scipione Riva-Rocci sulla Gazzetta Medica di Torino (1896), tuttavia il suo metodo è ancora largamente diffuso per la valutazione
dei valori pressori. Nel 1905 Korotkoff descrive i suoni prodotti
nelle arterie con il variare della pressione determinano così non
soltanto la pressione sistolica ma anche quella diastolica. La corretta valutazione della pressione arteriosa è di straordinaria importanza, in quanto l’ipertensione è riconosciuta come principale fattore di rischio per le malattie cardiovascolari e come causa accertata per morte improvvisa. La classificazione dell’Organizzazione
Mondiale della Sanità stabilisce che la pressione arteriosa è da
considerarsi normale al di sotto dei valori 140/90mmHg. La definizione di “Ipertensione essenziale” (essentielle Hypertonie) risale
al 1911 ad opera di Frank, termine con il quale indicava tutte le
tipologie di ipertensione, mentre oggi, per essenziale si indicano le
ipertensioni di cui non si conoscono le cause. Nel 1954 Pickering
pone una prima linea divisoria tra i valori di normotensione ed ipertensione. Attualmente l’ipertensione borderline è compresa tra
valori di 140/90 e 160/95, mentre viene definita ipertensione la
pressione diastolica che supera i 95mmHg. Secondo l’American
National Committee on Detection, Evalutation and Treatment
ofHigh Blood Pressure i pazienti si distinguono i tre categorie a
seconda dei valori pressori diastolici
• ipertensione Lieve (PAD compresa tra 90 e 104 mmHg)
• ipertensione Moderata (PAD compresa tra 105 e 114mmHg)
• ipertensione Grave (PAD maggiore di 115 mmHg)
La pressione arteriosa dipende da numerose variabili quali, ad
56
DAVIDE GIROLA
esempio, l’età, dal peso, dall’iperventilazione (alcalosi respiratoria)
l’assunzione di sodio con la dieta, l’assunzione di integratori di
magnesio, potassio e calcio, il grado di consumo di alcol, la postura e modificazioni sotto il diretto controllo del sistema nervoso
simpatico, come quelle “fasiche” dovute agli stati psicologici e
situazioni di stress psicofisico od emotivo, dal ritmo sonno-veglia
(modificazioni “toniche”), dalla temperatura esterna e, ovviamente
dalla presenza di determinate patologie dell’apparato cardiovascolare e/o di altri apparati e organi ed in presenza o meno di terapia
farmacologica. La PA durante l’esercizio subisce degli “aggiustamenti” a seconda della situazione (fase della gara) e,ovviamente
dal tipo di disciplina (“lavoro di pressione” negli sports di potenza
con elevati valori pressori e “lavoro di volume” negli sports di
endurance con valori di PA prossimi alla norma)
Valutazione della Pressione Arteriosa
Come è intuibile, la valutazione della Pressione Arteriosa
non è sempre di facile attuazione e, anche se è un problema
riguardante la clinica, l’importanza della sua determinazione
è fondamentale, soprattutto se si desidera valutare la qualità
del training ed ottenere una valutazione precipua e globale
nei soggetti cardiopatici o ad elevato rischio cardiovascolare. Inoltre, come si vedrà più avanti, in questi soggetti, sono
numerosi i casi “di ischemia silente da sforzo” e un attenta
valutazione o monitoraggio della PA è praticamente d’obbligo soprattutto nei pazienti “borderline” o in fase di terapia
antipertensiva. Il metodo di Riva-Rocci impone una serie di
FIG 15
CLASSIFICAZIONE DELLA PRESSIONE ARTERIOSA
Range (mmHg)
Categoria
Diastolica
<85
Pressione normale
85-89
Pressione normale alta
90-104
Ipertensione Lieve
105-114
Ipertensione Moderata
115
Ipertensone Grave
Sistolica (quando la PAD è 90 mmHg)
<140
Pressione normale
140-159
Ipertensione sistolica isolata borderline
160
Ipertensione sistolica isolata
≥
≥
57
CARDIOLOGIA & FITNESS
FATTORI INFLUENZANTI I VALORI DI PRESSIONE ARTERIOSA
Fattori tecnico-metodologici
Fattori biologici (soggetto)
(osservatore)
Tipo e manutenzione della strumentazione
Età
Tecnica di misurazione
Temperatura ambiente esterno
Dimensioni del manicotto
S. N. S (status psicofisico, emozionale,
Criteri di valutazione
ritmo sonno-veglia)
Postura
Patologie cardiovascolari e/o di altri
apparati ed organi (grado di iperensione
e presenza di terapia antipertensiva)
Overtraining ed Overeaching
Tipo di sforzo effettuato
Distanza temporale dal fumo, dal pasto,
dall’attività fisica
Abitudine alla misurazione
Assunzione di sodio, alcol e integratori
di Potassio, Magnesio e Calcio
FIG 16
accorgimenti e considerazioni che possono essere di tipo
tecnico-metodologico, tanto che i valori pressori possono
rivelarsi diversi anche di misurazione in misurazione sul
medesimo soggetto e nello stesso momento; inoltre, molti
soggetti possono risultare apparentemente ipertesi ma si
tratta soltanto di un condizionamento psicologico scatenante
reazioni neurovegetative adrenergiche in grado di aumentare
la PA (“ipertensione da ambulatorio” o “da camice bianco”).
La British Hypertension Society impone una serie di raccomandazione per una corretta tecnica di valutazione tramite
sfigmomanometro.
1 Il soggetto deve essere rilassato con il braccio appoggiato;
i vestiti non devono stringere l’arto; il soggetto deve essere
seduto da almeno 5 minuti, l’ambiente circostante deve
essere tranquillo.
2 Il manicotto gonfiabile deve essere a livello del cuore (margine inferiore del manicotto di 2-3 cm al di sopra spazio
antecubitale del braccio: la lunghezza e la larghezza del
manicotto è di estrema importanza e deve essere rapportata alla circonferenza del braccio; un manicotto troppo stretto comporta una sovrastima della PA (considerazionei
importanza nei soggetti con braccia ipertrofiche o grasse).
3 Il diaframma dello stetoscopio deve essere sull’arteria brachiale
58
DAVIDE GIROLA
4 La colonnina di mercurio deve essere in posizione verticale.
5 Bisogna gonfiare tramite il bulbo collegato al manicotto fino
a che il polso scompare (scomparsa del polso radiale).
6 Ridurre la pressione (sgonfiare) di 2-3 mmHg/sec.
7 Misurare la PA Sistolica (primo suono, 1° tono di Korotkoff)
e la diastolica (scomparsa, 5° tono di Korotkoff) il più vicino
ai 2mmHg.
8 Nei bambini e durante lo sforzo fisico, la diastolica deve
essere valutata al il 4° tono di Korotkoff (fase di smorzamento).
9 La prima misurazione va effettuate su entrambe le braccia e
va effettuata anche in ortostaismo.
10 Le seconde misurazioni vanno effettuate a distanza di 2
minuti circa.
Polsi di pressione
Fin dall’antichità la palpazione dei polsi arteriosi, parte integrante
dell’esame obiettivo dell’intero sistema cardiovascolare, ha rappresentato un valido sistema di valutazione per stabilire l’adeguatezza del flusso sistemico e addirittura per evidenziare la presenza
di alcune patologie, come quelle di tipo ostruttivo o valvolare. Un
caratteristico tracciato dei polsi di pressione è rapresentato da
quello del primo tratto dell’aorta: la differenza tra le due pressioni
vigenti in questo tratto (sistolica-diastolica=120-80=40mmHg),
indica la pressione del polso, che risulta essere influenzata dalla
gettata sistolica e dalla complianza (distensibilità) dell’albero arterioso. Il tracciato del polso di pressione (sfigmogramma) rivela
che l’onda normale del polso aortico centrale è costituita da un
fase di ascesa rapida (effluso rapido), un picco di forma arrotondata (efflusso lento), una fase ascendente comprendente un’incisura (incisura anacrota corrispondente al massimo flusso aortico), una branca discendente meno rapida interrotta dall’incisura
dicrota (chiusura della valvola aortica); alterazioni di tale sfigmogramma indicano la presenza di patologie cardiovascolari come
l’aterosclerosi, la pervietà del dotto arterioso o l’insufficienza aortica. Il polso (radiale) può essere debole (pulsus parvus) in caso
di riduzione della gettata sistolica del ventricolo sinistro (iperattività del sistema simpatico per emorragie o freddo intenso); può
essere ipocinetico (ipovolemia, insufficienza ventricolare sinistra
59
CARDIOLOGIA & FITNESS
dopo infarto miocardico), ipercinetico (ipercinesa circolatoria da
ansia, anemia, esercizio fisico, diminuzione delle resistenze
vascolari periferiche); il polso paradosso presenta invece oscillazioni di forza, caratterizzato dall’accentuazione della fisiologica
riduzione dell’ampiezza del polso durante l’inspirazione, dato che
in questa fase la gettata sistolica diminuisce (accumulo di sangue
nei polmoni durante l’inspirazione per aumento del diametro dei
vasi con l’aumentata negatività intratoriacica): talvolta il polso
paradosso é rilevabile nel tamponamento cardiaco (versamento
di liquido nelsacco pericardico), dove la diminuzione della pressione sistolica durate l’inspirazione supera il valore fisiologico di
10mmHg. Altri tipi di polsi arteriosi (bifido, dicroto, alternante o
mancante) indicano extrasistoli, mioardiopatie dilatative, ipertrofiche, extrasistoli e fibrillazioni atriali.
Toni cardiaci
I toni cardiaci sono determinati dalla repenti e brusche accelerazioni e decelerazioni del sangue all’interno del sistema cardiovascolare; in particolare, sono costituiti dalle vibrazioni delle valvole
(atrio-ventricolari e semilunari) in tensione appena dopo la loro
chiusura e dalla vibrazione del sangue che vibra intorno ad esse,
delle pareti del cuore e dei vasi vicini. Tali vibrazioni si propagano
alla cassa toracica e vengono auscultate tramite lo stetoscopio;
1° tono cardiaco (T1): dura circa 0,14 secondi e dipende dalla
chiusura delle valvole atrio-ventricolari (A-V); la contrazione
dei ventricoli provoca un reflusso di sangue verso le valvole
che le fa proitettare (sollevamento a cupola) verso gli atri fino
a che non vengono trattenute bruscamente dalle corde tendinee; a questo punto la tensione elastica prodotto provoca un
“controritorno” del sangue verso i corrispondenti ventricoli;
2° tono cardiaco (T2): dura circa 0,11 secondi (maggior tensione delle valvole semilunari) si origina dalla chiusura delle
valvole semilunari, mentre la “camera vibrante” è costituita
principalmente dalle arterie aorta e polmonare che possideno un coefficiente di elasticità maggiore rispetto a quello
dei ventricolo (suono più rapido e schioccante, con frequenza più alta rispetto al primo tono); durante l’inspirazione il
secondo tono cardiaco si sdoppia in due componenti, aortica (A2) e polmonare (P2), allorché il maggior ritorno venoso
60
DAVIDE GIROLA
aumenta il volume ventricolare destro ed il corrispondente
periodo di eiezione (ritardo chiusura della valvola polmonare);
3° tono cardiaco (T3): è un suono prodotto nel ventricolo all’inizio del terzo medio della diastole (termine riempimento
rapido) circa 0,14-0,16 secondi dopo A2; è apprezzabile nei
bambini e in soggetti portatori di determinate patologie
come lo scompenso cardiaco;
4°tono cardiaco (T4): è associato ad una contrazione atriale
efficace ed è un rumore presistolico; è frequente quando è
presente una diminuita elasticità ventricolare che aumenta
la resistenza al riempimento, come nei casi di ipertensione
sistemica miocardiopatia ipertrofica, insufficienza mitralica e
infarto miocardico acuto.
I toni T3 e T4 sinistri sono particolarmente accentuati durante l’esercizio fisico specie se sono associati a cardiopatia ischemica
61
CARDIOLOGIA & FITNESS
Bibliografia
1. Guide de Cardiologie du sport. F. Plas.
les Editions J. B. Baillière Paris 1976
2. Trattato di Fisiologia Medica. AC Guyton. Piccin Ed. 1991
3. Principles of Internal Medicine. Harrison 14th edition 1998.
McGraw Hill ed
4. Muscolo e Locomozione GA Cavagna. Cortina ed 1988
5. Treatment of Heart Disease. TJ Willerson Gower Med Publ 1996
6. Cardiologia dello Sport. P. Zeppilli C. E. S. I. 1990
7. Muscolo e locomozione. Cavagna, Cortina Ed 1988
62