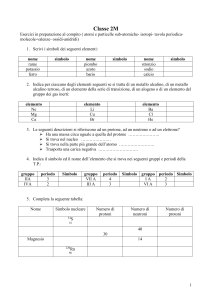
CHIMICA 1:
Chimica Generale e Inorganica
Laurea Triennale
Biotecnologie
Leggi fondamentali
Dr. Laura Orian
Dipartimento di Scienze chimiche
Università degli Studi di Padova
Via Marzolo 1 35129 Padova
Tel. 0498275140
E-mail [email protected]
Legge di conservazione della massa (legge di Lavoisier)
La massa totale delle sostanze presenti al termine di una
reazione chimica è la stessa della massa totale delle sostanze
presenti prima della reazione stessa.
Nulla si crea, nulla si distrugge….
Legge della composizione costante (legge di Proust)
Tutti i campioni di un composto hanno la stessa composizione,
cioè le stesse proporzioni in peso degli elementi costituenti.
Legge delle proporzioni multiple (Dalton)
Se due elementi formano più di un singolo composto, le
masse di un elemento combinate con una massa fissa del
secondo stanno fra loro come numeri interi piccoli.
CONCETTI CHIAVE DI ELETTRICITA’ E MAGNETISMO
Come si comportano le particelle cariche in un campo elettrico e in un campo magnetico?
Alla scoperta della struttura dell’atomo…
Thomson (1897)
Dispositivo
utilizzato da
Thomson
per studiare le
proprietà
dell’elettrone
(m/e).
Millikan
Determinazione della carica dell’elettrone
e= -1.602 x 10-19 C
Ma gli atomi sono neutri……
Dove si trova la carica positiva?
Thomson, ovvero il modello ‘pane all’uvetta’….
CONCETTI CHIAVE DI RADIOATTIVITA’
I tubi a raggi catodici fanno fluorescere alcuni materiali esterni ai tubi stessi perché emettono raggi
di natura sconosciuta (Roentgen: scoperta dei raggi X)
Un materiale fluorescente contenente uranio è in grado di impressionare una lastra fotografica anche al buio
(Becquerel: scoperta della radioattività).
I materiali radioattivi emettono raggi (nuclei di elio con doppia carica positiva), raggi (particelle con carica negativa
Con le stesse proprietà degli elettroni) e raggi (radiazioni elettromagnetiche molto penetranti).
Rutherford, ovvero l’atomo è….vuoto!
Rutherford stesso identificò le
Particelle positive presenti nell’atomo
Come protoni e previde anche
L’esistenza di particelle nucleari neutre
(neutroni)
Il numero di protoni presenti in un atomo è detto numero atomico o Z ed è uguale,
in un atomo neutro, al numero di elettroni.
Il numero totale di neutroni e protoni in un atomo è detto numero di massa o A.
L’unità di massa atomica amu (u) è definita come 1/12 della massa del carbonio-12.
Tutti gli atomi di un elemento hanno Z uguale. Ogni atomo ha un suo simbolo atomico. I numeri Z e A si indicano
a pedice e ad apice e precedono il simbolo atomico.
Atomi con uguale Z ma diverso A si chiamano isotopi.
Un atomo che ha perso o acquistato un elettrone è detto ione; il numero dei protoni resta costante.
Gli atomi sono organizzati nella tavola periodica degli elementi. Righe e colonne si chiamano rispettivamente
periodi e gruppi.
Gas nobili
Metalli alcalini
Alogeni
Metalli alcalinoterrosi
Metalli di transizione
Le proprietà periodiche…..
…. e moltissime altre!
Tavola periodica e carattere metallico degli elementi
LA TAVOLA PERIODICA è UTILIZZATA PER ORGANIZZARE E
CORRELARE LE PROPRIETÀ DEGLI ELEMENTI
I METALLI PRESENTANO LUCENTEZZA E CONDUCIBILITÀ
TERMICA E ELETTRICA
►
Possiamo facilmente riconoscere un metallo per la sua caratteristica
lucentezza.
Sappiamo anche che i metalli sono buoni conduttori di elettricità.
Inoltre, i metalli conducono molto bene anche il calore.
Altre proprietà dei metalli sono la malleabilità, ovvero la capacità di
essere lavorati sotto forma di lamine sottili , e la duttilità, ovvero la
proprietà di essere ridotti in fili.
Un’altra importante caratteristica dei metalli è la durezza.
A temperatura ambiente, tutti gli elementi metallici, fatta eccezione per
il mercurio, sono solidi. La loro reattività chimica è molto variabile.
LA TAVOLA PERIODICA è UTILIZZATA PER ORGANIZZARE E
CORRELARE LE PROPRIETÀ DEGLI ELEMENTI
I NON METALLI SONO ISOLANTI E SI PRESENTANO NEI TRE
STATI FISICI
►
Un elemento che mostra proprietà non-metalliche è definito non-metallo.
A temperatura e pressione ambiente, numerosi non-metalli sono solidi
mentre molti altri sono gas; solo il bromo è liquido.
Le proprietà dei non-metalli solidi sono quasi completamente opposte
a quelle dei metalli: non hanno l’aspetto caratteristico di un metallo,
sono cattivi conduttori del calore e, con l’eccezione della grafite, di
elettricità, i non-metalli non sono duttili né malleabili.
Anche i non-metalli mostrano una reattività chimica variabile.
LA TAVOLA PERIODICA è UTILIZZATA PER ORGANIZZARE E
CORRELARE LE PROPRIETÀ DEGLI ELEMENTI
I METALLOIDI PRESENTANO INTERESSANTI PROPRIETÀ
INTERMEDIE
►
Le proprietà dei metalloidi sono intermedie tra quelle dei metalli e dei
non-metalli. La conducibilità elettrica dei metalloidi è simile a quella dei
metalli. I metalloidi sono semiconduttori: conducono l’elettricità ma
non in modo così efficace come i metalli. In particolare, i semiconduttori
sono isolanti a basse temperature, mentre diventano buoni conduttori
ad alte temperature. Per aumentare le caratteristiche dei
semiconduttori, essi vengono sottoposti a «drogaggio», ossia addizionati
di elementi diversi (B, P, As, Sb) che ne esaltano la buona conducibilità
ad alte temperature.
La mole e il numero di Avogadro
E’ necessario stabilire una correlazione tra la massa misurata di un elemento e un certo numero di atomi noto
(anche se non numerabile). La grandezza in SI che descrive una quantità di sostanza correlandola ad un numero
di particelle è detta mole (mol).
Una mole è la quantità di sostanza che che contiene lo stesso numero di specie elementari come ad esempio
di atomi di carbonio-12 contenuti in 12 g esatti di carbonio-12.
La costante (o numero) di Avogadro dà il numero di specie contate in una mole: 6.02214179 x 1023.
La maggior parte degli elementi sono composti da miscele di due o più isotopi; pertanto gli atomi che formano
Una mole non hanno tutti la stessa massa, ma occorre tener presente le proporzioni con cui sono presenti in natura
(abbondanze isotopiche naturali). Per gli elementi il valore numerico della massa in grammi di una mole di atomi e la
massa atomica media pesata in unità di massa atomica sono uguali.
Ecco perché la massa atomica del carbonio non è 12, ma 12.011: in natura è presente anche l’isotopo carbonio-13
(abbondanza 1.11%)!
Suggerimento:
Mi alleno con il calcolo di moli e massa.
IL CARBONIO-12 È L'ISOTOPO DI RIFERIMENTO PER LE
MASSEATOMICHE RELATIVE
►PER CALCOLARE LA MASSA ATOMICA DI UN ELEMENTO
OCCORRE RIFERIRSI A UN ATOMO MEDIO
I chimici hanno generalmente a che fare con miscele di isotopi di un
certo elemento provenienti da fonti naturali; poiché la composizione
delle miscele isotopiche è praticamente costante, indipendentemente
dalla fonte, possiamo parlare di atomo medio di un elemento,
facendo riferimento alla massa media della miscela isotopica
naturale.
Per esempio, l’idrogeno naturale è una miscela di due isotopi
L’«atomo medio» dell’elemento idrogeno, secondo la sua
distribuzione in natura, possiede una massa che è 0,083 992 volte
quella dell’atomo di C. Poiché 0,083 992 x 12,000 u = 1,0079 u, la
massa atomica media dell’idrogeno è 1,0079 u.
12
IL CARBONIO-12 È L'ISOTOPO DI RIFERIMENTO PER LE
MASSEATOMICHE RELATIVE
►PER CALCOLARE LA MASSA ATOMICA DI UN ELEMENTO
OCCORRE RIFERIRSI A UN ATOMO MEDIO
Osserviamo che questo valore medio è appena più grande della
massa atomica di 1H perché l’idrogeno in natura contiene anche una
piccola frazione di 2H. In generale, il numero di massa di un isotopo
è leggermente diverso dalla sua massa, perché il primo è sempre un
numero intero, mentre la massa atomica relativa è calcolata in
rapporto a u.
Generalizzando, si trova la seguente espressione per il calcolo delle
masse atomiche medie basate sulle abbondanze relative di ciascun
isotopo: