Atomo: modello microscopico
1
Modello atomico di Dalton (1808)
• Materia è composta di atomi indivisibili e
indistruttibili
• Atomi uguali hanno identica massa e identiche
proprietà chimiche
• Gli atomi non possono essere convertiti gli uni negli
altri
• Nei composti, gli atomi di un elemento si combinano
solo con numeri interi di atomi di un altro elemento
• Gli atomi non si creano né si distruggono, ma si
trasferiscono interi da un composto all’altro
2
Cosa spiegava?
• Legge di conservazione della massa
• Legge delle proporzioni definite
• Legge delle proporzioni multiple (Dalton)
Cosa non spiegava?
Cosa spinge gli atomi a ricombinarsi in modo diverso
durante le reazioni chimiche?
3
4
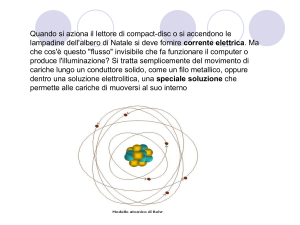
Elettricità: interazioni tra cariche
Un corpo è elettricamente carico se manifesta la
proprietà di attirare altri corpi di piccole dimensioni
quando viene sottoposto a strofinio.
Esistono due tipi di carica elettrica che, per
convenzione, vengono denominati negativa (-) e
positiva (+).
Un corpo è elettricamente neutro quando possiede il
medesimo numero di cariche positive e di cariche
negative: normalmente la materia è elettricamente
neutra (il che non significa, per quanto definito
sopra, che sia priva di carica).
5
Legge di Coulomb (1785)
Si applica a oggetti elettricamente carichi.
‘Cariche di segno uguale si respingono e cariche di
segno opposto si attraggono (Legge di Coulomb)’
6
Legge di Coulomb
Due cariche elettriche si respingono (se uguali) o si
attraggono (se opposte) con una forza direttamente
proporzionale al prodotto delle due cariche (Q1, Q2) e
inversamente proporzionale al quadrato della distanza
che le separa (d). La forza dipende anche dal mezzo (k)
in cui si trovano le cariche: è massima nel vuoto.
7
Evoluzione del modello atomico:
particelle subatomiche
• Elettrone (Thomson 1897): particella unitaria di
carica elettrica negativa.
• Protone (Rutherford 1914): particella unitaria di
carica elettrica positiva.
• Neutrone (Chadwick 1932): particella unitaria priva
di carica elettrica.
8
Particelle subatomiche
Particella
Simbolo Carica
Massa
subatomica
convenzionale (g)
Massa
(u)
Elettrone
0 e
-1
1 (-), negativa 9.1 ∙ 10-28
Protone
1 p
1
1 (+), positiva
1.67 ∙ 10-24 1.0072
Neutrone
1 n
0
0, neutra
1.67 ∙ 10-24 1.0086
0.0054
9
Elettrone
Una serie di esperimenti, utilizzando i tubi di Crookes
permise a Thomson di ipotizzare l’esistenza
dell’elettrone.
E’ una particella fondamentale in chimica:
• E’ responsabile della formazione dei legami chimici.
• E’ responsabile della conduzione di corrente elettrica
e di calore.
• Ha carica elettrica negativa:
e = −1,602 176 53(14) ∙ 10−19 C
• Ha carica elettrica convenzionale e = -1
10
Tubo di Crookes
Tubo di Crookes
11
Paddle wheel
Esistenza elettroni: tubo di Crookes
Maltese cross experiment
12
Osservazioni sperimentali
• L’emissione di raggi catodici è una proprietà della
materia: non dipende dal tipo di catodo o di gas
rarefatto.
• Raggi catodici hanno natura corpuscolare.
• Si propagano in linea retta.
• Hanno carica elettrica negativa: sono infatti deviati
da campi elettrici e magnetici.
13
Protone
La materia, in generale, non è carica.
Se ammettiamo che gli atomi contengano elettroni,
necessariamente, occorre ammettere che essi
contengano anche particelle cariche positivamente,
in numero uguale agli elettroni.
L’esistenza dei protoni fu dimostrata dagli esperimenti
sui raggi anodici effettuati inizialmente da Goldstein.
14
Protone (Rutherford 1914)
• E’ la più piccola particella stabile,
positivamente, presente in tutti gli atomi
carica
• Il numero di protoni in un nucleo conferisce le
proprietà chimiche all’atomo
• Ha carica elettrica positiva:
p = 1,602 176 53(14) ∙ 10−19 C
• Ha carica elettrica convenzionale p = +1
15
Raggi anodici (Goldstein 1886)
16
Osservazioni sperimentali
• Dipendono dal gas di riempimento.
• La loro natura è corpuscolare.
• Hanno carica che è sempre un multiplo intero della
carica dell’elettrone.
• Carica e massa di tali particelle è minima quando il
gas di riempimento è l’idrogeno.
• La massa della particella minima è molto maggiore di
quella dell’elettrone (mp = 1836 ∙ me) .
• Rutherford assegnò il nome ‘protone’ alla particella
H+ .
17
Esercizio
• Sapendo che :
• Un atomo di idrogeno è formato da 1 protone e 1
elettrone
• Un atomo di carbonio è formato da 6 protoni 6
neutroni e 6 elettroni
• Un atomo di cloro è formato da 17 protoni 18
neutroni e 17 elettroni
Calcola la massa atomica relativa e confrontala col
valore riportato per quell’atomo sulla tavola
periodica. Come lo spieghi?
18
Neutrone (Chadwick 1932)
• Particella ipotizzata già da Rutherford per spiegare la
discrepanza tra la somma delle masse di tutti i
protoni e gli elettroni di un atomo e la sua massa
atomica. Inoltre cominciava ad essere nota l’esistenza
degli isotopi.
• Neutroni sono presenti in tutti gli atomi, tranne che
nel 1H
• Sono particelle molto penetranti, proprio perché
prive di carica
19
Da Dalton a Thomson
Secondo il modello di Thomson (1907) gli elettroni,
carichi negativamente, sono uniformemente
distribuiti in una sfera di uguale carica positiva
(‘plum - pudding’)
20
Esperimento indipendente (1911)
Ipotesi di Rutherford: se il modello
di Thomson fosse vero, le
particelle non dovrebbero subire
deviazioni apprezzabili. Invece …
Esperimento di Rutherford
22
Da Thomson a Rutherford
• Atomo è una sfera al cui centro è situato il nucleo,
carico positivamente
• Gli elettroni si muovono intorno al nucleo, su orbite
circolari, occupando un volume molto maggiore di
quello occupato dal nucleo
23
Modello planetario
• Il nucleo è formato da protoni e neutroni.
• Nel nucleo risiede la maggior parte della massa
atomica (infatti gli elettroni hanno massa trascurabile
rispetto a protoni e neutroni).
• Gli elettroni orbitano intorno al nucleo.
• Il numero di elettroni e di protoni in un atomo è
uguale (elettroneutralità).
• La maggior parte del volume atomico è costituito da
spazio vuoto.
24
Identità chimica degli atomi
• E’ determinata dal numero di protoni contenuti nel
nucleo: nelle trasformazioni chimiche i nuclei
rimangono inalterati.
• Il numero atomico indica il numero di protoni di un
determinato elemento ed è indicato con Z.
• La somma del numero di neutroni (N) e del numero di
protoni (Z) presenti in un atomo prende il nome di
numero di massa (A): A = Z + N.
A U
Z
25
Isotopi
• Può accadere che gli atomi di un elemento abbiano
numero di massa (A) diverso (pur mantenendo lo
stesso numero atomico, Z): si definiscono isotopi.
• Isotopi: sono nuclidi aventi lo stesso numero di
protoni (quindi sono chimicamente indistinguibili),
ma diverso numero di neutroni, quindi diverso
numero di massa (A)
• Alcuni isotopi sono naturalmente radioattivi: il
nucleo è instabile e decade.
26
Composizione isotopica
Gli atomi di un elemento sono presenti in natura con
una abbondanza isotopica relativa costante.
La massa atomica di un elemento è la media ponderata
delle masse degli atomi che costituiscono
quell’elemento.
28
Decadimenti nucleari
Decadimento spontaneo : tempo di dimezzamento di
5730 anni
14 C
0 e + 14 N + hν (energia)
→
6
-1
7
Sintesi: avviene continuamente
14 N + 1 n
14 C + 1 H
→
7
0
6
1
E’ utilizzata nella datazione dei reperti di natura
organica.
30