INTRODUZIONE ALLA TAVOLA PERIODICA
Tra l’ottocento e il novecento i chimici avevano accumulato una grande quantità di dati sperimentali e avevano
potuto osservare come molti elementi manifestassero caratteristiche e comportamenti assai simili, al punto da far
nascere l’idea di raggrupparli in “famiglie” omogenee. Nel 1869 il chimico russo Dmitrij Ivanovic Mendeleev
prima
formulazione
autografa della
TP di
Mendeleev
Mendeleev
in una foto
del 1897
pubblicò la sua tavola periodica (ci avevano provato anche il tedesco Döbereiner e il londinese Newlands),
disponendo gli elementi nella loro valenza massima e in ordine di massa atomica crescente. Il peso atomico veniva
scelto come grandezza ordinatrice e messa in relazione con le proprietà chimiche degli elementi, sinteticamente
espresse dalla loro valenza. Si individuavano in tal modo righe di elementi con massa atomica crescente e colonne
di elementi con proprietà chimiche simili.
Ne consegue la legge periodica di Mendeleev per cui:
le proprietà degli elementi variano con cadenza periodica
all’aumentare della loro rispettiva massa atomica.
Si definiscono periodi le righe dove sono disposti gli elementi nella loro valenza massima, al crescere della massa
atomica. Ad esempio, appartenevano al secondo periodo Li (litio), Be (berillio), B (boro), C (carbonio), N (azoto),
O (ossigeno) e F (fluoro).
Si definiscono gruppi le colonne dove sono disposti gli elementi che manifestano proprietà chimiche simili, che
hanno cioè la stessa valenza massima. Per Mendeleev al primo gruppo appartenevano oltre a H (idrogeno), anche
Li (litio), K(potassio) e così via.
Per valenza si intende la capacità di un atomo di legarsi o sostituirsi a un certo numero di atomi di idrogeno (o di
ossigeno). Si osservava così che la valenza degli atomi di diversi elementi cambiava seguendo un andamento
regolare: Nell’ambito di un periodo la valenza nei confronti dell’idrogeno aumentava da 1 a 4 per poi diminuire di
nuovo fino a 0. Ad esempio, le formule degli idruri degli elementi del secondo periodo sono:
LiH
BeH2
BH3
CH4
NH3
H2O
HF
e le corrispondenti valenze rispetto all’idrogeno sono:
1
2
3
4
3
2
1
La valenza massima nei confronti dell’ossigeno passava invece gradualmente da 1 a 7. Gli elementi del terzo
periodo formano infatti ossidi con le seguenti formule:
Na2O
MgO
Al2O3 SiO2
P2O5
SO3
Cl2O7
Per determinare la valenza nei confronti dell’ossigeno bisogna ricordare che quest’ultimo nell’acqua lega due atomi
di idrogeno per cui la sua valenza è due. Ad esempio, due atomi di sodio legano un atomo di ossigeno e formano un
composto di formula Na2O, dove ogni atomo di sodio ha valenza pari a ½ di quella dell’ossigeno (che è pari a 2) e
diventa pari quindia uno; il Mg si lega ad un atomo di ossigeno nell’ossido che ha formula chimica MgO e la sua
valenza è due al pari di quella dell’ossigeno; due atomi di alluminio legano invece tre atomi di ossigeno per cui è
come se legassero sei atomi di idrogeno: il rapporto è 2/6 e la valenza dell’Al nei confronti dell’O è di 3.
Anche il calcio Ca e il berillio Be hanno valenza 2 come il magnesio Mg: ecco perché Be, Mg e Ca si vengono a
trovare tutti nella stessa colonna della tavola periodica. Infatti la valenza degli elementi di uno stesso gruppo
generalmente non cambia: tutti gli elementi del gruppo I hanno valenza 1 (come il litio e il sodio); quelli del
2°gruppo hanno valenza 2; quelli del 3° hanno valenza 3 e così via.
Nel grafico che segue viene mostrato l’andamento periodico della valenza massima nei confronti dell’idrogeno
(colore rosso) e dell’ossigeno (colore blu) degli elementi che appartengono al 2° e al 3° periodo.
8
7
valenza
6
5
idrogeno
4
ossigeno
3
2
1
0
Li
Be
B
C
N
O
F
Ne
Na Mg
idrogeno
1
2
3
4
3
2
1
0
1
ossigeno
1
2
3
4
5
6
7
0
1
Al
Si
P
Si
Cl
Ar
2
3
4
3
2
1
0
2
3
4
5
6
7
0
La tavola periodica si rivelò subito uno degli strumenti teorici più importanti per la chimica: da un lato permetteva
di raccogliere razionalmente le analogie tra le proprietà degli elementi, dall’altro apriva nuovi orizzonti di ricerca.
Per rispettare l’andamento periodico Mendeleev aveva dovuto introdurre delle caselle vuote, che prefiguravano
l’esistenza di elementi allora sconosciuti. E’ ad esempio il caso dello scandio Sc, scoperto nel 1879 e chiamato da
Mendeleev ekaboro perché da lui collocato sotto al boro B e all’alluminio Al. Non solo, la tavola di Mendeleev
faceva intuire l’esistenza di nuove proprietà della materia: per rispettare la legge periodica il tellurio Te, con massa
atomica 128, avrebbe dovuto seguire e non precedere lo iodio I, con massa atomica 127. Il rispetto della legge
periodica non era in questi casi garantito dalla progressione crescente delle masse atomiche per cui doveva esistere
qualche altro principio ordinatore.
Per rispondere ai quesiti lasciati aperti da Mendeleev, occorre descrivere brevemente come furono scoperte le
particelle subatomiche e i diversi modelli proposti per descrivere la struttura dell’atomo.
Le particelle subatomiche
I fenomeni elettrici dovuti allo strofinio di alcuni materiali erano noti fin
dall’antichità; per strofinio inoltre alcuni materiali si respingevano ed altri
invece si attraevano: doveva esistere pertanto una nuova proprietà della
materia, capace di attrarre o respingere altri corpi elettrizzati per strofinio.
Nella figura a sinistra si osserva che una bacchetta di vetro elettrizzata
positivamente attrae a sé piccoli pezzi di carta.
La spiegazione viene illustrata nelle figure che seguono: esiste una forza, detta di Coulomb, proporzionale al
prodotto delle cariche Q1e Q2 e inversamente proporzionale al quadrato della loro distanza. Ciò significa che la
forza cambia al variare delle cariche, del loro segno e della loro distanza: maggiori sono le cariche e minore la
distanza più grande è la forza, che è repulsiva se i segni delle cariche sono concordi, attrattiva se i segni delle
cariche sono opposti. La costante k è un fattore moltiplicativo su cui non indagheremo.
A Le forze elettriche dello
stesso tipo (positive o negative)
sono repulsive;
B le forze elettriche di tipo
contrario sono attrattive
Esercizio
1) Completa la seguente tabella relativa alla legge di Coulomb
Carica 1
Carica 2
Distanza tra le
Q1 (C)
Q1 (C)
cariche d (m)
1
1
1
1
1/2
1
1
2
1
2
2
1
1
1
2
1
1
1/2
F k
Q1 Q2
(N)
d2
1
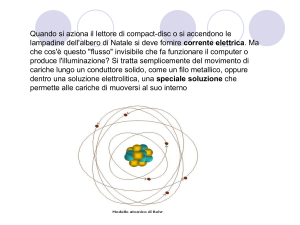
Già attorno al 1830, mentre studiava gli effetti del passaggio della corrente elettrica nelle soluzioni acquose,
Michael Faraday (tra le cui invenzioni si conta anche il becco Bunsen, perfezionato successivamente da un
assistente di Robert Wilhelm Bunsen) provava sperimentalmente che atomi e molecole dovessero contenere cariche
elettriche.
Nel 1897 Joseph John Thomson, uno scienziato inglese che studiava gli effetti del passaggio di scariche elettriche
sui gas, scoprì la prima particella subatomica: l’elettrone.
A pressione normale i gas non sono conduttori di elettricità tuttavia lo diventano a pressioni molto basse.
A Schema di un tubo di Crookes. A
pressioni di circa 10-6 atm gli elettroni
emessi dal catodo urtano la parete
opposta.
B i raggi catodici tracciano una scia
luminosa e sono deviati dall’attrazione
esercitata dal magnete.
Consideriamo un gas contenuto in un tubo, collegato ad una pompa a vuoto e munito di due placche metalliche alle
estremità chiamate elettrodi, collegati a loro volta ad un generatore di corrente continua ad alto potenziale. Se la
pressione viene abbassata a circa 50 mmHg, il gas si lascia attraversare da una corrente elettrica e dà luogo ad una
scarica. Se la pressione viene abbassata ulteriormente (10 mmHg) il tubo si riempie di una luminosità diffusa il cui
colore dipende dalla natura del gas utilizzato (ad esempio luce rossastra al neon usata per le insegne pubblicitarie).
Quando la pressione viene ulteriormente ridotta (circa 0,5 mmHg), scompare la colonna luminosa e si manifesta
una fluorescenza verde. A partire da esperimenti di questo tipo Thomson e altri dimostrarono che la fluorescenza
era causata non da “raggi” luminosi provenienti dal catodo (elettrodo negativo) e detti perciò “raggi catodici”, ma
da particelle aventi carica elettrica negativa, tutte uguali tra loro e di massa molto minore di quella del più piccolo
atomo conosciuto, quello di idrogeno. Inserendo infatti lungo il cammino di questi “raggi” una ruota a pale di vetro,
questi ne provocavano la rotazione, dimostrando la loro natura corpuscolare. I “raggi” interagivano infine con un
magnete confermando di possedere una carica negativa.
Nel 1885 Eugene Goldstein, lavorando sempre con un tubo simile a quello di Thomson ma con un catodo forato,
aveva osservato che, proprio dietro al catodo si sviluppavano dei raggi, inizialmente detti “raggi canale”.
Determinò più tardi che si trattava di particelle cariche positivamente, dotate di massa dipendente dalla natura del
gas presente nel tubo, ma sempre più grande di quella degli elettroni. Il fatto venne interpretato immaginando che i
raggi catodici potessero colpire nel loro cammino le molecole di gas strappando loro uno o più elettroni. Ciò che
restava delle molecole colpite erano particelle cariche positivamente che si mettevano in movimento verso il
catodo, cioè in senso contrario agli elettroni.
Le masse delle molecole erano tutte multipli interi della massa più piccola, ottenuta quando il gas utilizzato era
idrogeno. Questa particella fondamentale venne chiamata protone: la sua massa è molto maggiore di quella
dell’elettrone (1836 volte più grande) ma la sua carica risulta essere esattamente la stessa, anche se di segno
contrario. Storicamente, la scoperta del protone non è legata ai risultati di un esperimento preciso, come è invece
avvenuto per le altre particelle: infatti, intorno al 1920, si accertò che non esisteva alcun componente nucleare di
carica positiva più leggero dell'atomo di idrogeno (ricordiamo che la massa degli elettroni è trascurabile rispetto a
quella dei protoni) e si arrivò alla conclusione che il costituente fondamentale dei nuclei atomici fosse il nucleo di
idrogeno, che fu chiamato protone (dal greco proton, che significa “primo”).
Oggi sappiamo con esattezza che la materia risulta normalmente neutra perché gli atomi di cui è costituita sono
formati da un numero uguale di protoni (con carica positiva) e di elettroni (con carica negativa).
Nel 1909 un fisico statunitense, Robert Millikan, eseguì un esperimento attraverso il quale riuscì a misurare
indirettamente la carica dell’elettrone. Utilizzò un’apparecchiatura simile a quella riportata in figura, in cui alcune
goccioline di olio venivano spruzzate con un nebulizzatore all’interno di una camera e caricate negativamente
mediante elettroni strappati con raggi X dalle molecole di azoto e ossigeno presenti nell’aria all’interno del
dispositivo. Le goccioline tendevano a cadere, nella camera tenuta sotto vuoto, per azione della forza di gravità ma
il campo elettrico tra le due piastre cariche veniva regolato in modo tale da annullare la forza gravitazionale sulle
goccioline stesse.
Millikan scoprì che non tutte le goccioline avevano la stessa carica, tuttavia i valori della carica erano tutti multipli
di uno stesso valore molto piccolo: la carica del singolo elettrone pari a 1,7∙10-19 C.
Come la massa anche la carica viene ad avere una struttura quantizzata per cui qualunque carica è multiplo intero
della carica dell’elettrone.
Nel 1932 James Chadwick affermò con sicurezza che negli atomi è presente anche un altro tipo di particella, con
massa praticamente uguale a quella del protone ma neutra e per questo chiamata neutrone.
Fu proprio la proprietà dei neutroni di essere privi di carica elettrica che ne ritardò la scoperta: queste particelle
sono infatti molto penetranti e difficili da osservare direttamente a differenza delle particelle cariche (come i
protoni, gli elettroni e le particelle alfa) che perdono energia quando passano attraverso la materia.
Gli scienziati del XX secolo hanno scoperto che l’atomo è formato da molte altre particelle tra le quali il neutrino,
il positrone e il quark sulle quali non indagheremo in questo corso base.
Nella tabella che segue sono riportate le caratteristiche principali delle particelle subatomiche. Và ricordato che le
particelle subatomiche sono perfettamente identiche qualunque sia il tipo di atomo al quale appartengono.
Particella subatomica
elettrone
protone
kg
carica
uma
-
9,11∙10
-31
0,0005486
+
1,67∙10
-27
1,007
n
1,67∙10
-27
1,009
e
p
neutrone
massa
C
scoperta
(convenzionale)
da
nel
1,60∙10
-19
-1
Thomson
1897
1,60∙10
-19
+1
Goldstein
1885
0
Chadwick
1932
0
Esercizi
2) Una bacchetta di plastica, strofinata con un panno di lana, presenta una carica elettrica Q=-1,45∙10-10 C. Quanti
elettroni sono stati trasferiti dal panno di lana alla bacchetta?
……………………………………………………………………………………………………………………….
3) Confrontando le proprietà dei protoni e degli elettroni, indica per ogni affermazione se è vera o falsa:
a) gli elettroni sono uguali in tutti gli atomi mentre i protoni sono diversi
V
F
b) la massa di un protone è molto più grande di quella di un elettrone
V
F
c) la carica elettrica di un protone è di segno opposto a quella di un elettrone
V
F
d) la carica elettrica di un elettrone è molto più piccola di quella di un protone
e) la massa degli elettroni è sempre uguale, quella dei protoni può cambiare
V
F
V
F
4) Due bacchette elettrizzate per strofinio attirano entrambe una terza bacchetta elettrizzata. In base a questa
informazione, che cosa prevedi che avvenga se si avvicinano le prime bacchette?
a) si respingono
d) si neutralizzano
b) si attirano
c) non si attirano e non si respingono
e) nessuna previsione può essere fatta
Come si può facilmente osservare dai dati riportati in tabella 1 uma corrisponde circa alla massa del protone e del
neutrone, infatti vale l’equivalenza per cui:
1 uma = 1,6607∙10-27 kg= 1,6607∙10-24 g
Se vogliamo determinare a quanti uma corrisponde un grammo si scopre che 1 g corrisponde a un Numero di
Avogadro di uma (vedi figura sotto): una mole di atomi di H, della massa di 1 g circa, è costituita infatti da un
Numero di Avogadro di atomi ciascuno dei quali contiene all’interno del suo nucleo, con alta probabilità come
vedremo tra poco, un solo protone il cui peso è proprio di 1 uma (o 1 u).
Già Thomson nelle sue ricerche sperimentali sul neon aveva ipotizzato l’esistenza di due diversi atomi di questo
gas, completamente identici dal punto di vista chimico, ma diversi nella massa.
Nel 1913 un chimico inglese, Henry Moseley, studiò i raggi X prodotti utilizzando tubi in cui l’anodo poteva essere
costituito da metalli diversi, colpiti da un fascio di elettroni provenienti dal catodo. Scoprì che la lunghezza d’onda
(la distanza tra due picchi successivi dell’onda) dei raggi X emessi poteva variare in relazione al metallo impiegato.
La lunghezza d’onda è legata al numero di protoni presenti nel nucleo e, poiché un determinato elemento ha sempre
la stessa lunghezza d’onda si scoprì in questo modo che tutti gli atomi di uno stesso elemento possiedono lo stesso
numero di protoni. Il numero di protoni presenti nel nucleo di un elemento è chiamato numero atomico di
quell’elemento e si rappresenta con il simbolo Z. Atomi dello stesso elemento aventi massa differente vengono
chiamati isotopi. Gli isotopi del neon sono, ad esempio, il neon-20 (con 10 neutroni), il neon-21 (con 11 neutroni) e
il neon-22 (con 12 neutroni). Si chiama invece numero di massa, indicato con la lettera A, la somma di protoni e
neutroni presenti nel nucleo di un atomo.
Misure molto accurate hanno dimostrato che la massa del nucleo calcolata come somma delle masse dei suoi
nucleoni (protoni e neutroni) è minore della massa effettiva. Proprio da questo difetto di massa prende origine, in
base all’equazione di Einstein E=mc2, l’enorme energia che serve per tenere vicini nel nucleo protoni e neutroni.
Attorno al 1930 gli scienziati compresero che quando si fosse riusciti a rompere il nucleo si sarebbe liberata
l’energia nucleare. Nelle reazioni nucleari gli atomi non si conservano e neppure la loro massa: viene infatti violata
la legge di Lavoisier. Nelle reazioni chimiche invece il nucleo è protetto da una nube di elettroni e sono proprio
questi che interagendo determinano i cambiamenti che caratterizzano le reazioni chimiche.
Per indicare il numero atomico e il numero di massa degli isotopi viene
occupato il lato sinistro del simbolo dell’elemento.
numero
di massa
simbolo
chimico
numero
atomico
A
X
Z
Segue la rappresentazione dei tre isotopi dell’idrogeno con relative proprietà.
+
-
protone
1
elettrone
1
2
-
H
1
+
3
-
H
+
1
H
+
neutrone
nome
prozio
deuterio
Trizio
numero atomico Z
1
1
1
numero di massa A
1
2
3
numero di neutroni N
0
1
2
1,00783 uma
2,01410 uma
3,016 uma
99,984
0,0156
10-16
massa isotopica
abbondanza percentuale
In natura gli elementi sono costituiti da una miscela di isotopi presenti in una percentuale praticamente costante.
Pertanto il peso atomico di un elemento che si ricava sperimentalmente è un valore medio, che tiene conto appunto
della massa dei singoli isotopi e della percentuale con cui essi sono presenti.
Facciamo un esempio concreto e consideriamo i dati della tabella riportata sopra per determinare il peso atomico
medio dell’idrogeno. Su 100 atomi di idrogeno 99,984 sono atomi di prozio, 0,0156 di deuterio e 10-16 di trizio, per
cui la massa atomica media (peso atomico) si calcola facendo una media pesata come segue:
PAH
1,00783 99,984 2,01410 00156 3,016 10 -16
1,008
100
Ogni elemento compare dunque nella TPE con la sua massa atomica media: quella dell’idrogeno è ovviamente
vicina alla massa del protio, l’isotopo più abbondante; il carbonio ha massa atomica media pari a 12,01, di poco
superiore alla massa di 12 uma esatti assegnati all’isotopo 12. Anche in questo caso il peso atomico dell’elemento è
facilmente determinabile a partire dai dati relativi ai suoi isotopi naturali.
-
+
-
protone
12
6
elettrone
C
neutrone
+ +
+ +
+ +
-
-
13
6
C
-
-
+ +
+ +
+ +
-
nome
-
carbonio-12
carbonio-13
numero atomico Z
6
6
numero di massa A
12
13
numero di neutroni N
6
7
12,00 uma
13,004 uma
98,89
1,11
massa isotopica
abbondanza percentuale
Il peso atomico del carbonio risulta pertanto dalla seguente formula:
PAC
12,00 98,89 13,004 1,11 12,01
100
-
Esercizi
5) Il simbolo
rappresenta:
a) un isotopo del carbonio con A=14
c) isotopo del carbonio con Z=14
b) un isotopo del carbonio con 14 neutroni
e) isotopo del carbonio con A=6
d) isotopo del carbonio con massa 14u
6) Qual è la differenza tra numero di massa e peso atomico?
……………………………………………………………………………………………………………………….
……………………………………………………………………………………………………………………….
7) Il neon ha due isotopi: il neon-20 ha una massa di 19,992 u e il neon-22 di 21,991 u. In un campione contenente
100 atomi di neon, 90 sono di neon-20 e 10 di neon-22. Calcola la massa atomica media del neon.
………………………………………………………………………………………………………………..……….
………………………………………………………………………………………………………………..……….
8) Completa la seguente tabella relativa a 4 isotopi neutri
numero di
protoni Z
+
+
+
-
numero di
neutroni
numero di
elettroni
numero di
massa A
nome dell’isotopo
3
-
-
-
-
+ +
+ +
+ +
-
carbonio-14
-
+
+
+
+
-
9
-
-
-
-
++
+ +
+
+
+
+
+
+
+
+
-
-
12
13
-
-
-
9) Completa la seguente tabella
elemento n° di protoni n° di neutroni n° di elettroni n° di massa
18
8
O
27
60
56
100
10) Considera la seguente miscela di isotopi del rame:
massa (uma)
percentuale in natura
(%)
62,935
69,09
64,934
30,91
Calcola la massa atomica media del rame:
………………………………………………………………………..……………………………………………….
11) Sapendo che 1 uma=1,66·10-24 g, calcola la massa in grammi di:
a) una molecola di acqua
………………………………………………………………………………………………………………..……….
b) un miliardo (109) di molecole di acqua
………………………………………………………………………..……………………………………………….
c) 6·1023 molecole di acqua
…………………………………………………………………………………………………………………………
12) Determina il Peso Molecolare dell’anidride carbonica CO2 e a seguire:
a) la massa di una molecola;
b) la massa di un miliardo di molecole;
c) la massa di 6·1023 molecole di acqua
Cosa puoi osservare?
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
Soluzioni: 1) ½,2,4,0,25,4 2) 9,06·10 8 3) F V V F F 4) a 5) a 7) 20,19 u 8) 3,3,6,Li-6; 6,8,6,13; 4,5,4,Be-9; 12 25 Mg-25
9) 8,10,8,18;
44g
,33,27;
; 10) 63,55 11) a) 2,99·10-23 g; b) 2,99·10-14 g; c) 18 g 12) a) 7,31·10-23 gM; b) 7,31·10-14 g; c)