
Liceo Ginnasio “Goffredo Mameli”
PROGRAMMA ANNUALE SVOLTO DI CHIMICA E BIOLOGIA
CLASSE: IA A.S. 2015-16
DOCENTE: PRO.SSA I. PASQUA
Biologia
UD1
Da Mendel ai modelli di ereditarietà
La prima e la seconda legge di Mendel.
Le conseguenze della seconda legge di
Mendel.
La terza legge di Mendel.
Come interagiscono gli alleli?
I gruppi sanguigni
In che rapporto stanno geni e cromosomi?
La determinazione cromosomica del sesso.
UD2
Il linguaggio della vita
Come si dimostra che i geni sono fatti di DNA?
I virus.
Quale è la struttura del DNA?
La duplicazione del DNA è semiconservativa
UD4
La regolazione genica
La genetica di virus e batteri.
I geni che si spostano: plasmidi e trasposoni.
Virus a RNA e a DNA
La trasformaszione, la trasduzione, la
trasduzione generalizzata
La coniugazione
Fattori di fertilità, i plasmidi metabolici, i
fattori di resistenza, i trasposoni.
.
UD5
L’organizzazione del corpo umano
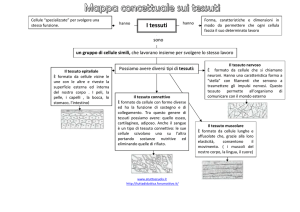
I tessuti: cellule specializzate per una funzione.
I tessuti epiteliali
Epitelio di rivestimento, ghiandolare, sensoriale.
Il tessuto muscolare.
Il tessuto muscolare scheletrico striato
Il tessuto muscolare liscio
Il tessuto muscolare cardiaco
I tessuti connettivi
Tessuti connettivo denso
Tessuto connettivo lasso
Tessuto connettivo adiposo
I tessuti connettivi specializzati
Il tessuto nervoso
Organi, sistemi e apparati
Sistema nervoso, sistema endocrino.
Le membrane interne
Lepidermide e derma
La rigenerazione dei tessuti
UD3
Il genoma in azione
I geni guidano la costruzione delle
proteine.
In che modo l’informazione passa dal
DNA alle proteine?
Alcuni virus costituiscono un’eccezione
al dogma centrale .
La trascrizione: dal DNA all’RNA.
La traduzione: dal DNA alle proteine.
Che cosa sono le mutazioni.
Le cellule staminali
Le cellule tumorali
Le sostanze cancerogene e gli oncogeni
L’omeostasi
La febbre
The organization of the human body
Verifica le tue conoscenze
Verifica le tue abilità
Mettiti alla prova
fattori che modificano la stabilità genetica di una
popolazione.
La selezione naturale.
La teoria evolutiva e il concetto di specie.
Chimica
CONTENUTI
• UD1 Introduzione alla chimica
Che cos’è la chimica?
Il metodo sperimentale.
Le grandezze fisiche e la loro misura.
Che cosa significa misurare.
Una misura non è mai esatta.
I numeri esponenziali.
Le cifre significative.
• Domande aperte.
• Esercizi di applicazione.
Test di conoscenza e comprensione.
Esperienze di laboratorio.
• UD2 Come è fatta la materia
La teoria atomica di Dal ton.
Le sostanze: aspetti diversi della materia.
La tavola periodica degli elementi.
Gli stati di aggregazione della materia.
Sistemi omogenei ed eterogenei.
• Domande aperte.
Test di conoscenza e comprensione.
• UD4 Dall’atomo di Dal ton all’atomo di Bohr
L’atomo.
La materia e l’elettricità.
• UD5 L’atomo oggi
La duplice natura dell’elettrone.
Le onde di materia di De Broglie.
•
• UD3 La ricerca delle regolarità
quantitative
Le rpime leggi della chimica.
La legge dei volumi di combinazione
tra gas.
La teoria atomico-molecolare.
Elementi e composti.
La massa atomica e molecolare.
La mole.
Il calcolo stechiometrico.
• Domande aperte.
• Esercizi di applicazione.
Test di conoscenza e comprensione
• UD6
Le proprietà periodiche degli
elementi
Il sistema periodico moderno
Le particelle subatomiche.
Gli isotopi.
La radioattività spontanea.
La luce e la materia.
La duplice natura della luce.
La luce come onda elettromagnetica.
Fenomeni ondulatori della luce.
Quanti di energia.
Il modello atomico di Bohr.
L’energia di ionizzazione e l’affinità
elettronica.
L’energia di ionizzazione e i livelli
energetici.
• Domande aperte.
• Esercizi di applicazione.
Test di conoscenza e comprensione
• UD7 Il legame chimico
Come si formano e che cosa sono i legami
chimici.
La teoria di Lewis e il legame covalente.
L’elettronegatività e la natura dei legami.
Il legame covalente puro o omeopolare.
Il legame covalente polare.
Il legame ionico ed eteropolare.
Il legame di coordinazione.
Il principio di indeterminazione di Heisenberg.
Gli orbitali e i loro numeri quantici.
La varietà degli orbitali.
L’energia degli orbitali.
Distribuzione elettronica negli atomi degli
elementi.
Costruzione progressiva degli atomi.
• Domande aperte.
• Esercizi di applicazione.
Test di conoscenza e comprensione
•
Gli stati fisici della materia e i passaggi di
stato
Corpi solidi, liquidi e gassosi
I cambiamenti di stato
Curve di riscaldamento e raffreddamento
Calore e caloria
Il piano costruttivo della tavola
periodica.
Le principali proprietà periodiche
degli elementi.
Come leggere la tavola periodica
degli elementi.
• Domande aperte.
Test di conoscenza e comprensione
•
• UD7 Lo stato liquido
Le caratteristiche dello stato liquido
L’evaporazione e la condensazione
Roma, 1 giugno 2016
Firma degli alunni
Prof.ssa Irene Pasqua
….......................................
…........................................
….........................................
Lo stato gassoso
Le caratteristiche dello stato gassoso
Le variabili di stato dei gas
Le leggi dei gas. La legge di Boyle
Il gas perfetto
Le leggi di charles e Gay-Lussac
Equazione di stato dei gas perfettiLa
densità di un gas
La legge di Dal ton
La teoria cinetica










![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)
