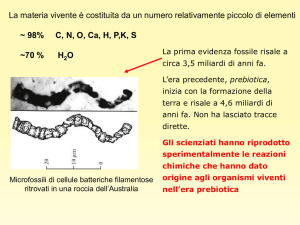
Scheda di lavoro relativa all'esperienza di laboratorio:
IL PRINCIPIO dell'EQUILIBRIO MOBILE
Identificazione del problema e scopo dell'esperienza: attraverso il cambiamento di colore di una reazione
all'equilibrio si osservano gli effetti di una sua perturbazione in termini delle concentrazioni delle specie coinvolte.
Premessa teorica (completa):
Un sistema chimico aperto/chiuso evolve spontaneamente verso uno stato di equilibrio in cui si stabilizzano le
tendenze a reagire dei reagenti attraverso la reazione diretta/inversa e dei ……………….…….. nella reazione
………………………….
Lo stato di equilibrio è la particolare situazione caratterizzata dalla costanza (invarianza) delle proprietà
microscopiche/macroscopiche, per esempio, il colore, la temperatura, …………………, ………………………
L’equilibrio chimico è un equilibrio dinamico, in cui sono possibili due reazioni concorrenti; la doppia
........................... indica che la reazione puo' avvenire in entrambe le direzioni; la reazione è allora in generale
reversibile/irreversibile e lo stato di equilibrio può essere raggiunto sia partendo dai ……………………. che dai
………………………..
All'equilibrio la velocità della reazione diretta è minore/uguale/maggiore a quella della reazione ..........................
per cui si può immaginare si abbia una incessante attività di interconversione tra reagenti e prodotti che si
trasformano gli uni negli altri pur mantenendo immutate le loro ……………………….
Il grado di reversibilità è condizionato dalla ……...…………….. ............................................. Keq che è data dal
rapporto tra i prodotti delle concentrazioni .................... dei prodotti e dei reagenti, ciascuna elevata al proprio
.......................................... ................................ La costante di equilibrio è costante a pressione/temperatura costante.
Il valore della costante di equilibrio puo' essere utilizzato per prevedere la direzione privilegiata verso cui un sistema
chiuso/aperto/isolato tende spontaneamente ad evolvere: se la Keq>>1 la reazione è molto spostata a destra/sinistra e
viceversa.
La Keq è in relazione con la variazione di energia libera di Gibbs G che misura la spontaneità della reazione: la
reazione è spontanea se porta a diminuzione/aumento dell'energia libera per cui G=G ................-G ...............<.......
L’equilibrio corrisponde ad uno stato di minima energia per cui si ha che G è minore/uguale/maggiore a zero;
poiché G=H-TS all'equilibrio si ha che ...............=.............. : il fattore .............................. e il fattore
......................... sono perfettamente bilanciati: sono bilanciate cioè la tendenza a procedere nella direzione in cui i
legami diventano più stabili (…….<0) e quella per cui il disordine aumenta (S…….).
Un sistema perturbato dal suo stato di equilibrio ..........................................................................................................
................................................................................(Principio di Le Chatelier o ............................................................).
Materiale: 4 vetrini da orologio, ............................................................................................................................
Reattivi (nomi e formule): soluzione di solfocianuro di potassio KSCN 0,002M; cristalli di KSCN; ……………...
............................................................................................................................................................................................
Procedimento, Reazioni e Osservazioni: mescolo nel beker ..................................................................................
In soluzione avviene la seguente reazione (da bilanciare):
La sostanza che colora di rosso il sistema è lo ione complesso tiocianato di ferro (III) che si forma tra lo ione ferrico e
lo ione tiocianato:
Ione ………………………
……….…………
di colore …………………….……
incolore
……..........................
di colore ………………….
per cui vale la seguente Keq=……………………………………………………..
divido la soluzione in 4 parti uguali; prendo come riferimento il primo vetrino.
A) aggiungo qualche cristallo di ......................e osservo che ...........................................................................................
B) aggiungo qualche cristallo di ......................e osservo che ..........................................................................................
C) aggiungo qualche cristallo di idrogeno fosfato di sodio Na2HPO4 che in soluzione dà luogo a ioni H2PO4- in grado
di formare con lo ione Fe+3 un composto di colore ……………………………… secondo la seguente reazione:
e osservo che
.........................................................................................................................................................................
D) se scaldo la soluzione osservo che …………………………………………………………………………………
Elaborazione dei risultati ottenuti:
A) l'equilibrio si sposta a
destra/sinistra perché .........................................................................................................
B) l'equilibrio si sposta a ............................ perché ..........................................................................................................
C) l'equilibrio si sposta a ............................ perché ...........................................................................................................
D) l’equilibrio si sposta a ……………..… perché ………………………………..…………………………………….
H) Se un prodotto fosse gassoso dove si sposterebbe l'equilibrio aumentando la pressione? .........................................
In sintesi:
il
In base al
si può prevedere
Principio di Le Chatelier
di un
l’evoluzione
che subisce
sistema chimico
stabilisce che l’aumento di
de
temperatura
favorisce le
reazioni
endotermiche
pressione
favorisce le
reazioni con
diminuzione di n in
fase gassosa
concentrazione
de
favorisce
la formazione
dei prodotti
favorisce
la formazione
dei reagenti
reagenti
i
i
prodotti
perturbazioni dello stato di
equilibrio