I GLUCIDI (dal greco glucos, dolce),
comunemente noti con il termine carboidrati,
sono composti costituiti da carbonio, idrogeno e
ossigeno (sostanze ternarie), che conferiscono
sapore, consistenza e varietà agli alimenti. Inoltre
i carboidrati e rappresentano la fonte principale di
energia del nostro organismo e
conseguentemente occupano un posto
preminente nella dieta dell'uomo.
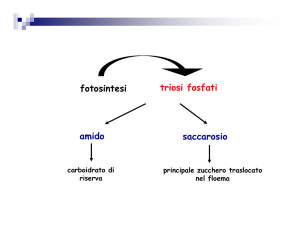
La produzione di carboidrati in natura avviene nelle piante verdi
mediante il processo di fotosintesi clorofilliana,
clorofilliana che catalizza la
conversione dell’anidride carbonica ed acqua in D(+)-glucosio.
Il valore energetico dei carboidrati è variabile:
valori medi di utilità pratica sono quelli fissati
dal Decreto Legislativo 16 febbraio 1993 n.77
(G.U. n. 69, 24/3/1993)
che regola l’etichettatura nutrizionale
dei prodotti alimentari
uniformando la legislazione italiana
a quella vigente nei Paesi dell’Unione Europea:
si attribuisce
un valore calorico di 4,1 kcal/g (17 kJ/g)
ai carboidrati disponibili (amido e zuccheri)
e
di 2,4 kcal/g (10 kJ/g) ai polialcoli.
Tabella 1. Principali carboidrati di interesse agroalimentare
Classe
(DP)*
Gruppo
Monosaccaridi
Zuccheri
(1-2)
Disaccaridi
Polioli
Oligo
saccaridi
(3-9)
Poli
saccaridi
(>9)
Componenti
Glucosio, fruttosio, galattosio
Saccarosio, maltosio, lattosio, trealosio
Sorbitolo, mannitolo, xilitolo,
lattitolo, maltitolo
MaltoMaltooligosaccaridi
Maltodestrine
altri
oligosaccaridi
Amido
Raffinosio, stachiosio, fructooligosaccharidi,
galattooligosaccaridi
Polisaccaridi
non amidacei
Cellulosa, emicellulosa, pectine,
carragenine, idrocolloidi
DP* = grado di polimerizzazione
Amilosio, amilopectine, amidi modificati
Monosaccaridi
Chimicamente possono quindi essere considerati come aldeidi
(aldosi) o chetoni (chetosi) di alcoli polivalenti, con formula bruta
(CH2O)n,
avremo pertanto i triosi (3 atomi di carbonio), i tetraosi (4 C), i
pentaosi (5 C), gli esosi (6 C), gli eptosi (7 C), ecc
la forma del glucosio solitamente presente in natura è
destrogira ([α]D20 = + 52,7°), mentre il fruttosio è presente in
natura nella forma levogira (([α]D20 = - 92,4°), comunque
entrambi sono inclusi nella serie D in quanto le loro
configurazioni assolute sono correlate alla D-gliceraldeide.
L’aldeide glicerica a)
è il più semplice aldoso dotato di attività ottica
il C in posizione 2 asimmetrico
conferisce alla molecola
due stereoisomeri
Aldosi
a)
CHO
|
H-C-OH
(epimeri)
|
CH2OH
D-Gliceraldeide
b)
CHO
|
HO-C-H
|
CH2OH
L-Gliceraldeide
Formula di proiezione degli stereoisomeri della gliceraldeide
Il diidrossiacetone
è il più semplice chetoso
Chetosi
CH2OH
|
C=O
|
CH2OH
Diidrossiacetone
CH2OH
|
C=O
|
H-C-OH
|
CH2OH
Eritrulosio
Aumentando il numero degli atomi di C,
aumentano gli stereoisomeri
i tetraosi presentano due C asimmetrici,
i pentosi tre, gli esosi quattro (ciò per gli aldosi).
Due
monosaccaridi
che
differiscono
tra
loro
unicamente per la configurazione di uno solo degli
atomi di C asimmetrici sono definiti epimeri
Per monosaccaridi contenenti più di sei atomi di C
il numero degli stereoisomeri è duplicato per ogni
atomo di C asimmetrico addizionale.
Strutture cicliche
I pentosi e gli esosi possono dare origine a
strutture cicliche costituite da cinque (furanosi)
(furanosi) o
da sei (piranosi)
(piranosi) atomi di carbonio.
La denominazione di furanosidi e piranosidi deriva
dalla similitudine
similitudine che le forme cicliche assumono
rispettivamente al furano ed al pirano.
pirano.
La formazione delle strutture piranosiche
è resa possibile dalla formazione di
un legame semiacetalico del gruppo ossidrile
alcolico dell’atomo di carbonio 5
con l’atomo
l’atomo di carbonio aldeidico (figura 4)).
Aldoesosi
proiezione di Fischer
LINEARE
CICLICHE
furano
(figura 4))
pirano
proiezione di Fischer
Conformazione lineare e ciclica del D(+)-glucosio,
simile al composto eterociclico pirano
figura 4
Il semiacetale formatosi per reazione tra il gruppo aldeidico ed
il gruppo ossidrilico in C-5 , crea un nuovo centro asimmetrico
sul carbonio C-1 in grado di generare due forme
stereoisomere, più precisamente due diasteroisomeri che
differiscono per la posizione del C1 e che vengono indicati
come anomeri α e β.
Derivati dei monosaccaridi
Per ossidazione del C aldeidico si formano gli
acidi poliossicarbossilici detti acidi aldonici. Ad
esempio, dal D-glucosio si ottiene l’acido gluconico (il
fosfogluconico è un importante intermedio del
metabolismo dei carboidrati).
Per ossidazione sia del C aldeidico che del C del
gruppo ossidrilico primario si ottengono acidi aldarici
(poliidrossidicarbossilici). (Questi acidi non hanno
interesse in campo alimentare o significato biologico).
Una terza possibile via di ossidazione è quella in
cui soltanto C che porta il gruppo ossidrilico primario
viene ossidato ad acido carbossilico con formazione
degli acidi uronici. (Gli acidi uronici sono componenti
delle glicoproteine e delle pectine, quest’ultime sono
polisaccaridi di interesse alimentare)
Altri importanti derivati dei monosaccaridi sono
gli zuccheri fosfati,
fosfati presenti in tutte le cellule
viventi,
i deossi zuccheri,
zuccheri largamente presenti in natura,
quale
2-deossi-D-ribosio
costituente
dell’acido
deossiribonucleico CHO
|
CH2
|
(H-C-OH)2
|
CH2OH
gli ammino zuccheri,
zuccheri fra i quali la D-glucosammina
componente principale della chitina, polisaccaride
strutturale presente nell’esoscheletro degli insetti e dei
crostacei.
Dal D-glucosio deriva l’acido glucuronico (1)
Dal D-galattosio l’acido galatturonico (2)
(1)
CHO
|
α H-C-OH
|
β HO-C-H
|
γ H-C-OH
|
δ H-C-OH
|
1° COOH
(2)
CHO
|
H-C-OH
|
HO-C-H
|
HO-C-H
|
H-C-OH
|
COOH
Gli acidi aldonici (ossidazione C aldeidico) e
uronici (ossidazione C con ossidrile primario)
ambedue hanno 2 COOH e
lattonizzano facilmente
formando anelli a 5 o a 6 atomi di C
come il D-δ
δ-gluconolattone ed il D-δ
δ-glucuronolattone.
Un importante esempio di quest’ultimo tipo di acidi è
l’acido L-ascorbico (vitamina C), che strutturalmente è il
γ-lattone di un acido esonico che presenta una struttura
endiolica agli atomi di carbonio 2 e 3 (figura 8A). è
particolarmente instabile e si ossida facilmente ad
acido deidroascorbico (figura 8).
A
B
Figura 8. (A) Acido L-ascorbico, (B) acido deidroascorbico
Stereoisomeria dei monosaccaridi
• I monosaccaridi in cui è presente lo stesso numero di
atomi di carbonio comprendono una serie di forme
molecolari (stereoisomeri) con identica formula di
struttura, ma diversi arrangiamenti tridimensionali dei
rispettivi atomi e gruppi funzionali.
• Il numero degli atomi di carbonio asimmetrici (atomi di
carbonio ai quali quattro differenti atomi o gruppi sono
chimicamente legati) determina il numero di
stereoisomeri che sono presenti.
• Gli stereoisomeri che presentano un’immagine speculare
uno dell’altro sono noti come enantiomeri o coppia
enantiomorfa, mentre stereoisomeri non speculari sono
comunemente definiti diasteroisomeri.
Numero di atomi di carbonio asimmetrici:
stereoisomeri e coppie enantiomorfe (2n)
Monosaccaride
Numero di
atomi di
carbonio
asimmetrici
Numero di
stereoisomeri
Numero di
coppie
enantiomorfe
Aldotriosi e
chetotetraosi
Aldotetraosi e
chetopentosi
1
2
1
2
4
2
Aldopentosi e
chetoesosi
Aldoesosi
3
8
4
4
16
8
D galattosio
D glucosio
O
H
O
H
C
C
HO
C
HO
C
C
D mannosio
C
OH
C
HO
OH
CH2OH
O
H
C
OH
C
HO
C
HO
C
C
OH
C
OH
C
OH
C
OH
CH2OH
CH2OH
• Due monosaccaridi che differiscono tra loro
unicamente per la configurazione di uno
solo degli atomo di carbonio asimmetrici,
sono definiti epimeri.
• Il D-glucosio e il D-galattosio sono epimeri
in quanto cambia solo la configurazione
rispetto al carbonio 4.
• Analogamente il D-mannosio è epimero in
C2 del D-glucosio.
gli esosi possono dare origine a strutture cicliche
La formazione delle strutture piranosiche è resa
possibile dalla formazione di un legame semiacetalico
del gruppo ossidrile alcolico dell’atomo di carbonio 5 con
l’atomo di carbonio aldeidico
Conformazione lineare e ciclica del D(+)-glucosio
Glucosio
0.1%
α-D-glucosio
36%
β-D-glucosio
64%
• Possiamo quindi definire anomeri gli
stereoisomeri che differiscono tra loro per la
posizione dell’ossidrile semiacetalico, cioè per la
configurazione interno al nuovo centro di
asimmetria originato dalla ciclizzazione del
monosaccaride.
• Tutti gli aldosi con 5 e 6 atomi di carbonio
formano anelli piranosici e possono esistere in
forme anomeriche.
• Anche i chetosi possono originare forme cicliche e
quindi esistere come forme anomeriche α e β.In
questo caso il gruppo ossidrilico alcolico del
carbonio 5 si unisce al al gruppo carbonilico del
carbonio 2, formando un emichetale che genera
una ciclizzazione a cinque atomi (anello
furanosico).
Glucosio
•questo monosaccaride è il più importante degli esosi
•ha un potere edulcorante pari a circa il 70-80% di quello del
saccarosio
•In soluzione, ruota a destra il piano della luce polarizzata: di qui il
nome di "destrosio"
•Il glucosio è contenuto in una vasta gamma di alimenti, quali
miele, frutta e vegetali
•Il glucosio si ottiene per idrolisi di molti carboidrati, fra cui il
saccarosio, il maltosio, la cellulosa, l'amido e il glicogeno.
Industrialmente può essere ottenuto per via enzimatica da amido
ottenuto come sottoprodotto del mais
D(-)Fruttosio
•monosaccaride noto anche con il nome di levulosio in quanto le sue
soluzioni ruotano il piano della luce polarizzata verso sinistra
•è presente, insieme al glucosio, nella frutta e quindi in tutti gli alimenti
derivati dalla frutta, quali succhi, nettari, marmellate, ecc
• Sciroppi ad alto contenuto di fruttosio (High Fructose Corn Syrup =
HFCS) vengono normalmente prodotti dall’amido mediante un processo
enzimatico che prevede in una prima fase la produzione di sciroppi di
glucosio ed una seconda fase di isomerizzazione del glucosio in fruttosio.
L’isomerizzazione del glucosio in fruttosio avviene tramite l’enzima
glucosio isomerasi (enzima intracellulare ricavato da Streptomyces
murines),
il fruttosio in natura è presente nella la forma furanosica,
mentre allo stato cristallino presenta la forma piranosica.
•Il fruttosio ha un elevato potere edulcorante (1,50), ben
superiore, a quello del glucosio (0,74) e del saccarosio (1,00)
e alle limitate implicazioni negative che la sua assunzione
pone a livello nutrizionale in quanto il fruttosio è uno dei
carboidrati che presenta uno dei più bassi valori di indice
glicemico fra tutti gli alimenti.
L’ Indice Glicemico (IG)
è l’incremento di glucosio nel sangue determinato dalla assunzione di un
dato alimento; esso viene valutato in base ad una scala, i cui i valori sono
compresi tra 0 e 100 (il valore 100 è attribuito al pane bianco)
Valori di IG
• compresi tra 70 e 100 sono considerati alti
• tra 55 e 70 sono considerati medi
• inferiore a 55 sono considerati bassi
D(+)-Galattosio
•Il D-glucosio e il D-galattosio sono epimeri in quanto cambia solo la
configurazione rispetto al carbonio 4
•non si trova allo stato libero ma è abbondante allo stato combinato,
è uno dei costituenti del disaccaride lattosio ed entra nella
composizione di glucidi più complessi .
•Il galattosio è uno zucchero riducente, destrogiro
•è relativamente poco solubile in acqua
•è fermentescibile.
• ha un potere dolcificante (0.60) inferiore a quello del glucosio.
Legame glicosidico
Un monosaccaride può essere chimicamente legato ad un altro
monosaccaride in seguito alla reazione dell’atomo di carbonio
anomerico di uno dei monosaccaridi con un gruppo ossidrilico dell’
altro monosaccaride. Il legame che viene cosi a formarsi e che unisce i
due monosaccaridi è chiamato legame glicosidico.
Potere edulcorante di alcuni carboidrati
Zuccheri
Potere
edulcorante
Alditoli
Potere
edulcorante
Saccarosio
1.00
Xilosio
0.90
Glucosio
0.74
Sorbitolo
0.70
Fruttosio
1.50
Mannitolo
0.50
Galattosio
0.60
Lattitolo
0.30
Lattosio
0.30
Maltitolo
0.75
Maltosio
0.50
Isomalto
0.45 ÷ 0.60
* calcolato assumendo il valore 1 per il disaccaride saccarosio
Disaccaridi
Disaccaride
Monomeri
Tipo di legame
coinvolto
Maltosio
glucosio
(1→
→4) α-glicosidico
Isomaltosio
glucosio
(1→
→6) α-glicosidico
cellobiosio
glucosio
(1→
→4) β-glicosidico
Lattosio
glucosio e
galattosio
(1→
→4) β-glicosidico
Saccarosio
glucosio e
fruttosio
(1→2) α,β-diglicosidico
Trealosio
glucosio
(1→1) α,β-diglicosidico
Caratteristiche
riducenti,
subiscono la
mutarotazione
non-riducenti,
non subiscono la
mutarotazione
Saccarosio
•Noto anche con il nome di sucrosio, questo disaccaride è il
comune zucchero da tavola, presente in vari vegetali, in particolare
nella barbabietola e nella canna da zucchero, da cui viene estratto.
è costituito da una molecola di glucosio ed una molecola di fruttosio,
unite tra loro da un legame glicosidico tra il C-1 del glucosio ed il C2 del fruttosio, in questo modo il legame glicosidico blocca tutte e
due le funzioni carboniliche dei due monosaccaridi per cui non ci
sono gruppi carbonilici “liberi” con conseguente assenza di
mutarotazione ed attività riducente.
Circa 1/10 della popolazione mondiale vive grazie alla produzione
lavorazione dello zucchero. Nel mondo se ne producono circa 130
milioni di tonnellate (1/3 da canna; 2/3 da barbabietola)
Oggi lo zucchero, come il pane, fa parte della nostra dieta quotidiana, ma
prima del XVIII aveva un valore così elevato che lo chiamavano “l’oro
dolce”.
Il processo industriale di estrazione dello zucchero dalla barbabietola
può essere sintetizzato nelle seguenti fasi:
- le barbabietole, prive del loro impianto fogliare, vengono lavate e
tagliate in lunghe fettucce sottili;
- - le fettucce vengono inviate in un impianto di estrazione con acqua
calda dove per diffusione, il saccarosio contenuto nelle fettucce viene
solubilizzato arricchendo progressivamente l’acqua di estrazione (fase
di solubilizzazione con produzione del “sugo greggio”);
- - il sugo greggio viene depurato con la calce per eliminare le
impurezze ( sostanze pectiche, albuminoidi ed acide) quindi dopo
filtrazione si ottiene il “sugo leggero”;
- -il sugo leggero subisce un processo di evaporazione per eliminare
gran parte dell’acqua, ottenendo in tal modo una soluzione molto densa
nota come “sugo denso”,
Il sugo denso viene fatto cristallizzare più volte all’interno di speciali
concentratori noti come “bolle di cottura”, da cui si forma la “massa
cotta”, costituita da un aggregato di cristalli di saccarosio e sciroppo
zuccherino noto come “acqua madre”;
- mediante una successiva fase di centrifugazione i cristalli sono
separati dallo sciroppo e quindi inviati negli essiccatoi dove viene
eliminata l’acqua residua. Il saccarosio è quindi raffreddato ed è pronto
per il confezionamento.
Maltosio
è un α-D-glucopiranosil-(1→4)-α-D-glucopiranoso, in cui il
secondo residuo di glucosio ha un atomo di carbonio anomerico
libero, in grado di esistere in forma α o β di cui la forma β (riportata
in figura) è quella predominante in natura. è un α-D-glucopiranosil(1→4)-α-D-glucopiranoso, in cui il secondo residuo di glucosio ha
un atomo di carbonio anomerico libero, in grado di esistere in forma
α o β di cui la forma β (riportata in figura) è quella predominante in
natura.
•Il maltosio può essere ottenuto, insieme ad altri prodotti, per
parziale idrolisi dell’amido, ad esempio dal malto (orzo germinato)
per azione dall’enzima diastasi, da cui il nome di zucchero di malto.
•È uno disaccaride facilmente digeribile per azione dell’enzima
maltasi che lo scinde in due molecole di glucosio:
maltasi
Maltosio + H2O
2 glucosio
Per questa sua prerogativa trova largo impiego nella preparazione
di alimenti per neonati e di bevande
•Viene inoltre usato come substrato per la fermentazione del lievito
ed è importante nel processo di produzione della birra.
Cellobiosio
è un β-D-glucopiranosil-(1→4)- β-D-glucopiranoso, in cui il secondo
residuo di glucosio ha un atomo di carbonio anomerico libero ed è
pertanto riducente.
è idrolizzato in due molecole di D(+)-glucosio dall’enzima emulsina
(estratto dalle mandorle amare), in grado di idrolizzare il legame
glucosidico β(1→4) che unisce i due monomeri di glucosio.
Lattosio
è un disaccaride, formato da una molecola di glucosio e una di
galattosio, presente nel latte a cui conferisce un sapore leggermente
dolce (il lattosio è dolce circa 1/3 del saccarosio)
OH OH
H
H OH
O
H
H
O
O
HO
H
H
OH
H
HO
H
H
H
OH
OH
Per idrolisi acida o per trattamento con l’enzima lattasi il
lattosio si idrolizza in D(+)-glucosio e D(+)-galattosio
Il lattosio è facilmente attaccato da numerosi microrganismi che
provocano le principali fermentazioni del latte e del formaggio. La più
importante è la fermentazione lattica, che avviene spontaneamente
nel latte lasciato a riposo. Ad esempio nella fermentazione lattica i
batteri lattici
• idrolizzano il lattosio in una molecola di glucosio e una di galattosio,
•trasformano quindi il galattosio in glucosio e infine
•fermentano le due molecole di glucosio producendo 4 molecole di
acido lattico.
La fermentazione porta all’acidificazione del latte ed è dannosa in
quello destinata all’alimentazione diretta perché porta alla
coagulazione della caseina.
Polisaccaridi
I polisaccaridi possono essere classificati in base alla funzione in
Amido
L’amido è un polisaccaride costituito da molecole di α-D-glucosio presente
in quantità apprezzabili nei cereali, nei legumi secchi e nelle patate.
E’ generalmente presente per un 20% come amilosio,
amilosio polisaccaride
costituito da lunghe catene prive di ramificazioni in cui le unità di glucosio
sono unite da un legame glicosidico α(1→4). Le catene del polisaccaride
assumono una conformazione a spirale (avvolgimento elicoidale dell’αamilosio), in grado di conferire una intensa colorazione blu a soluzioni di
iodio.
H OH
H
O
H OH
HO
H
HO
H
H
H
OH
O
H OH
O
H
HO
H
H
H
OH
O
n
O
H
HO
H
H
OH
OH
Il restante 80%, chiamato amilopectina , è costituito da catene
polisaccaridiche altamente ramificate. Tali ramificazioni sono
originate da legami glicosidici α(1→6), che costituiscono i
punti di ramificazione di tratti lineari in cui il glucosio è legato
con legame α(1→4). La lunghezza media delle ramificazioni
può essere costituita di 20-25 unità monosaccaridiche di
glucosio a seconda della sua origine.
α-amilasi
degradano il legami α-(1--- 4)
β-amilasi
degradano il legami α-(1--- 4)
rimuovendo il maltosio dalle estremità delle
ramificazioni esterne
amilo α-(1—6)-glucosidasi idrolizzano
i legami α-(1--- 6 ) delle ramificazioni
glicogeno
Nel processo digestivo e di assimilazione dell’amido, l’α-amilasi, che
è presente sia nella saliva che nel succo pancreatico, idrolizza i
legami α(1→4) con formazione di una miscela di destrine e
glucosio. I polisaccaridi a lunghezza intermedia che si formano per
azione enzimatica sono chiamate destrine.
Le amilo α-(1—6)-glucosidasi idrolizzano i legami α-(1--- 6 ) delle
ramificazioni, consentendo alle α e β-amilasi di trasformarle in
glucosio, che è l’unico zucchero che il nostro organismo può
metabolizzare.
Cellulosa
è un polisaccaride costituito da molecole di β-D-glucosio, unite
mediante legami β(1→4), presente in quantità apprezzabili nelle
piante e nei fiocchi di cotone (che possono essere costituiti fino
al 95% di cellulosa pura).
La cellulosa è il componente principale delle cellule delle piante e
costituisce circa il 50% in peso del legno e delle radici, mentre il
restante 50% è costituito da emicellulose e lignina.
L’uomo non possiede nel corredo enzimatico del sistema digestivo
gli enzimi in grado di scindere il legame β-glicosidico, mentre
possiedono quelli in grado di idrolizzare il legame α-glicosidico
dell’amido. Per questo motivo la cellulosa non rappresenta è
utilizzabile come alimento, ma solamente come fibra.
Molti microrganismi contengono gli enzimi in grado di idrolizzare la
cellulosa (cellulasi) Ciò consente ad esempio ai ruminanti di nutrirsi
della cellulosa presente nelle piante ingerite a seguito della
presenza nel rumine di batteri e protozoi in grado di produrre gli
enzimi necessari all’idrolisi della cellulosa.
Inulina
È la riserva glucidica di alcuni vegetali che non sono in grado di
accumulare l’amido, come la dalia, la patata dolce, etc.
è un polisaccaride, non ramificato, costituito da molecole di β-Dfruttosio, unite mediante legami β(2→1),con la presenza di una
molecola di glucosio all’inizio e al termine della catena
Molti microrganismi contengono l’inulasi, enzima in grado di
idrolizzare l’inulina, mentre l’uomo non possiede nel corredo
enzimatico del sistema digestivo gli enzimi in grado di idrolizzare
inulina, per cui questa, come la cellulosa, non è utilizzabile come
alimento, ma solamente come fibra.
Pectine
sono polisaccaridi costituiti da alcune centinaia di molecole di acido
galatturonico con legame α(1→4) variamente esterificato con alcool
metilico, a vario grado di neutralizzazione.
Si trovano in natura combinate con la cellulosa negli spazi
intercellulari dei tessuti vegetali. Molti tipi di frutta e verdura come
mele, pere, carote, patate, ecc., devono la loro consistenza proprio
alla presenza di questi polisaccaridi.
Le pectine sono estratte dalle bucce delle arance, che ne
contengono in media il 3% (della buccia fresca), e dalla polpa di
mela spremuta.
Le pectine fanno parte della frazione “gel forming” della fibra e
devono le loro proprietà gelificanti alla presenza dei gruppi
metossilici
Le pectine altamente metossilate, con circa il 70% di acido
galatturonico esterificato, vengono usate in commercio come tali
per la preparazione di marmellate e gelatine altamente
zuccherose.
Le pectine scarsamente metossilate,(grado di esterificazione 30%
circa) che gelificano in presenza di ioni Ca++ ed in assenza di
saccarosio od altri soluti, si usano sempre più per la preparazione
di gelatine a basso contenuto calorico.
Fibra alimentare o dietetica
si definisce la frazione degli alimenti vegetali, che costituisce la
parete cellulare delle piante, priva di interesse nutrizionale.
nutrizionale
La fibra alimentare è costituita di:
Cellulosa
F. idrofila
Lignina
Emicellulose
o insolubile
Pectine
Polisaccaridi
Gomme
F. gelificante
non cellulosici
Mucillagini
o solubile
Pilsaccaridi algali
La fibra alimentare è un importante componente della dieta umana
e, pur non potendosi considerare un nutriente, esercita effetti di
tipo funzionale e metabolico (migliora la funzionalità intestinale).
Il fabbisogno giornaliero stabilito dai LARN è di 30 g/die,
Composizione chimica della fibra
La fibra insolubile assorbe acqua da 5 a 25 volte il suo peso e
trattiene i gas .
La fibra solubile è fermentata dai batteri dell’intestino crasso con
formazione di acidi grassi a catena corta. Per questo motivo viene
considerata un ingrediente alimentare non digeribile in grado di
stimolare selettivamente la crescita e/o l’attività metabolica di un
numero limitato di gruppi microbici , importanti per il buon
funzionamento dell’organismo”.
Edulcoranti intensivi
Per edulcoranti intensivi si intendono sostanze che presentano
un alto potere edulcorante, spesso superiore centinaia di volte a
quello relativo al saccarosio.
Il loro impiego nasce dall’esigenza da parte dei nutrizionalisti e,
maggiormente dell’industria alimentare, di disporre di composti
dolcificanti "alternativi" con la peculiarità di assicurare un ridotto
apporto calorico a parità di potere edulcorante.
Gli edulcoranti intensivi di maggior impiego in Italia sono la
saccarina, l’aspartame, l’acesulfame ed i ciclammati.
Altri edulcoranti intensivi sono la neoesperidina diidrocalcone e la
taumatina.
Potere edulcorante e DGA di alcuni edulcoranti intensivi
Sigla
CE
Denominazione
E950
Acesulfame K
E951
E952
E959
E954
E957
Potere
edulcorante
[saccarosio=1]
160-250
Dose
giornaliera
Accettabile
9 mg/Kg
Aspartame
130-250
40 mg/Kg
Ciclammati
30-80
7 mg/Kg
Neoesperidina
2000-3000
5.0 mg/Kg
Saccarina
300-500
5.0 mg/Kg**
Taumatina
2000-2500
1-2 mg/kg
Saccarina
• – E’indubbiamente l’edulcorante di sintesi più noto ed impiegato da
più lungo tempo.
• Per decenni è stato l’unico succedaneo del saccarosio assunto da
soggetti affetti da diabete e solo recentemente il suo uso è in declino,
anche in relazione ad un ipotetico rischio di genotossicità legato alla
correlazione tra assunzione di saccarina ed insorgenza di tumori alla
vescica. Numerosi studi scientifici hanno comunque dimostrato che
questa sostanza, alle dosi di consumo usuali, non è affatto tossica e non
può essere associata all’insorgenza di eventuali forme tumorali
nell’uomo.
La saccarina si presenta come una polvere bianca
cristallina, inodore con un potere edulcorante
decisamente superiore al saccarosio ed un
retrogusto metallico.
Relativamente al suo metabolismo, la saccarina è
solo parzialmente assorbita, escreta immodificata
nelle urine e non da alcun apporto calorico. Inoltre
non favorisce l’insorgenza della carie dentaria ed è
stabile alle alte temperatura.
Viene essenzialmente impiegata nella formulazione
di bustine impiegate come succedanei del
saccarosio in sinergia con altri edulcoranti sintetici
e/o alditoli.
Aspartame
•
•
•
Scoperto casualmente nel 1965, e’ un edulcorante artificiale dipeptidico
costituito dagli ammino acidi fenilalanina ed acido aspartico uniti sotto
forma di estere metilico
Benché abbia un contenuto energetico significativo (4 kcal/g, come il
saccarosio), le quantità utilizzate nella formulazione di alimenti dietetici
ed ipocalorici sono talmente esigue per cui il suo apporto calorico è
praticamente irrilevante.
L’aspartame è in grado di conferire una sensazione dolce, che tende a
persistere nel tempo, simile a quella del saccarosio e di intensità da 130 a
250 volte superiore al saccarosio in relazione alla concentrazione in
soluzioni e all’origine della matrice alimentare (tende ad esaltare il sapore
di frutta come l’arancia ed il limone). Si presenta come una polvere
bianca granulare, priva di odore, sapore dolce privo di retrogusto, con
una solubilità in acqua del 1% per soluzioni con valore di pH massimo di
5.2 e temperatura di 25°C.
• Trova largo impiego nella preparazione di bevande
ipocaloriche
• I prodotti alimentari contenenti aspartame debbono
riportare in etichetta la dizione «contiene una fonte di
fenilalanina», in difesa dei soggetti affetti da
chetonuria, difetto genetico del metabolismo
fenilalaninico dovuto a deficienza o assenza dell'enzima
fenilalanina idrossilasi (fenilalaninasi) che, in
condizioni
normali,
catalizza
la
conversione
dell'aminoacido fenilalanina in tirosina. Inoltre, nei
confronti di questo edulcorante esiste una campagna di
opinione che associa l’uso dell’aspartame con
l’insorgenza di allergie, intolleranze alimentari e
determinate patologie tumorali. I numerosi studi
condotti da quando questo edulcorante è stato
approvato per il suo uso in campo alimentare hanno
tuttavia escluso, alle dosi in cui è normalmente assunto,
simili complicanze.
Acesulfame
• Presenta una struttura chimica che in parte ricorda
quella della saccarina.
• Ha un potere edulcorante 200 volte superiore a quello
del saccarosio. Possiede un sapore dolce deciso e netto
che conferisce agli alimenti un retrogusto amaro solo
nel caso venga utilizzato ad alte concentrazioni. Per
ovviare a questo inconveniente è solitamente impiegato
in sinergia con altri edulcoranti intensivi. La
concentrazione massima di impiego varia 2.5 g/kg nella
microconfetteria a 350 mg/L nelle bevande analcoliche
ipocaloriche. Non è metabolizzato dall'organismo e
viene escreto immodificato nelle urine
Ciclammati
• Sono dolcificanti intensivi di sintesi che derivano dai
sali di sodio e di calcio dell’acido ciclamico (acido
cicloesilsulfamico).
• Ha un potere edulcorante 30 volte superiore a quello
del saccarosio, che risulta essere relativamente modesto
a confronto con quello di altri edulcoranti intensivi.
• Vengono usati in associazione con la saccarina per
coprirne il retrogusto amaro.
• L’uso dei ciclammati quali edulcoranti succedanei del
saccarosio è stato limitato negli Stati Uniti e in Gran
Bretagna, in seguito a ricerche condotte in campo
tossicologico in cui sono stati riscontrati effetti
cancerogeni e disturbi di assorbimento in animali da
esperimento. Anche la Comunità europea, tramite il
comitato scientifico sugli alimenti li ha sottoposti a
revisione ed ha deciso di abbassare l’ADI a 7 mg/Kg di
peso corporeo, proponendo inoltre una riduzione
dell’uso di ciclammati sia bandendoli da alcuni prodotti
alimentari,
quali
gomma
da
masticare
e
microconfetteria per rinfrescare l’alito, sia riducendone
la quantità ammissibile nell’edulcorazione di bevande
analcoliche (da 400 a 350 mg/L).