Formicidae
Da Wikipedia, l'enciclopedia libera.
Formicidae LATREILLE, 1809 è una vasta famiglia di insetti
imenotteri, comunemente conosciuti con il nome generico di
formiche.
Le formiche mostrano la massima diversità nelle zone a clima
tropicale, come l'America del Sud, l'Africa e l'Australia orientale
ma hanno molte specie anche nelle regioni temperate del pianeta.
Le formiche, come molti altri imenotteri, sono insetti eusociali.
Nelle loro società, che variano in dimensioni e in organizzazione
a seconda delle specie, vi è una classe riproduttiva - costituita
dalle regine (femmine fertili) e dai maschi - e una lavorativa,
costituita da femmine attere e sterili, dette operaie.
Indice
1 Evoluzione
2 Caratteristiche generali
2.1 Morfologia
2.2 Aspetto fisico
3 La riproduzione
3.1 Volo nuziale
3.2 Determinazione del sesso
3.3 Ciclo vitale
3.4 La riproduzione delle operaie
4 Organizzazione sociale e comportamento
4.1 Comunicazione
4.2 Difesa
4.3 Apprendimento
4.4 Formicai
4.4.1 Il formicaio artificiale
4.5 Raccolta del cibo
4.6 Locomozione
4.7 Cooperazione e competizione
4.8 Determinazione della casta
4.9 Rapporti con altri organismi
4.10 Caratteristiche di alcune specie
4.10.1 Formiche nomadi
4.10.2 Formiche otri
4.10.3 Formiche schiaviste
4.10.4 Formiche oricoltrici
4.10.5 Formiche lomecusomani
4.10.6 Formiche trappola
5 Tassonomia
5.1 Alcune specie
6 Altro sulle formiche
6.1 La lotta alle formiche
Formicidae
Testa di formica al microscopio elettronico
Classificazione scientifica
Dominio Eukaryota
Regno Animalia
Sottoregno Eumetazoa
Superphylum Protostomia
Phylum Arthropoda
Subphylum Tracheata
Superclasse Hexapoda
Classe Insecta
Sottoclasse Pterygota
Coorte Endopterygota
Superordine Oligoneoptera
Sezione Hymenopteroidea
Ordine Hymenoptera
Sottordine Apocrita
Sezione Aculeata
Superfamiglia Vespoidea
Famiglia Formicidae
LATREILLE, 1809
Sottofamiglie
Aenictinae
Aenictogitoninae
6.2 Formiche nella letteratura
6.3 Formiche nel cinema
6.4 Formiche in cucina
7 Note
8 Bibliografia
9 Voci correlate
10 Altri progetti
11 Collegamenti esterni
Evoluzione
Le formiche sono apparse sulla terra tra 140 e 168 milioni di anni
fa, contemporaneamente alle angiosperme, evolvendosi dalle
vespe solitarie.[1]
Finora, il più antico fossile ritrovato testimonia l'esistenza, nel
tardo Cretaceo, di una specie con molte caratteristiche fisiche
vespoidali (occhi composti grandi, scapi ridotti e addome
flessibile), che è stata battezzata Sphecomyrma freyi. Finora si
conoscono circa 5 sottofamiglie estinte. Le specie più antiche
esistenti ancora oggi appartengono ai generi Amblyopone e
Proceratium, sebbene la specie più primitiva, che conserva una
struttura sociale tipica delle prime specie comparse, sia
Prionomyrmex macrops.
Agroecomyrmecinae
Amblyoponinae
Aneuretinae
Cerapachyinae
Dolichoderinae
Dorylinae
Ecitoninae
Ectatomminae
Formicinae
Heteroponerinae
Leptanillinae
Leptanilloidinae
Martialinae
Myrmeciinae
Myrmicinae
Paraponerinae
Ponerinae
Proceratiinae
Pseudomyrmecinae
†Armaniinae
†Brownimeciinae
†Formiciinae
†Sphecomyrminae
Caratteristiche generali
Morfologia
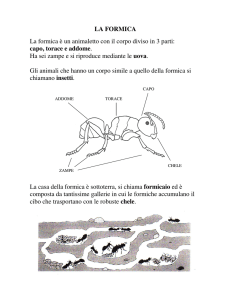
Come gli altri insetti, le formiche hanno il corpo diviso in capo, torace e addome. Hanno sei zampe, apparato
boccale masticatore con robuste mandibole e antenne genicolate. Tra il torace e l'addome le formiche hanno
un restringimento derivato dalla modificazione strutturale dei primi due uriti del gastro, nodulare o
squamiforme, che prendono il nome di peziolo e post-peziolo.
Il colore più tipico delle formiche è nero, ma ve ne sono molte che variano dal rosso all'arancione al giallo e
al verde (Oecophylla smaragdina e Rhytidoponera metallica). Le antenne sono costituite da una parte
basale, costituita dallo scapo e dal pedicello, e una flessibile, detta funicolo, costituita da una serie di
segmenti il cui numero varia a seconda delle specie.
Aspetto fisico
Le operaie delle formiche hanno
dimensioni variabili da 1 a circa
30 mm di Camponotus gigas; di
norma le femmine feconde (le
cosiddette regine) sono più grandi
delle operaie sterili e in alcune
specie possono raggiungere anche i
6 cm (Dorylus wilverthi).
Le operaie hanno un capo grosso e
robusto, mandibole forti ma meno
sviluppate di quelle dei soldati,
occhi piccoli, antenne formate da
undici o dodici segmenti o anche
meno. Dopo i due segmenti del
peduncolo addominale, l'addome si
ingrossa e al suo apice porta
l'aculeo a volte funzionante, mentre
in altri casi è atrofizzato
(Formicinae, Dolichoderinae). Le
operaie e i soldati differiscono
perché i secondi hanno un capo
molto più grosso. La femmina
feconda è più grossa, possiede gli
ocelli e le ali che però cadono dopo
l'accoppiamento. I maschi sono in
genere piccoli, sempre provvisti di
ali e hanno occhi e ocelli molto
sviluppati; il loro torace è più
grande, mentre le tre paia di zampe,
comuni a tutti gli insetti, sono
piccole. In quasi tutte le specie, le
operaie sono prive di ocelli, anche
se le regine e i maschi ne sono
spesso muniti. L'apparato digerente
delle formiche comprende due
espansioni a sacco, dette ingluvie e
ventriglio. Nel primo sacco
vengono accumulate le sostanze
alimentari; di queste, solo una
piccola parte passa nel ventriglio e
viene digerita e assimilata
dall'individuo.
Morfologia di una formica (Pachycondyla verenae):
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
Funicolo
Stelo o scapo
Lobo frontale
Fossa antennale
Clipeo
Mandibole
Pronoto
Occipite
Occhio composto
Scutello
Mesonoto
Spiracolo mesotoracico
Anepisterno
Metanoto
Spiracolo mesotoracico
Propodeo
Spiracolo propodeo
Ghiandola metapleurale
19.
20.
21.
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
Peziolo
Postpeziolo
Tergite
Sternite
Pungiglione
Femore
Tibia
Artiglio tarsale
Sperone tibiale
Tarso
Catepisterno
Coxa
Trocantere
Processo ventrale
Capo
Mesosoma
Peziolo
Gastro
Il resto del cibo contenuto
nell'ingluvie viene rigurgitato e
dato come cibo agli altri
componenti della società. Fra gli
18a. Bolla
organi di senso, il più sviluppato è
18b. Orifizio
l'olfatto che ha la sua sede nelle
antenne e serve alle formiche per
percepire le sensazioni più comuni
e utili alla vita. Gli occhi non danno sensazioni molto precise. Alla base delle mandibole sboccano i condotti
di particolari ghiandole poste nel capo e secernenti una sostanza che, mescolata a legno triturato, forma il
cartone utilizzato da alcune specie per costruire il nido. Nell'ultima porzione dell'addome, sboccano le
ghiandole del veleno contenente acido formico e altre sostanze tossiche o irritanti, oppure, in altre specie,
speciali ghiandole anali secernenti una sostanza odorifera contenente acido butirrico, "iridomirmecina" e
altre particolari sostanze odorose e ripugnanti che sono schizzate lontano per difesa o offesa.
In alcune specie sul peduncolo e all'inizio dell'addome, sono posti gli organi stridulanti che, per sfregamento,
emettono deboli suoni.
La riproduzione
Volo nuziale
In una colonia consolidata da tempo la regina depone annualmente delle uova che genereranno delle
formiche alate, sia maschi che femmine, che sciameranno e formeranno nuovi formicai, i maschi dopo
l'accoppiamento moriranno, mentre le femmine perderanno le ali e deporranno le uova per la formazione
della nuova colonia per tutta la vita.[2]
Determinazione del sesso
Presso le formiche, l'apparato riproduttore è sviluppato in tutti gli individui, anche se, nelle operaie, è
atrofizzato e non consente la riproduzione sessuata. Le formiche, come gli altri imenotteri eusociali sono
caratterizzate da un particolare meccanismo di determinazione del sesso, detto aplodiploidia. Le femmine si
sviluppano a partire da uova fecondate, dette anfigoniche, mentre i maschi nascono da uova non fecondate,
che prendono il nome di partenogeniche. Per regolare la fecondazione delle uova, la regina sfrutta una sacca
particolare posta nella parte posteriore dell'addome, detta spermateca.
Ciclo vitale
Le uova delle formiche sono prive di involucri protettivi. Le larve sono triangolari, spesso prive di arti e
incapaci di compiere movimenti complessi, ma possono contrarsi se minacciate. Le operaie nutrono le larve
rigurgitando nella loro bocca piccole gocce di cibo per mezzo della trofallassi, oppure offrendo loro uova
trofiche. In alcune specie le larve, munite di mandibole, sono in grado di frantumare da sole la membrana
delle uova, mentre in altre sono le stesse operaie che rompono le uova trofiche e le offrono direttamente alle
larve. Dal corpo e, in certe specie, da speciali papille attorno alla bocca delle larve, trasudano liquidi
particolari e sostanze grasse che piacciono assai alle operaie e che queste leccano avidamente. La larva delle
formiche secerne un po' di seta con la quale, quando è matura, si tesse un bozzolo in cui trascorre lo stadio di
pupa. Questo bozzolo, per svilupparsi, deve essere generalmente sotterrato dalle operaie. Le uova, le larve e
le ninfe sono assistite con gran cura dalle operaie, che le trasportano nelle parti più confortevoli del
formicaio a seconda delle necessità del loro sviluppo. La cura della prole costituisce la maggior parte del
lavoro che si svolge nel formicaio. Le regine non lavorano e vivono da quindici a venti anni. Le operaie
vivono da cinque a dieci anni; i maschi, invece, muoiono dopo essersi accoppiati. Le formiche vivono in
società che possono essere formate da poche decine oppure molte centinaia di migliaia di unità, fino a
qualche milione, ma solo in casi eccezionali, cioè in un territorio disabitato da animali di grandi dimensioni
e con una folta vegetazione.
La riproduzione delle operaie
Le operaie presentano organi riproduttori atrofizzati, ma hanno la possibilità di deporre uova partenogeniche,
dette "trofiche". Le uova delle operaie vengono generalmente offerte alle larve come cibo. In alcune specie
(Oecophylla longinoda) le operaie in casi estremi escono dal nido e formano nuove colonie deponendo le
uova trofiche, che si sviluppano per partenogenesi telitoca in femmine. In altre specie (Paraponera clavata),
le società sono formate esclusivamente da operaie, che si riproducono per partenogenesi telitoca. In molte
specie di formiche ponerine, quali per esempio Harpegnathos venator, le operaie, che in questo caso
prendono il nome di gamergati, possono riprodursi anche anfigonicamente.
Organizzazione sociale e comportamento
Le formiche sono, insieme alle api, i più noti fra gli insetti sociali. La loro organizzazione è ben nota e molto
efficiente. La struttura delle colonie e la loro organizzazione sociale può variare da specie a specie.
Comunicazione
Le formiche comunicano tra loro usando i feromoni.[3] Questi segnali
chimici sono più sviluppati nelle formiche che in altri gruppi
dell'ordine dei Hymenoptera. Come altri insetti, le formiche
percepiscono gli odori con le antenne, sottili e mobili. Le antenne
forniscono informazioni sulla direzione e sull'intensità dei profumi.
Poiché vivono per lo più sulla superficie terrestre, usano la superficie
del suolo per lasciare tracce di feromone che possono essere seguite
da altre formiche. Nelle specie che vanno in cerca di cibo in gruppi,
Formiche del genere Oecophylla
il membro che trova del cibo segna un percorso sulla via del ritorno
mentre collaborano nello
alla colonia che viene seguito da altre formiche che, una volta
smembramento di una formica rossa
raggiunto il cibo, fanno ritorno alla colonia in gruppo seguendo lo
stesso percorso e contrassegnandolo con ulteriori segnali chimici.
Quando la fonte di cibo si è esaurita, smettono di contrassegnare il percorso e l'odore si dissipa lentamente.
Questo comportamento consente alle formiche di sopravvivere anche in presenza di notevoli cambiamenti
nel loro ambiente o di ostacoli all'interno del percorso. Per esempio, quando un percorso stabilito per una
fonte di cibo è bloccato da un ostacolo, una delle formiche lo abbandona per esplorare nuove rotte. Se una
formica ha successo, lascia una traccia nuova che segna il percorso più breve anche per il ritorno. I migliori
percorsi sono seguiti da più formiche; questo metodo in maniera graduale fa sì che i gruppi di formiche alla
ricerca di cibo trovino sempre la strada migliore.[4]
Le formiche utilizzano i feromoni anche in altre diverse situazioni. Una formica ferita può emettere un
allarme tramite i feromoni alle formiche nelle vicinanze facendole allontanare dal luogo in cui è stata
attaccata. Altre specie di formiche utilizzano una sorta di "feromoni di propaganda" per confondere le
formiche nemiche e farle combattere tra di loro.[5] I feromoni sono prodotti da una vasta gamma di strutture
anatomiche, comprese le ghiandole di Dufour, le ghiandole velenifere e le ghiandole poste nella parte
posteriore, quelle del pigidio, del retto, dello sterno e delle tibie posteriori.[6]
I feromoni sono anche mescolati al cibo e scambiati tra le formiche tramite il sistema della trofallassi, che
implica un trasferimento di informazioni all'interno della colonia.[7] In questo modo le altre formiche
possono rilevare a quale gruppo di lavoro (ad esempio, quello della ricerca di cibo o quello della
manutenzione della colonia) appartengono gli altri membri.[8] Nella specie di formiche che prevedono
l'esistenza di una formica regina, le formiche operaie cominciano ad allevare nuove regine quando la regina
dominante smette di produrre un feromone specifico.[9]
Alcune formiche producono suoni tramite la stridulazione, utilizzando i segmenti dell'addome e le
mandibole. I suoni possono essere utilizzati per comunicare con i membri della colonia o con membri di
altre specie.[10][11]
Difesa
Le formiche si difendono e attaccano tramite morsi e, in molte specie, tramite punture che possono iniettare
o spruzzare sostanze chimiche come l'acido formico. Le formiche del
genere Paraponera, localizzate nell'America Centrale e Meridionale,
sono considerate tra le specie che dispongono dei pungiglioni più
dolorosi anche se le sue punture non sono mortali per l'uomo. A
questo pungiglione è stata data la valutazione più alta nell'indice di
dolore Schmidt Sting che rileva le varie intensità di dolore causato da
punture di vari insetti dell'ordine Hymenoptera. Il pungiglione della
specie Myrmecia pilosula può essere fatale per l'uomo ed è stato
sviluppato un siero antiveleno.[12] Le formiche del genere Solenopsis,
Una formice del genere Plectroctena
invece, dispongono di una sacca contenente una pozione di alcaloidi
ne attacca un'altra dello stesso genere
di piperidina.[13] Le loro punture sono dolorose e possono essere
per difendere il territorio.
pericolose per le persone ipersensibili alla sostanza.[14]
Le formiche del genere Odontomachus sono dotate di mandibole
dette "a tagliola" (in inglese, trap jaw) che attaccano più velocemente
di qualsiasi altro arto o appendice del regno animale.[15] Uno studio
delle Odontomachus bauri ha rilevato velocità di picco tra i 126 e
230 chilometri all'ora, con lo scatto di chiusura delle mandibole che
dura 130 microsecondi in media. Si è rilevato inoltre che usano le
mascelle come una catapulta per espellere gli intrusi o lanciarsi
all'indietro per sfuggire a una minaccia.[15] Prima del colpo, la
Una formica tessitrice (Oecophylla)
formica apre le sue mandibole al massimo della larghezza e si blocca
nella posizione di combattimento con
in questa posizione grazie un meccanismo interno. L'energia è
le mandibole spalancate.
immagazzinata in una spessa fascia muscolare e rilasciata in maniera
esplosiva quando viene innescata dalla stimolazione sensoriale dei
peli sulla parte interna delle mandibole. La "mandibole trappola" sono state rilevate nei seguenti generi:
Anochetus, Orectognathus e Strumigenys[15] oltre ad alcuni membri del genere Daceton armigerum[16]. Le
mandibole vengono anche utilizzate per altri compiti. Una specie di formica malese del genere Camponotus
ha sviluppato ghiandole mandibolari che si estendono fino all'addome. Quando le formiche operaie di questo
genere vengono disturbate, provocano la rottura della membrana dell'addome emettendo uno scoppio di
secrezioni contenenti acetofenoni e altre sostanze chimiche che immobilizzano gli aggressori. Ciò provoca
anche la morte della formica.[17] Altri tipi di difese suicide sono stati rilevati in un genere di formica
brasiliana, Forelius pusillus, in un piccolo gruppo di formiche, ogni sera, lascia l'interno della colonia
sigillando l'ingresso dall'esterno ed andando incontro ad una morte sicura.[18]
Oltre alla difesa contro i predatori, le formiche hanno necessità di
proteggere le loro colonie dagli agenti patogeni. Alcune formiche
operaie mantengono l'igiene della colonia e svolgono tutte le attività
inerenti tra cui la necroforesi, la rimozione dalla colonia dei membri
morti.[19] L'acido oleico è stato identificato come il composto
rilasciato dalle formiche morte che innesca il comportamento
necroforico nelle formiche della specie Atta mexicana[20] mentre le
formiche operaie del genere Linepithema humile reagiscono al
mancato rilascio di sostanze chimiche presenti sulla cuticola dei
membri ancora in vita.[21]
Formiche costruiscono un tumulo
sopra l'entrata della colonia per
prevenire l'entrata della pioggia.
I formicai possono essere protetti da minacce come le inondazioni e il surriscaldamento con elaborate
architetture.[22][23] Le operaie della specie Cataulacus muticus, una specie che vive nelle cavità degli alberi,
combatte eventuali inondazioni all'interno del nido bevendo l'acqua ed espellendola all'esterno.[24] Le
formiche del genere Camponotus anderseni, che nidificano nelle cavità del legno nella mangrovia,
combattono le immersioni in acqua passando alla respirazione anaerobica.[25]
Apprendimento
Molti animali possono imparare i comportamenti per imitazione ma le formiche sono l'unico gruppo, ad
eccezione dei mammiferi, in cui è stato rilevato un tipo di apprendimento interattivo per quanto riguarda la
raccolta di cibo. Un raccoglitore esperto del genere Temnothorax albipennis può condurre altri membri della
colonia alla scoperta di nuovo cibo tramite una modalità denominata "tandem running": la formica meno
esperta segue un "tutor" ed ottiene informazioni sul percorso e sul cibo da raccogliere. In questo processo il
leader si mostra molto sensibile ai progressi dell'apprendista rallentando quando questi resta indietro.[26]
Altri esperimenti hanno mostrato che alcuni membri della specie Cerapachys biroi possono essere collocati
in ruoli diversi all'interno della colonia in base alla loro esperienza precedente. Una intera generazione di
membri addetti alla caccia e alla raccolta del cibo viene divisa in due gruppi. A uno dei gruppi viene sempre
permesso di trovare del cibo mentre si fa in modo che l'altro subisca sempre degli insuccessi. In questo
modo il primo gruppo continua nella ricerca di cibo, intensificando anche gli sforzi, mentre l'altro si
specializza in un altro ruolo, la cura della covata.[27]
Formicai
Molti generi di formiche costruiscono formicai complessi mentre
altri sono nomadi e non costruiscono strutture permanenti. Le
formiche possono costruire formicai sotterranei o su alberi (quelli su
alberi sono molto rari). Queste colonie possono essere trovate nel
terreno, sotto le pietre o ceppi, o dentro i tronchi o all'esterno di essi.
I materiali utilizzati per la costruzione comprendono terreno e
materie vegetali[28]. Le formiche selezionano con attenzione i
materiali dei siti di nidificazione; le Temnothorax albipennis evitano
posti in cui ci sono formiche morte, in quanto queste possono
indicare la presenza di parassiti o malattie per loro fatali. Tutti i
gruppi sono pronti ad abbandonare le colonie al primo segno di
minaccia.[29]
Nidi di foglie di formiche tessitrici,
Filippine
Le formiche guerriere del Sud America e la formiche scacciatrici africane non costruiscono formicai
permanenti, ma invece si alternano tra nomadismo e fasi in cui le operaie formano una tana temporanea
(bivacco) con il proprio corpo, tenendosi l'un l'altra insieme.[30]
Le operaie del genere Oecophylla costruiscono i nidi sugli alberi attaccando insieme le foglie prima
ammucchiandole insieme con il lavoro di file di operaie e poi inducendo le larve alla produzione di seta.
Forme analoghe di costruzione si vedono in alcune specie di Polyrhachis.[31]
Il formicaio artificiale
Attorno alla vita delle formiche, soprattutto di quelle viventi nei climi temperati, si sanno molte cose;
tuttavia, moltissime restano ancora da scoprire, in particolar modo
per quello che riguarda le formiche dei climi tropicali. Per studiare i
comportamenti di questi insetti, non basta osservare ciò che si vede
in natura; è necessario ricorrere all'allevamento in laboratorio, in nidi
artificiali, con pareti di vetro, che consentano di vedere come si
svolge la vita all'interno del formicaio. Un formicaio artificiale è
diviso in diversi ambienti o camere e deve essere mantenuto in
condizioni di temperatura, luce, umidità simili a quelle naturali[32].
Al suo esterno le formiche si muovono alla ricerca dell'alimento e
depositano i materiali di rifiuto; inoltre, deve essere isolato, per
esempio con un opportuno fossatello ripieno d'acqua, per impedire
alle formiche di fuggire. Mediante questi formicai artificiali, gli
entomologi hanno potuto scoprire molti aspetti della vita segreta
Un formicaio artificiale
delle formiche e conoscere i rapporti intercorrenti fra i vari membri
della società e fra questi e gli animali, amici o nemici, che popolano
il mondo esterno.
Raccolta del cibo
La maggior parte delle formiche sono predatrici generaliste,
saprofaghe e/o erbivore[33] ma alcune hanno sviluppato metodi
speciali per l'approvvigionamento del cibo. Le formiche tagliafoglie
(Atta e Acromyrmex) si nutrono esclusivamente di un fungo che
cresce solo nelle loro colonie. Raccolgono di continuo foglie che
portano alla colonia, tagliano in pezzi sottili e pongono in speciali
aree in cui crescono poi i funghi. Le operaie sono specializzate in
compiti in base alle loro dimensioni. Le formiche più grandi sono
impiegate nel taglio dello stelo, quelle più piccole masticano le foglie
mentre quelle più piccole ancora si prendono cura dei funghi. Queste
Myrmecocystus impegnate nella
formiche sono molto sensibili alle varie reazioni del fungo a
raccolta del cibo.
materiali vegetali diversi e sembra che possano addirittura rilevare
segnali chimici. Se un particolare tipo di foglia è tossico per il fungo
non sarà più raccolto. Inoltre, batteri speciali sulla superficie esterna del loro corpo producono speciali
antibiotici che uccidono i batteri che possono danneggiare i funghi.[34]
La raccolta del cibo può condurre le formiche anche fino a 200 metri di distanza dalla colonia;[35] di solito
trovano la via del ritorno quasi sempre grazie alle tracce olfattive. Alcune specie di formiche sono impegnate
in tale attività anche di notte. Queste tipi di formiche vivono in zone calde e aride del mondo e la raccolta di
cibo diurna può rivelarsi fatale causa essiccazione, per cui le uscite notturne o la capacità di trovare il
percorso più breve riduce tale rischio. Le formiche del deserto (Cataglyphis fortis) utilizzano punti di
riferimento visivi in combinazione con altri metodi per orientarsi.[36] In assenza di punti di riferimento visivi,
la formica del deserto del Sahara si orienta tenendo traccia delle direzioni tramite un sistema di contapassi
interno,[37][38] integrando queste informazioni insieme ad altre di tipo visivo per trovare il percorso più breve
per il ritorno alla colonia.[39]
Alcune specie di formiche sono in grado di utilizzare il campo magnetico della Terra.[40] Gli occhi hanno
sviluppato cellule specializzate che rilevano la luce polarizzata dal Sole, che viene utilizzato per determinare
la direzione.[41][42] Questi rivelatori sono sensibili alla polarizzazione nella regione ultravioletta dello spettro
visibile.[43] In altre specie di formiche, un gruppo di raccoglitori può perdere la traccia olfattiva e separarsi
dalla colonna principale: in questi casi formano una colonna circolare continuamente in marcia che può
portarle alla morte per sfinimento.[44]
Locomozione
Le formiche operaie non hanno le ali e le femmine riproduttive perdono le ali dopo il volo di accoppiamento
al fine di iniziare la loro colonie. Pertanto, a differenza dei loro antenati, le vespe, la maggior parte delle
formiche viaggiano a piedi. Alcune specie sono in grado di saltare. Per esempio, le formiche della specie
Harpegnathos saltator sono in grado di saltare sincronizzando l'azione delle zampe centrali e posteriori.[45]
Ci sono altre specie di formiche semi-volanti, dotate di piccole ali, come quelle della specie Cephalotes
atratus, che sono in grado di controllare o rallentare la direzione della discesa durante un salto o una caduta.
[46]
Alcune specie di formiche inoltre sono particolarmente altruiste per il bene della comunità: durante gli
spostamenti e le ricerche di cibo, infatti, alcuni esemplari riempiono le voragini che incontrano durante il
tragitto con il loro corpo, facendo passare sopra di loro le altre. Questa "riparazione istantanea" del percorso
permette loro di procurare più cibo in minor tempo.[47] Alcune specie formano anche zattere galleggianti per
sopravvivere alle inondazioni. La formazione di queste zattere ha reso anche possibile ad alcune specie di
formiche la colonizzazione di isole.[48] Le Polyrhachis sokolova, una specie di formiche che si trova in
Australia nelle paludi di mangrovia, possono nuotare e vivere in colonie sott'acqua. Poiché non dispongono
di branchie, respirano in sacche di aria intrappolate nei formicai.[49]
Cooperazione e competizione
Non tutte le formiche hanno lo stesso
tipo di società. Le formiche bulldog
australiane sono tra le specie più
grandi e aggressive. Come quasi tutte
le formiche sono eusociali ma il loro
comportamento sociale è poco
sviluppato rispetto ad altre specie.
Ogni individuo caccia da solo,
usando i suoi grandi occhi invece
Le formiche onnivore della specie
delle capacità chimico-olfattive per
Iridomyrmex purpureus che si nutrono
[50]
scovare
le
prede.
Alcune
specie
di una cicala. Le formiche sono
Una formica saltatrice
(come
la
Tetramorium
caespitum)
animali sociali che collaborano alla
operaia Harpegnathos
attaccano
colonie
di
formiche
caccia e alla ricerca del cibo.
saltator, impegnata in una
confinanti.
Altre
sono
meno
battaglia con la regina di una
espansioniste ma altrettanto
colonia rivale.
aggressive: invadono colonie per rubare le uova o le larve, di cui si nutrono
oppure riutilizzano le operaie come schiave. Alcune specie di queste
formiche, come quelle amazzoniche, sono incapaci di procacciarsi il cibo da sole e hanno bisogno di operaie
precedentemente catturate per sopravvivere.[51]
Le formiche identificano membri della stessa famiglia o colonia attraverso il loro odore, che proviene da
secrezioni che impregnano i loro esoscheletri. Se una formica viene separata dalla sua colonia originale,
finirà per perderne l'odore caratteristico. Ogni formica che entra in una colonia, senza l'odore che le
corrisponde, finirà per essere attaccata.[52]
Alcune specie di formiche parassite si introducono nelle colonie di altre specie e si stabiliscono all'interno di
esse come parassiti sociali; le specie come Strumigenys xenos sono interamente parassite e non hanno
operaie, ma fanno affidamento sul cibo raccolto dagli ospitanti della specie Strumigenys perplexa.[53][54]
Questa forma di parassitismo è stato rilevato in molti altri generi di formiche e la formica parassita è di
solito una specie che è strettamente legata a quella ospitante. Una varietà di metodi sono impiegati per
entrare nella colonia delle formiche ospitanti. Una regina parassita può entrare nella colonia ospite prima che
la prima nidiata si sia schiusa, stabilendosi prima dello sviluppo dell'odore caratteristico della colonia stessa.
Altre specie usano i feromoni per confondere le formiche ospitanti o per ingannarle costringendole a portare
la regina parassita nella colonia. Altre si aprono semplicemente la strada.[55]
Un conflitto tra i sessi (coevoluzione antagonista) è stato rilevato in alcune specie di formiche in cui i
membri della colonia sembrano apparentemente in competizione tra loro per produrre la prole. La forma più
estrema comporta la produzione di discendenza clonale. Un conflitto sessuale estremo è stato rilevato nella
specie Wasmannia auropunctata in cui le regine producono figlie diploidi per partenogenesi telitoca mentre i
maschi producono cloni attraverso un processo in cui un uovo diploide perde il suo contributo materno nella
produzione di maschi aploidi che sono in tutto cloni del padre.[56]
Determinazione della casta
Presso le formiche si riscontrano varie forme di determinazione della casta. Nella stragrande maggioranza
delle specie, le operaie si sviluppano a partire da uova anfigoniche su cui la regina secerne un particolare
feromone, che inibisce lo sviluppo degli organi riproduttori. In alcune specie del genere Hypoponera,
invece, si ha una determinazione della casta basata sull'alimentazione: le larve che vengono alimentate con
maggiori quantità di cibo divengono regine, mentre quelle alimentate scarsamente divengono operaie. La
neotenina svolge un ruolo di centrale importanza, presso molte specie di formiche, nella determinazione
della casta operaia: un maggior livello di neotenina consente lo sviluppo di operaie sempre più grandi.
Rapporti con altri organismi
Le formiche scambiano rapporti simbiotici con una serie di specie,
incluse specie di formiche diverse tra loro, altri insetti, piante e
funghi. Sono predati da molti animali e anche da alcuni funghi.
Alcune specie di artropodi trascorrono parte della loro vita all'interno
di nidi di formiche, o predano le formiche, le loro larve e uova,
consumando le scorte alimentari delle colonie. Questi inquilini
possono avere una stretta somiglianza con le formiche. La natura di
questo tipo di mimetismo (mirmecomorfismo) varia, con alcuni casi
di mimetismo batesiano, in cui il processo di mimetismo riduce il
rischio di predazione. Altri mostrano un mimetismo di tipo
wasmaniano (termine derivante dal nome dell'entomologo Erich
Wasmann), una forma di mimetismo visto solo negli inquilini.[57][58]
Una formica raccoglie melata da un
afide.
Afidi ed altri insetti dell'ordine degli Hemiptera secernono un liquido dolce chiamato melata quando si
nutrono di linfa vegetale. Gli zuccheri nella melata sono una notevole fonte di energia che molte specie di
formiche raccolgono.[59] In alcuni casi gli afidi secernono la melata in risposta alle formiche quando queste
toccano le loro antenne. Le formiche a loro volta, tengono lontano i predatori e spostano gli afidi in un luogo
più sicuro. Quando le colonie si spostano in una nuova area portano gli afidi con loro per garantirsi una
fornitura continua di melata. Le formiche allevano anche cocciniglie per raccogliere la loro melata.[60] o
bruchi mirmecofili della famiglia dei Lycaenidae. I bruchi posseggono una ghiandola che secerne melata
quando le formiche li massaggiano. Alcuni bruchi producono vibrazioni e suoni che vengono percepiti dalle
formiche.[61] Altri bruchi si sono evoluti: questi bruchi mirmecofaghi secernono un feromone che fa credere
alle formiche di essere delle larve appartenenti alla loro colonia. Una volta portati poi all'interno del
formicaio si nutrono essi stessi delle larve di formiche che vi trovano.[62]
Le formiche della tribù Attini, incluse le formiche tagliatrici di foglie,
coltivano alcune specie di funghi dei generi Leucoagaricus o
Leucocoprinus della famiglia Agaricaceae. In questo mutualismo
fungo-formica, entrambe le specie dipendono l'uno dall'altro per la
sopravvivenza. La formica Allomerus decemarticulatus si è evoluta
in una modalità a tre insieme alla pianta ospitante Hirtella
physophora (Chrysobalanaceae) e a un tipo di fungo appiccicoso che
viene utilizzato per intrappolare gli insetti prede.[63]
Le formiche della specie Myrmelachista schumanni sono
Il ragno Myrmarachne plataleoides
responsabili, nella foresta amazzonica, dei giardini del diavolo
imita formiche tessitrici per evitare i
uccidendo le piante a loro non gradite e favorendo la crescita di
predatori.
alberi del genere Duroia hirsuta processo che crea una singolare
zona nella foresta pluviale in cui sono presenti solo tali alberi.[64][65]
Questo processo di modifica della vegetazione permette loro di avere
più siti possibili, all'interno del tronco di tale tipo di alberi, dove
costrutire formicai più adatti. Alcuni alberi secernono un nettare
speciale utilizzato come fonte di cibo dalle formiche che a loro volta
proteggono la pianta dagli insetti erbivori.[66] Alcune specie di alberi
come l'Acacia cornigera, in America centrale, hanno le cavità
utilizzate da una particolare specie di formiche (Pseudomyrmex
ferrugineus) per la creazione di colonie; in cambio esse difendono
l'albero dagli insetti fitofagi e dalle piante epifite. Altri studi
Una relazione simbiotica tra una
suggeriscono anche che le piante ottengano azoto dalle formiche. In
formica e un dente di leone. Il dente
cambio, le formiche si riforniscono di proteine e di lipidi dalla
di leone fornisce nettare alle formiche
pianta. Un altro esempio di questo tipo di ectosimbiosi viene dagli
mentre queste ne permettono
alberi di Macaranga, che hanno fusti adatti ad ospitare colonie di
l'impollinazione.
formiche del genere Crematogaster. Infine, molte specie di alberi
producono semi che sono poi dispersi dalle formiche.[67] La
dispersione dei semi da parte delle formiche, o mirmecocoria, è molto diffusa e nuove stime suggeriscono
che circa il 9% di tutte le specie di piante possono servirsi di formiche per la disseminazione.[68][69] Alcune
piante in ambienti particolari sono fortemente dipendenti dalle formiche per la loro sopravvivenza e per la
loro diffusione, dato che i semi vengono trasportati in sicurezza sotto il terreno. Molti semi dispersi dalle
formiche hanno particolari strutture esterne, gli oleosomi, che sono ricercati dalle formiche perché fonte di
cibo.[70] Una convergenza evolutiva, forse una forma di mimetismo, è stato rilevato nelle uova dei fasmidi:
hanno una struttura simile agli oleosomi e per questo motivo vengono trasportati dalle formiche nel
formicaio dove, una volta giunti, possono cominciare a schiudersi.[71]
La maggior parte delle formiche è predatrice ed ottiene cibo da altri insetti sociali, comprese altre formiche.
Alcune specie si specializzano nella predazione delle termiti (Megaponera e Termitopone) mentre alcune
specie della famiglia Cerapachyinae predano altre formiche.[35] Alcuni termiti, tra cui le Nasutitermes
corniger, formano associazioni con alcune specie di formiche per tenere lontano altre specie di formiche
predatori.[72] La vespa tropicale Mischocyttarus drewseni ricopre parte del suo nido con un repellente
chimico anti-formica.[73] Le api senza pungiglione (Trigona e Melipona) utilizzano difese chimiche contro le
formiche.
Iridomyrmex purpureus allevano una
cicalina.
Le mosche del genere
Bengalia (Calliphoridae)
cacciano le formiche e sono
cleptoparassiti: strappano via
le prede o il cibo dalle
mandibole delle formiche.[74]
Le femmine di foridi malesi
(Vestigipoda
I ragni talvolta si cibano di formiche.
myrmolarvoidea) vivono
all'interno delle colonie delle
Aenictus e vengono accudite dalle stesse formiche.[74]
Funghi dei generi Cordyceps e Ophiocordyceps infettano le formiche quando queste si arrampicano su di
esso e affondano le mandibile nei tessuti vegetali. Il fungo uccide le formiche, cresce sopra i loro resti e
produce un carpoforo. Sembra inoltre che il fungo alteri il comportamento delle formiche per contribuire a
disperdere le sue spore[75] in un microhabitat che meglio si adatta al fungo.[76] Anche i parassiti strepsitteri
manipolano la loro formica ospite costringendola ad arrampicarsi sugli steli d'erba, per aiutare il parassita a
trovare compagni.[77] Un nematode (Myrmeconema neotropicum) che infetta le formiche del genere
Cephalotes installandosi nel loro addome fa sì che il colore nero di questi diventi rosso. Il parassita altera
anche il comportamento della formica, costringendole ad alzare l'addome rendendolo più visibile. Il colore
rosso inganna gli uccelli che le scambiano per frutti maturi e le mangiano. Gli escrementi degli uccelli
vengono poi raccolti da altre formiche e dati come cibo ai piccoli, il che porta alla ulteriore diffusione del
nematode.[78]
Le rane sudamericane della famiglia Dendrobatidae si nutrono soprattutto di formiche, e le tossine presenti
nel loro strato cutaneo possono essere originate proprio dalle formiche ingerite.[79]
Il rapporto tra molte specie di uccelli e altre di formiche non è ancora ben compreso ed è ancora in fase di
studio. Un particolare comportamento da parte degli uccelli viene denominato "anting": alcuni di essi
riposano all'interno dei formicai o raccolgono le formiche innestandole nelle loro ali e all'interno delle piume
in modo che possano rimuovere gli ectoparassiti.
Infine formichieri, pangolini e diverse specie di marsupiali in Australia si sono adattati in maniera
particolare ad una dieta fatta quasi esclusivamente di formiche. Questi animali hanno lingue lunghe e
appiccicose per catturare le formiche e forti artigli per rompere i formicai. Anche gli orsi bruni si nutrono di
formiche: una percentuale del 12%, del 16% e del 4% del loro volume fecale in primavera, estate e autunno,
rispettivamente, si compone di formiche.[80]
Caratteristiche di alcune specie
Fra le tante specie alcune presentano caratteristiche curiose e interessanti. Per esempio, le formiche del
genere Messor, specializzate nella raccolta e immagazzinamento di semi, e le formiche del genere Atta, le
famigerate tagliafoglie, diffuse in Sud America, coltivatrici di un fungo particolare, di cui si nutrono. La
colonia di Atta è rigidamente divisa in caste, ognuna specializzata in un compito preciso: dalle operaie
minori, di pochi millimetri, che si occupano della coltivazione del fungo, alle operaie maggiori, che si
dedicano al trasporto e taglio delle foglie, ai soldati incaricati della difesa del nido, con la testa larga anche
6 mm.
Un nido di Atta può contenere milioni di individui e in una sola notte è in grado di spogliare un grande
albero di tutte le sue foglie. Il fogliame, sminuzzato e masticato dalle operaie minori, serve da lettiera per la
coltivazione del micelio fungino, che costituirà l'alimento base della colonia. L'impatto ambientale di tali
colonie fa di Atta sexdens e Atta cephalotes gli insetti più dannosi dell'America meridionale, capaci di
distruggere raccolti per miliardi di dollari. Normalmente le formiche sono considerate insetti tranquilli, ma
ve ne sono anche di molto aggressive. Per esempio, le formiche del genere Eciton, o formiche legionarie,
che vivono in Amazzonia, le quali si riuniscono in enormi eserciti che marciano attraverso la foresta
catturando ogni genere di insetti e razziando ogni cosa sul loro cammino. Le formiche più grandi e
pericolose sono probabilmente quelle cosiddette Bulldog del genere Myrmecia, che vivono in Australia.
Aggressivi ed enormi, questi insetti possono raggiungere anche i 2,5
centimetri di lunghezza. Ve ne sono anche di velenose, alcune
raccoglitrici di funghi. Infine alcune specie di formiche ospitano e
proteggono delle specie di afidi anziché predarli in cambio di una
loro secrezione zuccherina, la melata.
Questo è un esempio molto particolare di simbiosi tra due insetti, che
curiosamente ricorda molto il rapporto tra l'uomo e gli animali
domestici.
Formiche che "allevano" afidi
In Europa la specie più diffusa è probabilmente la formica rossa, che
è considerata specie protetta in molte zone in quanto con la sua
azione rimuove milioni di carcasse di insetti e rende fertile il terreno.
Di tutte le specie solo una trentina sono diffuse in tutto il mondo. Circa 4500 specie vivono nelle regioni
tropicali ed equatoriali; ottocentocinquanta specie popolano il bacino del Mediterraneo e altre ottocento
specie sono proprie delle regioni temperate e fredde.
Le formiche più grosse vivono nei paesi caldi e sono predatrici e carnivore; appartengono alla sottofamiglia
delle Ponerine. Fra le Mirmicine si annovera la maggior parte delle specie presenti in Europa. Alle
Dolicoderine appartengono la Linepithema humile o formica argentina e varie specie di Tapinoma frequenti
nei nostri giardini. Alla sottofamiglia delle Formicine, appartengono le specie più evolute; sono diffuse
anche nei paesi temperati e freddi. Si annoverano i generi Camponotus, Myrmecocystus e Formica.
Formiche nomadi
Le colonie di alcune specie di formiche non realizzano un nido permanente e si spostano continuamente in
cerca di cibo, alternando fasi di migrazione con fasi sedentarie. Durante queste ultime, la colonia costruisce
un nido temporaneo, in cui la regina depone le uova. Una volta che le uova deposte si sono sviluppate in
esemplari adulti, la colonia abbandona il nido e rientra in una fase di migrazione, durante la quale si sposta
continuamente. Nella migrazione, la regina viene costantemente protetta dalle operaie, mentre queste ultime
si dispongono in colonne rettilinee e predano i piccoli animali che trovano sul percorso. Le colonne si
formano grazie alle tracce di feromoni rilasciate dalle operaie in prima fila durante il percorso.
Fra le specie nomadi, si ricordano in particolare i generi Dorylus, Aenictus, Labidus ed Eciton, note per la
loro aggressività e le loro abitudini caratteristiche. Poi, specie nomadi secondarie sono alcune di quelle
appartenenti ai generi:
Leptogenys (Ponerinae)
Pheidologeton (Myrmicinae)
Onychomyrmex (Amblyoponinae)
Leptanilla, Protanilla (Leptanillinae)
Leptanilloides (Leptanilloidinae)
Cheliomyrmex, Neivamyrmex, Labidus, Nomamyrmex (Ecitoninae)
Simopelta (Ponerinae)
Formiche otri
Le operaie di molte specie della sottofamiglia Formicinae hanno la possibilità di riempire l'addome con
sostanze liquide, che poi distribuiscono alle compagne per trofallassi. In particolare, presso le colonie del
genere Myrmecocystus, alcune operaie specializzate si riempiono l'addome di sostanze liquide e si
appendono al soffitto del nido, distribuendo via via le sostanze contenute all'interno del loro addome alle
compagne. Fra le formiche che presentano un addome estensibile, ci sono anche le specie del genere Lasius.
Formiche schiaviste
Il fenomeno della dulosi, o parassitismo sociale, è comune nelle specie del genere Polyergus e in alcune di
quelle appartenenti ai generi Lasius, Aphaenogaster e Formica. Nelle colonie di queste specie, le operaie
usano invadere i nidi di colonie limitrofe, spesso appartenenti a specie particolari, per rubare le larve e
trasportarle al proprio nido. Queste poi vengono allevate ed entrano a far parte della colonia come operaie
schiavizzate, dando così vita a una società eterogenea. Una volta acquistato l'odore della colonia schiavista,
le operaie schiavizzate le rimangono "fedeli".
Fra le specie di formiche che compiono la dulosi, si distinguono schiaviste obbligate (che non possono
nutrirsi da sole e devono ricorrere alle operaie di altre specie), e schiaviste facoltative (che compiono il
parassitismo sociale solamente per incrementare la popolazione delle operaie nella propria colonia). Un
esempio - l'unico - di formiche schiaviste obbligate sono le specie appartenenti al genere Polyergus.
Le femmine alate di una specie schiavista obbligata formano nuove colonie introducendosi nei nidi di altre
specie e uccidendo la regina. Poi, le femmine prendono il suo posto e assumono il suo odore cospargendosi
con le sue membra, in modo da non essere riconosciute dalle operaie come intruse. Esse cominciano così a
deporre le uova, e a sostituire la popolazione operaia della vecchia colonia con gli esemplari della propria
specie. Questo metodo, definito comunemente "usurpazione", viene utilizzato anche da alcune specie dei
generi Myrmecia e Bothriomyrmex.
Formiche oricoltrici
Alcune specie di formiche usano coltivare il micelio di un fungo all'interno del nido, che concimano con
residui vegetali o pezzi di foglie tagliati, a scopi alimentari. Esse coltivano particolari specie di funghi
Basidiomiceti, che proteggono dai parassiti e bagnano continuamente con la saliva. Le operaie non fanno
sviluppare, dal micelio del fungo, corpi fruttiferi, poiché esse si nutrono solamente delle ife. Per evitare la
formazione di corpi fruttiferi, le operaie legano le ife a formare delle sacche.
Le femmine alate, prima di sciamare all'esterno del nido, prelevano una parte del micelio e lo trasportano fra
le mandibole durante la sciamatura. Poi, esse, una volta scavata una tana, lo depositano e cominciano a
deporre le uova. Le prime operaie della nuova colonia cominciano in seguito a concimare il fungo, formando
così una coltivazione. Fra le specie oricoltrici, si ricordano quelle appartenenti ai generi Atta e Acromyrmex.
Formiche lomecusomani
Le specie appartenenti ai generi Myrmica e Formica vengono parassitate da un coleottero, la Lomechusa,
che penetra nelle colonie e offre alle formiche operaie una sostanza dolce dai tricomi, dei peluzzi posti sulla
parte inferiore delle elitre (ali anteriori, che nei Coleotteri proteggono l'addome). La sostanza offerta dalla
Lomechusa alle formiche operaie funge da "droga" di cui le formiche
non possono più fare a meno, e che le rende vulnerabili. Una volta
drogate, le operaie della colonia parassitata ospitano la Lomechusa
nel nido e smettono di curare la prole. Così, la Lomechusa si nutre
delle larve senza reazioni da parte delle formiche operaie. Le colonie
parassitate dalla Lomechusa rimangono costituite dalle formiche
operaie drogate, le quali muoiono dopo poco tempo lasciando il nido
vuoto. Le specie parassitate dalla Lomechusa vengono comunemente
dette formiche "lomecusomani".
Formiche trappola
Alcune specie di formiche, distribuite nelle sottofamiglie Ponerinae e
Formica tagliafoglie della specie Atta
Myrmicinae, predano piccoli artropodi utilizzando le mandibole
columbica, che trasporta al nido un
come trappole che scattano velocemente al passaggio della preda. Le
pezzo di foglia tagliata.
operaie di queste specie, dette comunemente "formiche trappola", si
appostano per lunghi periodi di tempo aspettando l'arrivo della preda.
Quando quest'ultima tocca i peli sensoriali delle mandibole, queste scattano in poche frazioni di secondo,
catturando la preda. Le specie di formiche trappola più note appartengono ai seguenti generi:
Anochetus (Ponerinae)
Acanthognathus (Myrmicinae)
Daceton (Myrmicinae)
Orectognathus (Myrmicinae)
Microdaceton (Myrmicinae)
Strumigenys (Myrmicinae)
Odontomachus (Ponerinae) - organismi viventi più veloci finora conosciuti, possono chiudere le
mandibole in appena 0,3 millisecondi.[81]
Tassonomia
Esistono oltre 12.000 specie di formiche, classificate in circa 300 generi e 25 sottofamiglie.[82]
Sottofamiglia Aenictinae
Aenictus SHUCKARD, 1840
Sottofamiglia Aenictogitoninae
Aenictogiton EMERY, 1901
Sottofamiglia Agroecomyrmecinae
† Agroecomyrmex W.M. WHEELER, 1910
Tatuidris BROWN & KEMPF, 1968
Sottofamiglia Amblyoponinae
Adetomyrma WARD, 1994
Amblyopone ERICHSON, 1842
Apomyrma BROWN, GOTWALD & LÉVIEUX, 1971
Aenictogiton sp.
(Aenictogitoninae)
Bannapone XU, 2000
Concoctio BROWN, 1974
Myopopone ROGER, 1861
Mystrium ROGER, 1862
Onychomyrmex EMERY, 1895
Opamyrma YAMANE, BUI & EGUCHI, 2008
Paraprionopelta KUSNEZOV, 1955
Prionopelta MAYR, 1866
Sottofamiglia Aneuretinae
† Aneuretellus DLUSSKY, 1988
Aneuretus EMERY, 1893
† Burmomyrma DLUSSKY, 1996
† Cananeuretus ENGEL & GRIMALDI, 2005
† Mianeuretus CARPENTER, 1930
† Paraneuretus WHEELER, 1912
† Pityomyrmex WHEELER, 1915
† Protaneuretus WHEELER, 1915
Adetomyrma venatrix
(Amblyoponinae)
† Sottofamiglia Armaniinae
Archaeopone DLUSSKY, 1975
Armania DLUSSKY, 1983
Dolichomyrma DLUSSKY, 1975
Khetania DLUSSKY, 1999
Orapia DLUSSKY, BROTHERS & RASNITSYN, 2004
Poneropterus DLUSSKY, 1983
Pseudarmania DLUSSKY, 1983
† Sottofamiglia Brownimeciinae
Dolichoderus bispinosus
(Dolichoderinae)
Brownimecia GRIMALDI, AGOSTI & CARPENTER, 1997
Sottofamiglia Cerapachyinae
Acanthostichus MAYR, 1887
Cerapachys F. SMITH, 1857
Cylindromyrmex MAYR, 1870
† Procerapachys W.M. WHEELER, 1915
Simopone FOREL, 1891
Sphinctomyrmex MAYR, 1866
Sottofamiglia Dolichoderinae
Anillidris SANTSCHI, 1936
Anonychomyrma DONISTHORPE, 1947
Aptinoma FISHER, 2009
Arnoldius DUBOVIKOV, 2005
Dorylus emeryi
(Dorylinae)
Axinidris WEBER, 1941
Azteca FOREL, 1878
Bothriomyrmex EMERY, 1869
Chronoxenus SANTSCHI, 1919
Doleromyrma FOREL, 1907
Dolichoderus LUND, 1831
Dorymyrmex MAYR, 1866
Ecphorella FOREL, 1909
Forelius EMERY, 1888
Froggattella FOREL, 1902
Gracilidris WILD & CUEZZO, 2006
Iridomyrmex MAYR, 1862
Leptomyrmex MAYR, 1862
Linepithema MAYR, 1866
Liometopum MAYR, 1861
Loweriella SHATTUCK, 1992
Nebothriomyrmex DUBOVIKOV, 2004
Ochetellus SHATTUCK, 1992
Papyrius SHATTUCK, 1992
Philidris SHATTUCK, 1992
Ravavy FISHER, 2009
Tapinoma FOERSTER, 1850
Technomyrmex MAYR, 1872
Turneria FOREL, 1895
Camponotus ligniperda
(Formicinae)
Sottofamiglia Dorylinae
Dorylus FABRICIUS, 1793
Sottofamiglia Ecitoninae
Formica rufa
(Formicinae)
Cheliomyrmex MAYR, 1870
Eciton LATREILLE, 1804
Labidus JURINE, 1807
Neivamyrmex BORGMEIER, 1940
Nomamyrmex BORGMEIER, 1936
Sottofamiglia Ectatomminae
Ectatomma F. SMITH, 1858
Gnamptogenys ROGER, 1863
Rhytidoponera MAYR, 1862
Typhlomyrmex MAYR, 1862
† Sottofamiglia Formiciinae
† Formicium
† Titanomyrma ARCHIBALD ET AL. 2011
Sottofamiglia Formicinae
Heteroponera panamensis
(Heteroponerinae)
Myrmecia brevinoda
(Myrmeciinae)
Acropyga ROGER, 1862
Agraulomyrmex PRINS, 1983
Alloformica DLUSSKY, 1969
Anoplolepis SANTSCHI, 1914
Aphomomyrmex EMERY, 1899
Bajcaridris AGOSTI, 1994
Brachymyrmex MAYR, 1868
Bregmatomyrma W.M. WHEELER, 1929
Calomyrmex EMERY, 1895
Camponotites DLUSSKY, 1981
Camponotus MAYR, 1861
Cataglyphis FOERSTER, 1850
Cladomyrma W.M. WHEELER, 1920
Drymomyrmex W.M. WHEELER, 1915
Echinopla F. SMITH, 1857
Euprenolepis EMERY, 1906
Forelophilus KUTTER, 1931
Formica LINNAEUS, 1758
Gesomyrmex MAYR, 1868
Gigantiops ROGER, 1863
Glaphyromyrmex W.M. WHEELER,1915
Iberoformica TINAUT, 1990
Lasiophanes EMERY, 1895
Lasius FABRICIUS, 1804
Lepisiota SANTSCHI, 1926
Melophorus LUBBOCK, 1883
Myrmecocystus WESMAEL, 1838
Myrmecorhynchus ANDRÉ, 1896
Myrmelachista ROGER, 1863
Myrmoteras FOREL, 1893
Notoncus EMERY, 1895
Notostigma EMERY, 1920
Nylanderia EMERY, 1906
Atta cephalotes
(Myrmicinae)
Cephalotes atratus
(Myrmicinae)
Oecophylla F. SMITH, 1860
Opisthopsis DALLA TORRE, 1893
Overbeckia VIEHMEYER, 1916
Paraparatrechina DONISTHORPE, 1947
Paratrechina MOTSCHOULSKY, 1863
Petalomyrmex R.R. SNELLING, 1979
Phasmomyrmex STITZ, 1910
Plagiolepis MAYR, 1861
Polyergus LATREILLE, 1804
Polyrachis F. SMITH, 1857
Prenolepis MAYR, 1861
Proformica RUZSKY, 1902
Prolasius FOREL, 1892
Pseudolasius EMERY, 1887
Pseudonotoncus CLARK, 1934
Rossomyrmex ARNOL'DI, 1928
Santschiella FOREL, 1916
Stigmacros FOREL, 1905
Tapinolepis EMERY, 1925
Teratomyrmex MCAREAVEY, 1957
Zatania LAPOLLA, KALLAL & BRADY, 2012
Formicoxenus provancheri
(Myrmicinae)
Sottofamiglia Heteroponerinae
Acanthoponera MAYR, 1862
Aulacopone ARNOL'DI, 1930
Heteroponera MAYR, 1887
Sottofamiglia Leptanillinae
Anomalomyrma TAYLOR, 1990
Leptanilla EMERY, 1870
Phaulomyrma G.C.WHEELER & E.W.WHEELER, 1930
Protanilla TAYLOR, 1990
Yavnella J.KUGLER, 1987
Myrmica sp.
(Myrmicinae)
Sottofamiglia Leptanilloidinae
Amyrmex KUSNEZOV, 1953
Asphinctanilloides BRANDÃO ET AL., 1999
Leptanilloides MANN, 1923
Sottofamiglia Martialinae
Martialis RABELING & VERHAAGH, 2008
Sottofamiglia Myrmeciinae
Pheidole adrianoi
(Myrmicinae)
Pogonomyrmex maricopa
(Myrmicinae)
† Archimyrmex COCKERELL, 1923
Myrmecia FABRICIUS, 1804
Nothomyrmecia CLARK, 1934
† Prionomyrmex MAYR, 1868
Sottofamiglia Myrmicinae
Acanthognathus MAYR, 1887
Acanthomyrmex EMERY, 1893
Acromyrmex MAYR, 1865
Adelomyrmex EMERY, 1897
Adlerzia FOREL, 1902
Allomerus MAYR, 1878
Ancyridris W.M. WHEELER, 1935
Anergates FOREL, 1874
Anillomyrma EMERY, 1913
Anisopheidole FOREL, 1914
Ankylomyrma BOLTON, 1973
Aphaenogaster MAYR, 1853
Apterostigma MAYR, 1865
Atopomyrmex ANDRÉ, 1889
Atta FABRICIUS, 1804
Austromorium SHATTUCK, 2009
Baracidris BOLTON, 1981
Bariamyrma LATTKE, 1990
Basiceros W.A. SCHULZ, 1906
Blepharidatta W.M. WHEELER, 1915
Bondroitia FOREL, 1911
Calyptomyrmex EMERY, 1887
Cardiocondyla EMERY, 1869
Carebara WESTWOOD, 1840
Carebarella EMERY, 1906
Cataulacus F. SMITH, 1853
Cephalotes LATREILLE, 1802
Odontomachus sp.
Ponerinae
Proceratium croceum
(Proceratiinae)
Chalepoxenus MENOZZI, 1923
Chimaeridris WILSON, 1989
Colobostruma W.M. WHEELER, 1927
Crematogaster LUND, 1831
Cryptomyrmex FERNÁNDEZ, 2004
Cyphoidris FERNÁNDEZ, 2004
Cyphomyrmex MAYR, 1862
Dacatria RIGATO, 1994
Dacetinops BROWN & WILSON, 1957
Daceton PERTY, 1833
Decamorium FOREL, 1913
Diaphoromyrma FERNÁNDEZ ET AL., 2009
Dicroaspis EMERY, 1908
Dilobocondyla SANTSCHI, 1910
Diplomorium MAYR, 1901
Dolopomyrmex COVER & DEYRUP, 2007
Electromyrmex W.M. WHEELER, 1910
Enneamerus MAYR, 1868
Epopostruma FOREL, 1895
Eurhopalothrix BROWN & KEMPF, 1961
Eutetramorium EMERY, 1899
Formicoxenus MAYR, 1855
Gauromyrmex MENOZZI, 1933
Goniomma EMERY, 1895
Harpagoxenus FOREL, 1893
Huberia FOREL, 1890
Hylomyrma FOREL, 1912
Indomyrma BROWN, 1986
Ishakidris BOLTON, 1984
Kalathomyrmex KLINGENBERG & BRANDÃO, 2009
Kartidris BOLTON, 1991
Lachnomyrmex W.M. WHEELER, 1910
Lasiomyrma TERAYAMA & YAMANE, 2000
Lenomyrmex FERNÁNDEZ & PALACIO, 1999
Leptothorax MAYR, 1855
Liomyrmex MAYR, 1865
Lophomyrmex EMERY, 1892
Lordomyrma EMERY, 1897
Machomyrma FOREL, 1895
Manica JURINE, 1807
Mayriella FOREL, 1902
Megalomyrmex FOREL, 1885
Melissotarsus EMERY, 1877
Meranoplus F. SMITH, 1853
Mesostruma BROWN, 1948
Messor FOREL, 1890
Metapone FOREL, 1911
Microdaceton SANTSCHI, 1913
Monomorium MAYR, 1855
Mycetagroicus BRANDÃO & MAYHÉ-NUNES, 2001
Mycetarotes EMERY, 1913
Mycetophylax EMERY, 1913
Mycetosoritis W.M. WHEELER, 1907
Mycocepurus FOREL, 1893
Pseudomyrmex ferrugineus
(Pseudomyrmecinae)
Myrmecina CURTIS, 1829
Myrmica LATREILLE, 1804
Myrmicaria W.W. SAUNDERS, 1842
Myrmicocrypta F. SMITH, 1860
Myrmoxenus RUZSKY, 1902
Nesomyrmex W.M. WHEELER, 1910
Ochetomyrmex MAYR, 1878
Octostruma FOREL, 1912
Ocymyrmex EMERY, 1886
Orectognathus F. SMITH, 1853
Oxyepoecus SANTSCHI, 1926
Oxyopomyrmex ANDRÈ, 1881
Paratopula W.M. WHEELER, 1919
Parvimyrma EGUCHI & BUI, 2007
Perissomyrmex M.R. SMITH, 1947
Peronomyrmex VIEHMEYER, 1922
Phalacromyrmex KEMPF, 1960
Pheidole WESTWOOD, 1839
Pheidologeton MAYR, 1862
Pilotrochus BROWN, 1978
Podomyrma F. SMITH, 1859
Poecilomyrma MANN, 1921
Pogonomyrmex MAYR, 1868
Pristomyrmex MAYR, 1866
Proatta FOREL, 1912
Procryptocerus EMERY, 1887
Propodilobus BRANSTETTER, 2009
Protalaridris BROWN, 1980
Protomognathus W.M. WHEELER, 1905
Pseudoatta GALLARDO, 1916
Pyramica ROGER, 1862
Recurvidris BOLTON, 1992
Rhopalomastix FOREL, 1900
Rhopalothrix MAYR, 1870
Rhoptromyrmex MAYR, 1901
Rogeria EMERY, 1894
Romblonella W.M. WHEELER, 1935
Rostromyrmex ROSCISZEWSKI, 1994
Rotastruma BOLTON, 1991
Secostruma BOLTON, 1988
Sericomyrmex MAYR, 1865
Solenopsis WESTWOOD, 1840
Stegomyrmex EMERY, 1912
Stenamma WESTWOOD, 1839
Stereomyrmex EMERY, 1901
Strongylognathus MAYR, 1853
Strumigenys F. SMITH, 1860
Talaridris WEBER, 1941
Teleutomyrmex KUTTER, 1950
Temnothorax MAYR, 1861
Terataner EMERY, 1912
Tetheamyrma BOLTON, 1991
Tetramorium MAYR, 1855
Trachymyrmex FOREL, 1893
Tranopelta MAYR, 1866
Tropidomyrmex SILVA, FEITOSA, ET AL. 2009
Tyrannomyrmex FERNÁNDEZ, 2003
Vollenhovia MAYR, 1865
Vombisidris BOLTON, 1991
Wasmania FOREL, 1893
Xenomyrmex FOREL, 1885
Sottofamiglia Paraponerinae
Paraponera F. SMITH, 1858
Sottofamiglia Ponerinae
Anochetus MAYR, 1861
Asphinctopone SANTSCHI, 1914
Belonopelta MAYR, 1870
Boloponera FISHER, 2006
Centromyrmex MAYR, 1866
Cryptopone EMERY, 1893
Diacamma MAYR, 1862
Dinoponera ROGER, 1861
Dolioponera BROWN, 1974
Emeryopone FOREL, 1912
Feroponera BOLTON & FISHER, 2008
Harpegnathos JERDON, 1851
Hypoponera SANTSCHI, 1938
Leptogenys ROGER, 1861
Loboponera BOLTON & BROWN, 2002
Myopias ROGER, 1861
Odontomachus LATREILLE, 1804
Odontoponera MAYR, 1862
Pachycondyla SMITH, 1858
Phrynoponera W.M. WHEELER, 1920
Platythyrea ROGER, 1863
Plectroctena F. SMITH, 1858
Ponera LATREILLE, 1804
Promyopias SANTSCHI, 1914
Psalidomyrmex ANDRÉ, 1890
Simopelta MANN, 1922
Streblognathus MAYR, 1862
Thaumatomyrmex MAYR, 1887
Sottofamiglia Proceratiinae
† Bradoponera MAYR, 1868
Discothyrea ROGER, 1863
Probolomyrmex MAYR, 1901
Proceratium ROGER, 1863
Sottofamiglia Pseudomyrmecinae
Myrcidris WARD, 1990
Pseudomyrmex LUND, 1831
Tetraponera F. SMITH, 1852
† Sottofamiglia Sphecomyrminae
† Haidomyrmex DLUSSKY, 1996
† Haidomyrmodes PERRICHOT ET AL., 2008
† Baikuris DLUSSKY, 1987
† Cretomyrma DLUSSKY, 1975
† Dlusskydris DLUSSKY, 1975
† Sphecomyrma WILSON, CARPENTER & BROWN, 1967
† Sphecomyrmodes ENGEL & GRIMALDI, 2005
† Zigrasimecia BARDEN & GRIMALDI, 2013
Incertae sedis
† Gerontoformica NEL & PERRAULT, 2004
† Myanmyrma ENGEL & GRIMALDI, 2005
Scyphodon BRUES, 1925
Tschinkel
Alcune specie
Le specie di formiche più note diffuse nelle aree a clima temperato e le specie più rilevanti sono riportate
nella seguente lista:
la formica fosca (Formica fusca), comune nei prati, le cui pupe vengono rapite dalla formica
amazzone (Polyergus rufescens) che è una specie schiavista obbligata
la formica rossa dei boschi (Formica rufa), con livrea rosso ruggine, addome, zampe e antenne di
colorazione bruna. Questa specie è priva di pungiglione, ma è capace di lanciare, anche a 30 cm di
distanza, potenti getti di acido formico prodotto da un apparato addominale. Diffusa nei boschi di
conifere, soprattutto di abeti e larici, dell'Europa, costruisce nidi giganteschi, alti sino a 2 m, che
vengono trapiantati anche in altri boschi per la lotta contro gli insetti dannosi
la formica mietitrice (Messor barbarus), che accumula semi e frutta in camere asciutte e, più tardi,
mediante la saliva, riduce queste provviste in una sorta di pappa che serve di nutrimento alle larve.
le formiche erculee e le formiche rovinaboschi (genere Camponotus), che scavano gallerie e celle
nelle conifere, nelle querce e nei lecci
la formica del miele (Myrmecocystus mexicanus), del Messico e degli Stati Uniti meridionali, le cui
operaie raccolgono il liquido zuccherino dalle galle di alcune querce e, tornate al nido, lo rigurgitano a
operaie che hanno l'unico compito di funzionare come serbatoi alimentari
le formiche tagliafoglie (generi Atta e Acromyrmex), che vivono nell'America tropicale e sono così
chiamate perché le operaie predatrici tagliano le foglie, triturano i frammenti, li riducono in masserelle
che attaccano l'una all'altra, li incorporano in una massa di sostanza vegetale sulla quale fanno
crescere un fungo, di cui poi si nutrono: le colonie molto numerose sono particolarmente dannose
le formiche scacciatrici (sottogenere Anomma, genere Dorylus), cosiddette perché quando invadono
un territorio, ogni animale è costretto ad abbandonare la propria abitazione
le formiche guerriere, o formiche soldato, o formiche legionarie (genere Eciton);
la formica amazzone (Polyergus rufescens)
Altro sulle formiche
La lotta alle formiche
Non poche formiche sono dannose all'uomo, perché favoriscono la diffusione di insetti dannosi come gli
afidi; altre, come le specie di Messor, dette "formiche mietitrici", rubano dai campi grandi quantità di grano
e altri cereali; altre ancora danneggiano le gemme e le foglioline delle piante. La lotta contro le formiche è
difficile perché per eliminarle veramente occorre sopprimere le regine, cosa assai difficoltosa perché
raramente queste escono all'aperto.
Formiche nella letteratura
Le formiche sono protagoniste di molte opere letterarie tra cui:
la favola La cicala e la formica di Esopo scritta tra il 620 a.C. e il 540 a.C. circa;
le favole di Jean de La Fontaine in particolare ne La cicala e la formica, riadattata tra il 1669 e il 1693
dall'omonima opera di Esopo;
il romanzo Ciondolino di Luigi Bertelli, meglio noto con lo pseudonimo di Vamba, scritto nel 1895;
il racconto L'impero delle formiche di H. G. Wells del 1905;
il racconto La formica argentina di italo Calvino del 1952;
il romanzo Anni senza fine di Clifford Simak del 1952;
il romanzo Fase IV, di Barry N. Malzberg del 1973, trasposizione letteraria del film Fase IV:
distruzione Terra di Saul Bass;
il romanzo Formiche di Bernard Werber del 1991;
il romanzo Formicaio del biologo Edward Osborne Wilson del 2010.
Formiche nel cinema
Assalto alla Terra (Them!) (1954)
Fase IV: distruzione Terra (Phase IV) (1974)
L'impero delle termiti giganti (Empire of the Ants) (1977)
Terrore a Lakewood (It Happened at Lakewood Manor) (1977) Film TV
Z la formica (1998)
A Bug's Life - Megaminimondo (1998)
Marabunta - Minaccia alla Terra (Legion of Fire: Killer Ants!) (1998) Film TV
Glass Trap - Formiche assassine (Glass Trap) (2005)
Ant Bully - Una vita da formica (2006)
Indiana Jones e il regno del teschio di cristallo (2008)
Formiche in cucina
In alcuni paesi del sud est asiatico le formiche e le loro larve (in particolare quelle della specie Oecophylla
smaragdina) sono considerate un cibo prelibato[83]. Le larve vengono raccolte scuotendo i nidi dentro un
cesto di vimini e in seguito separando le larve dalle operaie. Le larve vengono mangiate crude oppure
utilizzate per cucinare delle frittate, mentre le operaie, a causa del sapore aspro dovuto all'acido formico,
vengono utilizzate al posto del limone nelle insalate.
In Colombia, le regine di Atta laevigata vengono catturate durante le abbondanti sciamature che avvengono
da marzo a giugno; alle regine vengono strappate le ali, poi vengono bollite in acqua salata e
successivamente arrostite[84].
Note
1. ^ C.S. Moreau, C.D. Bell; R. Vila; S.B. Archibald; N.E. Pierce, Phylogeny of the ants: Diversification in the age of
angiosperms (abstract) in Science, vol. 312, nº 5770, 2006, pp. 101-104, DOI:10.1126/science.1124891. URL
consultato il 7 febbraio 2012.
2. ^ Le Formiche Alate (http://www.mondodelleformiche.com/2012/06/le-formiche-alate.html)
3. ^ (EN) Jackson DE, Ratnieks FL, Communication in ants in Curr. Biol., vol. 16, nº 15, agosto 2006, pp. R570–R574,
DOI:10.1016/j.cub.2006.07.015, PMID 16890508.
4. ^ Goss S, Aron S, Deneubourg JL, Pasteels JM, Self-organized shortcuts in the Argentine ant in
Naturwissenschaften, vol. 76, 1989, pp. 579–581, Bibcode:1989NW.....76..579G, DOI:10.1007/BF00462870.
5. ^ (EN) D'Ettorre P, Heinze J, Sociobiology of slave-making ants in Acta ethologica, vol. 3, 2001, pp. 67–82,
DOI:10.1007/s102110100038.
6. ^ Franks NR, Resh VH, Cardé RT (eds), Encyclopedia of Insects, San Diego, Academic Press, 2003, pp. 29–32,
ISBN 0-12-586990-8.
7. ^ Detrain C, Deneubourg JL, Pasteels JM, Information processing in social insects, Birkhäuser, 1999, pp. 224–227,
ISBN 3-7643-5792-4.
8. ^ (EN) Greene MJ, Gordon DM, Structural complexity of chemical recognition cues affects the perception of group
membership in the ants Linephithema humile and Aphaenogaster cockerelli in Journal of Experimental Biology,
vol. 210, Pt 5, 2007, pp. 897–905, DOI:10.1242/jeb.02706, PMID 17297148.
9. ^ Hölldobler & Wilson (1990), p. 354
10. ^ Hickling R, Brown RL, Analysis of acoustic communication by ants in Journal of the Acoustical Society of
America, vol. 108, nº 4, 2000, pp. 1920–1929, DOI:10.1121/1.1290515, PMID 11051518.
11. ^ Roces F, Hölldobler B, Use of stridulation in foraging leaf-cutting ants: Mechanical support during cutting or
short-range recruitment signal? in Behavioral Ecology and Sociobiology, vol. 39, 1996, p. 293,
DOI:10.1007/s002650050292.
12. ^ (EN) Clarke PS, The natural history of sensitivity to jack jumper ants (Hymenoptera: Formicidae: Myrmecia
pilosula) in Tasmania in Medical Journal of Australia, vol. 145, 11-12, 1986, pp. 564–566, PMID 3796365.
13. ^ (EN) Obin MS, Vander Meer RK, Gaster flagging by fire ants (Solenopsis spp.): Functional significance of venom
dispersal behavior in Journal of Chemical Ecology, vol. 11, 1985, pp. 1757–1768, DOI:10.1007/BF01012125.
14. ^ (EN) Stafford CT, Hypersensitivity to fire ant venom in Annals of allergy, asthma, & immunology, vol. 77, nº 2,
1996, pp. 87–99, DOI:10.1016/S1081-1206(10)63493-X.
15. ^ a b c (EN) Patek SN, Baio JE, Fisher BL, Suarez AV, Multifunctionality and mechanical origins: Ballistic jaw
propulsion in trap-jaw ants (PDF) in Proceedings of the National Academy of Sciences, vol. 103, nº 34, 22 agosto
2006, pp. 12787–12792, DOI:10.1073/pnas.0604290103, PMC 1568925, PMID 16924120. URL consultato il 7 giugno
2008.
16. ^ (EN) Gronenberg W, The trap-jaw mechanism in the Dacetine ant Daceton armigerum and Strumigenys sp. (PDF)
in The Journal of Experimental Biology, vol. 199, nº 9, 1996, pp. 2021–2033.
17. ^ (EN) Jones, T.H.; Clark, D.A.; Edwards, A.A.; Davidson, D.W.; Spande, T.F. & Snelling, Roy R., The Chemistry of
Exploding Ants, Camponotus spp. (Cylindricus complex) in Journal of Chemical Ecology, vol. 30, nº 8, 2004,
pp. 1479–1492, DOI:10.1023/B:JOEC.0000042063.01424.28, PMID 15537154.
18. ^ (EN) Tofilski,Adam; Couvillon, MJ;Evison, SEF; Helantera, H; Robinson, EJH; Ratnieks, FLW, Preemptive
Defensive Self-Sacrifice by Ant Workers (PDF) in The American Naturalist, vol. 172, nº 5, 2008, pp. E239–E243,
DOI:10.1086/591688, PMID 18928332.
19. ^ (EN) Julian GE, Cahan S, Undertaking specialization in the desert leaf-cutter ant Acromyrmex versicolor in
Animal Behaviour, vol. 58, nº 2, 1999, pp. 437–442, DOI:10.1006/anbe.1999.1184, PMID 10458895.
20. ^ (EN) López-Riquelme GO, Malo EA, Cruz-López L, Fanjul-Moles ML, Antennal olfactory sensitivity in response
to task-related odours of three castes of the ant Atta mexicana (hymenoptera: formicidae) in Physiological
Entomology, vol. 31, nº 4, 2006, pp. 353–360, DOI:10.1111/j.1365-3032.2006.00526.x.
21. ^ (EN) Choe, Dong-Hwan;Millar JG; Rust MK, Chemical signals associated with life inhibit necrophoresis in
Argentine ants in Proc. Nat. Acad. Sci., vol. 106, nº 20, 2009, pp. 8251–8255, DOI:10.1073/pnas.0901270106,
22.
23.
24.
25.
26.
27.
28.
29.
30.
31.
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
PMC 2688878, PMID 19416815.
^ (EN) Tschinkel WR, The nest architecture of the Florida harvester ant, Pogonomyrmex badius in Journal of Insect
Science, vol. 4, nº 21, 2004, pp. 1–19.
^ (EN) Peeters C, Hölldobler B, Moffett M, Musthak Ali TM, "Wall-papering" and elaborate nest architecture in the
ponerine ant Harpegnathos saltator in Insectes Sociaux, vol. 41, 1994, pp. 211–218, DOI:10.1007/BF01240479.
^ (EN) Maschwitz U, Moog J, Communal peeing: a new mode of flood control in ants in Naturwissenschaften,
vol. 87, nº 12, 2000, pp. 563–565, DOI:10.1007/s001140050780, PMID 11198200.
^ (EN) Nielsen MG, Christian KA, The mangrove ant, Camponotus anderseni switches to anaerobic respiration in
response to elevated CO2 levels in Journal of Insect Physiology, vol. 53, nº 5, 2007, pp. 505–508,
DOI:10.1016/j.jinsphys.2007.02.002, PMID 17382956.
^ Franks NR, Richardson T, Teaching in tandem-running ants in Nature, vol. 439, nº 7073, 2006, p. 153,
DOI:10.1038/439153a, PMID 16407943.
^ Ravary F, Lecoutey E, Kaminski G, Châline N, Jaisson P, Individual experience alone can generate lasting
division of labor in ants in Current Biology, vol. 17, nº 15, 2007, pp. 1308–1312, DOI:10.1016/j.cub.2007.06.047,
PMID 17629482.
^ Hölldobler & Wilson (1990), pp. 143-179
^ Franks NR, Hooper J, Webb C, Dornhaus A, Tomb evaders: house-hunting hygiene in ants in Biology Letters,
vol. 1, nº 2, 2005, pp. 190–192, DOI:10.1098/rsbl.2005.0302, PMC 1626204, PMID 17148163.
^ Hölldobler & Wilson (1990), p. 573
^ Robson SK, Kohout RJ, Evolution of nest-weaving behaviour in arboreal nesting ants of the genus Polyrhachis Fr.
Smith (Hymenoptera: Formicidae) in Australian Journal of Entomology, vol. 44, nº 2, 2005, pp. 164–169,
DOI:10.1111/j.1440-6055.2005.00462.x.
^ Il formicaio artificiale: informazioni sul mantenimento di una colonia, 11 marzo 2011. URL consultato il 14 marzo
2013.
^ (EN) Wilson EO, Hölldobler B, The rise of the ants: A phylogenetic and ecological explanation in Proceedings of
the National Academy of Sciences, vol. 102, nº 21, 2005, pp. 7411–7414, DOI:10.1073/pnas.0502264102,
PMC 1140440, PMID 15899976.
^ (EN) Schultz TR, Ants, plants and antibiotics in Nature, vol. 398, nº 6730, 1999, pp. 747–748,
DOI:10.1038/19619.
^ a b Carrol CR, Janzen DH, Ecology of foraging by ants in Annual Review of Ecology and Systematics, vol. 4, 1973,
pp. 231–257, DOI:10.1146/annurev.es.04.110173.001311.
^ (EN) Åkesson S, Wehner R, Visual navigation in desert ants Cataglyphis fortis: are snapshots coupled to a
celestial system of reference? (PDF) in Journal of Experimental Biology, vol. 205, 2002, pp. 1971–1978.
^ (EN) Werner R, Desert ant navigation: how miniature brains solve complex tasks in Journal of Comparative
Physiology, vol. 189, nº 8, 2003, pp. 579–588, DOI:10.1007/s00359-003-0431-1, PMID 12879352.
^ (EN) Ants on Stilts Help Show Bugs Have "Pedometers", National Geographic Society. URL consultato il 15 settembre
2009.
^ (EN) Sommer S, Wehner R, The ant's estimation of distance travelled: experiments with desert ants, Cataglyphis
fortis in Journal of Comparative Physiology, vol. 190, nº 1, 2004, pp. 1–6, DOI:10.1007/s00359-003-0465-4,
PMID 14614570.
^ Banks AN, Srygley RB, Orientation by magnetic field in leaf-cutter ants, Atta colombica (Hymenoptera:
Formicidae) in Ethology, vol. 109, 2003, pp. 835–84, DOI:10.1046/j.0179-1613.2003.00927.x.
^ (EN) Fukushi T, Homing in wood ants, Formica japonica: use of the skyline panorama in Journal of Experimental
Biology, vol. 204, nº 12, 15 giugno 2001, pp. 2063–2072, PMID 11441048.
^ Wehner R, Menzel R, Homing in the ant Cataglyphis bicolor in Science, vol. 164, nº 3876, 1969, pp. 192–194,
DOI:10.1126/science.164.3876.192, PMID 5774195.
^ Reginald Frederick Chapman, The Insects: Structure and Function, 4ª ed., Cambridge University Press, 1998,
p. 600, ISBN 0-521-57890-6.
^ Delsuc F, Army Ants Trapped by Their Evolutionary History in PLoS Biol., vol. 1, nº 2, 2003, pp. E37,
DOI:10.1371/journal.pbio.0000037, PMC 261877, PMID 14624241.
^ Baroni-Urbani C, Boyan GS, Blarer A, Billen J, Musthak Ali TM, A novel mechanism for jumping in the Indian
ant Harpegnathos saltator (Jerdon) (Formicidae, Ponerinae) in Experientia, vol. 50, 1994, pp. 63–71,
DOI:10.1007/BF01992052.
^ (EN) Yanoviak SP, Dudley R, Kaspari M, Directed aerial descent in canopy ants (PDF) in Nature, vol. 433,
nº 7026, 2005, pp. 624–626, DOI:10.1038/nature03254, PMID 15703745.
^ Anche le formiche nel loro piccolo... asfaltano, Corriere della Sera, 26 maggio 2007. URL consultato il 16 settembre
2009.
48. ^ Morrison LW, A review of Bahamian ant (Hymenoptera: Formicidae) biogeography in Journal of Biogeography,
vol. 25, nº 3, 1998, pp. 561–571, DOI:10.1046/j.1365-2699.1998.2530561.x.
49. ^ Clay RE, Andersen AN, Ant fauna of a mangrove community in the Australian seasonal tropics, with particular
reference to zonation in Australian Journal of Zoology, vol. 44, 1996, pp. 521–533, DOI:10.1071/ZO9960521.
50. ^ Crosland MWJ, Crozier RH, Jefferson E, Aspects of the biology of the primitive ant genus Myrmecia F.
(Hymenoptera: Formicidae) in Australian Journal of Entomology, vol. 27, 1988, pp. 305–309, DOI:10.1111/j.14406055.1988.tb01179.x.
51. ^ (EN) Diehl E, Junqueira LK, Berti-Filho E, Ant and termite mound coinhabitants in the wetlands of Santo Antonio
da Patrulha, Rio Grande do Sul, Brazil in Brazilian Journal of Biology, vol. 65, nº 3, 2005, pp. 431–437,
DOI:10.1590/S1519-69842005000300008.
52. ^ Henderson G, Andersen JF, Phillips JK, Jeanne RL, Internest aggression and identification of possible nestmate
discrimination pheromones in polygynous ant Formica montana in Journal of Chemical Ecology, vol. 16, nº 7, 2005,
pp. 2217–2228, DOI:10.1007/BF01026932.
53. ^ (EN) Ward PS, A new workerless social parasite in the ant genus Pseudomyrmex (Hymenoptera: Formicidae), with
a discussion of the origin of social parasitism in ants in Systematic Entomology, vol. 21, 1996, pp. 253–263,
DOI:10.1046/j.1365-3113.1996.d01-12.x.
54. ^ (EN) Taylor RW, The Australian workerless inquiline ant, Strumigenys xenos Brown (Hymenoptera-Formicidae)
recorded from New Zealand in New Zealand Entomologist, vol. 4, nº 1, 1968, pp. 47–49.
55. ^ Hölldobler & Wilson (1990), pp. 436—448
56. ^ Fournier, D, Estoup A, Orivel J, Foucaud J, Jourdan H, Le Breton J, Keller L, Clonal reproduction by males and
females in the little fire ant in Nature, vol. 435, nº 7046, 2005, pp. 1230–1234, DOI:10.1038/nature03705,
PMID 15988525.
57. ^ (EN) Reiskind J, Ant-mimicry in Panamanian clubionid and salticid spiders (Araneae: Clubionidae, Salticidae) in
Biotropica, vol. 9, nº 1, 1977, pp. 1–8, DOI:10.2307/2387854.
58. ^ (EN) Cushing PE, Myrmecomorphy and myrmecophily in spiders: A Review (PDF) in The Florida Entomologist,
vol. 80, nº 2, 1997, pp. 165–193, DOI:10.2307/3495552, JSTOR 3495552.
59. ^ (EN) Styrsky JD, Eubanks MD, Ecological consequences of interactions between ants and honeydew-producing
insects in Proc. Biol. Sci., vol. 274, nº 1607, gennaio 2007, pp. 151–164, DOI:10.1098/rspb.2006.3701,
PMC 1685857, PMID 17148245.
60. ^ Jahn GC, Beardsley JW, Effects of Pheidole megacephala (Hymenoptera: Formicidae) on survival and dispersal of
Dysmicoccus neobrevipes (Homoptera: Pseudococcidae) in Journal of Economic Entomology, vol. 89, 1996,
pp. 1124–1129.
61. ^ DeVries PJ, Singing caterpillars, ants and symbiosis in Scientific American, vol. 267, nº 4, 1992, p. 76,
DOI:10.1038/scientificamerican1092-76.
62. ^ Pierce NE, Braby MF, Heath A, The ecology and evolution of ant association in the Lycaenidae (Lepidoptera) in
Annual Review of Entomology, vol. 47, 2002, pp. 733–771, DOI:10.1146/annurev.ento.47.091201.145257,
PMID 11729090.
63. ^ Dejean A, Solano PJ, Ayroles J, Corbara B, Orivel J, Arboreal ants build traps to capture prey in Nature, vol. 434,
nº 7036, 2005, p. 973, DOI:10.1038/434973a, PMID 15846335.
64. ^ L'origine dei giardini del diavolo. URL consultato il 5 giugno 2011.
65. ^ (EN) (EN) Frederickson ME, Gordon DM, The devil to pay: a cost of mutualism with Myrmelachista schumanni
ants in ‘devil’s gardens’ is increased herbivory on Duroia hirsuta trees (PDF) in Proceedings of the Royal Society B,
vol. 274, nº 1613, 2007, pp. 1117–1123, DOI:10.1111/j.1461-0248.2005.00741.x, PMC 2124481, PMID 17301016.
66. ^ (EN) Katayama N, Suzuki N, Role of extrafloral nectaries of Vicia faba in attraction of ants and herbivore
exclusion by ants in Entomological Science, vol. 7, nº 2, 2004, pp. 119–124, DOI:10.1111/j.1479-8298.2004.00057.x.
67. ^ Hanzawa FM, Beattie AJ, Culver DC, Directed dispersal: demographic analysis of an ant-seed mutualism in
American Naturalist, vol. 131, nº 1, 1988, pp. 1–13, DOI:10.1086/284769.
68. ^ (EN) Giladi I, Choosing benefits or partners: a review of the evidence for the evolution of myrmecochory in Oikos,
vol. 112, nº 3, 2006, pp. 481–492, DOI:10.1111/j.0030-1299.2006.14258.x.
69. ^ (EN) Szabolcs Lengyel, Aaron D. Gove, Andrew M. Latimer, Jonathan D. Majer, Robert R. Dunn, Convergent
evolution of seed dispersal by ants, and phylogeny and biogeography in flowering plants: A global survey in
Perspectives in Plant Ecology, Evolution and Systematics, vol. 12, 2010, pp. 43–55,
DOI:10.1016/j.ppees.2009.08.001.
70. ^ Fischer RC, Ölzant SM, Wanek W, Mayer V, The fate of Corydalis cava elaiosomes within an ant colony of
Myrmica rubra: elaiosomes are preferentially fed to larvae in Insectes sociaux, vol. 52, nº 1, 2005, pp. 55–62,
DOI:10.1007/s00040-004-0773-x.
71. ^ (EN) Hughes L, Westoby M, Capitula on stick insect eggs and elaiosomes on seeds: convergent adaptations for
72.
73.
74.
75.
76.
77.
78.
79.
80.
81.
82.
83.
84.
burial by ants in Functional Ecology, vol. 6, nº 6, 1º gennaio 1992, pp. 642–648, DOI:10.2307/2389958,
ISSN 02698463.
^ Quinet Y, Tekule N & de Biseau JC, Behavioural Interactions Between Crematogaster brevispinosa rochai Forel
(Hymenoptera: Formicidae) and Two Nasutitermes Species (Isoptera: Termitidae) in Journal of Insect Behavior,
vol. 18, nº 1, 2005, pp. 1–17, DOI:10.1007/s10905-005-9343-y.
^ Jeanne, RL, Social biology of the neotropical wasp Mischocyttarus drewseni in Bull. Mus. Comp. Zool., vol. 144,
1972, pp. 63–150.
^ a b (EN) Sivinski J, Marshall S, Petersson E, Kleptoparasitism and phoresy in the Diptera (PDF) in Florida
Entomologist, vol. 82, nº 2, 1999, pp. 179–197, DOI:10.2307/3496570, JSTOR 3496570.
^ Schaechter E, Some weird and wonderful fungi in Microbiology Today, vol. 27, nº 3, 2000, pp. 116–117.
^ Sandra B. Andersen, Sylvia Gerritsma, Kalsum M. Yusah, David Mayntz, Nigel L. Hywel-Jones, Johan Billen,
Jacobus J. Boomsma, and David P. Hughes, The Life of a Dead Ant: The Expression of an Adaptive Extended
Phenotype. in The American Naturalist, vol. 174, nº 3, 2009, pp. 424–433, DOI:10.1086/603640, PMID 19627240.
^ (EN) Wojcik DP, Behavioral interactions between ants and their parasites in The Florida Entomologist, vol. 72,
nº 1, 1989, pp. 43–51, DOI:10.2307/3494966.
^ (EN) Poinar G Jr., Yanoviak SP, Myrmeconema neotropicum n. g., n. sp., a new tetradonematid nematode
parasitising South American populations of Cephalotes atratus (Hymenoptera: Formicidae), with the discovery of an
apparent parasite-induced host morph (PDF) in Systematic Parasitology, vol. 69, nº 2, 2008, pp. 145–153,
DOI:10.1007/s11230-007-9125-3, PMID 18038201.
^ Caldwell JP, The evolution of myrmecophagy and its correlates in poison frogs (Family Dendrobatidae) in Journal
of Zoology, vol. 240, nº 1, 1996, pp. 75–101, DOI:10.1111/j.1469-7998.1996.tb05487.x.
^ (EN) Swenson JE, Jansson A, Riig R, Sandegren R, Bears and ants: myrmecophagy by brown bears in central
Scandinavia in Canadian Journal of Zoology, vol. 77, nº 4, 1999, pp. 551–561, DOI:10.1139/cjz-77-4-551.
^ Patek SN, Baio JE, Fisher BL e Suarez AV, Multifunctionality and mechanical origins: ballistic jaw propulsion in
trap-jaw ants in PNAS2006; 103(34): 12787-12792.
^ Subfamilies of Formicidae su AntWeb. URL consultato il 3 febbraio 2012.
^ Insalata di formiche regine. URL consultato il 27 novembre 2010.
^ Entomofagia. URL consultato il 15 maggio 2012.
Bibliografia
Borror DJ, Triplehorn CA, Delong DM, Introduction to the Study of Insects, 6th Edition, Saunders
College Publishing, 1989, ISBN 0-03-025397-7.
Emery C., Fauna Entomologica Italiana - Hymenoptera - Formicidae in Boll. Soc. Entom. Ital. 47:79275, 1916.
Hölldobler B, Wilson EO, The Ants, Harvard University Press, 1990, ISBN 0-674-04075-9, ..
Maurice Maeterlinck, "La vita delle formiche"
Edward O. Wilson e Bert Hölldobler, "Formiche. Storia di un'esplorazione scientifica", Adelphi,
Milano, 1997
Julian S. Huxley, "La vita segreta delle formiche"
Ward PS, Phylogeny, classification, and species-level taxonomy of ants (Hymenoptera: Formicidae) in
Zootaxa 2007; 1668: 549–563.
Voci correlate
Mirmecoria
Mirmecofilia
Mirmecomorfismo
Mirmecologia
Stigmergia
Altri progetti
Wikiquote contiene citazioni sulla formica
Wikizionario contiene il lemma di dizionario «formica»
Wikimedia Commons (https://commons.wikimedia.org/wiki/?uselang=it) contiene immagini o
altri file sulla famiglia Formicidae (https://commons.wikimedia.org/wiki/Formicidae?uselang=it)
Wikispecies (https://species.wikimedia.org/wiki/?uselang=it) contiene informazioni sulla
famiglia Formicidae (https://species.wikimedia.org/wiki/Formicidae?uselang=it)
Collegamenti esterni
Formicidae in Tesauro del Nuovo soggettario, BNCF, marzo 2013.
Formiche italiane su formicarium.it.
(EN) Ants of the World su AntWeb v4.80.
(EN) AntWiki, Bringing Ants to the World.
Come costruire un formicaio su Youtube.
Estratto da "http://it.wikipedia.org/w/index.php?title=Formicidae&oldid=71528337"
Categorie: Formicidae Taxa classificati da Pierre André Latreille | [altre]
Questa pagina è stata modificata per l'ultima volta il 21 mar 2015 alle 18:54.
Il testo è disponibile secondo la licenza Creative Commons Attribuzione-Condividi allo stesso modo;
possono applicarsi condizioni ulteriori. Vedi le Condizioni d'uso per i dettagli. Wikipedia® è un
marchio registrato della Wikimedia Foundation, Inc.