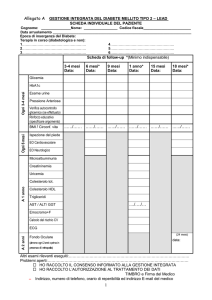
Trasporto e metabolismo dei lipidi in
ambito extracellulare. Le lipoproteine
plasmatiche
VLDL
LDL
CETP
P col
LCAT
HDL
sintesi
colesterolo
colesterolo
intracellulare
densità
recettori per
LDL
TRASPORTO RETROGRADO DEL COLESTEROLO
membrana
cellulare ricca di
colesterolo
FEGATO
IPERTRIGLCERIDEMIA E IPERCOLESTEROLEMIA
membrana
cellulare ricca di
colesterolo
FEGATO
In presenza di elevate concentrazioni di trigliceridi si ottiene dunque una
più veloce scomparsa delle HDL. Si riduce parimenti la possibilità di
riportare il colesterolo al fegato, che è l’unico organo che può eliminarne
l’eccesso attraverso la formazione di acidi biliari (mentre i TG riportati al
fegato tornano in circolo sotto forma di VLDL)
sintesi
colesterolo
colesterolo
intracellulare
Questa omeostasi perfetta non è osservabile nei
macrofagi per la presenza di un diverso
recettore per le
densità
LDL (recettore scavenger).
recettori per
LDL
Apolipoproteina(a)
L’apo(a) è una glicoproteina ad alto peso molecolare altamente polimorfa prodotta
principalmente dal fegato. La struttura è omologa a quella del plasminogeno , sia
per la presenza del dominio proteasico (che tuttavia non può essere convertito
nella forma attiva) che per la presenza di un dominio costituito da sequenze
kringle. Questo ultimo dominio comprende un kringle omologo al kringle 5 del
plasminogeno e diversi altri kringle simili tra loro e al kringle 4. Il numero di kringle
4 nella sequenza primaria è alla base del polimorfismo dell’apo(a), nonché della
variabilità del suo peso molecolare. La rilevanza dell’apo(a) nel sistema
lipoproteico deriva dal fatto che essa si associa, mediante la formazione di un
ponte disolfuro, all’apo B-100 a formare una lipoproteina denominata Lp(a). I livelli
plasmatici della Lp(a) sono correlati al peso molecolare delle isoforme
dell’apo(a) e al rapporto tra kringle 4 e kringle 5.
La Lp(a) è considerata una lipoproteina aterogena e un fattore di rischio
indipendente per l’insorgenza di malattie coronariche. Essa si lega infatti ai
glicosaminoglicani con una affinità molto superiore a quella delle LDL. Gran
parte dell’aterogenicità sembra dipendere da processi che hanno luogo
nell’intima dei vasi arteriosi. L’omologia tra plasminogeno ed apo(a)
suggerisce che la Lp(a) possa inibire il legame del plasminogeno alla fibrina
e favorire così la trombosi. La mancata attivazione del plasminogeno
impedisce, a sua volta, l’attivazione della forma latente del TFG-beta
(transforming growth factor-beta) con conseguente stimolazione della
proliferazione delle fibre muscolari lisce.
I fibrati sono farmaci ipolipidemizzanti. La la loro efficacia è rivolta principalmente
sui trigliceridi e, in misura minore, sulle LDL e sulle HDL.
L'azione dei fibrati è anche rivolta, almeno in parte, alla modulazione dei geni che
codificano le lipoproteine. Infatti, i fibrati attivano fattori di trascrizione (fattori che
controllano l'attività dei geni) appartenenti alla superfamiglia dei recettori nucleari
degli ormoni, chiamati PPAR (Peroxisome Proliferator-Activated Receptors).
I fibrati inibiscono la sintesi e stimolano il catabolismo delle VLDL, con il risultato
di una notevole riduzione della trigliceridemia e di una minore diminuizione della
colesterolemia. In particolare, attraverso PPAR viene inibita la sintesi dei
trigliceridi endogeni, mentre viene stimolata la sintesi della lipoproteinlipasi
(l'enzima che catabolizza le VLDL, trasformandole in IDL).
L'attivazione di PPAR-alfa media l'azione dei fibrati sulle HDL, in quanto induce la
sintesi delle principali apolipoproteine delle HDL (APOA-I e APOA-II). Per la loro
azione prevalente sui trigliceridi, i fibrati sono indicati soprattutto per il trattamento
delle ipertrigliceridemie isolate e per le forme combinate di ipertrigliceridemia e
ipercolesterolemia. La riduzione dei trigliceridi è di circa 20-50%, mentre la
riduzione delle LDL di solito non va oltre il 25% e l'aumento delle HDL del 10-25%.
In studi di prevenzione primaria e secondaria il gemfibrozil ha ridotto gli eventi
coronarici.
IPERLIPEMIE
Circa l’80% delle iperlipemie sono classificabili secondo quanto proposto da
Fredrickson in modo accurato e con poca spesa, interpretando correttamente il livello
di colesterolo e di trigliceridi ematici o esaminando semplicemente l’aspetto del
campione di siero o di plasma dopo averlo lasciato una notte in frigorifero.
Se il campione appare chiarificato con uno strato cremoso in superficie, è indice che
sono presenti dei chilomicroni e la dislipidemia è probabilmente di tipo I o V o, più
raramente, di tipo III.
Se il campione si mantiene opalescente, è indice che sono presenti delle VLDL e la
dislipidemia è probabilmente di tipo IIb, IV o V.
Se si verificano entrambe le condizioni (presenza di uno strato cremoso in superficie
ed opalescenza del campione), siamo verosimilmente in presenza di una dislipidemia
tipo V.
DOSAGGIO DEL COLESTEROLO
I numerosi metodi proposti per la determinazione della colesterolemia, molti
dei quali tuttora in uso, rappresentano ancora oggi dei tentativi non del tutto
soddisfacenti per venire incontro all’esigenza di economicità, semplicità e
rapidità nell’esecuzione e di maggiore accuratezza e precisione nei risultati.
Essi si basano su reazioni colorimetriche non enzimatiche (reazione di
Liebermann-Burchard, reazione al FeCl3-H2SO4, reazione all’acido ptoluensulfonico) o sull’uso della reazione enzimatica catalizzata dalla
colesterolo ossidasi.
Reazione di Liebermann-Burchard
Avviene in un mezzo reso fortemente acido in presenza di acido solforico, acido
acetico e anidride acetica e consiste nella graduale ossidazione del colesterolo
fino a formare un cromoforo dell’acido colesta-esaene-sulfonico.
Malgrado sia la metodica non enzimatica più frequentemente usata, la reazione
di Liebermann-Burchard risente di numerose variabili quali la concentrazione dei
reagenti, la quantità d’acqua presente nella miscela finale, la temperatura e il
tempo di reazione e la lunghezza d’onda della luce utilizzata per la misura del
prodotto finale.
Il colore che si sviluppa nella reazione è instabile nel tempo ed è più intenso
quando il colesterolo è esterificato rispetto a quando è libero.
Infine alcune sostanze presenti nel campione biologico (bilirubina, retinolo) o
aggiunte nella miscela di reazione (digitonina - utilizzata per precipitare il
colesterolo non esterificato) possono interferire nel dosaggio dando luogo ad
una sovrastima dell’analita.
Reazione al FeCl3-H2SO4
Dà luogo ad un colore più intenso e costante nel tempo rispetto a quanto osservato
con la reazione di Liebermann-Burchard per l’effetto stabilizzante del metallo sulla
formazione del catione enilico ad alte concentrazioni di acido solforico, cosa che rende
questa procedura particolarmente adatta per lo sviluppo di micrometodi. Inoltre,
quando l’acido solforico è aggiunto nella miscela di reazione separatamente dagli altri
reagenti (ma non quando viene premescolato a questi), il colesterolo libero e quello
esterificato sviluppano un colore di medesima intensità, rendendo superflua una
preventiva saponificazione dell’analita.
L’azide sodica (a volte usata per inibire la crescita batterica), gli alogeni, i perossidi e
certi farmaci e vitamine possono interferire con la reazione al FeCl3-H2SO4. E’ inoltre
preferibile deproteinizzare il campione prima di far sviluppare il colore. Ciò può essere
fatto indifferentemente per aggiunta di un solvente organico o per precipitazione in
acido. Questo secondo metodo è apparentemente più semplice, ma può determinare
una rimozione del ferro con le proteine, causando così un insufficiente sviluppo del
colore, o rendere più difficoltosa una eventuale, successiva rimozione della bilirubina
dall’estratto.
Reazione all’acido p-toluensulfonico
Ha i seguenti vantaggi rispetto alla reazione di Liebermann-Burchard: i
reagenti sono più stabili, il colore del prodotto di reazione non si modifica
nel tempo, il colore sviluppato dal colesterolo libero e quello sviluppato dal
colesterolo esterificato hanno la medesima intensità.
Tuttavia in questo caso la bilirubina interferisce notevolmente nella
determinazione del colesterolo dando luogo spesso ad una sovrastima
dell’analita.
METODO ENZIMATICO
La determinazione enzimatica del colesterolo prevede
1) l’idrolisi del colesterolo esterificato,
2) l’ossidazione del colesterolo libero a colest-4-en-3-one a spese dell’ossigeno
atmosferico con produzione di perossido di idrogeno
3) e il dosaggio di quest’ultimo composto mediante reazioni enzimatiche e/o
colorimetriche.
Questo metodo presenta il vantaggio di un’elevata specificità per cui la reazione può
essere seguita direttamente nel siero.
Il principale problema risiede nel fatto che l’idrolisi degli esteri del colesterolo è
spesso solo parziale e che quindi la concentrazione del colesterolo totale può essere
sottostimata. Si è visto inoltre che il grado di idrolisi raggiungibile nel corso della
reazione enzimatica dipende sia dalla natura dell’acido organico esterificante (gli
esteri dell’acido arachidonico e dell’acido acetico sono particolarmente resistenti
all’azione delle esterasi) sia dal tipo di enzima usato (le esterasi di origine microbica
hanno maggiore difficoltà, rispetto alle esterasi di origine animale, ad idrolizzare gli
esteri del colesterolo con acidi grassi polinsaturi a catena lunga). Ciò pone seri
problemi all’affidabilità del metodo.
Reazione tra H2O2 e metanolo in presenza di perossidasi, si formano
acqua e formaldeide, la quale reagisce con il reattivo acetilacetoneammoniaca a formare la 3,5-diacetil-1,4-diidrolutidina che è rilevabile
allo spettrofotometro alla lunghezza d'onda di 415 nm. La sua
concentrazione è direttamente proporzionale a quella iniziale di
colesterolo.
HDL-COLESTEROLO E LDL-COLESTEROLO
Una volta identificata in un soggetto la necessità di eseguire l’analisi delle
lipoproteine, l’interesse si sposta dal colesterolo totale all’LDL-colesterolo.
Il fine ultimo della identificazione occasionale e dello screening è quello di individuare
i soggetti con elevati livelli di LDL-colesterolo e l’obiettivo specifico del trattamento è
la riduzione di tale livello.
Ne consegue che l’LDL-colesterolo servirà come indice-chiave per le decisioni
cliniche da prendere in merito al trattamento ipocolesterolemizzante.
Il dato riguardante l’HDL-colesterolo è utile soprattutto nei soggetti che presentano
una trigliceridemia normale e una colesterolemia al limite dei valori di riferimento,
dove il riscontro di un HDL-colesterolo anormalmente elevato o basso può costituire
un criterio importante per decidere il trattamento più appropriato da intraprendere.
Metodi di determinazione
I metodi più frequentemente usati nella determinazione del HDL-colesterolo si
basano sulla precipitazione selettiva delle VLDL e delle LDL e sul dosaggio del
colesterolo sul supernatante così ottenuto.
Gli agenti precipitanti maggiormente usati sono l’eparina-cloruro di manganese, il
destrano solfato-cloruro di calcio o magnesio e il fosfotungstato di sodio.
Il metodo basato sull’uso dell’eparina-cloruro di manganese non è con gran parte dei
metodi enzimatici utilizzati per la determinazione del colesterolo mentre può essere
accoppiato alla reazione di Liebermann-Buchard. Le VLDL e le LDL precipitano solo
parzialmente in campioni con un contenuto di trigliceridi superiore a 4 g/L.
La precipitazione delle lipoproteine con destrano solfato e sali di calcio o magnesio
permette un successivo dosaggio del colesterolo mediante il metodo enzimatico.
Tuttavia molte delle procedure utilizzanti il destrano tendono a sottostimare l’HDLcolesterolo.
Anche il metodo utilizzante il fosfotungstato di sodio sottostima l’HDL-colesterolo, ma
in misura minore rispetto al metodo utilizzante il destrano. Esso è particolarmente
utile per precipitare le VLDL e le LDL in sieri ipertrigliceridemici. Il suo principale
svantaggio è di essere molto sensibile a variazioni di temperatura o di concentrazione
dei reagenti.
L’LDL-colesterolo è ricavato indirettamente utilizzando i dati (espressi in mg/L) del
colesterolo totale, dell’HDL-colesterolo e dei trigliceridi mediante la formula:
[LDL-colesterolo] = [colesterolo totale] – [HDL-colesterlo] – [trigliceridi] x 0,2
La formula presuppone che la maggior parte dei trigliceridi si trovi nelle VLDL e che
vi sia un rapporto di 5:1 tra trigliceridi e colesterolo nella frazione VLDL. Per questa
ragione la formula non è valida nei soggetti con dislipidemia tipo III o con
trigliceridemia superiore a 4 g/L.
In alternativa, l’LDL-colesterolo può essere determinato direttamente utilizzando in
sequenza due detergenti, in modo da dissolvere, in un primo momento, tutte le
lipoproteine diverse dalle LDL (chilomicroni, VLDL, IDL, HDL) e, in un secondo
momento, le sole LDL. Il colesterolo, che si libera per aggiunta dei detergenti, viene
cimentato in presenza di una esterasi e una ossidasi specifica in modo da produrre
perossido di idrogeno.
Il perossido di idrogeno, prodotto dal colesterolo liberato per aggiunta del primo
detergente, è decomposto mediante una catalasi o fatto reagire con 4aminoantipirina in presenza di una perossidasi in modo da formare un prodotto di
reazione incolore. Il perossido di idrogeno, prodotto dal colesterolo liberatosi dalle
LDL dopo l’aggiunta del secondo detergente, è fatto invece reagire con un
cromogeno in presenza di perossidasi e il prodotto di reazione è dosato
spettrofotometricamente
La determinazione dei trigliceridi ematici può essere utile nelle seguenti
circostanze:
1) per valutare il metabolismo lipidico nel suo insieme nell’analisi dei fattori di rischio
per la malattia coronarica;
2) per stimare la concentrazione del colesterolo contenuto nelle VLDL, per una misura
indiretta dell’LDL-colesterolo;
3) per determinare se un basso livello di HDL-colesterolo sia correlabile ad una
ipertrigliceridemia;
4) per evidenziare una ipertrigliceridemia secondaria all’uso di antiipertensivi, di
farmaci che diminuiscono la colesterolemia o hanno altre funzioni (ad esempio,
estrogeni);
5) per seguire l’efficacia della dieta, dell’esercizio fisico o di farmaci che diminuiscono
la trigliceridemia.
6) per valutare il rischio di insorgenza di una pancreatite acuta attribuibile
all’ipertrigliceridemia;
7) per vedere se i xantomi eruttivi, i xantomi palmari e la lipemia retinalis del paziente
sono da attribuirsi effettivamente ad un aumento delle lipoproteine ricche in trigliceridi.
Metodi di determinazione
Il livello dei trigliceridi può essere misurato mediante la determinazione quantitativa
del glicerolo in essi contenuto mediante reazioni colorimetriche o metodi enzimatici.
In tutti i casi la misura deve essere corretta per il glicerolo contenuto inizialmente nel
campione.
Un aumento del glicerolo può essere osservato nelle condizioni di stress, dopo
infusione di mannitolo o trattamento di pazienti coronaropatici con nitroglicerina, nel
diabete mellito, in alcune epatopatie, nel corso di emodialisi o a seguito dell’uso di
siringhe o provette lubrificate con glicerolo.
Reazioni colorimetriche
La procedura prevede quattro tappe successive:
(1) estrazione dei trigliceridi,
(2) loro saponificazione,
(3) ossidazione del glicerolo a formaldeide,
(4) determinazione quantitativa della formaldeide.
L’estrazione viene comunemente fatta in metanolo, etanolo, isopropanolo o
cloroformio e serve per denaturare le lipoproteine e liberare così il trigliceride che
può essere purificato per partizione in solventi organici (esano, nonano) o con l’uso
di adsorbenti (zeolite, silicato di magnesio attivato).
La saponificazione del trigliceride avviene generalmente a caldo in presenza di
potassa alcolica
Il glicerolo viene quindi ossidato a formaldeide in presenza di
periodato.
La formaldeide viene infine misurata per mezzo di una reazione
colorimetrica (reazione di Eegriwe, di Schryver o di Pay) o al
fluorimetro dopo condensazione con acetilacetone eammoniaca
(reazione di Hantzsch).
Reazione di Hantzsch
Metodi enzimatici
I metodi enzimatici richiedono l’iniziale idrolisi del trigliceride ad opera di una lipasi.
Generalmente, alla miscela di reazione viene aggiunto un enzima proteolitico (achimotripsina) per disgregare le lipoproteine.
Sono stati descritti diversi metodi per il dosaggio del glicerolo che prevedono
l’utilizzo di uno, due o tre reazioni enzimatiche. Infatti il glicerolo può essere
ossidato direttamente a diidrossiacetone in presenza di NAD+.
In alternativa il glicerolo può essere fosforilato a glicerolo-3-fosfato
e quest’ultimo composto può essere a sua volta ossidato a
diidrossiacetonefosfato a spese dell’NAD+
o a spese dell’ossigeno atmosferico.
Un ulteriore metodo, infine, prevede di determinare enzimaticamente non il
glicerolo-3-fosfato (come nei due casi precedenti), ma l’ADP che si è formato
nella reazione catalizzata dalla glicerolo chinasi.
Preparazione del campione ed intervalli di riferimento
Il paziente deve essere a digiuno. Infatti, se il paziente ha mangiato, non solo non è
più possibile interpretare il significato dell’ipertrigliceridemia, ma la presenza di
chilomicroni nel campione può interferire sia con il saggio colorimetrico sia nella
determinazione dei volume del campione. Il paziente deve inoltre astenersi dal bere
alcool per almeno 36 ore prima dell’analisi in quanto questo composto determina una
brusca e transiente elevazione della trigliceridemia.
La determinazione può essere fatta sia sul plasma (reso incoagulabile per aggiunta di
EDTA) che sul siero. I valori nel plasma sono inferiori del 2-4% rispetto ai valori del
siero in quanto gli anticoagulanti (in particolare il fluoruro, il citrato e l’ossalato)
determinano una fuoriuscita di acqua dai globuli rossi.
Valori di trigliceridi inferiori a 2,5 g/L sono da considerarsi normali, anche se soggetti
con questi valori possono presentare ugualmente altre importanti alterazioni delle
lipoproteine e delle apolipoproteine.
Livelli di trigliceridi a digiuno compresi fra 2,5 g/L e 5 g/L si associano ad un
aumento del rischio di malattia cardiovascolare (il doppio rispetto la norma) e
richiedono ulteriori indagini cliniche sul paziente.
Valori superiori a 5 g/L portano invece ad un aumento del rischio per la pancreatite
acuta.