SECONDO PRINCIPIO DELLA TERMODINAMICA, ENTROPIA
Per le macchine termiche
Enunciato di Kelvin: è impossibile realizzare una macchina termica il cui unico risultato sia
quello di trasformare in lavoro il calore proveniente da un’unica sorgente.
Per le macchine frigorifere
Nota: una macchina frigorifera ha un funzionamento inverso a quello di una macchina termica:
preleva calore dalla sorgente fredda e lo cede alla sorgente calda a spese di un lavoro esterno fatto
sul gas (il compressore elettrico che porta a liquefazione il gas nella serpentina)
Enunciato di Clausius: è impossibile realizzare una macchina frigorifera il cui unico risultato sia
quello di trasferire calore dalla sorgente più fredda a quella più calda.
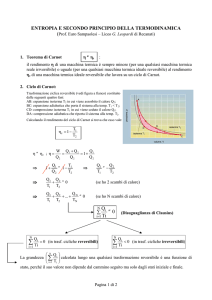
Disuguaglianza di Clausius
Per un ciclo reversibile (indicando con l’indice 2 il corpo più caldo e con 1quello più freddo)
avremo:
reversibile Carnot
reversibile 1
Q1
Q2
carnot 1
T1
T2
Q1 T1
Q2 T2
Q1 Q2
T1 T2
Poiché Q1, nella macchina di Carnot è negativo, essendo la quantità di calore ceduto all’ambiente,
avremo:
Q1 Q2
0
T1 T2
2
Qi
T
i 1
0
i
Per un ciclo irreversibile:
reversibile Carnot
Q1 Q2
0
T1 T2
def: Chiamo entropia S una grandezza la cui variazione è data dal rapporto tra il calore Q
scambiato lungo una trasformazione e la temperatura alla quale è avvenuto lo scambio:
S
Q
T
J
K
Quando il calore viene fornito al sistema (Q maggiore di zero) l’entropia aumenta
Quando il calore viene sottratto al sistema (Q minore di zero) l’entropia diminuisce
In una macchina reale e quindi irreversibile l’entropia aumenta sempre e quindi la sua
variazione è positiva (l’entropia dell’universo aumenta)
In una macchina ideale e quindi reversibile, come quella che esegue un ciclo di Carnot, la
variazione di entropia è nulla e quindi l’entropia è costante.
S
Q2 Q1
J
0
T2 T1
K
Nel caso di una trasformazione adiabatica, nella quale non c’è scambio di calore con
l’esterno, essendo Q=0, allora S=0. Non ci sarà variazione di entropia. Tali
trasformazioni vengono infatti dette anche isoentropiche.
Per un gas perfetto che subisce una trasformazione reversibile si ha che:
S ncV ln
Tf
Ti
nR ln
Vf
Vi
E’ importante notare come tale equazione non definisca l’ entropia del sistema, ma la
variazione di entropia dello stesso. Nelle considerazioni termodinamiche, infatti, l’ entropia
viene sempre definita partendo da un riferimento arbitrario che si ammette uguale a zero; ciò
equivale all’ introduzione di una costante incognita che scompare qualora si prendano in
considerazione differenze di entropia, ma non permette di conoscere il valore assoluto dell’
entropia di uno stato. Questa difficoltà venne superata dal teorema di Nerst (noto anche
come III Principio della Termodinamica) che ammette l’ esistenza di uno stato in cui
l’entropia ha effettivamente valore nullo. Quest’ ultimo si può quindi assumere come
riferimento assoluto, e, per un sistema isolato, è quello la cui temperatura coincide con lo
zero assoluto. Temperatura non raggiungibile per limiti teorici.
Nel caso di un’espansione libera un gas ideale racchiuso in un contenitore termicamente
isolato, diviso in due da un setto. Il gas che inizialmente si trova in metà del contenitore si
espande liberamente attraverso un buco finché la pressione è uguale nelle due metà.
In questo caso la temperatura resta costante.
a) La variazione di entropia di ciò che circonda localmente il sistema è zero (non c’è
scambio di calore con l’esterno.
b) Per calcolare la variazione di entropia del sistema pensiamo di sostituire l’espansione
libera irreversibile con una trasformazione isoterma reversibile che operi tra gli stessi
stati iniziale e finale. Quindi si usa l’equazione:
S nR ln
Vf
Vi
Nota 1. Da quest’ultima equazione è evidente che la variazione di entropia dipende solo dallo stato
iniziale e finale, ed è invece indipendente dal cammino reversibile. In questo caso, inoltre, S può
essere positiva o negativa a seconda del fatto che il gas assorba o ceda calore durante la
trasformazione.
Da ricordare che in termodinamica viene detta funzione di stato una quantità fisica dipendente solo
dalle condizioni in cui si trova in sistema. Esempi di funzioni di stato sono la pressione, la
temperatura, il volume, l’entalpia e l’energia interna.
Nota 2. Le trasformazioni termodinamiche si distinguono anche in reversibili e irreversibili. Le
trasformazioni reversibili sono quelle che avvengono in un tempo al limite infinito e in cui non sono
presenti effetti dissipativi (attrito, anelasticità, ecc). Una trasformazione reversibile, pertanto, si
2
svolge in maniera tale per cui, alla fine, sia il sistema che l’ ambiente circostante possono essere
riportati ciascuno nel proprio stato iniziale, senza che nell’ universo resti alcuna traccia. Tutto ciò
che avviene in un senso durante una trasformazione reversibile, accade nel senso opposto se si
cambia il verso di percorrenza della trasformazione. Così, ad esempio, se il sistema durante una
trasformazione reversibile assorbe calore da un altro corpo, invertendo la trasformazione restituisce
a quel corpo la stessa quantità di calore che gli aveva sottratto. Nelle trasformazioni reversibili non
esistono effetti dissipativi per definizione. In natura, tuttavia, è impossibile una totale assenza di
effetti dissipativi. Questi, semmai, possono essere ridotti considerando piccole trasformazioni, in
sistemi in cui le coordinate termodinamiche cambiano molto lentamente sono stati ridotti al
massimo gli attriti.
Es 1: Determinare la variazione di entropia che si verifica quando un pezzo di ghiaccio di 200 g si
scioglie a 0 °C.
Q mL f 0, 2kg 3, 4 105
S
J
6,8 104 J
kg
Q 6,8 104 J
J
200
T
273K
K
Per sciogliere il ghiaccio (sistema) abbiamo dovuto fornirgli calore. Quindi il sistema ha acquistato
calore e pertanto la sua variazione di entropia e positiva.
Es2. Vengono trasferiti 1050 J di calore da una sorgente alla temperatura di 303 °C ad una avente
una temperatura di 32 °C.
a) Quanto vale la variazione di entropia dell’universo se la trasformazione è irreversibile?
b) Se una macchina termica reversibile opera tra le due temperature quanto lavoro viene
eseguito dalla macchina quando sono prelevati 1050 J di calore dalla sorgente calda?
c) Quanto vale la variazione di entropia nel caso b)?
a) La variazione di entropia della sorgente calda è negativa perché tale sorgente perde calore,
mentre quella della sorgente fredda è positiva perché questa sorgente acquista calore:
Sc
Q
1050 J
J
1,82
Tc
576 K
K
S f
Q 1050 J
J
3, 44
T f 305 K
K
Suniverso Sc S f 1,82 3, 44 1, 62
J
K
L’aumento di entropia della sorgente fredda compensa la diminuzione di entropia della sorgente
calda.
b) Il rendimento della macchina è:
1
Tf
Tc
0, 47
L Qc 494 J
3
c) Poiché la macchina è reversibile la variazione complessiva di entropia deve essere zero. La
variazione di entropia della sorgente calda sarà ancora:
Sc
Q
1050 J
J
1,82
Tc
576 K
K
che ora dovrà avere lo stesso modulo di quella della sorgente fredda.
Es 3. Una macchina termica irreversibile in un ciclo di funzionamento preleva 3200 J dalla sorgente
calda alla temperatura di 620 K e cede 2240 J alla sorgente fredda. Determina la temperatura della
2
Q
J
sorgente fredda sapendo che i 2, 23 .
K
i 1 Ti
Ricordando che, per convenzione, Qc è positiva e che Qf è negativa si ha che:
Qc Q f
J
2, 23
Tc T f
K
Qf
Tf
2, 23
J 3200 J
J
7,39
K 620 K
K
Tf
Qf
7,39
2240 J
303 K
J
7,39
K
Es 4. Si hanno due serbatoi di calore mantenuti rispettivamente alle temperature costanti di 150 °C e
27 °C. I serbatoi, quando vengono posti in contatto tra di loro, si scambiano 2000 J di calore.
Determinare la variazione di entropia del sistema.
Sc
Q
2000 J
J
4, 73
Tc
423 K
K
S f
Q 2000 J
J
6, 67
T f 300 K
K
Suniverso Sc S f 4, 73 6, 67 1,94
J
K
Es 5. Attraverso le pareti della tua casa vengono dispersi nell’ambiente in un secondo 18 kJ di
calore. Se la temperatura interna della casa è 300 K e quella esterna è 270 K, determina l’aumento
di entropia del sistema causato da questo passaggio di calore.
Sc
Q
18000 J
J
60
Tc
300 K
K
S f
Q 18000 J
J
66, 7
Tf
270 K
K
Suniverso Sc S f 60 66, 7 6, 7
J
K
Es 6. Al mare un tuo amico di massa 80 kg si tuffa da uno scoglio posto a 10 metri dal suolo.
Nell’impatto con l’acqua, che si trova a 22 °C, tutta l’energia viene trasferita all’acqua senza che se
ne modifichi sensibilmente la temperatura. Determinare la variazione di entropia dell’universo dopo
il tuffo.
Quando il tuo amico raggiunge l’acqua tutta la sua energia potenziale si trasforma in calore. Quindi:
4
Eg Q mgh 80 kg 9,8
S
m
10 m 7840 J
s2
Q 7840 J
J
26, 6
T 295 K
K
Es 7. La temperatura del frigorifero di casa tua è di 4 °C e quella della tua cucina è di 20 °C. Il
compressore del frigorifero assorbe una potenza di 700 W. Determinare l’aumento di entropia
dell’ambiente dopo un’ora di funzionamento del frigorifero, considerato come una macchina di
Carnet.
1
Tf
Tc
L
t
L
Qc
S f
277 K
1 0,95 0, 05
293 K
J
3600s 2520 000 J
s
L 2520 000 J
Qc
50 400 000 J
0, 05
P
Sc
1
L P t 700
Qc 50 400 000 J
J
172013
Tc
293 K
K
Qf
Tf
50 400 000 J
J
181950
277 K
K
Stot 181950 172013 9936 J
5