Chimica Fisica II – Laboratorio
A.A. 2012-2013
Anno Accademico 2012 – 2013
Corso di Laurea in Chimica
Chimica Fisica II - Laboratorio
Esperienza di Laboratorio:
Determinazione del calore specifico
di miscele liquide
Dott. Lorenzo Franco
1
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Tipi di trasformazioni termodinamiche
Trasformazione isoterma (variazione di temperatura ∆T = 0). Si realizza
mettendo il sistema in contatto termico con un bagno termostatico. Un
semplice termostato a 273 K è costituito da un bagno di acqua e
ghiaccio fondente.
Trasformazione adiabatica (calore scambiato q = 0 ). Si realizza in un
recipiente termicamente isolato dall’esterno, in modo che il sistema non
possa scambiare energia con l’ambiente sotto forma di calore ma possa
scambiare energia sotto forma di lavoro.
Un thermos, o vaso di Dewar, è un esempio di contenitore adiabatico.
2
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Se ad un sistema si fornisce calore, la sua temperatura generalmente
aumenta. Si definisce capacità termica C il rapporto tra energia fornita
come calore q e l’aumento di temperatura ∆T:
q
C=
∆T
in J K-1 o J °C-1
La capacità termica è una grandezza estensiva. Si trasforma in una
grandezza intensiva dividendo per la massa o il numero di moli
capacità termica specifica
(calore specifico)
capacità termica molare
(calore specifico molare)
C
Cs =
m
C
Cm =
n
J K-1 g-1
J K-1 mole-1
3 3
Chimica Fisica II – Laboratorio
A.A. 2012-2013
E’ utile distinguere i casi di trasferimenti di energia termica a pressione o
volume costante:
capacità termica a pressione costante
Cp
capacità termica a volume costante
Cv
Sia Cv che Cp sono proprietà estensive. Si ottengono grandezze
intensive dividendo per le moli di sostanza
c p ,m =
cv ,m
Cp
n
Cv
=
n
Capacità termiche molari
4
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Scambio di energia (calore) a volume costante: se non vi è lavoro si
ricava dal primo principio che
dU = dq
quindi
dq
∂U
Cv =
=
dT V ∂T V
La misura di Cv è tuttavia spesso complicata dalla necessità di
mantenere V=costante.
Risulta spesso più conveniente la misura di Cp.
5
Chimica Fisica II – Laboratorio
A.A. 2012-2013
ENTALPIA
Molte trasformazioni avvengono a pressione costante (trasformazioni
isobare). In queste trasformazioni viene scambiato calore ma spesso
anche il volume cambia e si ha quindi lavoro di volume. La variazione di
energia interna non è quindi pari al calore scambiato.
Risulta utile definire un’altra funzione di stato detta Entalpia
H = U + PV
Le variazioni di entalpia derivano da variazioni di energia interna (∆U) e
del prodotto PV ( ∆(PV) ):
∆H = ∆U + ∆(PV)= ∆U + V∆P + P∆V
Se la trasformazione è isobara (P=costante), ∆P=0, e si ottiene
∆H = ∆U + P∆ V
6
Chimica Fisica II – Laboratorio
A.A. 2012-2013
La variazione di entalpia è pari al calore scambiato a
pressione costante, con solo lavoro di volume:
∆H = q p
Dimostrazione:
qp = ∆U – wvol
(primo principio)
= U2-U1 + p(V2-V1)
= (U2+p2V2) – (U1+p1V1)
= H2 – H1
= ∆H
7
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Come dipende l’entalpia dalla temperatura, a pressione fissata?
A pressione costante e con solo lavoro di volume, per incrementare la
temperatura dobbiamo fornire calore al sistema. Da ∆H = q, si ottiene
che l’entalpia è una funzione crescente della temperatura.
Hm
p = costante
Il Calore specifico (molare) a pressione
costante Cp,m è la derivata di Hm(T,p) rispetto
alla temperatura, a pressione costante:
H m (T , p)
C p ,m
1 dq
∂H m
=
=
n dT p ∂T p
T
n = numero di moli
8
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Se all’interno di un intervallo di temperature ∆T il calore specifico si può
considerare costante, si considerano variazioni finite:
C p ,m
∆H m
=
∆T p
q 1
=
∆T n
9
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Metodo di misura della capacità termica Cp:
si fornisce una quantità nota di energia come calore q, a
pressione costante (ottenibile facilmente con un
campione esposto all’atmosfera e in grado di dilatarsi)
si registra l’innalzamento di temperatura ∆T.
⇒ Occorre evitare che il sistema scambi calore con
l’ambiente esterno: il sistema deve essere
contenuto in un contenitore isolato termicamente
(thermos o vaso dewar)
10
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Per fornire una quantità nota di calore si sfrutta il calore dissipato da una
resistenza attraversata da corrente (effetto Joule):
Potenza dissipata P da una resistenza R attraversata da una corrente i
e sottoposta ad una differenza di potenziale V :
P = Vi = Ri 2
L’energia dissipata come calore, nel tempo t è::
E = q = ∫ V (t ) ⋅ i (t )dt
t0
0
Se si esegue la misura mantenendo V ed i costanti nel tempo:
E = q = R ⋅i ⋅t =V ⋅i ⋅t
2
11
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Come ottenere una trasformazione adiabatica in un sistema?
Il sistema (campione in esame) è posto all’interno di un contenitore con
pareti isolanti
12
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Apparato sperimentale:
termometro a mercurio
Vaso Dewar
generatore di corrente
con voltmetro e amperometro
cronometro digitale
resistenza elettrica
agitatore magnetico
13
Chimica Fisica II – Laboratorio
A.A. 2012-2013
• Con un Alimentatore di corrente si fornisce alla resistenza una
corrente i ad una V note
• Con un termometro si registra la temperatura a vari istanti
Si ottiene una tabella del tipo:
Tempo
(s)
Temperatura
(K)
Corrente
(Ampere)
Ddp
(Volts)
t1
T1
i1
V1
t2
T2
i2
V2
..
..
..
…
14
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Dalla tabella si ricavano grafici quali:
T
tempo
Fine riscaldamento
Inizio riscaldamento
15
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Osservazioni:
• Prima dell’accensione si può osservare una lieve variazione di
temperatura: il campione sta equilibrando la sua temperatura.
• Dopo lo spegnimento della corrente, si ha un ulteriore aumento della
temperatura per inerzia termica e poi una graduale diminuzione della
temperatura, per dissipazione di calore verso l’esterno.
• Si devono raccogliere punti prima, durante e dopo l’accensione della
corrente. La variazione di T si stima come dalla figura seguente:
T
∆Τi
tempo
dopo riscaldamento
Prima del riscaldamento
riscaldamento
16
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Attenzione:
Il campione liquido è contenuto in un becker di plastica, con un
termometro, un’ancoretta magnetica e la resistenza elettrica.
Tutti questi oggetti hanno una capacità termica propria.
Come separare il contributo del campione dalla somma campione+sistema
di misura?
⇒ Si fa una misura con un campione a
capacità termica nota (es: acqua distillata)
17
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Si considera l’esperimento fatto su un campione di Riferimento
(indicato con r) e sul campione incognito (indicato con s).
mr, ms = masse dei campioni
ir, is = corrente (media) durante il riscaldamento
Vr, Vs = ddp applicata (media) durante il riscaldamento
tr, ts = tempi di riscaldamento
∆Tr, ∆Ts = variazioni di temperatura
cr, cs = capacità termiche specifiche (per unità di massa)
C0 = capacità termica del sistema di misura
18
Chimica Fisica II – Laboratorio
A.A. 2012-2013
I calori scambiati nell’esperimento col riferimento o con l’incognito sono:
qr = wel ,r = Vrir tr
qs = wel ,s = Vsis ts
Ma è anche:
qr = (C0 + mr cr )∆Tr
qs = (C0 + ms cs )∆Ts
Unendo le precedenti relazioni:
Vrir tr = (C0 + mr cr )∆Tr
Vsis ts = (C0 + ms cs )∆Ts
19
Chimica Fisica II – Laboratorio
A.A. 2012-2013
Dalla misura fatta sul riferimento si ottiene C0:
Vrir tr = (C0 + mr cr )∆Tr
Vrir tr
C0 =
− mr cr
∆Tr
Il valore di C0 viene inserito nella formula per il campione incognito
e si ricava il valore di cs
Vsis ts
Vrir tr mr cr
cs =
−
+
ms ∆Ts ms ∆Tr
ms
20
Chimica Fisica II – Laboratorio
A.A. 2012-2013
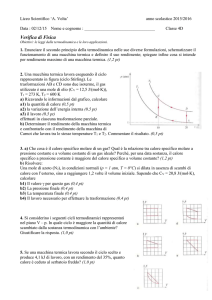
Per la determinazione di ∆T si può procedere come indicato in figura,
calcolando le rette prima, durante e dopo il riscaldamento, e stimando gli
errori sui valori.
303
tf : fine
ririscaldamento
T2
302
Tdopo = a d + bd t
301
300
∆T
T/K
299
298
297
Tprima = a p + b p t
296
T1
295
t m = (ti + t f ) / 2
0
200
400
600
800
1000
t/s
ti : inizio
riscaldamento
21
Chimica Fisica II – Laboratorio
A.A. 2012-2013
In questa esperienza si usa come fluido di calibrazione l’acqua distillata e
come fluidi incogniti alcune soluzioni di acqua:glicole etilenico da 10% a 50%
in peso/peso.
Queste soluzioni sono simili a quelle usate nelle miscele anticongelanti de
radiatori. In questi casi occorre trovare il rapporto ottimale tra
la
concentrazione di glicole (che abbassa il punto di congelamento della
miscela) e le proprietà di viscosità e di capacità termica (il glicole ha minore
calore specifico dell’acqua)
Di ciascuna soluzione si determina la curva di riscaldamento e si calcola la
capacità termica.
Si riportano i dati con la indicazione della precisione sui valori trovati (calcolo
degli errori).
22