1. Introduzione
1.1 Il surrene
Il surrene è un organo pari ad attività endocrina. Esso inizia a formarsi nella 5°
settimana di vita intrauterina e la sua maturazione definitiva avviene entro i tre anni di vita.
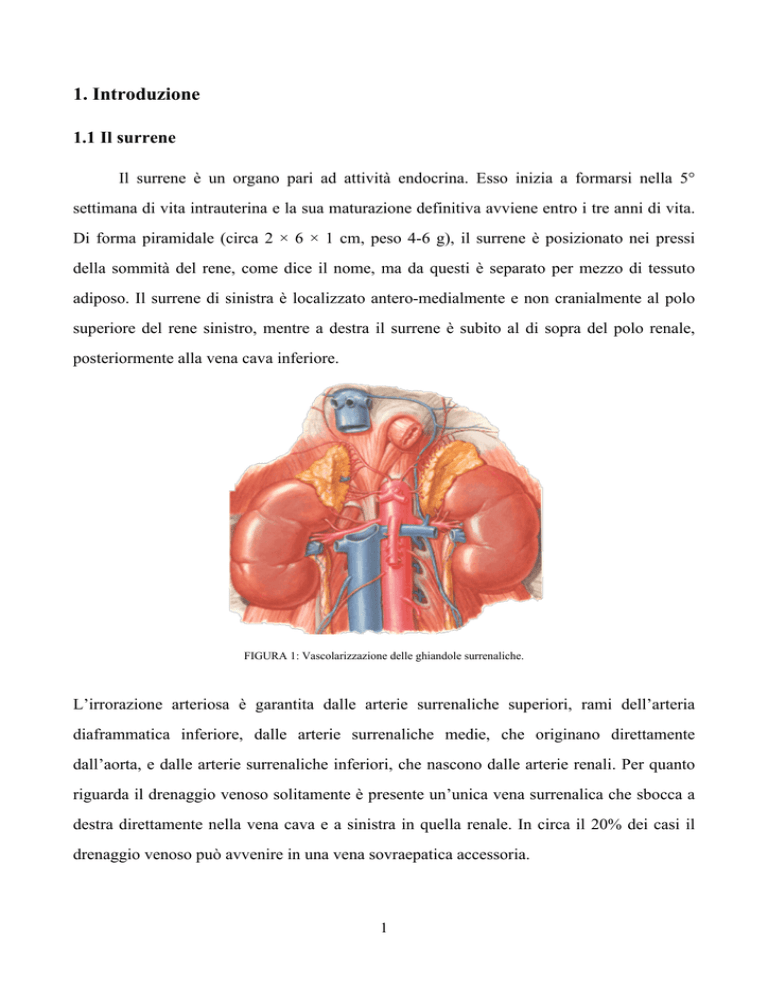
Di forma piramidale (circa 2 × 6 × 1 cm, peso 4-6 g), il surrene è posizionato nei pressi
della sommità del rene, come dice il nome, ma da questi è separato per mezzo di tessuto
adiposo. Il surrene di sinistra è localizzato antero-medialmente e non cranialmente al polo
superiore del rene sinistro, mentre a destra il surrene è subito al di sopra del polo renale,
posteriormente alla vena cava inferiore.
FIGURA 1: Vascolarizzazione delle ghiandole surrenaliche.
L’irrorazione arteriosa è garantita dalle arterie surrenaliche superiori, rami dell’arteria
diaframmatica inferiore, dalle arterie surrenaliche medie, che originano direttamente
dall’aorta, e dalle arterie surrenaliche inferiori, che nascono dalle arterie renali. Per quanto
riguarda il drenaggio venoso solitamente è presente un’unica vena surrenalica che sbocca a
destra direttamente nella vena cava e a sinistra in quella renale. In circa il 20% dei casi il
drenaggio venoso può avvenire in una vena sovraepatica accessoria.
1
Il surrene è responsabile principalmente della regolazione della risposta allo stress
mediante la sintesi di corticosteroidi e catecolammine, tra cui il cortisolo e l'adrenalina. Il
parenchima, circondato da una capsula fibrosa, è diviso in due regioni istologicamente e
funzionalmente distinte: una più grande detta corteccia surrenale (75%), derivante dal
mesoderma, ed una più piccola detta zona midollare (25%), derivante dall’ectoderma.
FIGURA 2: Istologia delle ghiandole surrenaliche.
La corteccia surrenale è divisa a sua volta in tre zone: la glomerulare (15%), più esterna, che
sintetizza e secerne ormoni mineralcorticoidi per il mantenimento dell'equilibrio idrico
(aldosterone), la fascicolata (78%) che sintetizza e secerne i glucocorticoidi e controlla il
metabolismo di carboidrati, grassi e proteine (cortisolo) e la reticolare (7%), più interna, che
produce gli ormoni sessuali come androgeni, estrogeni e progesterone. La midollare risulta
ricoperta completamente dalla corticale e sintetizza vari ormoni tra i quali le catecolamine,
principalmente epinefrina. Comprende cellule specializzate della neurocresta (cellule
2
neuroendocrine), denominate cellule cromaffini, o feocromociti, e cellule di sostegno o
sostentacolari. Cellule neuroendocrine simili alle cromaffini sono ampiamente disperse
nell’organismo, organizzate in un sistema extrasurrenalico costituito da piccoli noduli, che
insieme alla midollare del surrene costituiscono il sistema paragangliare (1).
1.2 La steroidogenesi
FIGURA 3: Steroidogenesi surrenalica.
La steroidogenesi inizia dal colesterolo, proveniente dalla dieta o per sintesi
endogena dall’acetato; gli enzimi coinvolti in tale processo appartengono alla famiglia delle
ossigenasi citocromo P-450. Il corticosurrene è in grado di sintetizzare glucocorticoidi,
mineralcorticoidi, androgeni, progestinici ed estrogeni e la struttura degli ormoni steroidei
deriva dal nucleo ciclopentanoperidrofenantrenico. Gli steroidi surrenalici possiedono 19 o
21 atomi di carboni: i primi hanno attività prevalentemente di tipo androgenico, mentre gli
altri hanno prevalente azione glucocorticoide e mineralcorticoide. La zona glomerulare è
regolata dall’asse renina-angitensina-aldosterone (RAA), poiché priva dell’enzima 17idrossilasi e pertanto in grado di sintetizzare solo aldosterone. Al contrario si comportano le
3
zone reticolare e fascicolata, regolate dall’ormone adrenocorticotropo (ACTH), nelle quali,
mancando la 18-idrossilasi, si formano solo glucocorticoidi ed androgeni (2).
FIGURA 4: Regolazione della secrezione di glucocorticoidi da parte dell’ACTH.
1.3 Patologie della midollare surrenalica
1.3.1 Feocromocitoma
I feocromocitomi sono neoplasie rare formate de cellule cromaffini che sintetizzano
e rilasciano catecolamine e, in alcuni casi, ormoni peptidici. Tali neoplasie si associano,
come gli adenomi secernenti aldosterone, ad ipertensione che regredisce solo dopo
l’asportazione del tumore. Occasionalmente i feocromocitomi possono produrre altri
steroidi o peptidi ed essere perciò associati ad altre endocrinopatie. Circa l’85% dei
feocromocitomi insorge nella midollare del surrene, i rimanenti nei paragangli
extrasurrenalici, soprattutto in quelli sottodiaframmatici. In questi casi, i tumori che non
presentano positività alla reazione cromaffine vengono denominati paragangliomi per
differenziarli dai feocromocitomi funzionali. Il 90% dei feocromocitomi si manifesta come
neoplasia sporadica, ma il rimanente 10% insorge nell’ambito di alcune sindromi familiari a
trasmissione autosomica dominante, come la sindrome MEN tipo II, la neurofibromatosi
4
tipo I, la malattia di Hippel-Lindau e la sindrome di Sturge-Weber. Anche se i
feocromocitomi non familiari insorgono più frequentemente fra i 40 e i 60 anni di età, con
una lieve predilezione per il sesso femminile, nella sindrome familiare le neoplasie
insorgono precocemente, nei bambini, con una forte predilezione per il sesso maschile. La
maggior parte dei tumori nel corso delle sindromi familiari sono bilaterali (70%), mentre tra
quelli sporadici solo il 10-15% lo sono. Un’altra differenza significativa è che solo il 10%
dei feocromocitomi è maligno, mentre lo sono il 20-40% dei paragangliomi extrasurrenalici.
L’aspetto clinico dominante nei pazienti con feocromocitoma è l’ipertensione, descritta
come un rialzo pressorio improvviso e veloce, associato a tachicardia, palpitazioni, cefalea,
sudorazione, tremori e ansietà. Questi episodi possono associarsi a dolore addominale o
toracico, nausea e vomito. Episodi ipertensivi parossistici isolati si verificano in meno della
metà dei pazienti. Circa due terzi di essi hanno uno stato cronico di rialzo pressorio, con un
carattere ipertensivo incostante. L’attacco parossistico può essere precipitato da stress
emotivi, esercizio fisico, variazioni posturali e palpazione nella regione del tumore.
L’aumento pressorio è causato dal rilascio improvviso di catecolamine e ciò può precipitare
in insufficienza cardiaca congestizia, edema polmonare acuto, infarto miocardico,
fibrillazione ventricolare, emorragia cerebrale e, quindi, condurre a morte. Le complicanze
cardiache sono attribuibili, almeno in parte, a quella che viene definita cardiomiopatia da
catecolamine, o instabilità miocardica da catecolamine e aritmie ventricolari. Le lesioni
miocardiche sono dovute al danno ischemico provocato dalla vasocostrizione da
catecolamine o per un loro effetto tossico diretto. I feocromocitomi possono elaborare anche
altri ormoni, come l’ACTH e la somatostatina, e pertanto presentarsi come un quadro
clinico correlato a questa evenienza. I paragangliomi, ovvero i feocromocitomi che
insorgono nei paragangli, possono insorgere in ogni organo in cui sia presente tessuto
paragangliare. Sono neoplasie rare con una frequenza di circa un decimo di quella dei
feocromocitomi surrenalici. La maggior parte si manifestano nella seconda o terza decade di
vita, senza differenza fra i sessi. Nonostante la rarità e le piccole dimensioni, essi hanno una
notevole importanza clinica perché nel 10-40% dei casi sono maligni e recidivano dopo
5
l’asportazione. Circa il 10% del totale dà luogo a metastasi disseminate, con prognosi
infausta.
1.3.2 Neuroblastoma
Il neuroblastoma rappresenta la neoplasia solida extracranica più frequente dell’età
infantile; può originare dalla midollare surrenalica o da qualsiasi altra localizzazione nel
sistema nervoso simpatico. La maggior parte dei neuroblastomi sono sporadici, anche se si
osservano casi familiari.
1.4 Patologie della corteccia surrenalica
Le affezioni del surrene corticale possono essere suddivise in due gruppi: associate a
iper- o a ipofunzione dell’organo. Possono comunque essere presenti patologie che
coinvolgono la ghiandola senza alterarne la funzionalità.
1.4.1 Iperfunzione surrenalica
Così come ci sono tre principali tipi di steroidi corticosurrenalici, anche le sindromi
cliniche indotte dal loro eccesso sono tre: la sindrome di Cushing da eccesso di cortisolo,
l’iperaldosteronismo e le sindromi adrenogenitali o virilizzanti da eccesso di androgeni.
Ipercortisolismo (sindrome di Cushing)
La sindrome di Cushing è determinata da ogni condizione in grado di elevare i livelli
di glucocorticoidi. Ci sono quattro possibili cause di eccesso di cortisolo. La più comune è
la somministrazione prolungata di glucocorticoidi a scopo terapeutico. Le altre tre cause di
ipercortisolismo sono endogene e riguardano malattie primitive ipotalamo-ipofisarie,
associate a ipersecrezione di ACTH, ipersecrezione di cortisolo da parte di un adenoma, un
carcinoma o un’iperplasia nodulare del surrene o secrezione di ACTH ectopico da parta di
una neoplasia non endocrina. L’ipersecrezione primaria di ACTH rappresenta oltre il 50%
dei casi di ipercortisolismo endogeno e viene detta Malattia di Cushing. Essa colpisce le
donne con una frequenza cinque volte maggiore rispetto agli uomini e con un picco di
incidenza dai 20 ai 30 anni. Nella maggior parte di queste pazienti l’ipofisi è sede di un
6
piccolo adenoma ACTH secernente che non è responsabile di effetto massa a livello
encefalico. Nella maggior parte dei restanti casi, tuttavia, nell’ipofisi non si trovano
adenomi, ma solo un’iperplasia corticotropa. In qualche paziente, l’alterazione di base è a
livello ipotalamico, con una ipersecrezione di ormone rilasciante la corticotropina. Nella
malattia di Cushing si ha una iperplasia corticale nodulare, causata da alti livelli di ACTH
che, a sua volta, è responsabile dell’ipercortisolismo. Le neoplasie primitive surrenaliche,
come l’adenoma, il carcinoma o l’iperplasia, sono alla base del 15-30% dei casi di sindrome
di Cushing endogena; questa forma è anche conosciuta come ACTH-indipendente o
sindrome di Cushing surrenalica poiché queste ghiandole hanno funzione autonoma,
svincolate dal controllo ipofisario. Nell’adulto, carcinoma ed adenoma surrenalico hanno la
stessa frequenza, mentre nel bambino è più comune il carcinoma. L’iperplasia surrenalica
autonoma è molto rara. La produzione di cortisolo è solitamente maggiore in caso di
carcinoma che negli adenomi e nelle iperplasie. In caso di neoplasia solitaria monolaterale,
la corticale residua omolaterale ed il surrene controlaterale vanno incontro ad atrofia, a
causa della soppressione della secrezione di ACTH indotta dagli elevati livelli di cortisolo.
Quindi, nella sindrome di Cushing a origine surrenalica, i livelli di cortisolo sono
marcatamente elevati, pur in presenza di diminuiti livelli di ACTH circolante. La secrezione
ectopica di ACTH da parte di neoplasie non ipofisarie costituisce la causa della sindrome di
Cushing nella maggior parte dei restanti casi. Spesso, la neoplasia responsabile è un
carcinoma polmonare a piccole cellule, anche se altre neoplasie, come i carcinoidi, i
carcinomi midollari della tiroide ed i tumori a cellule insulari del pancreas possono essere
associati a questa sindrome. Vi sono inoltre rari casi con produzione ectopica di fattore
rilasciante la corticotropina, che a sua volta stimola la secrezione di ACTH e determina
ipercortisolismo. Come nella variante ipofisaria, anche in questa forma i surreni vanno
incontro ad iperplasia bilaterale, ma spesso il rapido declino del paziente a causa della
neoplasia, impedisce che raggiungano notevoli dimensioni. Questa varietà di sindrome di
Cushing è più frequente negli uomini fra la quinta e la sesta decade di età. I primi sintomi
della patologia sono ipertensione ed aumento del peso corporeo. Nel tempo si rende visibile
7
il modello tipico di distribuzione centrale del tessuto adiposo, che porta ad obesità
localizzata al tronco, faccia lunare e accumulo adiposo in regione cervicale e del dorso
(gibbosità a bufalo). L’ipercortisolismo causa atrofia selettiva delle miofibre veloci (tipo II),
il che porta a riduzione delle masse muscolari e debolezza della muscolatura prossimale
degli arti. I glucocorticoidi stimolano la gluconeogenesi ed inibiscono la captazione
cellulare del glucosio portando a iperglicemia, glicosuria e polidipsia. Gli effetti catabolici
sulle proteine sono responsabili della perdita di collageno e riassorbimento osseo.
Conseguentemente la cute è fragile, sottile e facilmente soggetta a ecchimosi; la
cicatrizzazione è ritardata; l’addome è sede frequente di strie cutanee. Il riassorbimento
osseo porta ad osteoporosi, a cui seguono lombalgie ed una maggiore predisposizione a
fratture. I pazienti con sindrome di Cushing sono particolarmente esposti a varie infezioni
per l’immunosoppressione causata dai glucocorticoidi. Fanno parte del quadro un certo
numero di disturbi psichici, tra cui oscillazioni dell’umore, depressione e psicosi franca,
come pure irsutismo e disturbi del ciclo mestruale.
FIGURA 5: Effetti da eccesso di glucocorticoidi.
8
Iperaldosteronismo primario
L’iperaldosteronismo primario (IAP) è un termine generico in cui sono comprese
alcune rare sindromi strettamente correlate, caratterizzate dalla ipersecrezione cronica di
aldosterone. Livelli eccessivi di aldosterone causano ritenzione di sodio e perdita di
potassio, che portano ad ipertensione ed ipocaliemia. L’iperaldosteronismo può essere
primario o secondario ad una causa extrasurrenalica. L’iperaldosteronismo primario consiste
in una produzione eccessiva autonoma di questo ormone, a cui consegue perdita di funzione
del sistema renina-angiotensina e diminuzione dell’attività reninica plasmatica. Questa
condizione può derivare da una neoplasia surrenalica secernente aldosterone, solitamente un
adenoma, o da un’iperplasia corticosurrenalica primaria. Nell’80% dei casi circa,
l’iperaldosteronismo primario è sostenuto da un adenoma secernente monolaterale,
condizione conosciuta come sindrome di Conn. Essa si verifica con frequenza circa doppia
nelle donne di mezza età rispetto agli uomini.
FIGURA 6: Azione dell’aldosterone sulle cellule epiteliali nella parte distale del nefrone.
Nella forma secondaria, invece, l’aldosterone viene secreto in seguito all’inattivazione del
sistema renina-angiotensina. Sono caratteristici alti livelli di renina plasmatica e la
condizione è di comune riscontro in corso di insufficienza cardiaca congestizia, riduzione
della
perfusione
renale
(nefrosclerosi
arteriolare,
stenosi
dell’arteria
renale),
ipoalbuminemia e gravidanza (per gli aumenti determinati dagli estrogeni dei substrati
reninici del plasma). Le manifestazioni cliniche dell’aldosteronismo primario sono
9
rappresentate da ipertensione e ipocaliemia. I livelli sierici di renina, come accennato, sono
bassi. L’ipocaliemia deriva da perdita renale di potassio e può causare una varia
sintomatologia
neuromuscolare,
tra
cui
astenia,
parestesie,
disturbi
visivi
e,
occasionalmente, tetania franca. La ritenzione di sodio comporta un aumento del sodio
corporeo totale e un’espansione del volume extracellulare, producendo una concentrazione
del sodio intracellulare con aumento della reattività vascolare. L’ipertensione è quindi in
parte il risultato ultimo della ritenzione del sodio. Sia l’espansione del volume extracellulare
che l’ipocaliemia impongono un sovraccarico di lavoro al cuore, talora causando
modificazioni elettrocardiografiche e scompenso cardiaco.
Sindromi adrenogenitali
Le alterazioni della differenziazione sessuale, come la virilizzazione, possono
conseguire ad affezioni primitive delle gonadi ed a parecchie affezioni primitive
surrenaliche. Quest’ultimo gruppo comprende le neoplasie corticosurrenaliche ed un gruppo
di entità denominate iperplasie surrenaliche congenite. Le neoplasie corticosurrenaliche
associate a virilizzazione sono per lo più rappresentate da carcinomi surrenalici a secrezione
androgena piuttosto che da adenomi; si tratta comunque di tumori morfologicamente
identici ad altre neoplasie corticali. Le iperplasie surrenaliche congenite rappresentano un
gruppo di patologie dovute ad errori metabolici congeniti, a trasmissione autosomica
recessiva, caratterizzate dal deficit o dalla totale assenza di enzimi chiave nella sintesi degli
steroidi, soprattutto del cortisolo. A causa del blocco nella sintesi di questo ormone, la
steroidogenesi è convogliata verso altre vie, con il risultato di un aumento nella produzione
di androgeni, responsabili della virilizzazione. Contemporaneamente il deficit di cortisolo
induce un’iperproduzione di ACTH che stimola l’iperplasia della corteccia surrenale. In
alcuni casi, il deficit enzimatico è a scapito anche della produzione di aldosterone,
aggiungendo alla sindrome virilizzante i problemi di una massiva perdita di sali. In altri
casi, il deficit di enzimi che si viene a creare è incompatibile con la vita, oppure può
interessare solo la produzione di aldosterone, senza intaccare la sintesi del cortisolo. Esiste,
quindi, un ampio spettro di sindromi cliniche possibili, in ognuna delle quali il deficit
10
enzimatico può essere tale da bloccare completamente o solo in parte una o più vie della
steroidogenisi. Circa il 90% dei casi di iperplasia surrenalica congenita è dovuto ad un
difetto nella conversione del progesterone in 11-desossicorticosterone da parte dell’enzima
21-idrossilasi. A seconda del tipo della mutazione, questo difetto può essere totale o
parziale. Si distinguono tre diverse sindromi: l’adrenogenitalismo con perdita di sali,
l’adrenogenitalismo virilizzante semplice e l’adrenogenitalismo non classico, che
comprende le forme fruste, completamente asintomatiche o associate a manifestazioni da
eccesso di androgeni solo durante la seconda infanzia e la pubertà. La sindrome con perdita
di sali deriva dall’incapacità di convertire il progesterone in desossicorticosterone a causa
del deficit totale di idrossilasi. La sintesi di mineralcorticoidi è virtualmente assente e
contemporaneamente c’è un blocco nella conversione dell’idrossiprogesterone in
desossicortisolo, con insufficiente sintesi di cortisolo. Durante la vita fetale, l’equilibrio
elettrolitico è mantenuto dal rene materno, ma alla nascita la sindrome si rende subito
manifesta con perdita di sali, iponatremia ed ipercaliemia, cui consegue acidosi,
ipotensione, collasso cardiocircolatorio e, talora, morte. Contemporaneamente, il blocco
nella sintesi del cortisolo e l’eccessiva produzione di androgeni induce virilizzazione, che
nelle femmine può essere evidente già alla nascita o addirittura in utero, ma nei maschi è
difficile da valutare. Nelle femmine si possono osservare vari gradi di virilizzazione, da una
moderata ipertrofia del clitoride ad una completa fusione labioscrotale con ipertrofia
clitoridea così marcata da inglobare l’uretra, con formazione di un organo simil-fallico. Nei
maschi, la sindrome passa inizialmente inosservata finché, 5-15 giorni dopo la nascita,
compare la crisi da perdita dei sali. La sindrome androgenitale virilizzante semplice senza
perdita di sali, che si presenta come ambiguità genitale, si manifesta quando il deficit di 21idrossilasi è solo parziale. In tal caso, la produzione di minaralcorticoidi, anche se
diminuita, è comunque sufficiente a garantire il riassorbimento dei sali; mentre il basso
livello di glucocorticoidi è insufficiente a garantire un controllo inibitorio sulla secrezione di
ACTH. Quindi, il livello di aldosterone è parzialmente ridotto, ma quelli di testosterone e
ACTH sono entrambi aumentati, con conseguente iperplasia corticosurrenalica. Il virilismo
11
surrenalico non comune o ad insorgenza tardiva è molto più comune delle forme “classiche”
appena descritte. Questi pazienti possono essere praticamente asintomatici o manifestare
solo segni lievi di virilizzazione come l’irsutismo.
FIGURA 7: Genitali ambigui con ingrossamento del clitoride e scrotalizzazione delle grandi labbra.
1.4.2 Ipofunzione surrenalica
Insufficienza corticosurrenalica primaria (malattia di Addison)
La malattia di Addison è una rara condizione causata da progressiva distruzione della
corticale surrenalica. In generale, le manifestazioni cliniche dell’iposurrenalismo non si
presentano fino a quando almeno il 90% del parenchima corticosurrenalico non risulti
compromesso. Un gran numero di patologie possono colpire il surrene, tra cui linfomi,
amiloidosi, sarcoidosi, emocromatosi, infezioni fungine ed emorragie, ma oltre il 90% dei
casi di insufficienza cronica sono attribuibili alla surrenalite autoimmune, alla tubercolosi o
a neoplasie metastatiche. La surrenalite autoimmune da sola è responsabile dal 60 al 70%
dei casi, presentandosi in forma sporadica o familiare. Nella metà dei casi il surrene è
l’unico organo colpito dal processo autoimmune, ma nei rimanenti concomitano affezioni
analoghe in altri organi, come la tiroidite di Hashimoto, l’anemia perniciosa, il diabete
mellito tipo I e l’ipoparatiroidismo idiopatico. In circa la metà dei casi di surrenalite
autoimmune sono presenti anticorpi anti-surrene in circolo, così come anticorpi diretti
contro altri organi e tessuti.
12
FIGURA 8: Autoanticorpi anti-corteccia surrenalica (ACA)
determinati tramite immunofluorescenza indiretta.
Nei pazienti affetti c’è una notevole incidenza di particolari antigeni di
istocompatibilità, soprattutto HLA-B8 e DR-3, il che suggerisce l’esistenza di una
predisposizione genetica. Le infezioni, in particolare tubercolare e micotica, possono a loro
volta essere causa della malattia di Addison. La surrenalite tubercolare è ora molto rara
grazie allo sviluppo di agenti antitubercolari. Il coinvolgimento surrenalico deriva quasi
sempre dalla disseminazione di un focolaio primario polmonare o del tratto genitourinario.
L’insufficienza cronica può essere causata anche da infezioni fungine diffuse, sostenute
soprattutto dall’Histoplasma capsulatum e dal Coccidioides immitis. La localizzazione
metastatica è una potenziale causa di insufficienza surrenalica. I surreni rappresentano una
sede abbastanza comune di metastatizzazione in pazienti con carcinomi disseminati.
Nonostante in tali pazienti la funzionalità sia per lo più conservata, le metastasi distruggono
occasionalmente una quantità tale di parenchima da determinare un certo grado di
insufficienza funzionale. Quelle di più frequente riscontro sono di origine polmonare e
mammaria seguite da carcinomi gastrointestinali, melanoma maligno e neoplasie
emopoietiche. La malattia di Addison inizia insidiosamente e non richiama l’attenzione
finché oltre il 90% della corticale, bilateralmente, non è distrutta ed i livelli di steroidi
circolanti non sono scesi notevolmente. Inizialmente si manifesta con facile affaticabilità e
progressiva debolezza, sintomi ai quali non viene generalmente dato grande valore. Comuni
sono i disturbi gastrointestinali, rappresentati da anoressia, nausea, vomito, perdita di peso e
diarrea. Nei pazienti con malattia surrenalica primitiva, gli alti livelli circolanti di precursori
dell’ACTH stimolano i melanociti, con conseguente iperpigmentazione cutanea, soprattutto
13
nelle zone fotoesposte e dei punti soggetti a pressione, come collo, gomiti, ginocchia e
nocche delle dita. Al contrario, l’iperpigmentazione non si riscontra in pazienti affetti da
insufficienza corticosurrenalica secondaria a malattie primitive della regione ipotalamoipofisaria. La riduzione dell’attività mineralcorticoide nell’insufficienza primaria porta a
perdita di sodio e potassio, a cui segue ipercaliemia, iponatremia, diminuzione dei fluidi
corporei ed ipotensione. Il cuore presenta spesso dimensioni ridotte, a causa dell’ipovolemia
cronica. L’ipoglicemia è una conseguenza occasionale del deficit di glucocorticoidi e della
diminuita gluconeogenesi. Gli stress costituiti da infezioni, traumi, manovre chirurgiche
possono scatenare in tali pazienti una crisi surrenalica acuta, che si manifesta con vomito
incoercibile, dolore addominale, ipotensione, coma e collasso vascolare. Questi pazienti
vanno rapidamente incontro a morte a meno che non venga intrapresa immediatamente una
terapia sostitutiva corticosteroidea.
Insufficienza corticosurrenalica secondaria
Una qualsiasi affezione dell’ipotalamo o dell’ipofisi, come una metastasi,
un’infezione, un infarto o danni da radioterapia, che causi una diminuzione del rilascio di
ACTH può condurre allo sviluppo di un iposurrenalismo molto simile alla malattia di
Addison. Analogamente agisce la prolungata somministrazione di glucocorticoidi esogeni,
sopprimendo la secrezione di ACTH e la funzione surrenalica. Tuttavia se l’iposurrenalismo
è secondario, manca l’iperpigmentazione cutanea, poiché i livelli di ormone melanotropo
restano bassi. Inoltre l’iposurrenalismo secondario è caratterizzato da deficit di cortisolo e di
androgeni, ma la sintesi di aldosterone è nella norma. Quindi nell’iposurrenalismo
secondario a insufficienza ipofisaria non c’è marcata iponatremia e ipercaliemia. Il deficit di
ACTH si può manifestare da solo, anche se in molti casi rappresenta parte di un
panipopituitarismo, associato a deficit multipli di altre tropine.
Neoplasie corticali
Le neoplasie surrenaliche funzionali possono sostenere una qualsiasi delle forme di
ipersurrenalismo, anche se non tutte le neoplasie del corticosurrene elaborano ormoni
steroidei. Gli adenomi corticosurrenalici sono per la maggior parte tumori non funzionanti
14
di riscontro incidentale. L’adenoma corticale classico è una lesione nodulare, ben
circoscritta, fino a 2.5 cm di asse maggiore, che provoca aumento di dimensione del surrene.
Alcuni adenomi protrudono dalla capsula, altri sono contenuti nello spessore corticale, altri
sembrano inglobati nella midollare. I carcinomi corticosurrenalici sono neoplasie rare che
insorgono ad ogni età. Sono più frequentemente funzionanti degli adenomi e pertanto spesso
associati a virilizzazione o altre manifestazioni cliniche di iperfunzione surrenalica. Questi
tumori sono generalmente molto voluminosi (fino a oltre 20 cm) al momento della diagnosi,
e hanno un alto grado di malignità (3).
1.4.3 Incidentalomi
Con questo termine si intendono masse surrenaliche riscontrate casualmente in
occasione di esami per immagini eseguiti per motivi diversi, non inerenti a patologie del
surrene. L’occasionale osservazione di tali masse è stata stimata essere dello 0.5-1.5% di
tutti i pazienti sottoposti a TAC dell’addome superiore. Le dimensioni variano da pochi
millimetri fino a 10 cm di diametro. Gli incidentalomi costituiscono attualmente la patologia
surrenalica di più frequente riscontro clinico. Tali masse si rivelano essere adenomi (3353%) o carcinomi (fino al 18% dei casi) del surrene, feocromocitomi (0-23%), metastasi
(0.5-21%), cisti (3-8%), semplici iperplasie (0-14%) (2).
1.5 Il carcinoma adrenocorticale
Il carcinoma adrenocorticale (CAC) è una affezione rara, la cui incidenza è circa di
1-2 casi per milione all’anno (4). Insorge principalmente nei bambini sotto i 3 anni e negli
adulti fra i 40 e i 50 anni, con una frequenza leggermente maggiore nel sesso femminile.
Nonostante abbia solitamente origine sporadica, può far parte di patologie congenite
o famigliari, come la Sindrome di Li-Fraumeni e la sindrome di Beckwith-Wiedemann.
15
FIGURA 9: CAC aderente al rene.
1.5.1 CAC associati ad iperfunzione
I CAC ipersecretori sono comunemente caratterizzati da una secrezione aumentata
combinata di glucocorticoidi ed androgeni. I glucocorticoidi sono responsabili della
sindrome di Cushing, caratterizzata da obesità localizzata al tronco, perdita di proteine e
conseguente formazione di strie cutanee, atrofia muscolare (miopatia) ed osteoporosi,
aumentata suscettibilità alle infezioni, diabete, ipertensione, disturbi psichiatrici, disfunzioni
gonadiche in uomini e donne. L’ipersecrezione di androgeni può essere alla base di una
serie di cambiamenti nella donna, caratterizzati da irsutismo, anomalie mestruali, infertilità
ed eventualmente virilizzazione franca, caratterizzata da calvizie, abbassamento della voce
ed ipertrofia del clitoride. Possono essere ipersecreti anche altri steroidi biologicamente
attivi. L’ipersecrezione di desossicorticosterone può portare ad un grave quadro clinico da
eccesso di mineralcorticoidi, caratterizzato da ipertensione ed ipocaliemia. Eccezionalmente
tumori con secrezione di estrogeni possono provocare ginecomastia nell’uomo e metrorragia
dopo la menopausa nelle donne. Un significativo sottogruppo di CAC secerne solo o
prevalentemente una singola classe di steroidi biologicamente attivi, molto spesso
androgeni, ma anche cortisolo (6, 8, 9, 10).
1.5.2 CAC non associati ad iperfunzione
Alcuni CAC non-ipersecretori non presentano un quadro clinico da eccesso
ormonale, ma possono produrre precursori biologicamente inattivi di steroidi, come 1716
idrossiprogesterone. Solitamente tali tumori vengono diagnosticati come incidentalomi (8,
11), in occasione di esami per immagini eseguiti per motivi non correlati a patologia
surrenalica. Frequentemente i CAC non associati ad iperfunzione vengono diagnosticati
grazie a sintomi dovuti all’espansione del tumore. Essi riguardano manifestazioni locali,
come dolore e palpazione della massa o metastasi a distanza, soprattutto a fegato, polmoni
ed ossa. Il paziente può presentare febbre in concomitanza con la necrosi tumorale. Nella
maggior parte dei casi lo stato generale del paziente non è deteriorato, perfino in presenza di
una impressionante massa tumorale e di metastasi. Ciò spiega perché i CAC non associati
ad ipersecrezione spesso vengano diagnosticati tardivamente (12).
1.5.3 Diagnosi di CAC
Le indagini indicate per la diagnosi di CAC sono lo studio completo della
funzionalità adrenocorticale e gli esami per immagini.
Studio della funzionalità adrenocorticale
L’indagine endocrinologica di routine valuta la secrezione di vari steroidi
adrenocorticali. L’ipersecrezione di cortisolo ACTH- indipendente è facilmente valutabile.
Essa porta all’aumento del cortisolo urinario, che non è sopprimibile con alte dosi di
desametasone, associato a livelli plasmatici di ACTH non rilevabili. Anche i livelli
plasmatici di 17-idrossiprogesterone sono elevati (di base e/o dopo stimolazione da ACTH),
come lo sono quelli di deidroepiandrosterone solfato (DHEAS), androgeno surrenalico
specifico, che portano all’aumento della concentrazione plasmatica di testosterone nelle
femmine. Altri steroidi, come DOC, Delta-4-androstenedione e, raramente, estrogeni,
possono essere prodotti in eccesso dal tumore. Eccezionalmente può verificarsi la
produzione di aldosterone. Ciò diventa clinicamente importante per tumori sopra i 3 cm, a
causa degli alti livelli plasmatici di aldosterone e della possibile associazione con la
secrezione di cortisolo o altri steroidi, che escludono la diagnosi di adenoma di Conn. Il tipo
e l’entità della secrezione ormonale non consentono la distinzione fra adenoma e carcinoma,
ma sono utili dopo l'asportazione del tumore come marcatori di ripresa di malattia. La
17
valutazione della secrezione urinaria di adrenalina, noradrenalina, e dei loro metaboliti sono
utili per la differenziazione da masse originanti dalla parte midollare del surrene.
Diagnostica per immagini
Per quanto riguarda la diagnostica per immagini si procede solitamente con ecografia
associata a tomografia assiale computerizzata (TAC) o risonanza magnetica (RMN)
addominale. I reperti tipici sono quelli di una massa, ben delimitata da una sottile capsula,
che può presentare una zona centrale necrotico-emorragica e calcificazioni. La misurazione
della massa è di particolare importanza perché grandi dimensioni sembrano essere predittive
di malignità. È importante valutare il surrene controlaterale che può presentare una massa o
un'ipotrofia, provocata dall'ipersecrezione controlaterale (13, 14).
La TAC del surrene è il metodo di indagine più utilizzato (15). Tale tecnica è in
grado di evidenziare i tipici caratteri che suggeriscono la malignità del tumore, rappresentati
dalla disomogeneità del tumore con zone di necrosi, talvolta calcificazioni, margini
irregolari. Nel tumore maligno la densità ai Raggi-X è alta (sopra 20 UG). Ciò indica un
basso contenuto lipidico in opposizione a ciò che si evidenzia negli adenomi. La
misurazione dinamica della densità mediante contrasto rappresenta la tecnica più sensibile
per la distinzione fra lesione benigna e maligna. La TAC contribuisce inoltre alla
evidenziazione di invasione locale e metastasi a distanza. L’invasione dei vasi locoregionali attraverso le vene renali e la vena cava inferiore può risalire fino all’atrio destro e
causare embolismo metastatico polmonare (16).
18
FIGURA 10: CT scan: CAC destro con invasione contigua del fegato ed invasione della vena cava.
La TAC del torace e la scintigrafia ossea sono raccomandate per escludere la presenza di
metastasi polmonari e ossee. La scintigrafia del surrene con iodo-colesterolo non è
essenziale, ma può aiutare in situazioni particolari di difficile diagnosi (17). La RMN e/o
l’ecografia possono contribuire alla diagnosi di noduli epatici ed invasione venosa. Recenti
studi hanno dimostrato che i CAC quasi sempre presentano una elevata captazione di 18fluorodesossiglucosio. Per tale motivo, la tomografia ad emissione di positroni con 18fluorodesossiglucosio (18FDG-PET scan) può permettere di distinguere tra tumore
adrenocorticale maligno e benigno. Tale procedura non invasiva contribuisce inoltre alla
valutazione della estensione della massa (18, 19, 20).
Una volta dimostrata l’evidenza per CAC, è necessario procedere con la stadiazione e
la valutazione prognostica, prima di decidere l’approccio terapeutico. Un tumore eterogeneo
sopra i 6 cm, con ipersecrezione combinata di cortisolo e androgeni permette una facile
diagnosi, con o senza evidenza di metastasi a distanza. Un tumore piccolo (4-5 cm) senza
evidente secrezione di steroidi o disseminazione locale o a distanza può essere un problema
diagnostico (21). In caso di dubbio, la presenza di un singolo indizio che faccia sospettare
malignità è indicativo per l’intervento chirurgico. Un primo approccio per la stadiazione, e
di conseguenza per la valutazione prognostica, è rappresentato dalle dimensioni del tumore
e dalla presenza o assenza di metastasi a distanza.
19
1.5.4 Prognosi in pazienti con CAC
La distinzione fra carcinoma e adenoma adrenocorticale è molto difficile. La
dimensione del tumore è di per sé un eccellente indicatore di malignità (22). Mentre tumori
sopra i 6 cm hanno il 25% di possibilità di essere maligni, tumori sotto i 4 cm hanno il 2%
di possibilità di esserlo. Non vi è una singola caratteristica patologica che consenta di fare
diagnosi di tumore adrenocorticale maligno. I patologi hanno elaborato paradigmi usando
una combinazione di vari parametri istologici che rendono possibile stabilire un “punteggio”
per un dato tumore. La scala più utilizzata è il punteggio di Weiss (23), che prende in
considerazione nove differenti parametri: ad ognuno viene attribuito il valore 1 quando
presente, 0 quando assente. Il punteggio finale si ottiene sommando i valori ottenuti per ogni
parametro. Un punteggio superiore a 3 è solitamente associato a tumore maligno, nonostante
ci sia una forte possibilità di associazione a malignità anche con valori inferiori (addirittura
sotto 2).
FIGURA 11: Criteri istopatologici proposti da Weiss per la diagnosi differenziale fra CAC e adenoma.
20
Ultimamente sono stati studiati molti marcatori molecolari come predittori di
malignità nel CAC. Attraverso questi studi sono state evidenziate anomalie genetiche
associate a prognosi sfavorevole:
un’alta espressione di IGF-2 è presente nel 90% dei CAC, ma non negli adenomi.
Uno specifico riarrangiamento del gene a livello del locus IGF-2 (11p15) può portare
sia alla perdita dell’allele materno e alla duplicazione di quello paterno, sia alla
perdita del normale imprinting materno, generando altre modifiche dell’espressione
del gene che favoriscono la crescita cellulare (5, 24);
la perdita dell’allele al locus 17p13 è presente nell’85% dei CAC e quasi mai negli
adenomi con punteggio di Weiss inferiore a 1. Questo locus comprende il gene p53.
Ciononostante, mutazioni di p53 sono state trovate in una piccolissima percentuale di
CAC, suggerendo che in tale locus possa essere presente un non ancora identificato
gene oncosoppressore. Uno studio prospettico ha inoltre evidenziato come la perdita
di eterozigosi (LOH) in 17p13 sia un fattore predittivo indipendente di malignità del
CAC (25);
recentemente l’overespressione della Ciclina E nelle cellule tumorali è stata
fortemente associata a fenotipo tumorale maligno (26).
Poiché tali anomalie molecolari sono state evidenziate prevalentemente in tumori con
punteggio di Weiss inferiore a 3 o addirittura 2, è chiaro che tale punteggio non ha
un’ottimale sensibilità diagnostica. Per questo motivo è stata proposta una modifica del
punteggio di Weiss, che prende in considerazione soltanto i parametri istologici più
indicativi. Tali parametri sono l’indice mitotico (2 punti), la presenza di cellule chiare 25%
(2 punti), le mitosi atipiche (1 punto), la necrosi (1 punto) e l’invasione vascolare (1 punto).
Un punteggio superiore a 3 è solitamente associato a malignità.
Le possibilità di guarigione sono legate all’estensione della malattia. La maggior
parte degli anatomopatologi basa le prognosi sulla seguente stadiazione, derivante dalla
modifica della stadiazione secondo il sistema Mac Farlane (27):
21
STADIO I
T1 N0 M0: tumore localizzato, con dimensioni < 5 cm;
STADIO II
T2 N0 M0: tumore localizzato, con dimensioni > 5 cm;
STADIO III
T1-2 N1 M0 / T3-4 N1 M0: tumore di qualsiasi dimensione che abbia
infiltrato tessuti ed organi adiacenti e/o presenti invasione linfonodale o dei vasi
ematici;
STADIO IV
T1-4 M1: tumore con metastasi a distanza.
Le probabilità di guarigione variano dal 15% al 70% in rapporto principalmente alla
radicalità dell’asportazione chirurgica della massa ed alla presenza di metastasi. Altri fattori
prognostici sono l’età (bambini < 3 anni sembrano avere prognosi migliore), la secrezione di
cortisolo (tali CAC hanno una sopravvivenza ridotta e sono caratteristici dell’adulto; i CAC
legati ad iperfunzione nei bambini presentano solitamente secrezioni di androgeni) e le
dimensioni in peso e/o volume della massa asportata, dato importante anche per orientare la
diagnosi differenziale fra adenoma e carcinoma. Una massa di piccole dimensioni orienta
per una lesione benigna e questo rimane molto spesso l'unico criterio di distinzione
benignità/malignità anche dopo l'asportazione. In genere neoplasie con volume < 200 cm3 o
con dimensione massima < 5 cm hanno possibilità di guarigione dell'80-90%; neoplasie al
di sopra di tali limiti hanno prognosi peggiore (possibilità di guarigione del 40-50%). Gli
aspetti istologici non rappresentano nel bambino criteri prognostici affidabili (12).
1.5.5 Terapia in pazienti con CAC
Il carcinoma adrenocorticale è una affezione con prognosi infausta (6, 21, 28). Ad
oggi l’asportazione completa del tumore è l'unica modalità terapeutica che consente di
ottenere la guarigione. In assenza di metastasi, l'asportazione rappresenta di regola l’unico
trattamento. La massa dovrebbe essere rimossa intera, asportando tutte le aree sospette che
la circondano ed i linfonodi regionali aumentati di volume. La migliore possibilità di cura si
ha quando un tumore localizzato (stadio 1 o 2 del MacFarlane modificato) è soggetto a
completa asportazione (chirurgia “curativa”). Purtroppo almeno al 50% dei pazienti viene
fatta diagnosi di CAC in stadi avanzati (tumore invasivo o metastatico), con probabilità di
22
sopravvivenza a 5 anni pari a 0% per carcinoma metastatico. Anche in seguito a chirurgia
“curativa” di tumori localizzati, in più del 50% dei pazienti vi è recidiva della malattia. Vi è
quindi necessità di disporre di trattamenti per i casi di CAC avanzato e di trattamenti
adiuvanti che impediscano la recidiva del tumore dopo asportazione chirurgica. L'impiego
di trattamenti medici è di dubbia efficacia e di regola raccomandato solo nei casi con
metastasi alla diagnosi, nei tumori localizzati ma inoperabili inizialmente o in caso di
residui dopo l'asportazione della massa. È controversa l'utilità della terapia medica dopo
l’asportazione completa di masse molto voluminose (superiori a 200 cm3) o localmente
invasive. In letteratura sono descritti l'impiego di mitotane, di chemioterapia o loro
combinazioni.
Il mitotane
Il mitotane (1,1dicloro-2(o-clorofenil)-2-(p-clorofenil)etano;o,p’DDD) è un isomero
dell’insetticida p,p’DDD, chimicamente correlato al DDT. Più di 40 anni fa è stato descritto
il primo efficace utilizzo di tale sostanza in pazienti con CAC metastatico, dimostrando la
diminuzione dell’ipersecrezione di cortisolo e l’azione antitumorale del farmaco (29).
FIG. 12: Mitotane (1,1dicloro-2(o-clorofenil)-2-(p-clorofenil)etano;o,p’DDD)
Il meccanismo d'azione di questa molecola non è stato ancora completamente chiarito,
nonostante l'esteso uso clinico. Esso possiede attività adrenolitica con specificità per la
corteccia surrenalica, inibendo la conversione intramitocondriale del colesterolo a
pregnenolone e dell’11-desossicortisolo a cortisolo (30). È inoltre in grado di causare
necrosi surrenalica selettiva, anche a livello di localizzazioni secondarie, e di contrastare la
23
chemioresistenza del tumore riducendo la fuoriuscita cellulare di farmaci per inibizione,
almeno in vitro, dell’espressione del gene MDR1 (31). L’azione citotossica si evidenzia in
animali da esperimento con accumulo di lipidi ed atrofia della corteccia surrenalica,
soprattutto a carico delle regioni fascicolata e reticolare (32); le alterazione a carico della
glomerulare sono relativamente poco evidenti. Alla microscopia elettronica si osserva
distruzione delle creste mitocondriali seguita da rigonfiamento mitocondriale, lisi e quindi
morte della cellula già dopo 12 ore di trattamento (33). L’effetto inibitorio sulla
steroidogenesi si esplica prevalentemente sulla conversione del colesterolo a pregnenolone,
facendo presupporre un coinvolgimento dell’enzima citrocromo P450scc (Cholesterol Side
Chain Cleaveage Enzyme) (34). Il farmaco inibisce anche altri enzimi citocromo P-450
dipendenti (11- e 18-β-idrossilasi) e non P-450 dipendenti (3-β-idrossisteroidodeidrogenasi)
(35). Il mitotane viene routinariamente somministrato in compresse da 500 mg (Lysodren,
Bristol Meyer Squibb) in base alla tollerabilità ed ai livelli sierici del farmaco. Per via
dell’elevata tossicità, si consiglia di monitorare le concentrazioni ematiche del farmaco;
livelli ematici superiori a 14 mg/l sono in grado di esprimere effetto antineoplastico. Valori
superiori a 20 mg/l sono invece frequentemente associati ad effetti collaterali: solo pazienti
che hanno raggiunto tali livelli sviluppavano tossicità neurologica di grado 3-4 (36). I livelli
ematici non sono così chiaramente correlati alla dose somministrata e per questa ragione il
monitoraggio può essere utile al fine di migliorare la qualità di vita dei pazienti. A causa
della lunga emivita del o,p’DDD, i livelli considerati terapeutici in genere vengono
raggiunti dopo alcuni mesi di terapia (37). L’uso di basse dosi per lunghi periodi,
monitorandone i livelli plasmatici, rende inoltre il mitotane adatto alla terapia adiuvante
(38), consentendo il raggiungimento di concentrazioni plasmatiche adeguate, sebbene non
sia mai stato definito un valore soglia per l’efficacia dell’effetto antineoplastico del
farmaco. È possibile che gli effetti terapeutici delle basse dosi possano rivelarsi migliori di
quelli delle alti dosi grazie alla migliore compliance dei pazienti ad un trattamento
continuativo. Il monitoraggio dei livelli plasmatici permette inoltre di raggiungere i livelli
considerati terapeutici con dosi effettivamente più basse riducendo gli effetti collaterali ed
24
ottenendo una migliore tollerabilità. Gli effetti collaterali dipendono dalla dose e sono
sostanzialmente di tipo gastroenterologico (diarrea, nausea, anoressia), frequenti a dosi pari
a 12 g/die, o riguardanti il SNC (letargia, atassia, confusione, vertigini) (39, 40) e tendono a
risolversi lentamente dopo la sospensione del farmaco (6, 41).
La chemioterapia
Per quanto riguarda la chemioterapia, i farmaci più frequentemente impiegati sono il
cisplatino, l'etoposide, l’adriamicina (o doxorubicina), il 5-fluorouracile e la vincristina.
Solo
l’adriamicina
ed
il
cisplatino
hanno
mostrato
una
qualche
attività
in
monochemioterapia (42)
1.6 La chemioresistenza
Il principale problema che si manifesta successivamente al trattamento dei pazienti
affetti da diverse neoplasie endocrino-relate con chemioterapici è l’insorgenza della
chemioresistenza. Questo fenomeno, che vanifica i trattamenti con sostanze normalmente
utilizzate nella terapia contro il cancro, è dato dalla diminuzione, nel lume cellulare, della
concentrazione dei chemioterapici ed è dovuto in massima parte all’aumentata espressione
del gene Multidrug Resistance Type 1 (MDR1) localizzato sul cromosoma 7 e formato da
28 esoni. MDR1 codifica per la proteina Permeability Glycoprotein (P-gp), costituita da
1280 amminoacidi (43). P-gp è una glicoproteina transmembranaria appartenente alla
superfamiglia dei trasportatori di membrana ATP Binding Cassette (ABC) di circa 170
chilodalton (44). P-gp è composta da 2 unità identiche ognuna costituita da sei domini
transmembrana α-elica che formano la via di traslocazione ed un dominio citosolico che
accoppia il legame con l’ATP alla traslocazione del substrato (45).
25
FIGURA 13: Permeability Glycoprotein (P-gp).
L’espressione di questo gene è in grado di conferire il fenotipo chemioresistenza a
cellule normalmente sensibili al trattamento con chemioterapici (46). P-gp conferisce infatti
alle cellule tumorali la capacità di resistere a dosi letali di farmaci citotossici, pompando
attivamente i farmaci al di fuori delle cellule e riducendone quindi la citotossicità. P-gp
necessita dell’energia derivante dall’idrolisi dell’ATP per espletare la sua funzione di
pompa. I livelli di chemioresistenza alle differenti sostanze possono essere alterati da
mutazioni spontanee del gene MDR1 (47). P-gp è omologa ad un gruppo di proteine di
trasporto ATP-dipendenti associate alla membrana presenti nei batteri (48). Tale proteina ha
la capacità di permettere il trasporto di sostanze diverse tra loro in composizione chimica,
carica e dimensioni ed è implicata nel conferimento del fenotipo chemioresistenza in cancro,
malaria ed infezioni batteriche (49, 50, 51). I substrati dei P-gp possono essere endogeni
(ormoni steroidei, citochine) o xenobiotici (farmaci citostatici) (52). P-gp trasporta farmaci
citotossici, allo stesso modo di sostanze esogene, come la digossina, gli oppioidi, gli
idrocarburi policiclici aromatici, il tecnezio sestamibi e la rodamina 123. Questi ultimi due
composti vengono utilizzati per visualizzare la funzione della nelle cellule normali e
tumorali. È stato dimostrato che la proteina è maggiormente espressa nelle neoplasie
derivanti da tessuti che esprimono normalmente MDR1, come le cellule del colon, del rene,
del surrene, del pancreas e del fegato, dove trasporta attivamente gli xenobiotici lipofili.
L’espressione di P-gp è costitutiva, ma può essere anche indotta da varie sostanze. La
26
modulazione dell’espressione di questa proteina può quindi influenzare l’attività e la
biodisponibilità dei farmaci a livello cellulare. Nell’intestino la modulazione di P-gp può
controllare il grado di assorbimento di vari farmaci. Presso la barriera emato-encefalica la
proteina può influenzare la captazione dei substrati a livello cerebrale: un’elevata
espressione di P-gp può limitare la captazione di quantità sufficienti di farmaci
nell’encefalo, mentre un’attività ridotta della stessa può portare ad un accumulo abnorme di
farmaci a livello cerebrale e ad effetti collaterali (53). La P-gp umana è una proteina analoga
ai trasportatori ABC dei batteri. Analogamente ad essi è formata da quattro distinti domini:
due domini integrali di membrana altamente idrofobici e due domini idrofilici che legano i
nucleotidi localizzati sulla faccia citoplasmatica della membrana. P-gp è formata da due
subunità identiche, ciascuna composta da un dominio integrale di membrana e da un
dominio che lega i nucleotidi; la sequenza amminoacidica delle due subunità è strettamente
correlata, suggerendo una pseudo-simmetria della struttura della proteina. Le due metà sono
separate da una regione di legame che è fosforilata in diversi siti dalla proteina chinasi C. La
fosforilazione di questa regione non sembra essere necessaria per il trasporto attivo dei
substrati, ma modula la capacità di P-gp di regolare i canali ionici eterologhi (54).
I domini integrali di membrana di P-gp hanno due ruoli centrali nel processo di trasporto. In
primo luogo essi formano il canale all’interno del quale i soluti sono traslocati attraverso la
membrana; in secondo luogo essi forniscono i residui amminoacidici che interagiscono
direttamente con il substrato e formano i siti di legame per esso. Ogni dominio integrale di
membrana della P-gp consta di sei α-eliche separate da residui idrofilici, per un totale di
dodici α-eliche per molecola (Figura 13). I due domini di legame dei nucleotidi di P-gp
condividono il 30-40% della sequenza amminoacidica tra di loro e con gli equivalenti
domini di altri trasportatori ABC. Questi domini legano ed idrolizzano l’ATP ed accoppiano
l’idrolisi dell’ATP alla traslocazione dei soluti attraverso la membrana. È stato dimostrato
che la superfamiglia dei trasportatori di membrana ATP-dipendenti trasloca un’ampia
gamma di substrati, tra i quali gli zuccheri, gli amminoacidi, gli ioni metallici, i peptidi e le
proteine, composti idrofobici e metaboliti attraverso le membrane extracellulare ed
27
intracellulare. I geni che codificano per questi trasportatori sono fondamentali per molti
processi nelle cellule. Mutazioni a loro carico possono infatti determinare o favorire molti
disordini genetici umani, tra i quali la fibrosi cistica, disordini neurologici, degenerazione
retinica, difetti di trasporto del colesterolo e della bile, anemia ed alterata risposta ai farmaci
(55). Il trasporto delle sostanze attraverso la membrana plasmatica è molto complesso e
coinvolge interazioni allosteriche tra diversi siti di riconoscimento delle sostanze traslocate
e i due siti che legano l’ATP (NBDs) (56). Il meccanismo di trasduzione dell’energia è
ancora sconosciuto, ma probabilmente esso coinvolge cambiamenti conformazionali indotti
dall’idrolisi dell’ATP. Se osservata dalla superficie extracellulare della membrana la
proteina è a forma circolare, con un anello proteico del diametro di circa 10 nm che circonda
un largo poro centrale. L’anello della proteina ha due importanti funzioni: è dotato di
simmetria e può essere presente un gap che rappresenta probabilmente l’accesso tra il poro
centrale e la fase lipidica (56). La proteina cambia conformazione al passaggio delle
sostanze. Esistono infatti una forma aperta ed una forma chiusa (57).
A fronte dei progressi nel trattamento delle neoplasie, la chemioresistenza
multifarmacologica rappresenta la principale causa di fallimento terapeutico. Essa è un
fenomeno per cui le cellule tumorali, sottoposte ad un trattamento con un agente citotossico,
sviluppano una reattività crociata nei confronti di un gruppo di composti non correlati né
strutturalmente, né funzionalmente. Quando le cellule sono resistenti non rispondono a
nessun agente antitumorale e quindi ogni trattamento risulta inefficace. Alcune neoplasie
sono inizialmente resistenti alla maggior parte degli agenti antineoplastici mentre altre,
inizialmente sensibili agli agenti citotossici, sviluppano frequentemente resistenza nei
confronti di un elevato numero di agenti chemioterapici, compresi quelli utilizzati nel
trattamento primario. Questo fenomeno è dovuto all’autoinduzione del gene MDR1 (58). La
chemioresistenza di cellule tumorali è il risultato dell’overespressione dei trasportatori di
membrana, quali P-gp. Quest’ultima determina un aumentato efflusso di farmaci citotossici
dalle cellule tumorali, riducendone quindi la concentrazione intracellulare. Inoltre, P-gp è
espressa in alcune neoplasie in assenza di una precedente esposizione ad agenti
28
chemioterapici. L’espressione e la funzionalità del prodotto del gene MDR1 può influenzare
direttamente l’effetto terapeutico di questi farmaci. Ciò è importante soprattutto nella terapia
delle neoplasie dove l’elevata espressione ed attività di MDR1 rendono le cellule tumorali
refrattarie al trattamento con molti farmaci che sono substrati di P-gp. I farmaci citotossici
che sono più frequentemente associati a P-gp sono prodotti naturali idrofobici, anfipatici,
come taxani, alcaloidi della vinca (vincristina, vinblastina), antracicline (doxorubicina,
epirubicina, daunorubicina), epipodofillotossine (etoposide, teniposide), topotecano,
dactinomicina e mitomicina C (59). Nel corso degli anni sono stati identificati molti agenti
che modulano la funzione della P-gp. Questi modulatori possono aumentare l’accumulo dei
farmaci nelle neoplasie che esprimono P-gp e nei tessuti normali. Essi comprendono i
bloccanti dei canali del calcio, gli antagonisti della calmodulina, gli steroidi, gli inibitori
della protein-chinasi C, i farmaci immunosoppressori, gli antibiotici ed i surfattanti. I
modulatori di prima generazione sono stati identificati negli anni ottanta e comprendono il
verapamile, la ciclosporina, il tamoxifene e molti antagonisti della calmodulina. Essi
presentano una bassa affinità di legame; perciò sono necessarie dosi elevate, che danno
luogo a tossicità, per poter restituire sensibilità alle cellule dotate di resistenza
multifarmacologica che overesprimono P-gp (60). Molti di questi farmaci sono essi stessi
substrati per P-gp e quindi competono con i composti citotossici per l’efflusso della pompa.
Infine, essendo molti di essi substrati anche per altri trasportatori e sistemi enzimatici, si
possono evidenziare interazioni farmacologiche imprevedibili in presenza di agenti
chemioterapici (60). Gli agenti modulatori di P-gp di seconda generazione comprendono il
dexverapamile, la dexniguldipina, il valspodar e il biricodar. Questi agenti sono più potenti
di quelli di prima generazione ed anche meno tossici, possedendo un miglior profilo
farmacologico. Essi inibiscono però il metabolismo e l’escrezione degli agenti citotossici,
comportando quindi tossicità. Gli inibitori di terza generazione (tariquidar XR9576,
zosuquidar LY335979, laniquidar R101933 e ONT-093) possiedono elevata affinità e
specificità per P-gp. Finora, però, non è stato dimostrata alcuna interazione farmacologica
clinicamente rilevante con i comuni agenti chemioterapici. Il continuo sviluppo di questi
29
agenti potrebbe rappresentare un potenziale trattamento delle neoplasie chemioresistenti
(60).
Ad oggi sono stati scoperti più di 50 polimorfismi di un singolo nucleotide (SNPs) a
carico di MDR1.
FIGURA 14: Localizzazione dei polimorfismi in relazione alla struttura degli esoni di MDR-1 e alla probabile
disposizione di P-gp.
Studi hanno evidenziato come, tra questi, uno SNP sinonimo nell’esone 26 (C3435T), uno
SNP sinonimo nell’esone 12 (C1236T) ed uno SNP non-sinonimo nell’esone 22
(G2677T/A) siano spesso associati ad una alterata attività di P-gp. Molti studi si sono
focalizzati sugli effetti individuali di C3435T, soprattutto in relazione alla variazione della
chemioresistenza (61). Gli individui omozigoti TT per C3435T dimostrano in vivo
diminuzione dell’attività di P-gp, ridotta funzione delle proteine nelle cellule di sangue
periferico, aumento dei livelli plasmatici di digossina, diminuzione dell’efflusso di
rodamina 123 e minor livello di espressione dell’mRNA di MDR1 nei leucociti, rispetto ai
genotipi CT e CC. Quindi, l’attività della proteina P-gp sembrerebbe essere elevata nei
soggetti omozigoti CC, moderata nei soggetti eterozigoti CT e ridotta nei soggetti omozigoti
TT. Infatti, gli individui omozigoti TT mostrano una espressione quattro volte minore di Pgp rispetto agli individui omozigoti CC e, come risultato, pazienti di questo tipo rivelano un
alto livello plasmatico di digossina dopo somministrazione orale. Siccome una
overespressione della proteina P-gp è stata associata ad alterazione dell’assorbimento dei
30
farmaci, tale SNP potrebbe offrire un utile approccio per individuare la corretta terapia. Per
facilitare l’applicazione clinica, 1280 soggetti provenienti da 10 differenti gruppi etnici sono
stati studiati per questo SNP attraverso la tecnica RFLP PCR (reazione a catena della
polimerasi- polimorfismo della lunghezza dei frammenti di restrizione) e, per ogni gruppo,
sono state accertate la frequenza allelica e genotipica. Sono state riscontrate marcate
differenze nella frequenza allelica ed in quella genotipica fra le popolazioni Africane e
quelle Asiatiche/Caucasiche. Il primo gruppo presenta una frequenza media dell’81% per
l’allele C, rispetto ad una frequenza media del 49% per il secondo gruppo. L’elevata
frequenza dell’allele C nelle popolazioni Africane implica una overespressione di P-gp e
può avere importanti implicazioni terapeutiche e prognostiche per l’utilizzo di farmaci P-gpdipendenti in individui con tale caratteristica (62).
31
2. Scopo dello studio
Caratteristica del CAC è quella di essere fortemente chemioresistente, per cui risulta
difficile trovare una terapia farmacologica efficace per tale affezione. La chemioresistenza,
in tali cellule tumorali, è legata ad una iperespressione di MDR1, con conseguente aumento
di sintesi della proteina P-gp. Studi precedenti hanno inoltre dimostrato che il mitotane è di
grado di modulare l’espressione di MDR1, contrastando così la resistenza del tumore (32).
Scopo del nostro studio è stato quello di valutare il genotipo per il polimorfismo C3435T
del gene MDR1 in una casistica di pazienti affetti da CAC, confrontandola con una
popolazione di soggetti non affetti da tale neoplasia, e verificare se la risposta alla terapia
potesse variare in base alla presenza del polimorfismo. Inoltre, sulle cellule di una linea
cellulare continua di CAC umano, le NCI-H295, sono stati valutati:
il genotipo per il polimorfismo C3435T di MDR1,
l’espressione di MDR1,
la resistenza a comuni chemioterapici.
32
3. Materiali e metodi
3.1 Soggetti studiati
In collaborazione con l’Istituto di Medicina Interna dell’Università di Torino (Prof.
Massimo Terzolo) sono stati raccolti campioni di sangue venoso periferico (addizionati di
anticoagulante) provenienti da 31 pazienti affetti da CAC.
PAZIENTE SESSO ETÀ
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
M
F
F
M
F
F
M
F
M
M
M
M
F
F
F
F
F
F
F
M
M
M
M
F
M
M
F
M
F
M
F
47
62
43
34
33
42
24
71
52
33
33
31
35
58
44
34
36
53
31
56
31
36
59
41
35
46
44
75
55
37
37
RESPONSIVITÀ ALLA
CHEMIOTERAPIA
PROGRESSIONE MALATTIA
MAI ESEGUITA
MAI ESEGUITA
PROGRESSIONE MALATTIA
MAI ESEGUITA
PROGRESSIONE MALATTIA
RISPOSTA PARZIALE
MAI ESEGUITA
MAI ESEGUITA
MAI ESEGUITA
RECIDIVA
RECIDIVA
MAI ESEGUITA
MAI ESEGUITA
MAI ESEGUITA
MAI ESEGUITA
DATI NON DISPONIBILI
MAI ESEGUITA
PROGRESSIONE MALATTIA
MAI ESEGUITA
PROGRESSIONE MALATTIA
MAI ESEGUITA
MAI ESEGUITA
PROGRESSIONE MALATTIA
MAI ESEGUITA
DATI NON DISPONIBILI
MAI ESEGUITA
MALATTIA STABILE
MAI ESEGUITA
RISPOSTA COMPLETA
MAI ESEGUITA
RESPONSIVITÀ ALLA
TERAPIA CON MITOTANE
PROGRESSIONE MALATTIA
RECIDIVA
RISPOSTA COMPLETA
PROGRESSIONE MALATTIA
RISPOSTA COMPLETA
NON VALUTABILE
PROGRESSIONE MALATTIA
PROGRESSIONE MALATTIA
RISPOSTA COMPLETA
RISPOSTA COMPLETA
RECIDIVA
MALATTIA STABILE
RISPOSTA COMPLETA
RISPOSTA COMPLETA
RECIDIVA
RISPOSTA COMPLETA
DATI NON DISPONIBILI
RISPOSTA COMPLETA
NON VALUTABILE
RECIDIVA
NON VALUTABILE
RISPOSTA COMPLETA
RISPOSTA COMPLETA
PROGRESSIONE MALATTIA
NON VALUTABILE
DATI NON DISPONIBILI
RISPOSTA COMPLETA
MALATTIA STABILE
RISPOSTA COMPLETA
RISPOSTA COMPLETA
MAI ESEGUITA
TABELLA 1: Notizie cliniche dei pazienti affetti da CAC.
Sono state inoltre raccolte informazioni cliniche relative alla terapia medica a cui i pazienti
sono stati sottoposti dopo l’intervento chirurgico, nonché la risposta all’eventuale terapia.
Tali pazienti sono stati infatti sottoposti ad asportazione chirurgica del CAC e, a seconda dei
casi, sono stati trattati con vari protocolli chemioterapici (Epirubicina-Adriamicina-Platino,
33
streptozotocina, taxani, gemcitabina+xeloda o gemcitabina+capecitabina) e/o con mitomane
(Tabella 1).
PAZIENTE
97
98
99
100
101
104
105
121
122
124
126
127
128
142
143
148
149
168
170
171
179
180
181
182
186
193
194
200
203
214
249
SESSO
M
F
M
M
M
F
F
M
M
F
F
M
M
M
F
M
M
M
M
M
M
F
M
F
F
M
F
F
M
M
F
ETÀ
19
53
22
80
51
47
25
45
52
60
37
29
32
69
53
29
22
73
24
77
45
41
46
46
27
54
44
48
46
18
76
DIAGNOSI
TRAUMA CRANICO
ICTUS ISCHEMICO
TRAUMA CRANICO
ICTUS ISCHEMICO
TRAUMA CRANICO
TRAUMA CRANICO
TRAUMA CRANICO
TRAUMA CRANICO
ICTUS ISCHEMICO
ICTUS ISCHEMICO
TRAUMA CRANICO
TRAUMA CRANICO
EMORRAGIA CEREBRALE
ICTUS ISCHEMICO
EMORRAGIA CEREBRALE
TRAUMA CRANICO
TRAUMA CRANICO
ICTUS CEREBRALE
TRAUMA CRANICO
ICTUS ISCHEMICO
TRAUMA CRANICO
TRAUMA CRANICO
TRAUMA CRANICO
ICTUS CEREBRALE
ICTUS ISCHEMICO
TRAUMA CRANICO
ICTUS CEREBRALE
ICTUS CEREBRALE
ICTUS ISCHEMICO
TRAUMA CRANICO
ICTUS EMORRAGICO
TABELLA 2: Soggetti non affetti da tumore.
La stessa indagine è stata eseguita su una seconda popolazione di controllo, composta
sempre da 31 individui, scelti all’interno di un gruppo di pazienti non presentanti neoplasie
(Tabella 2), i cui campioni di sangue venoso periferico sono conservati nell’emoteca della
Sezione di Endocrinologia dell’Università degli Studi di Ferrara.
3.1.1 Estrazione del DNA da sangue
Da un’aliquota del campione di sangue intero raccolto per ciascun paziente è stato
estratto il DNA, al fine di poter effettuare l’analisi genotipica. L’estrazione del DNA è stata
34
eseguita utilizzando il kit QIAamp DNA Blood (Qiagen S.p.A. Milano), seguendo le
istruzioni del protocollo standard. Il processo di estrazione prevede diverse fasi di
purificazione del materiale estratto, volte ad eliminare tutte le componenti cellulari e
proteiche che possono interferire con le analisi successive. In un primo passaggio, ad un
volume standard di 200 µl di sangue, sono stati aggiunti 20 µl di proteasi K, la cui azione
serve a degradare il materiale proteico, e 200 µl del tampone di lisi AL, necessario per la
degradazione delle membrane biologiche. Il tutto è stato agitato per pochi secondi ed
incubato in bagnetto termostatato a 56° C per 10 minuti. Al termine dei 10 minuti, la
provetta contenente la miscela di reazione è stata centrifugata ad 8000 rpm per 20 secondi.
A questo punto sono stati aggiunti 200 µl di etanolo assoluto, che consentono la
precipitazione del DNA, ed il tutto è stato agitato per pochi secondi. Il campione è stato poi
centrifugato a 8000 rpm per 20 secondi. La soluzione così ottenuta è stata applicata ad una
colonnina QIAamp, costituita da una resina silicea che interagisce col DNA, bloccandolo
nella colonna. Tale colonnina è stata posta all’interno di uno specifico tubo di raccolta da 2
ml e centrifugata a 8000 rpm per 1 minuto. Al termine della centrifugazione, essa è stata
recuperata ed inserita in un nuovo tubo di raccolta, mentre il materiale eluito è stato
eliminato. Cominciano a questo punto una serie di lavaggi successivi volti a purificare il
DNA estratto: alla colonnina sono stati applicati 500 µl di tampone di lavaggio AW1, ed il
tutto è stato sottoposto a nuova centrifugazione a 8000 rpm per 1 minuto. La colonnina è
stata nuovamente recuperata e posta su un nuovo tubo di raccolta da 2 ml, mentre il
materiale eluito è stato ancora una volta eliminato. Sono stati applicati alla colonna 500 µl
di un altro tampone di lavaggio, AW2, ed il campione è stato centrifugato a massima
velocità per 3 minuti. Per il recupero del DNA, la colonnina è stata posta su una provetta
con chiusura di sicurezza da 1,5 ml e su di essa sono stati applicati 200 µl di tampone AE.
La colonna è stata lasciata a temperatura ambiente per circa 5 minuti e successivamente
centrifugata a 8000 rpm per 1 minuto. A questo punto, il DNA estratto si trova in soluzione
nella provetta da 1,5 ml. Il DNA è stato posto alla temperatura di –20°C, mentre una piccola
35
aliquota necessaria alle operazioni di genotipizzazione è stato conservato a 4°C per non più
di un mese.
3.1.2 Quantificazione del DNA allo spettrofotometro
Il DNA è stato quantificato allo spettrofotometro (Wallac Victor, Perkin Elmer)
mediante una lettura alla lunghezza d’onda di 260 nm (per DNA a doppia elica 1 OD a 260
nm corrisponde ad una concentrazione di 50 µg). Una seconda lettura a 280 nm è stata
inoltre eseguita per valutare la possibile contaminazione da proteine. Il DNA viene
considerato di buona qualità quando il rapporto lettura a 260nm/lettura a 280 nm è uguale a
1.8.
3.1.3 Reazione a catena della polimerasi (PCR)
La PCR (Polimerase Chain Reaction) è una tecnica che permette di ottenere copie
multiple di uno specifico segmento di DNA. Per questa reazione sono necessari primers o
inneschi (Forward e Reverse) per delimitare la regione da amplificare e permettere l’attacco
dell’enzima, deossiribonucleotidi per la costituzione del nuovo filamento di DNA e
l’enzima DNA polimerasi per la sua sintesi. Questi reagenti vengono addizionati a MgCl2
(Mg+ stabilizza le molecole di DNA cariche negativamente per la presenza dei gruppi
fosfato (PO43-) ed è cofattore della DNA polimerasi) ad un tampone ottimale per l’attività
dell’enzima ed, ovviamente, al DNA genomico da amplificare. Il volume finale della
miscela di amplificazione è di 50 µl (Tabella 3).
REAGENTI
DNA 100 ng
VOLUME
VEDI QUANTIFICAZIONE
PCR Buffer 10x
5 µl
50 mM MgCl2
1 µl
10 mM dNTPs
1 µl
Primer FOR 1:100
1 µl
Primer REV 1:100
1 µl
Taq DNA polimerasi
0,2 µl
H2O molecular grade
PORTO A VOLUME (50 µl)
TABELLA 3: Reazione di PCR.
36
Le sequenze della coppia di primers usati per lo studio dello SNP C3435T sono le seguenti:
GENE
MDR1
PRIMERS
For: 5’- AGTGGCTCCGAGCACACCT - 3’
Rev: 5’- TGCTCCCAGGCTGTTTATTTG - 3’
Tm
59°C
FRAMMENTO ATTESO
201 bp
TABELLA 4: Primers utilizzati per la genotipizzazione.
La reazione di PCR è stata condotta in termociclatori GeneAmp 9700 (Applera Italia), in
grado di variare ciclicamente, secondo un programma prestabilito, la temperatura della
reazione. Generalmente, la reazione di PCR prevede una fase di denaturazione, necessaria
alla separazione dei due filamenti, una fase di appaiamento, per permettere ai primers di
appaiarsi in maniera complementare al DNA stampo, ed una fase di estensione, in cui la
DNA polimerasi amplifica la sequenza di interesse. Ciascun ciclo di denaturazioneappaiamento-estensione viene ripetuto più volte, al fine di ottenere un elevato numero di
copie.
TEMPO
7’
30’’
1’
30’’
5’
∞
TEMPERATURA
95°C
95°C
57°C
72°C
72°C
4°C
DESCRIZIONE
CICLI
DENATURAZIONE INIZIALE
DENATURAZIONE
ANNEALING
ESTENSIONE
ESTENSIONE FINALE
CONSERVAZIONE
1
35
1
1
TABELLA 5: Condizioni termiche e tempi della reazione di PCR.
Contemporaneamente ai campioni contenenti i DNA dei pazienti sono stati amplificati, nella
stessa seduta, un controllo positivo ed un controllo negativo. Il primo, contenente DNA di
un paziente il cui prodotto PCR era stato precedentemente analizzato con successo, permette
di evidenziare possibili errori dovuti alla mancata aggiunta o alla degradazione di un
reagente; il secondo, non contenente DNA ma un uguale volume di acqua, permette di
evidenziare eventuali contaminazioni da DNA non di interesse.
37
3.1.4 Elettroforesi su gel di agarosio
Il risultato delle PCR è stato controllato mediante elettroforesi su gel di agarosio. Tale
tecnica permette la separazione dei frammenti amplificati di DNA in base alla loro dimensione:
applicando un campo elettrico continuo i frammenti di lunghezza minore migreranno più
velocemente poiché meno ostacolati dalle maglie del gel, mentre i frammenti più lunghi
migreranno più lentamente. Grazie alla presenza dei gruppi fosfato (PO43-), il DNA risulta
carico negativamente e migrerà quindi verso il polo positivo con velocità diversa in base alla
dimensione.
La separazioni elettroforetica dei campioni di DNA amplificato è stata eseguita su gel di
agarosio al 2%, preparato sciogliendo l’agarosio in TAE 1x (Tris acetato EDTA).
L’individuazione delle bande di DNA sul gel è stata possibile grazie all’aggiunta, prima
della solidificazione, di Gel Star 10000x (Lonza Group Ltd., Switzerland). Tale colorante
fluorescente ad alta sensibilità permette l’evidenziazione degli acidi nucleici dopo la corsa
illuminando il gel con luce ultravioletta a 302 o 312 nm. Sono stati quindi miscelati 10 µl
della reazione di amplificazione a 2 µl di loading buffer 6X (Qiagen S.p.A., Milano),
colorante di caricamento che permette la visualizzazione della corsa, e caricati su gel di
agarosio al 2%. La corsa è stata eseguita per 20 minuti applicando un voltaggio pari a 110
Volt. Il gel è stato poi analizzato su transilluminatore U.V. Gel Doc utilizzando Quantity
One software (Bio-Rad Laboratories).
Marker ct-
ct+
paz. 4
paz. 3
paz. 2
paz. 1
Marker
1000bp
750bp
500bp
300bp
150bp
50bp
FIGURA 15: Corsa elettroforetica dei prodotti PCR su gel di agarosio al 2% colorato con
Gel Star 10000x.
38
3.1.5 Purificazione dei prodotti PCR
Questa procedura viene eseguita per eliminare tutti i prodotti PCR secondari, non
utilizzati nella reazione di purificazione, come i dimeri di primer (primer dimers), gli
oligonucleotidi, i dNTPs ed i sali. Per fare ciò è stato utilizzato il kit NucleoSpin (MakereyNagel, Deutschland), il cui principio si basa sull’adsorbimento momentaneo del DNA, dopo
centrifugazione, sulla membrana di una apposita colonnina. Il DNA adsorbito verrà poi
rilasciato in un secondo momento utilizzando il corretto tampone di eluizione. 100 µl di
prodotto PCR sono stati miscelati a 200 µl di soluzione NT e la soluzione è stata caricata
sulla colonnina, centrifugando per 1 minuto a 11000 rpm. L’eluito è stato scartato, sono stati
aggiunti alla colonnina 600 µl di soluzione NT3 e la miscela è stata centrifugata per 1
minuto a 11000 rpm. L’eluito è stato nuovamente scartato e sono stati aggiunti 50 µl di
soluzione NE (tampone di eluizione). Dopo 1 minuto di incubazione a temperatura ambiente
il campione è stato nuovamente centrifugato per 1 minuto a 11000 rpm, eluendo il DNA
dalla colonnina.
3.1.6 Reazione di sequenza
Per la reazione di sequenza è stato utilizzato il BigDye Terminator V3.1 Cycle
Sequencing Kit (metodo di Sanger). In tale reazione il DNA viene esteso da una polimerasi
che utilizza, oltre ai deossiribonucleotidi, i dideossiribonucleotidi (ddNTPS). Questi, una
volta incorporati, bloccano l’estensione, non avendo il sito 3’ libero per l’aggiunta di altri
nucleotidi. Si ottengono così tanti frammenti di DNA la cui estensione si è bloccata a livelli
diversi. I ddNTPS sono marcati con fluorocromi (diversi per ognuno dei quattro nucleotidi),
e ciò permette la rivelazione della sequenza di nucleotidi durante il sequenziamento. La
reazione avviene in un volume di 10 µl (Tabella 6).
39
REAGENTI
VOLUMI
1-10 ng prodotto PCR purificato
VEDI QUANTIFICAZIONE
3.2 pmoli Primer Forward o Reverse
1 µl DI PRIMER 2,5 µM
10X Terminator Ready Reaction Mix
1 µl
5X BigDye Sequencing Buffer
2 µl
H2O molecular grade
PORTO A VOLUME (10 µl)
TABELLA 6: Miscela di reagenti per reazione di sequenza.
La reazione è stata caricata su un termociclatore GenAmp 9700 (Applera Italia) e sottoposta
al seguente programma termico: 45 cicli a 96°C 10 sec, 60°C 4 min.
3.1.7 Rimozione dei Dye Terminators e sequenziamento
Per eliminare i Dye Terminators sono state utilizzate le Centri-Sep Spin Columns
(Princeton Separations, Inc.). In una colonnina precedentemente idratata sono stati caricati 10
µl di reazione di sequenza seguendo le specifiche del kit ed il tutto e stato centrifugato 2
minuti a 2000 rpm. 5 µl dell’eluito sono stati denaturati insieme a 10 µl di HDI Formamide
(Sigma- Aldrich, Inc) per 2 minuti a 96 °C e subito messi in ghiaccio per mantenere la
denaturazione. La reazione di sequenza è stata quindi caricata sullo strumento 3130 Genetic
Analyzer (Applera Italia). La macchina, attraverso elettroforesi capillare, permette il
passaggio delle sequenze denaturate a livello di un laser che eccita i fluorocromi legati ai
nucleotidi terminali in 3’. I segnali di emissione vengono captati da un fotomoltiplicatore e
tradotti in elettroferogrammi dal Sequecincig Analysis Software 5.2 (Apllera Italia). Tali
elettroferogrammi sono stati infine confrontati con la sequenza di controllo, ottenuta dalla
banca dati NCBI (National Center of Biotechnology Information), per valutare il
polimorfismo C3435T del gene MDR1.
40
FIGURA 16: Elettroferogramma che evidenzia il polimorfismo C3435T del gene MDR1 in Forward.
FIGURA 17: Elettroferogramma che evidenzia il polimorfismo C3435T del gene MDR1 in Reverse.
3.2 Linea cellulare NCI-H295 e trattamenti
3.2.1 Linea cellulare NCI-H295
La linea cellulare NCI-H295 è stata ottenuta da un campione di CAC di una paziente
di colore di 48 anni. Tali cellule tumorali hanno morfologia epiteliale e producono ormoni
steroidei. La linea cellulare NCI-H295 è stata acquistata dall’American Type Culture
Collection (Manassas, VA, USA) ed è stata mantenuta in coltura a 37°C in atmosfera
umidificata con 5% CO2 in un mix 1:1 di Dulbecco’s Modified Eagle’s Medium e Ham’s
F12 Medium con 2,5Mm L-glutammina (EuroClone Ltd, Torquay, UK). A tale terreno di
coltura sono stati aggiunti 5 µg/ml di insulina, 0,01 mg/ml di transferrina, 30 nM di sodio
selenite, 10 nM di idrocortisone, 10 nM di 17-β estradiolo (Sigma-Aldrich, Inc) e 2 mM di
L-glutammina extra (EuroClone Ltd, Torquay, UK). Sono stati inoltre aggiunti 2% di siero
fetale bovino (FBS, ATCC, Manassas, VA, USA), 100 U/ml penicillina e 0.1 mg/ml
41
streptomicina (EuroClone Ltd, Torquay, UK). Le cellule della linea cellulare NCI-H295
crescono in adesione e, una volta raggiunta la confluenza di fiasca, vengono rimosse
meccanicamente tramite scraper e messe in coltura ad una diluizione 1:3.
3.2.2 Genotipizzazione
Le cellule di una fiasca T25 a confluenza (3 milioni circa) della linea cellulare NCIH295, dopo essere state rimosse con scraper e centrifugate per 7 minuti a 120 x g, sono state
raccolte e utilizzate per l’estrazione del DNA con Wizard Genomic DNA Purification Kit
(Promega Italia srl, Milano). Il pellet cellulare è stato trasferito in una provetta da 1,5 ml e
centrifugato per 10 secondi a 16000 rpm. Rimosso il surnatante, il nuovo pellet è stato
risospeso in 200 µl di soluzione fisiologica e nuovamente centrifugato alle stesse condizioni.
A questo punto il contenuto della provetta è stato ben miscelato a 600 µl di Nuclei Lysis
Solution ed a 3 µl di RNase Solution. Il tutto è stato incubato prima a 37°C per 30 minuti,
poi a temperatura ambiente per 5 minuti. Al termine delle incubazioni sono stati aggiunti
200 µl di Protein Precipitation Solution. La provetta è stata agitata vigorosamente per 20
secondi, posta in ghiaccio per 5 minuti e successivamente centrifugata per 4 minuti a 16000
x g, in modo da creare una ripartizione in fasi che vede la formazione di un anello proteico
bianco che separa il DNA contenuto nel surnatante dal resto delle componenti cellulari. Il
surnatante è stato quindi trasferito in una provetta da 1,5 ml e miscelato a 600 µl di
isopropanolo (Carlo Erba Reagents, Milano) a temperatura ambiente, fino alla
visualizzazone di filamenti bianchi di DNA. Il tutto è stato centrifugato per 1 minuto a
16000 rpm ed il surnatante è stato scartato. Il pellet di DNA ottenuto è stato lavato con
etanolo al 70% (Carlo Erba Reagents, Milano), centrifugato come descritto sopra e fatto
asciugare per circa 20 minuti. Esso è stato infine risospeso in 100 µl di DNA Rehydratation
Solution ed incubato overnight a 4°C. Il DNA così ottenuto ha seguito, per la valutazione
del polimorfismo C3435T, lo stesso iter del DNA dei soggetti precedentemente analizzati.
42
3.2.3 Valutazione dell’espressione di MDR1
Le cellule di una fiasca T75 a confluenza (10 milioni circa) della linea cellulare NCIH295, dopo essere state rimosse con scraper e centrifugate per 7 minuti a 120 x g, sono state
raccolte ed utilizzate per l’estrazione dell’RNA totale con Trizol (Life Technologies,
Milano).
Estrazione RNA totale con Trizol
Il pellet ricavato dalla centrifugazione delle cellule raccolte è stato incubato per 5
minuti a temperatura ambiente con 1 ml di Trizol (Life Technologies, Milano). Il Trizol è
composto da isotiocianato di guanidina, inibitore delle RNasi, e fenolo, denaturante delle
proteine, ed è in grado di dissociare i complessi nucleo-proteici. Sono stati aggiunti 0,2 ml
di cloroformio (Carlo Erba Reagents, Milano) ed il tutto è stato agitato vigorosamente per
inversione e successivamente incubato 3 minuti a temperatura ambiente. La provetta è stata
centrifugata a 12000 rpm per 15 minuti a 4°C, per ottenere una ripartizione del contenuto in
3 fasi dove la fase inferiore contiene le componenti cellulari, l’interfaccia DNA e proteine
ed il surnatante RNA. Quest’ultimo è stato trasferito in un’altra provetta in cui erano stati
aggiunti 0,5 ml di isopropanolo (Carlo Erba Reagents, Milano) ed incubato 10 minuti a
temperatura ambiente. La provetta è stata poi centrifugata a 12000 rpm per 10 minuti a 4°C,
permettendo la precipitazione dell’RNA sul fondo. Dopo eliminazione del surnatante, il
pellet ottenuto è stato lavato aggiungendo 1 ml di etanolo 75% in acqua DEPC
(dietilpirocarbonato, inibisce le RNasi) e agitando vigorosamente. Dopo aver centrifugato il
tutto a 7500 rpm per 5 minuti a 4°C, il surnatante è stato eliminato ed il pellet è stato
lasciato ad asciugare per 5 minuti. A questo punto l’RNA depositato sul fondo della
provetta è stato risospeso in 20 µl di acqua DEPC ed incubato a 55°C per 10 minuti. L’RNA
totale così ottenuto è stato conservato a -80°C.
Quantificazione dell’RNA totale
L’RNA ottenuto è stato quantificato mediante il sistema Experion (Bio-Rad
Laboratories), che applica la tecnologia microfluidica per automatizzare l’elettroforesi su
43
gel. I chip microfluidici hanno la capacità di alloggiare fino a 12 campioni per seduta e di
rilevare RNA in quantità nell’ordine di ng (RNA Std Sens Kit) e pg (RNA High Sens Kit).
La soluzione gel-stain è stata preparata centrifugando 600 µl di RNA gel, contenuto nell’
RNA Std Sens Kit, in uno spin filter a 4500 rpm per 10 minuti. 65 µl del gel così filtrato
sono stati miscelati ad 1 µl del reagente RNA stain in una provetta da microcentrifuga
RNase-free. Per quanto riguarda la preparazione dei campioni, 1 µl di una diluzione 1:10 di
RNA estratto dalla linea cellulare è stato mescolato a 3 µl di RNA ladder in provetta da
microcentrifuga e denaturato per 2 minuti a 70°C in termoblocco. Il tutto è stato poi posto in
ghiaccio per 5 minuti. A questo punto 9 µl della soluzione gel-stain sono stati caricati nel
pozzetto GS del chip di lettura, 9 µl di gel filtrato nel pozzetto G, 5 µl del reagente loading
buffer nei pozzetti da 1 a 12 e nel pozzetto L. 1 µl del ladder denaturato è stato aggiunto nel
pozzetto L, mentre 1 µl del campione denaturato è stato caricato nel pozzetto 1. Poiché tutto
il chip deve essere completo per poter procedere con la lettura, è stato aggiunto 1 µl di TE
buffer in ogni pozzetto non utilizzato.
FIGURA 18: Chip e reagenti dell’RNA Std Sens Kit Experion (Bio-Rad).
Lo strumento valuta la fluorescenza emessa dai campioni e, comparandola al marker
interno, è in grado di fornire la concentrazione del campione in ng/µl e la qualità dell’RNA
analizzato. Più alto è l’indice di qualità (QI), migliore è la condizione del nostro RNA. Un
QI intorno a 10 è da considerarsi molto buono.
Retrotrascrizione
Utilizzando un kit per la sintesi di DNA complementare a singolo strand (cDNA)
(SuperScript II Reverse Transcriptase, Invitrogen Corporation), sono stati trascritti 3 µg di
44
RNA totale. Inizialmente i 3 µg di RNA (corrispondenti nel nostro caso a 3 µl) sono stati
posti in una provetta da 200 µl contenente 1 µl di DNasi per ogni µg di RNA, 2 µl di
Reaction Buffer 10x e acqua DEPC fino a raggiungere un volume di reazione di 20 µl. La
provetta è stata incubata 30 minuti a 37°C. Tutte le incubazioni sono avvenute in
termociclatore GeneAmp 9700 (Applera Italia). Dopo aver aggiunto 2 µl di Stop Reaction
per bloccare le DNasi, la provetta è stata incubata a 65°C per 10 minuti. Il volume totale
della miscela di reazione è stato diviso equamente in tre provette, ognuna contenente 1 µl di
Random Examer, 1 µl di dNTPs e acqua fino ad un volume finale di 10 µl. Le provette sono
state incubate 5 minuti a 65°C e successivamente sono state poste in ghiaccio per 1 minuto.
Per la retrotrascrizione vera e propria sono stati aggiunti ad ogni provetta 9 µl di una mix
composta da 10x Buffer RT, MgCl2 25 mM, dTT 0,1 mM ed RNasi out (Tabella 7).
REAGENTI
10x Buffer RT
VOLUME
2 µl
MgCl2 25 mM
4 µl
dTT 0,1 mM
2 µl
RNasi out
1 µl
VOLUME TOTALE PERCAMPIONE
9 µl
TABELLA 7: Miscela di reagenti per retrotrascrizione.
I tre campioni, contenenti un volume totale di 19 µl, sono stati incubati 2 minuti a 25°C. Al
termine di tale incubazione è stato aggiunto 1 µl di Superscript II a due delle tre provette ed
i campioni sono stati sottoposti ad un ciclo di incubazione a tre diverse temperature:
TEMPO
10’
TEMPERATURA
25°C
30’
42°C
15’
70°C
TABELLA 8: Condizioni termiche di retrotrascrizione.
Infine, dopo aver aggiunto 1 µl di RNasi H ad ogni provetta, il tutto è stato incubato per 20
minuti a 37°C. A questo punto, nelle due provette a cui è stata aggiunta la Superscript, si
avrà cDNA, mentre la provetta in cui il reagente non è stato aggiunto rappresenta il
45
controllo negativo. Per verificare che l’RNA totale sia stato effettivamente retrotrascritto, è
stata allestita una PCR di controllo utilizzando il kit della MasterMix (Promega, Milano). A
2 µl di ogni campione, sono stati addizionati 48 µl di una miscela contenente Master Mix
2x, acqua molecular grade e la coppia di oligonucleotidi per l’amplificazione della β-actina,
gene house-keeping costitutivamente espresso in ogni tipo di cellula umana (Tabella 9).
REAGENTI
Retrotrascritto
VOLUME
2 µl
Master Mix 2x
25 µl
Primer Forward β-actina 1:100
1 µl
Primer Reverse β-actina 1:100
1 µl
H2O molecular grade
PORTO A VOLUME: 50 µl
TABELLA 9: Miscela di PCR di controllo per RT-PCR.
Valutazione dell’espressione di MDR1
Il cDNA ottenuto è stato amplificato mediante reazione di PCR utilizzando primers
oligonucleotidici disegnati all’interno dell’esone 26 di MDR1. Primers, condizioni di
reazione e dimensioni attese dei frammenti amplificati sono illustrate nella Tabella 10
(Figura 19):
Gene
MDR1
Primers
For: 5’- TTGCCTATGGAGACAACAGCC - 3’
Rev: 5’- ACGAGCTATGGCAATGCGTT - 3’
Denaturazione
Annealing
Estensione
Cicli
Frammento
94°C, 30”
55°C, 45”
74°C, 45”
45
97 bp
TABELLA 10: Primers e condizioni di PCR per l’amplificazione di MDR-1.
3.2.4 Immunofluorescenza
Le cellule NCI-H295 sono state seminate, ad una concentrazione di 104
cellule/pozzetto, in vetrini sterili per colture cellulari da 8 pozzetti (Lab-Tek Chamber Slide
System, Nalgene Nunc International, Naperville, IL, USA). Successivamente le cellule sono
state ibridate con un anticorpo monoclonale di topo anti P-gp diluito 1:500 (Sigma) per 30
minuti a 37°C, fissate in metanolo-acetone 1:1 per 10 minuti a -20°C, reidratate con
Phosphate Buffered Saline (PBS) per 10 min e bloccate con PBS contenente il 5% di siero
dell’animale da cui è stato prodotto l’anticorpo secondario. Dopo 3 lavaggi di 10 minuti a
46
temperatura ambiente con PBS, le cellule sono state ibridate con l’anticorpo secondario
anti-IgG di topo diluito 1:100 (Santa Cruz), marcato con TRITC e sviluppato in capra.
L’incubazione è avvenuta al buio per 1 ora a temperatura ambiente. Successivamente a tre
lavaggi di 10 minuti con PBS al buio, i vetrini sono stati montati con ProLong Gold antifade
reagent (Invitrogen Molecular Probes) contenente il colorante nucleare 4’,6’-diamidino-2phenylindole (DAPI) sotto il vetrino coprioggetto,
mantenuti al buio per 24 ore a
temperatura ambiente ed osservati con microscopio a fluorescenza Nikon Eclipse TE2000-U
con obiettivo 60 X ad immersione. Le cellule sono state fotografate con fotocamera digitale
DS-5M Nikon colour CCD e le foto sono state analizzate mediante il Multi-Analyst
software (Bio-Rad).
3.2.5 Saggi di vitalità cellulare
Per verificare la resistenza delle cellule NCI-H295 al trattamento con comuni
chemioterapici, esse sono state trattate con doxorubicina (Sigma, Milano) ad un range di
concentrazioni tra 10 nM e 1 µM, per un periodo di 3 e 7 giorni. Per i saggi sono state
utilizzate piastre da 96 pozzetti (Nunc-Thermo Fisher Scientific, Roskilde). La prima
colonna di ogni piastra non è stata seminata e ad ogni pozzetto sono stati aggiunti 100 µl di
medium completo (bianco). Le colonne successive sono state seminate con 2 x 104 cellule
per pozzetto. La prima colonna seminata è stata trattata solamente con medium (controllo),
mentre le successive colonne sono state trattate con concentrazioni crescenti di doxorubicina
per un volume di 100 µl. Di ogni colonna, solo i sei pozzetti centrali sono stati utilizzati per
l’esperimento, mentre quelli periferici sono stati riempiti con 100 µl di soluzione fisiologica
(Fresenius Kabi, Verona), che ha la funzione di proteggere i trattamenti da agenti esterni
(luce, temperatura, ecc). Le variazioni del numero di cellule dovute ai trattamenti sono state
valutate con il kit TACS MTT Cell Proliferation Assay (Trevigen Inc., Gaithersburg). Il
mattino successivo al termine di ogni trattamento sono stati aggiunti ad ogni pozzetto,
tranne a quelli periferici, 10 µl di soluzione MTT. Tale soluzione contiene sali di tetrazolio
che vengono ridotti da enzimi mitocondriali in formazani, precipitati insolubili di colore blu.
47
La formazione di tali precipitati è direttamente proporzionale al numero di cellule vive.
Dopo 4 ore di incubazione sono stati aggiunti agli stessi pozzetti 100 µl di soluzione SS
(soluzione di solubilizzazione). Essa permette di solubilizzare i precipitati e di rendere il
colore del surnatante omogeneo per la lettura colorimetrica. La mattina seguente le piastre
sono state valutate al Wallac Victor 1420 Multilabel Counter (Perkin Elmer, Monza) ad una
lunghezza d’onda di 560 nm. I trattamenti a 3 e 7 giorni sono stati ripetuti in triplicato.
3.2.6 Saggi di sintesi del DNA
La valutazione della proliferazione delle cellule NCI-H295 durante trattamento con
doxorubicina (Sigma, Milano) ad un range di concentrazioni tra 10 nM e 1 µM è stata
condotta mediante la tecnica di incorporazione di timidina triziata (3H-timidina) che misura
i livelli di sintesi di DNA. Per i trattamenti sono state utilizzate piastre da 24 pozzetti
(Nunc-Thermo Fisher Scientific, Roskilde). Tutti i pozzetti della piastra, tranne quelli
dell’ultima riga, sono stati seminati con 5 x 104 cellule in un volume di 1 ml. I pozzetti
seminati della prima colonna sono stati trattati con 1 ml di medium completo contenente 1,5
µl di timidina triziata 2 Ci/mmol (Amersham Pharmacia Biotech, Inc.) (controllo), mentre i
pozzetti seminati dalla seconda alla quinta colonna sono stati trattati rispettivamente con
doxorubicina 10 nM, 50 nM, 100 nM, 500 nM ed 1 µM in medium completo contenente 1,5
µl di timidina triziata 2 Ci/mmol. Tre pozzetti non seminati dell’ultima riga sono stati
riempiti con 1 ml di medium completo contenente 1,5 µl di timidina triziata 2 Ci/mmol. I
trattamenti sono stati ripristinati ogni 2 giorni e dopo tre e sette giorni le cellule di ogni
pozzetto sono state raccolte in 300 µl di soluzione fisiologica (Fresenius Kabi, Verona)
mediante rimozione meccanica. Esse sono state poi trasferite in una piastra da 96 pozzetti,
facendo corrispondere ad ogni pozzetto della piastra da 24 pozzetti, 3 pozzetti di quella da
96 (100 µl per pozzetto). Tre pozzetti di quest’ultima sono stati riempiti con 100 µl di
soluzione fisiologica contenente 1,5 µl di timidina triziata 2 Ci/mmol per ml (bianco). Le
cellule ed il surnatante sono poi state filtrate attraverso uno strumento (“cells harvester”)
che permette di bloccare in una apposita piastra da 96 pozzetti con filtro soltanto il DNA
48
(Perkin Elmer, Monza). Dopo aver fatto asciugare il filtro per qualche ora sono stati
aggiunti ad ogni pozzetto 30 µl di liquido di scintillazione e la piastra è stata isolata
superiormente ed inferiormente con pellicole plastificate (Wallac B&W Isoplate, Perkin
Elmer, Monza). Il filtro è stato successivamente inserito in uno scintilloscopio o contatore di
particelle β: la quantità di timidina triziata incorporata sarà proporzionale al segnale captato
dallo scintilloscopio. Il saggio è stato ripetuto in triplicato.
FIGURA 19: strumento per la raccolta di cellule coltivate ("Harvester")(Perkin Elmer, Monza).
3.3 Analisi statistica
Sono stati utilizzati i test statistici t di Student per valutare la significatività della
differenza fra le medie, Chi2 per valutare la significatività della differenza fra le percentuali
e Odd Ratio per valutare l’esistenza di una associazione fra due variabili e quantificare il
rischio relativo.
49
4. Risultati
4.1 Genotipizzazione casi e controlli
4.1.1 Descrizione dei campioni
Inizialmente è stata valutata la distribuzione di età, sesso e genotipo fra i pazienti
affetti da CAC (casi) ed i pazienti sani (controlli). L’età media per i casi è risultata essere
43,5 ± 13 (range 24-75 anni), mentre per i controlli di 44,8 ± 18 anni (range 18-80 anni).
Applicando il test t di Student si è valutata la differenza fra le medie. Essendo il valore di p
superiore a 0,05 il test è stato considerato non significativo. Ciò significa che la
distribuzione delle età nei due gruppi è omogenea.
Per valutare la diversa distribuzione di sesso e genotipo fra casi e controlli è stato
applicato il test Chi2. Essendo il valore di p non significativo, la distribuzione di sesso e
genotipo nei due gruppi è omogenea (Tabelle 11, 12 e 13 e Figure 20, 21 e 22). I campioni
rappresentanti i casi e quelli rappresentanti i controlli sono risultati quindi omogenei per età,
sesso e genotipo e perciò confrontabili fra loro. Il fatto che in essi i 3 possibili genotipi siano
distribuiti nello stesso modo ci suggerisce inoltre che il genotipo per il polimorfismo
C3435T del gene MDR1 ed il CAC siano fra loro non correlati.
GRUPPO
F
M
Totale
CASI
16
15
31
CONTROLLI
12
19
31
Totale complessivo
28
34
62
Chi2=0.58 p=0.44
TABELLA 11: Distribuzione maschi/femmine fra casi e controlli.
50
DISTRIBUZIONE SESSO PER
GRUPPO
20 19 CASI
16 CONTROLLI
15 15 12 10 5 0 F M FIGURA 20: Istogramma della distribuzione maschi/femmine fra casi e controlli.
Frequenze
GRUPPO
CC
CT
TT
Totale
CASI
9
14
8
31
CONTROLLI
10
16
5
31
Totale complessivo
19
30
13
62
Chi2=0.87 p=0.11
TABELLA 12: Distribuzione del genotipo fra casi e controlli in valori assoluto.
FIGURA 21: Istogramma della distribuzione del genotipo fra casi e controlli in valori assoluti.
51
Percentuali
GRUPPO
CC
CT
TT
CASI
29%
45%
25%
100%
32,3% 51,6% 16,1%
100%
CONTROLLI
Totale
TABELLA 13: Distribuzione del genotipo fra casi e controlli in percentuali.
FIGURA 22: Istogramma della distribuzione del genotipo fra casi e controlli in percentuali.
4.1.2 Genotipo e risposta ai farmaci
Dei 31 soggetti affetti da CAC e sottoposti a rimozione chirurgica del tumore, 11
sono stati trattati con chemioterapici (Epirubicina-Adriamicina-Platino, streptozotocina,
taxani, gemcitabina + xeloda o gemcitabina + capecitabina) e 24 con mitotane.
RISPOSTA ALLA CHEMIOTERAPIA
PROGRESSIONE MALATTIA
CC
CT
TT
Totale
4
3
1
8
1
1
STABILITÀ MALATTIA
RISPOSTA PARZIALE
1
1
RISPOSTA COMPLETA
1
1
Totale
4
5
2
TABELLA 14: Risposta alle chemioterapia e genotipo.
52
11
RISPOSTA AL MITOTANE
PROGRESSIONE MALATTIA
CC
CT
TT
Totale
3
5
1
9
1
1
2
STABILITÀ MALATTIA
RISPOSTA COMPLETA
3
6
4
13
Totale
6
12
6
24
TABELLA 15: Risposta al mitotane e genotipo.
Per poter ottenere una miglior elaborazione statistica dei dati, le possibili risposte ai
chemioterapici ed al mitotane sono state suddivise in 2 gruppi: responsivi e non responsivi
alla terapia. Il primo gruppo riguarda i casi di risposta completa e parziale alla terapia ed i
casi di stabilità di malattia, mentre il secondo comprende i pazienti che hanno dimostrato
progressione della malattia.
A questo puntro, in base ai genotipi, sono stati messi a confronto i pazienti responsivi
e non per entrambe le terapie ( Tabelle 16 e 17; Figure 23 e 24):
RISPOSTA ALLA CHEMIOTERAPIA(%)
CC
CT
TT
NON RESPONSIVI
100
60
50
0
40
50
100
100
100
RESPONSIVI
Totale
TABELLA 16: Risposta alla chemioterapia e genotipo.
FIGURA 23: Risposta alla chemioterapia e genotipo.
53
RISPOSTA AL MITOTANE (%)
CC
CT
TT
NON RESPONSIVI
50
41,7
16,7
RESPONSIVI
50
58,3
83,3
Totale
100
100
100
TABELLA 17: Risposta al mitotane e genotipo.
.
FIGURA 24: Risposta al mitotane e genotipo.
Sulla totalità dei pazienti con genotipo CC trattati con chemioterapia, il 100% è
risultato non responsivo, mentre per i pazienti con genotipo CT e TT così trattati, sono
risultati non responsivi rispettivamente il 60 ed il 50%. Sulla totalità dei pazienti con
genotipo CC trattati invece con mitotane, il 50% è risultato non responsivo, mentre per i
pazienti con genoptipo CT e TT così trattati, sono risultati non responsivi rispettivamente il
41,7 ed il 16,7%.
Poichè il CAC una affezione molto rara (1-2 casi per milione all’anno), non è stato
per noi possibile accumulare un’ampia casistica di campioni utile ai fini di ottenere una
significatività statistica. Avendo a disposizione un numero esiguo di dati su cui lavorare non
si sono potute applicare su questi risultati elaborazioni statistiche che potessero dimostrare
una significativa correlazione fra il genotipo per il polimorfismo C3435T del gene MDR1 e
la risposta alle varie terapie. Nonostante ciò, procedendo con una analisi descrittiva dei dati
percentuali, è possibile ipotizzare che pazienti con genotipo omozigote CC vadano più
54
frequentemente incontro a progressione della malattia, rispetto agli omozigoti TT. I soggetti
che possiedono almeno un allele C sembrano infatti essere meno responsivi alla terapia con
chemioterapici e a quella con mitotane (Tabelle 16 e 17 e Figure 23 e 24).
Essendo così pochi i pazienti trattati con chemioterapici, anche a causa della elevata
chemioresistenza delle cellule di CAC, si è cercato di correlare la risposta al mitotane col
genotipo per il polimorfismo C3435T di MDR1 utilizzando l’Odds Ratio:
RISPOSTA AL MITOTANE
RESPONSIVI
Totale
ODDS RATIO
CC
NON RESPONSIVI
3
3
6
1
INTERVALLO DI CONFIDENZA
CT
5
7
12
1,4
(0.19-10.03)
TT
1
5
6
5,0
(0.34-72.77)
Totale
9
15
24
TABELLA 18: Correlazione genotipo del paziente con risposta al mitotane utilizzando l’Odds Ratio.
Tale test evidenzia che i pazienti con genotipo eterozigote CT e quelli con genotipo
omozigote TT, hanno una risposta al mitotane superiore di 1,4 e 5 volte rispetto ai pazienti
con genotipo omozigote CC. Tuttavia, non è stata raggiunta la significatività statistica. Ciò è
da imputarsi molto probabilmente all’esiguo numero di campioni disponibili.
4.2 Linea cellulare NCI-H295
4.2.1 Genotipizzazione
Le cellule di CAC umano della linea cellulare NCI-H295 sono risultate omozigote
per C per il polimorfismo C3435T del gene MDR1 (Figure 25 e 26):
FIGURA 25: Elettroferogramma che evidenzia l’omozigosi per C per il polimorfismo C3435T del gene MDR1 nelle
cellule NCI-H295 in Forward.
55
FIGURA 26: Elettroferogramma che evidenzia l’omozigosi per C per il polimorfismo C3435T del gene MDR1 nelle
cellule NCI-H295 in Reverse.
4.2.2 Valutazione della espressione di MDR1
L’espressione di MDR1 è stata valutata mediante RT-PCR nella linea cellulare NCIH295, che risulta esprimere tale gene.
Marker
ct-
ct+
cDNA
600bp
500bp
400bp
300bp
200bp
100bp
FIGURA 27: Corsa elettroforetica dei prodotti PCR su gel di agarosio al 2% colorato con Gel Star 10000x.
4.2.3 Immunofluorescenza
L’espressione di P-gp è stata valutata mediante immunofluorescenza nella linea
cellulare NCI-H295, che risulta esprimere la proteina sia a livello di membrana plasmatica
che, in minor misura, a livello citoplasmatico. Le cellule sono state fotografate attraverso
una fotocamera digitale DS-5M Nikon colour CCD utilizzando filtri per il colorante
nucleare DAPI e per il fluorocromo TRITC, con cui gli anticorpi secondari sono marcati.
Utilizzando il Multi-Analyst software (Bio-Rad) è stato possibile elaborare le immagini,
associando ai nuclei cellulari il rispettivo risultato di espressione di P-gp in TRITC (Figura
28).
56
DAPI
TRITC
sovrapposizione
10 µm
10 µm
10 µm
10 µm
10 µm
10 µm
10 µm
10 µm
10 µm
FIGURA 28: Espressione di P-gp nelle cellule NCI-H295.
4.2.4 Valutazione della chemioresistenza e della proliferazione cellulare
La resistenza al trattamento con comuni chemioterapici è stata valutata con saggi di
vitalità cellulare, in cui le cellule NCI-H295 sono state trattate con doxorubicina in un range
di concentrazioni tra 10 nM ed 1 µM per un periodo di 3 e 7 giorni. I dati sono stati espressi
come media ± errore standard (SE). È stato utilizzato il test t di Student per valutare le
differenze individuali fra le medie e valori di P < 0.05% sono stati considerati significativi.
Tali cellule risultano resistenti al trattamento con doxorubicina fino alla
concentrazione 50 nM, mentre concentrazioni maggiori riducono la vitalità cellulare (Figure
29, 30 e 31).
57
FIGURA 29: Effetto della doxorubicina sulla vitalità delle cellule NCI-H295 a 3 giorni
(* P < 0,005; ** P < 0,001).
FIGURA 30: Effetto della doxorubicina sulla vitalità delle cellule NCI-H295 a 7 giorni
(* P < 0,005; ** P < 0,001).
FIGURA 31: Time course della vitalità delle cellule NCI-H295 trattate a concentrazioni crescenti di doxorubicina per 3
e 7 giorni.
58
Per quanto riguarda i saggi di incorporazione di timidina triziata, le cellule NCIH295 sono state trattate con doxorubicina in un range di concentrazioni tra 10 nM ed 1 µM
per un periodo di 7 giorni. La valutazione a 3 giorni non ha riportato risultati significativi a
causa del lungo tempo di replicazione di tali cellule (circa 4 giorni). Questi saggi
dimostrano come la sintesi del DNA nelle cellule NCI-H295 non sia significativamente
modificata dal trattamento con doxorubicina fino ad una concentrazione 50 nM, mentre
concentrazioni maggiori riducono la sintesi del DNA (Figura 32).
FIGURA 32: Effetti della doxorubicina sulla sintesi del DNA nelle cellule NCI-H295 a 7 giorni
(* P < 0,005; ** P < 0,001).
59
5. Discussione
Diversi studi hanno evidenziato come l’iper-espressione del gene MDR1 sia alla base
della chemioresistenza in diverse neoplasie, tra cui il CAC (46). Recentemente è stato
dimostrato che il polimorfismo C3435T a carico dell’esone 26 del gene MDR1 è in grado di
alterare l’attività di P-gp. Soggetti con genotipo omozigote TT per tale polimorfismo hanno
evidenziato una espressione quattro volte minore di P-gp rispetto agli individui omozigoti
CC (61). Le cellule NCI-H295, che mostrano una elevata espressione di MDR1, presentano
infatti
genotipo
omozigote
CC,
ovvero
quello
maggiormente
associato
alla
chemioresistenza. Sebbene il nostro studio non dimostri correlazione fra il genotipo per lo
SNPs C3435T del gene MDR1 e lo sviluppo di CAC, una sua valutazione può essere
importante ai fini della scelta terapeutica. I dati, ottenuti dalla genotipizzazione di 31
soggetti affetti da CAC e trattati con chemioterapia e/o mitotane, evidenziano che pazienti
con genotipo omozigote CC vanno più frequentemente incontro a progressione della
malattia, rispetto a quelli omozigoti TT (Tabelle 16 e 17 e Figure 23 e 24). Nonostante
l’esiguo numero di casi a nostra disposizione non abbia permesso il raggiungimento della
significatività statistica, l’analisi dei dati ottenuti mostra che i pazienti con genotipo
eterozigote CT e quelli con genotipo omozigote TT hanno una risposta al mitotane superiore
di 1,4 e 5 volte rispetto ai pazienti con genotipo omozigote CC (Tabella 20). Essendo il
CAC fortemente chemioresistente, risulta difficile trovare una terapia farmacologica
efficace per tale affezione. Ad oggi il mitotane, da solo o associato a chemioterapia, risulta
essere la scelta terapeutica più efficacie per il trattamento di CAC in stadi avanzati. Esso è
infatti in grado di inibire l’espressione di MDR1, diminuendo la chemioresistenza delle
cellule neoplastiche. La condizione di omozigosi CC per il polimorfismo C3435T del gene
MDR1 implica una overespressione di P-gp ed i nostri dati dimostrano che soggetti con tale
genotipo rispondono meno alla terapia con mitotane, evidenziando una più frequente
progressione della malattia, rispetto ai genotipi CT e TT. La genotipizzazione per lo SNP
C3435T del gene MDR1 può avere quindi importanti implicazioni terapeutiche e
60
prognostiche per l’utilizzo di farmaci substrati di P-gp. In base al genotipo per il
polimorfismo C3435T del gene MDR1, sarebbe quindi possibile esaminare i pazienti affetti
da CAC, individuando i soggetti che verosimilmente risponderanno alla terapia con
chemioterapici e/o mitotane prima di iniziarla. Si eviterebbe così di sottoporre ad inutili
terapie tutti quei pazienti che hanno una minore probabilità di rispondere positivamente al
trattamento farmacologico con chemioterapici, che hanno molteplici ed a volte gravi effetti
collaterali.
Il nostro modello sperimentale, la linea cellulare di CAC umano NCI-H295, esprime
MDR1 (Figura 27) e la proteina da esso codificata, P-gp, è presente sia a livello di
membrana plasmatica che, in minor misura, a livello citoplasmatico (Figura 28). Saggi di
vitalità cellulare e di incorporazione di timidina triziata dimostrano inoltre che le cellule
NCI-H295 non solo sono resistenti ad elevate concentrazioni di doxorubicina (50 nM), ma
continuano a proliferare nonostante il trattamento chemioterapico. Tali risultati
suggeriscono che la linea cellulare NCI-H295 rappresenti un buon modello per lo studio
della chemioresistenza del CAC. Inoltre, ci proponiamo di utilizzare tale modello in vitro
per individuare nuove strategie farmacologiche per cercare di ridurre il fenotipo
chemioresistenza del CAC e permettere un prolungamento della sopravvivenza nei pazienti
affetti da tale patologia.
61
Bibliografia
1. Balboni GC, Bastianini A, Brizzi E, Castorina S, Comparini L, Donato RF,
Filogamo G, Fusaroli P, Giordano Lanza G, Grossi CE, Manzoli FA, Marinozzi G,
Miani A, Mitolo V, Motta P, Nesci E, Orlandini GE, Passaponti A, Pizzini G, Reale E,
Renda T, Ridola C, Ruggeri A, Santoro A, Tedde G, Zaccheo D. Anatomia umana, III
edizione 1990, volume 2, 9:598-608.
2. Faglia G, Beck-Peccoz P. Malattie del sistema endocrino e del metabolismo, IV edizione
2006, 6:175-213.
3. Cotran RS, Kumar V, Collins T. Le basi patologiche delle malattie volume 2, VI
edizione 2000, 26:1335-1351.
4. Wajchenberg BL, Albergaria Pereira MA, Medonca BB, Latronico AC, Campos
Carneiro P, Alves VA, Zerbini MC, Liberman B, Carlos Gomes G, Kirschner MA.
Adrenocortical carcinoma: clinical and laboratory observations. 2000, Cancer; 88(4): 71136.
5. Libé R, Bertherat J. Molecular genetics of adrenocortical tumours, from familial to
sporadic diseases. 2005, Eur J Endocrinol; 153(4):477-87.
6. Luton JP, Cerdas S, Billaud L, Thomas G, Guilhaume B, Bertagna X, Laudat MH,
Louvel A, Chapuis Y, Blondeau P, et al. Clinical features of adrenocortical carcinoma,
prognostic factors, and the effect of mitotane therapy. 1990, N Engl J Med;
26;322(17):1195-201.
7. Luton JP, Martinez M, Coste J, Bertherat J. Outcome in patients with adrenal
incidentaloma selected for surgery: an analysis of 88 cases investigated in a single clinical
center. 2000, Eur J Endocrinol; 143(1):111-7.
62
8. Wajchenberg BL, Albergaria Pereira MA, Medonca BB, Latronico AC, Campos
Carneiro P, Alves VA, Zerbini MC, Liberman B, Carlos Gomes G, Kirschner MA.
Adrenocortical
carcinoma:
clinical
and
laboratory
observations.
2000,
Cancer;
15;88(4):711-36.
9. Allolio B, Hahner S, Weismann D, Fassnacht M. Management of adrenocortical
carcinoma. 2004, Clin Endocrinol (Oxf); 60(3):273-87.
10. Abiven G, Coste J, Groussin L, Anract P, Tissier F, Legmann P, Dousset B,
Bertagna X, Bertherat J. Clinical and biological features in the prognosis of adrenocortical
cancer: poor outcome of cortisol-secreting tumors in a series of 202 consecutive patients.
2006, J Clin Endocrinol Metab; 91(7):2650-5.
11. Kloos RT, Gross MD, Francis IR, Korobkin M, Shapiro B. Incidentally discovered
adrenal masses. 1995, Endocr Rev; 16(4):460-84.
12. Abiven G, Coste J, Groussin L, Anract P, Tissier F, Legmann P, Dousset B,
Bertagna X, Bertherat J. Clinical and biological features in the prognosis of adrenocortical
cancer: poor outcome of cortisol-secreting tumors in a series of 202 consecutive patients.
2006, J Clin Endocrinol Metab; 91(7):2650-5.
13. Krestin GP, Freidmann G, Fishbach R, Neufang KF, Allolio B. Evaluation of
adrenal masses in oncologic patients: dynamic contrast-enhanced MR vs CT. 1991, J
Comput Assist Tomogr.; 15(1):104-10.
14. Schwartz LH, Macari M, Huvos AG, Panicek DM. Collision tumors of the adrenal
gland: demonstration and characterization at MR imaging. 1996, Radiology; 201(3):757-60.
15. Boland GW, Lee MJ, Gazelle GS, Halpern EF, McNicholas MM, Mueller PR.
Characterization of adrenal masses using unenhanced CT: an analysis of the CT literature.
1998, AJR Am J Roentgenol; 171(1):201-4.
63
16. Icard P, Louvel A, Le Charpentier M, Chapuis Y. Adrenocortical tumors with
oncocytic cells: benign or malignant? 2001, Ann Chir; 126(3):249-53.
17. Gross MG, Shapiro B, Francis IR. Scintigraphic evaluation of clinically silent adrenal
masses. 1994, J Nucl Med; 35:1145-52.
18. Maurea S, Klain M, Mainolfi C, Ziviello M, Salvatore M. The diagnostic role of
radionuclide imaging in evaluation of patients with nonhypersecreting adrenal masses.
2001, J Nucl Med.; 42(6):884-92.
19. Becherer A, Vierhapper H, Pötzi C, Karanikas G, Kurtaran A, Schmaljohann J,
Staudenherz A, Dudczak R, Kletter K. FDG-PET in adrenocortical carcinoma. 2001,
Cancer Biother Radiopharm; 16(4):289-95.
20. Tenenbaum F, Groussin L, Foehrenbach H, Tissier F, Gouya H, Bertherat J,
Dousset B, Legmann P, Richard B, Bertagna X. 18F-fluorodeoxyglucose positron
emission tomography as a diagnostic tool for malignancy of adrenocortical tumours?
Preliminary results in 13 consecutive patients. 2004, Eur J Endocrinol.; 150(6):789-92.
21. Schteingart DE, Doherty GM, Gauger PG, Giordano TJ, Hammer GD, Korobkin
M, Worden FP. Management of patients with adrenal cancer: recommendations of an
international consensus conference. 2005, Endocr Relat Cancer; 12(3):667-80.
22. Grumbach MM, Biller BM, Braunstein GD, Campbell KK, Carney JA, Godley PA,
Harris EL, Lee JK, Oertel YC, Posner MC, Schlechte JA, Wieand HS. Management of
the clinically inapparent adrenal mass ("incidentaloma"). 2003, Ann Intern Med.;
138(5):424-9.
23. Weiss LM. Comparative histologic study of 43 metastasizing and nonmetastasizing
adrenocortical tumors. 1984, Am J Surg Pathol.; 8(3):163-9.
64
24. Gicquel C, Bertherat J, Le Bouc Y, Bertagna X. Pathogenesis of adrenocortical
incidentalomas and genetic syndromes associated with adrenocortical neoplasms. 2000,
Endocrinol Metab Clin North Am.; 29(1):1-13.
25. Gicquel C, Bertagna X, Gaston V, Coste J, Louvel A, Baudin E, Bertherat J,
Chapuis Y, Duclos JM, Schlumberger M, Plouin PF, Luton JP, Le Bouc Y. Molecular
markers and long-term recurrences in a large cohort of patients with sporadic adrenocortical
tumors. 2001, Cancer Res; 61 (18): 6762-7.
26. Tissier F, Louvel A, Grabar S, Hagnere AM, Bertherat J, Vacher-Lavenu MC,
Dousset B, Chapuis Y, Bertagna X, Gicquel C. Cyclin E correlates with malignancy and
adverse prognosis in adrenocortical tumors. 2004 Eur J Endocrinol; 150 (6): 809-17.
27. Mac Farlane DA. Cancer of the adrenal cortex: the natural story, prognosis and
treatment in the study of 58 cases. 1958, Ann Royal Coll Surg; 109: 613-8.
28. Allolio B, Fassnacht M. Clinical review: Adrenocortical carcinoma: clinical update.
2006, J Clin Endocrinol Metab.; 91(6):2027-37.
29. Lipsett MB, Bergenstal DM. The metabolic and corticotrophin-suppressing activity of
certain C21-deoxysteroids. 1959, Acta Endocrinol (Copenh).; 31(1):33-9.
30. Hart MM, Straw JA. Studies on the site of action of o,p'-DDD in the dog adrenal
cortex. 1. Inhibition of ACTH-mediated pregnenolone synthesis. 1971, Steroids; 17(5):55974.
31. Bates SE, Shieh CY, Mickley LA, Dichek HL, Gazdar A, Loriaux DL, Fojo AT.
Mitotane enhances cytotoxicity of chemotherapy in cell lines expressing a multidrug
resistance gene (mdr-1/P-glycoprotein) which is also expressed by adrenocortical
carcinomas. 1991, J Clin Endocrinol Metab.; 73(1):18-29.
32. Vilar O, Tullner WW. Effects of o,p' DDD on histology and 17-hydroxycorticosteroid
output of the dog adrenal cortex. 1959, Endocrinology; 65(1):80-6.
65
33. Kaminsky N, Luse S, Hartroft P. Ultrastructure of adrenal cortex of the dog during
treatment with DDD. 1962, J Natl Cancer Inst.; 29:127-59.
34. Bellantone R, Ferrante A, Boscherini M, Lombardi CP, Crucitti P, Crucitti F,
Favia G, Borrelli D, Boffi L, Capussotti L, Carbone G, Casaccia M, Cavallaro A, Del
Gaudio A, Dettori G, Di Giovanni V, Mazziotti A, Marrano D, Masenti E, Miccoli P,
Mosca F, Mussa A, Petronio R, Piat G, Marazano L. Role of reoperation in recurrence of
adrenal cortical carcinoma: results from 188 cases collected in the Italian National Registry
for Adrenal Cortical Carcinoma. 1997, Surgery; 122(6):1212-8.
35. Hart MM, Swackhamer ES, Straw JA. Studies on the site of action of o,p'-DDD in
the dog adrenal cortex. II. TPNH- and corticosteroid precursor-stimulation of o,p'-DDD
inhibited steroidogenesis. 1971, Steroids; 17(5):575-86.
36. van Slooten H, Moolenaar AJ, van Seters AP, Smeenk D. The treatment of
adrenocortical carcinoma with o,p'-DDD: prognostic implications of serum level
monitoring. 1984, Eur J Cancer Clin Oncol; 20(1):47-53.
37. Baudin E, Pellegriti G, Bonnay M, Penfornis A, Laplanche A, Vassal G,
Schlumberger M. Impact of monitoring plasma 1,1-dichlorodiphenildichloroethane
(o,p'DDD) levels on the treatment of patients with adrenocortical carcinoma. 2001, Cancer;
92(6):1385-92.
38. Terzolo M, Pia A, Berruti A, Osella G, Alì A, Carbone V, Testa E, Dogliotti L,
Angeli A. Low-dose monitored mitotane treatment achieves the therapeutic range with
manageable side effects in patients with adrenocortical cancer. 2000, J Clin Endocrinol
Metab.; 85(6):2234-8.
39. Hutter AM Jr, Kayhoe DE. Adrenal cortical carcinoma. Results of treatment with
o,p'DDD in 138 patients. 1966, Am J Med.; 41(4):581-92.
66
40. Schteingart DE, Motazedi A, Noonan RA, Thompson NW. Treatment of adrenal
carcinomas. 1982, Arch Surg.; 117(9):1142-6.
41. Terzolo M, Angeli A, Fassnacht M, Daffara F, Tauchmanova L, Conton PA,
Rossetto R, Buci L, Sperone P, Grossrubatscher E, Reimondo G, Bollito E, Papotti M,
Saeger W, Hahner S, Koschker AC, Arvat E, Ambrosi B, Loli P, Lombardi G,
Mannelli M, Bruzzi P, Mantero F, Allolio B, Dogliotti L, Berruti A. Adjuvant mitotane
treatment for adrenocortical carcinoma. 2007, N Engl J Med.; 356(23):2372-80.
42. Berruti A, Terzolo M, Pia A, Angeli A, Dogliotti L. Mitotane associated with
etoposide, doxorubicin, and cisplatin in the treatment of advanced adrenocortical carcinoma.
Italian Group for the Study of Adrenal Cancer. 1998, Cancer; 83(10):2194-200.
43.Gottesman, M. M., and I. Pastan. The multidrug transporter, a double-edged sword.
1988, J. Biol. Chem. 263:12163-12166.
44. Zatelli MC, Luchin A, Piccin D, Tagliati F, Bottoni A, Vignali C, Bondanelli M,
degli
Uberti
EC.
Cyclooxigenase-2
Inhibitors
Prevent
the
Development
of
Chemoresistance Phenotype in a Breast Cancer Cell line by inhibiting P-gp Expression.
2005, J Clin Endocrinol Metab; 90(10):5754-60.
45. Janice E. Chin, Rena Soffir, Kevin E. Noonan, Kyunghee Choi, And Igor B.
Roninson. Structure and Expression of the Human MDR (P-Glycoprotein) Gene Family.
1989, Molecular And Cellular Biology p.3808-3820.
46. Choi, K., C.-J. Chen, M. Kriegler, I. B. Roninson. An altered pattern of crossresistance in multidrug-resistant human cells results from spontaneous mutations 1988,
Cell.; 53(4):519-29.
47. Shen, D.-W., A. Fojo, I. B. Roninson, J. E. Chin, R. Soffir, I. Pastan, and M. M.
Gottesman. Multidrug-resistance in DNA mediated transformants is linked to transfer of
the human mdrl gene. 1986, Mol. Cell. Biol. 6:4039-4045.
67
48. Higgins, C. F., I. D. Hiles, G. P. C. Salmond, D. R. Gill, J. A. Downie, I. J. Evans, I.
B. Holland, L. Gray, S. D. Buckel, A. W. Bell, and M. A. Hermodson. A family of
related ATP binding subunits coupled to many distinct biological processes in bacteria.
1986, Nature 323:448-450.
49. Duraisingh, M.T. and Cowman, A.F. Contribution of the pfmdr1 gene to antimalarial
drug-resistance. 2005, Acta Trop. 94, 181– 190.
50. Huang, Y. and Sadee, W. Membrane transporters and channels in chemoresistance and
sensitivity of tumor cells. 2005, Cancer Lett. p.3808-3820.
51. Langton, K.P., Henderson, P.J. and Herbert, R.B. Antibiotic resistance: multidrug
efflux proteins, a common transport mechanism? 2005, Nat. Prod. Rep. 22, 439–451.
52. Patel VA, Dunn MJ, Sorokin A. Regulation of MDR1 (P-glycoprotein) by
cyclooxygenase 2. 2000, J Biol Chem; 277: 38915-38920.
53. Brinkmann U. Functional polymorphisms of the human multidrug resistance (MDR1)
gene: correlation with P glycoprotein expression and activity in vivo. 2002, Novartis Found
Symp; 243: 207-210.
54. Higgings CF, Callaghan R, Linton KJ, Rosenberg MF, Ford RC. Structure of the
multidrug resistance P-glycoprotein. 1997, Seminars in Cancer Biology; 8:135-142.
55. Dean M, Hamon Y, Chimini G. The human ATP-binding cassette (ABC) transporter
superfamily. 2001, J Lipid Res; 42: 1007-17.
56. van Veen, ORA.W. and Callaghan, R. ABC PROTEINS: From Bacteria to Man,
2003, Elsevier; pp. 81–106.
57. Chang G. Multidrug resistance ABC transporters. 2003, FEBS Letters; 555, 102-105.
58. Croop JM, Gros P, Housman DE. Genetics of Multidrug Resistance. 1998, J Clin
Inves; 81: 1303-1309.
68
59. Thomas H, MA, FRCP, PhD, Coley HM. Overcoming multidrug resistance in cancer:
an update on the clinical strategy of inhibiting P-Glycoprotein. 2003, Cancer; 10:159-165.
60. Roe MR, Folkes A, Ashworth P, Brumwell J, Chima L, Hunjan S, Pretswell I,
Dangerfield W, Ryder H, Charlton P. Reversal of P-glycoprotein mediated multidrug
resistance by novel anthranilamide derivatives. 1999, Bioorganic & Medicinal Chemistry
Letters; 9: 595-600.
61. Chava Kimchi-Sarfaty, Jung Mi Oh, In-Wha Kim, Zuben E. Sauna, Anna Maria
Calcagno, Suresh V. Ambudkar, Micheal M. Gottesman. A “Silente” Polymorphism in
the MDR1 Gene Changes Substrate Specificity. 2007, Science; 315: 525-528.
62. Balram C, Sharma A, Sivathasan C, Edmund J.D. Lee. Frequency of C3435T single
nucleotide MDR1 genetic polymorphism in an Asian population: phenotypic-genptypic
correlates. 2003, Br J Clin Pharmacol; 56:78-83.
69


![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)








![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)
