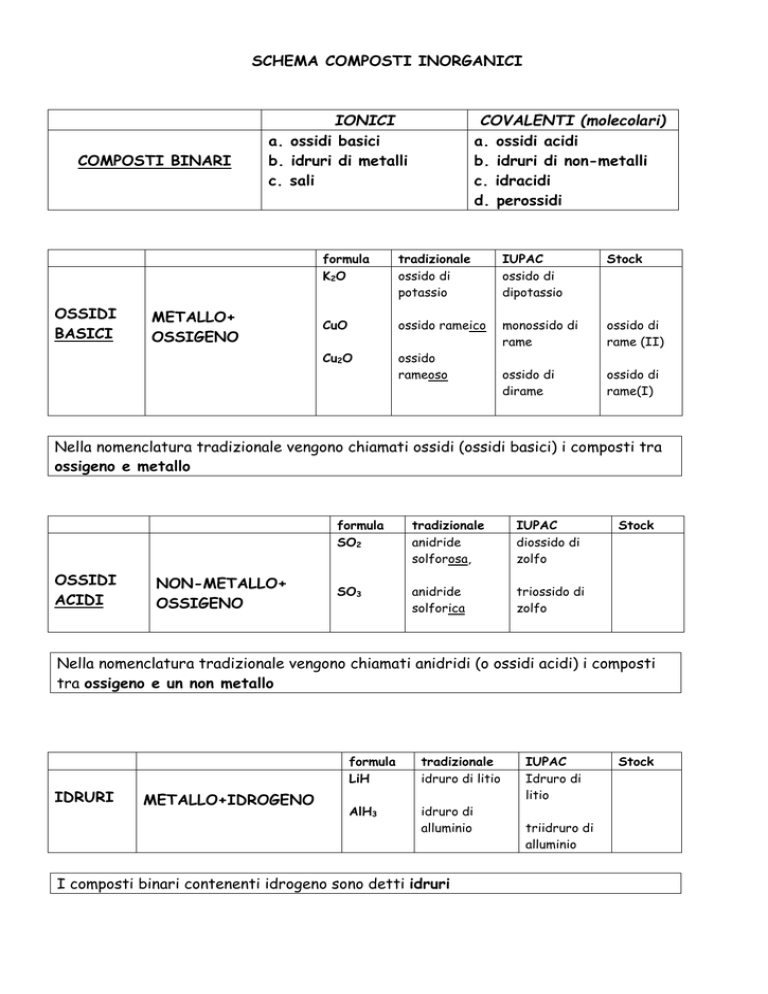
SCHEMA COMPOSTI INORGANICI
COMPOSTI BINARI
OSSIDI
BASICI
IONICI
a. ossidi basici
b. idruri di metalli
c. sali
METALLO+
OSSIGENO
COVALENTI (molecolari)
a. ossidi acidi
b. idruri di non-metalli
c. idracidi
d. perossidi
formula
K 2O
tradizionale
ossido di
potassio
IUPAC
ossido di
dipotassio
Stock
CuO
ossido rameico
monossido di
rame
ossido di
rame (II)
Cu2O
ossido
rameoso
ossido di
dirame
ossido di
rame(I)
Nella nomenclatura tradizionale vengono chiamati ossidi (ossidi basici) i composti tra
ossigeno e metallo
OSSIDI
ACIDI
NON-METALLO+
OSSIGENO
formula
SO2
tradizionale
anidride
solforosa,
IUPAC
diossido di
zolfo
SO3
anidride
solforica
triossido di
zolfo
Stock
Nella nomenclatura tradizionale vengono chiamati anidridi (o ossidi acidi) i composti
tra ossigeno e un non metallo
IDRURI
METALLO+IDROGENO
formula
LiH
tradizionale
idruro di litio
AlH3
idruro di
alluminio
I composti binari contenenti idrogeno sono detti idruri
IUPAC
Idruro di
litio
triidruro di
alluminio
Stock
PEROSSIDI
METALLO+2 ATOMI DI
OSSIGENO
formula
H 2S
IDRACIDI
H+NON-METALLO
(alogeni+S+CN-)
HCl
formula
tradizionale
Na2O2
H2O2
perossido di sodio
perossido di idrogeno(acqua ossigenata)
tradizionale
IUPAC
acido solfidrico solfuro di
diidrogeno
acido cloridrico,
cloruro di
idrogeno
Stock
I composti tra l’idrogeno e gli elementi del VII e del VI gruppo prendono il nome di
idracidi, perché manifestano carattere acido.
formula
NaCl
SALI
DEGLI
IDRACIDI
tradizionale
cloruro di sodio
IUPAC
Cloruro di sodio
Stock
METALLO+NONFeCl2
METALLO
cloruro ferroso
dicloruro di
ferro
FeCl3
cloruro ferrico
tricloruro di
ferro
cloruro
di
ferro(II
)
cloruro
di
ferro(II
I)
I composti costituiti da un metallo e un non metallo si chiamano sali binari. Il metallo
ha n.o. positivo e il non metallo ha n.o. negativo
IONICI
COMPOSTI TERNARI
a. idrossidi
b. sali degli ossiacidi
formula
tradizionale
COVALENTI
ossiacidi
IUPAC
Stock
IDROSSIDI
METALLO+OH-
AgOH
idrossido di
argento
Pb(OH)2
idrossido
piomboso,
diidrossido di
piombo
idrossido di
piombo (II)
Pb(OH)4
idrossido
piombico,
tetra
idrossido di
piombo
idrossido di
piombo(IV)
Gli idrossidi sono composti che contengono lo ione OH-, detto ossidrile, legato allo ione di un
metallo. Si formano dalla reazione tra un ossido basico e acqua e hanno carattere basico.
formula
H2CO3
H+
OSSIACIDI NON
METALLO+
OSSIGENO
tradizionale
acido carbonico
IUPAC
acido triossocarbonico
acido solforico
acido
tetraossosolforico(VI)
H2SO4
Stock
acido solforoso
H2SO3
acido triossosolforico(IV)
Gli acidi ossigenati o ossiacidi sono composti che contengono ione idrogeno H+, non
metallo e ossigeno. Si formano dalla reazione di un ossido acido (o anidride) con acqua
e hanno carattere acido
SALI DEGLI
OSSIACIDI
METALLO+
NON METALLO
+OSSIGENO
formula
Na2SO4
tradizionale
solfato di
sodio,
IUPAC
tetraossosolfato di
sodio
Stock
Fe2(SO4)3
solfato
ferrico
tri -tetraossosolfato
(VI) di ferro(III)
solfato di
ferro(III)
FeSO4
solfato
ferroso
tetraossosolfato(IV)
di ferro(II)
solfato di
ferro(II)
solfito
ferroso
triossosolfato di
ferro (II)
solfito di
ferro (II)
FeSO3
I sali ossigenati sono composti costituiti da uno ione metallico e un anione formato
da non metallo e ossigeno. La loro formula si scrive sostituendo l’idrogeno dell’acido
con il metallo.
COMPOSTI
QUATERNARI
formula
NaHSO4
tradizionale
bisolfato di
sodio
IUPAC
idrogeno
solfato(VI) di
sodio
NaHCO3
bicarbonato di
sodio
idrogeno
carbonato (IV)
di sodio
SALI ACIDI
METALLO+
H+
NON METALLO+
OSSIGENO
I sali che contengono atomi di idrogeno dell’ossiacido non sostituiti da ioni metallici sono
definiti sali acidi