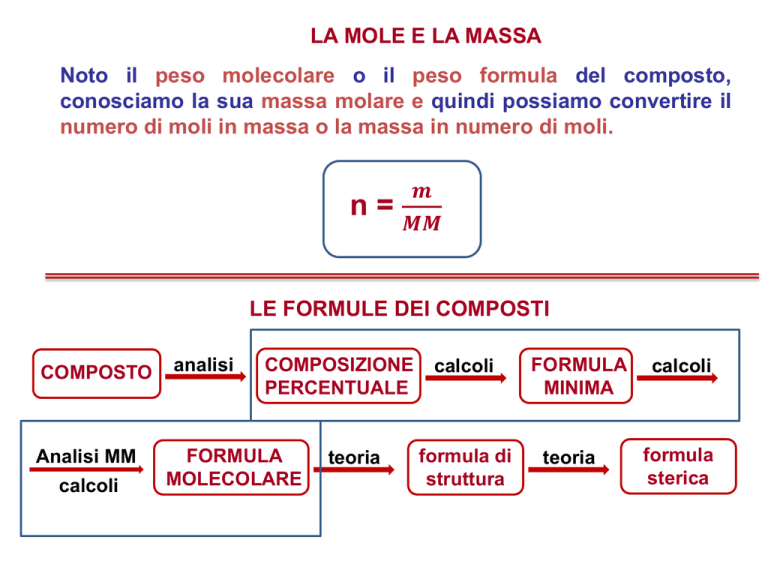
LA MOLE E LA MASSA
Noto il peso molecolare o il peso formula del composto,
conosciamo la sua massa molare e quindi possiamo convertire il
numero di moli in massa o la massa in numero di moli.
n=
𝒎
𝑴𝑴
LE FORMULE DEI COMPOSTI
COMPOSTO
Analisi MM
calcoli
analisi
COMPOSIZIONE
PERCENTUALE
FORMULA
MOLECOLARE
teoria
calcoli
formula di
struttura
FORMULA
MINIMA
teoria
calcoli
formula
sterica
LE FORMULE DEI COMPOSTI INORGANICI
Il principio dell’elettroneutralità:
La carica positiva totale dei cationi deve essere uguale alla carica
negativa totale degli anioni.
Mentre ci sono diversi anioni sia monoatomici che poliatomici, ci
sono solo due cationi poliatomici, NH4+ e Hg22+;
Negli ioni poliatomici la carica è la carica di tutto lo ione, cioè di
tutto l’insieme di atomi.
LO STATO (O NUMERO) DI OSSIDAZIONE
Regole per assegnare il numero di ossidazione ad un atomo:
1. Il numero di ossidazione degli atomi di un elemento allo stato
elementare è zero;
2. Il numero di ossidazione di un elemento in uno ione
monoatomico è uguale alla carica dello ione;
3. La somma dei numeri di ossidazione degli elementi in un
composto è zero; in uno ione poliatomico è uguale alla carica
dello ione;
4. Certi elementi hanno lo stesso numero di ossidazione in tutti
o in quasi tutti i loro composti; la posizione di un elemento
nella tavola periodica aiuta nell’assegnazione del numero di
ossidazione.
LA NOMENCLATURA
E’ l’insieme delle regole per assegnare il nome ai composti. E’
stata stabilita dalla International Union of Pure and Applied
Chemistry (IUPAC).
IONICI
COMPOSTI
BINARI
MOLECOLARI
LE RADICI DEI NON METALLI
LA NOMENCLATURA
COMPOSTI BINARI MOLECOLARI
COMPOSTI BINARI CON NOMI COMUNI
H2O
acqua
PH3 fosfina
H2O2 acqua ossigenata
perossido di idrogeno
AsH3 arsina
NH3 ammonica
CH4 metano
N2H4 idrazina
C2H2 acetilene
GLI IDRACIDI
LA NOMENCLATURA
OSSIACIDI HXAOY
COMPOSTI
TERNARI
SALI MXAOY
ALCUNI OSSIACIDI COMUNI
LA NOMENCLATURA
ALCUNI ANIONI POLIATOMICI CON METALLI
MnO42- manganato
MnO4- permanganato
CrO42- cromato
Cr2O72- dicromato o
bicromato
I SALI IDROGENATI
Lo ione ACETATO, CH3COO- deriva dall’acido acetico,
CH3COOH, è un composto organico che useremo molto in
chimica inorganica.
LA NOMENCLATURA
LA STRUTTURA DI ALCUNI ANIONI POLIATOMICI
IL BILANCIAMENTO DELLE REAZIONI
(EQUAZIONI) CHIMICHE
IL BILANCIAMENTO DELLE REAZIONI (EQUAZIONI) CHIMICHE
IL BILANCIAMENTO DELLE REAZIONI (EQUAZIONI) CHIMICHE
IL BILANCIAMENTO DELLE REAZIONI (EQUAZIONI) CHIMICHE
GLI ELETTROLITI
I composti che in acqua dissociano in IONI si chiamano ELETTROLITI:
Elettroliti FORTI:
completamente dissociati a = 1
Elettroliti DEBOLI:
parzialmente dissociati 0 < a < 1
Non elettroliti:
indissociati
a=0
GLI ELETTROLITI
LE REAZIONI DI OSSIDORIDUZIONE (REDOX)
LE REAZIONI DI OSSIDORIDUZIONE (REDOX)
La reazione redox
Zn(s) + H+(aq)
Zn2+(aq) + H2(g)
La semireazione di ossidazione
Zn(s)
Zn2+(aq) + 2 e-
La semireazione di riduzione
2 H+(aq) + 2 e-
H2(g)
La reazione redox bilanciata
Zn(s) + 2 H+(aq)
Zn2+(aq) + H2(g)
BILANCIAMENTO REAZIONI REDOX
BILANCIAMENTO REAZIONI REDOX
REAZIONI DI DISPROPORZIONE
LA STECHIOMETRIA
IL REAGENTE LIMITANTE
LA RESA PERCENTUALE
LE SOLUZIONI
LA CONCENTRAZIONE DELLE SOLUZIONI
LA CONCENTRAZIONE DELLE SOLUZIONI
LA CONCENTRAZIONE DELLE SOLUZIONI
LA CONCENTRAZIONE DELLE SOLUZIONI
LA DILUIZIONE DELLE SOLUZIONI











